Влияние даларгина на активность Na, K-АТФазы мембран синаптосом из коры головного мозга крыс при ишемии и реперфузии
Автор: Мохаммед М.Т., Кличханов Н.К.
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Проблемы прикладной экологии
Статья в выпуске: 1-1 т.13, 2011 года.
Бесплатный доступ
Исследовано влияние даларгина на активность Na, K АТФазы мембран синаптосом из коры головного мозга крыс при ишемии и реперфузии. Ишемия, вызванная путем окклюзии двух сонных артерий, приводит к ингибированию активности фермента. Степень снижения активности Na, K АТФазы зависела от длительности ишемии (30, 60, 90 мин). В период реперфузии (60 и 90 мин), после 60 мин ишемии, активность Na, K АТФазы возрастает относительно ишемического уровня. Внутрибрюшинное введение даларгина за 30 мин до ишемии в дозе 0,5 мг/кг, но не в дозе 0,1 мг/кг, предотвращает ингибирование фермента при ишемии.
K атфаза, ишемия, даларгин, синаптические мембраны, мозг крысы
Короткий адрес: https://sciup.org/148199592
IDR: 148199592 | УДК: 577.352.3
Текст научной статьи Влияние даларгина на активность Na, K-АТФазы мембран синаптосом из коры головного мозга крыс при ишемии и реперфузии
N a, K-АТФаза является интегральным мембранным ферментом, использующим энергию гидролиза АТФ для транспорт ионов Na+ и K+ против электрохимического градиента. В клетках мозга градиенты ионов натрия и калия, создаваемые этим ферментом, необходимы для осуществления таких физиологических функций как регуляция объема, поддержание электрического потенциала, вторичный активный транспорт, а также обеспечение осмотического баланса в системе нейрон-экстраклеточный компартмент [5].
Нарушение снабжения кислородом тканей мозга, наступающее при ишемическом повреждении мозга, приводит к снижению активности Na, K-АТФазы [13]. В результате подавления ее активности нарушается транспорт ионов, развивается деполяризация мембраны, нейроны утрачивают свою важнейшую функцию — электрическую проводимость. Это может привести к чрезмерной секреции нейромедиаторов, перегрузке нейронов ионами кальция, и далее к вторичному ишемическому повреждению, т.е. активации фосфолипаз, липаз, протеаз, эндонуклеаз, неконтролируемого фосфорилирования, деградации мембран, и отёку мозга. Вместе с тем пока неясно как зависит степень ингибирования Na, K-АТФазы мозга от длительности ишемии и последующей реперфузии.
D-Ala2, Leu5, Агд6-энкефалин (даларгин) является синтетическим аналогом лей-энкефалина [3]. Этот пептид активирует р- и 6-рецепторы и проникает через гематоэнцефалический барьер только при его использовании в дозах не менее 0,5 мг/кг [9]. В экспериментах на животных с острой ишемией миокарда, вызванной окклюзией коронарной артерии, получены данные о благоприятном действии даларгина [7]. Даларгин оказывает противоишемическое действие при снижении перфузионного давления в системе кровоснабжения мозга при реконструктивных операциях на сонных и позвоночных артериях мозга [1]. Целью
данной работы было выяснение зависимости активности Na, K-АТФазы мембран синаптосом из коры головного мозга крыс от длительности ишемии и реперфузии, а также роли опиоидного нейропептида даларгина в защите фермента от ишемического повреждения.
МЕТОДИКА ИССЛЕДОВАНИЯ
Опыты выполнены на 46 белых крысах-самцах Вистар, массой 200-230 г. Экспериментальную ишемию головного мозга вызывали окклюзией двух сонных артерий в течение 30, 60 и 90 мин. У части животных после 60-минутной окклюзии двух сонных артерий моделировали реперфузию путем снятия лигатуры. Продолжительность реперфузии составила 60 и 90 мин. У животных контрольной группы воспроизводилась наркотизация, кожный разрез и выделение артерий без последующей перевязки сосудов. Все хирургические процедуры проводили под наркозом (внутрибрюшное введение тиопентала натрия в дозе 40-50 мг/кг). В период ишемии и реперфузии температура тела животного поддерживали на нормальном уровне (37°С).
Фармакопейный препарат даларгин (НПО «Микроген») вводили внутрибрюшинно в дозе 0, 1 и 0, 5 мг/кг за 30 мин до наложения лигатуры на сонные артерии. Контрольным (ложноопери-рованным) животным вводили соответствующий объем физиологического раствора.
После декапитации крыс для исследования использовалась кора больших полушарий головного мозга. Синаптосомы выделяли методом центрифугирования [16]. Полученные синаптосомы подвергали осмотическому шоку в дистиллированной воде, после чего синаптические мембраны осаждали при 20000 g в течение 30 мин. После однократной промывки 0,32 М сахарозой препарат мембран хранили при -70°С и использовали для анализа в течение недели. Активность Na, К-АТФазы в мембранах синаптосом оценивали, измеряя количество неорганического фосфата (Рн), освобождающегося в ходе гидролиза АТФ [10]. Инкубационная среда для определения общей АТФазной активности содержала (в мМ/л): 130
- NaCl, 20 — KCl, 3 — MgCl2, 30 — трис-HCl буфер, pH — 7,4, 3 — АТФ и 40 мкг мембранного белка в 1,5 мл конечного объема. При определении активности Мд2+-АТФазы среда инкубации содержала те же компоненты и дополнительно 1 мМ уабаина — специфического ингибитора Na, К-АТФазы. Активность Na, К-АТФазы рассчитывали как разность между общей и Мд2+-зависимой АТФазной активностью. Содержание белка определяли по Лоури.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Как видно на рисунке, при ишемии активность Na, К-АТФазы мембран синаптосом снижается. Ингибирование активности фермента после 30, 60, 90 мин ишемии составило 32,1%, 45,8%, 53,7% относительно контроля (ложнооперированные животные) соответственно. Таким образом, степень ингибирования фермента зависит от длительности ишемии.
Ингибирование фермента снижает трансмембранные градиенты ионов, вызывает чрезмерное поступление в нейроны Na+ с последующим притоком Cl- и воды, что приводит к клеточному отеку. Обнаружена корреляция между ингибированием Na, К-АТФазы и отёком мозга в ишемизированной области [18].
Ишемия вызывает на клеточном уровне серию быстро развивающихся во времени изменений, которые могут повлиять на Na, К-АТФазу. В их числе ацидоз, перегрузка ионами кальция, активация протеаз, аккумуляция метаболитов липидов (жирных кислот, лизолипидов) и в некоторых тканях, транслокация ферментного белка с поверхности мембраны внутрь клетки [14]. Не исключено также, что обнаруженное нами ингибирование Na, К-АТФазы связано с потерей связи фермента с цитоскелетом. Цитоплазматический домен а-субъединицы Na, К-АТФазы связан с анкирином, который связывает фермент с элементами примембранного цитоскелета (фодрино-выми фибриллами). Такая связь с цитоскелетом стабилизирует Na, К-АТФазу в плазматической мембране. а-Фодрин и анкирин являются субстратами кальпаинов — группы нелизосомальных Ca2+-зависимых протеаз. Показано, что на раннем этапе реперфузии (5 мин) после тотальной ишемии миокарда резкое снижение активности Na, К-АТФазы связано с активацией кальпаинов, что приводит к деградации цитоскелетных белков и нарушению их связи с ферментом [17]. Активация селективного протеолиза а-фодрина под действием кальпаинов обнаружена в синаптосомах из мозга крыс при ишемии и реперфузии [15].
Ингибирование активности фермента при ишемии может происходить под действием активных форм кислорода (АФК), окислительной модификации липидного микроокружения и накопления продуктов их деградации, изменения редокс-состояния окружения, фосфорилирования субъединиц [19]. При ишемии Na, К-АТФаза функционирует в условиях высокой концентрации АФК, которые приводят к ингибированию гидролитической и транспортной функции Na, К-АТФазы. На частично очищенном препарате фермента из синаптосом мозга показано, что степень ингибирования Na, К-АТФазы зависит от вида АФК [11].
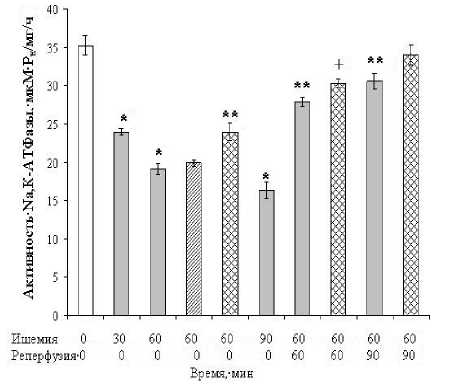
Рис. Изменение активности Na, К-АТФазы мембран синаптосом из коры головного мозга крыс при ишемии/реперфузии и введении даларгина: Светлый столбик - контрольные (ложнооперированные) животные; серые столбики - ишемия и реперфузия; столбики с косой штриховкой - введение даларгина в дозе 100 мкг/кг; дважды заштрихованные столбики - введение даларгина в дозе 500 мкг/кг. * - р < 0,05 относительно контроля; ** - р < 0,05 относительно ишемии 60 мин; +— р < 0,05 относительно ишемии 60 мин + реперфузия 60 мин.
Данные для построения рисунка
|
№ |
Группа |
Активность Na, К-АТФазы, мкмоль Р „ /мг/ч |
|
1 |
Контроль |
35,23+1,28 |
|
2 |
Ишемия 30 мин |
23,93+0,46 |
|
3 |
Ишемия 60 мин |
19,09+0,73 |
|
4 |
даларгин 100 мкг + ишемия 60 мин |
19,86+0,42 |
|
5 |
даларгин 500 мкг + ишемия 60мин |
23,95+1,14 |
|
6 |
Ишемия 90 мин |
16,31+1,12 |
|
7 |
Ишемия 60 мин+ реперфузия 60 мин |
27,86+0,62 |
|
8 |
Даларгин 500 мкг+ишемия 60 мин+ реперфузия 60 мин |
30,27+0,52 |
|
9 |
Ишемия 60 мин+ реперфузия 90 мин |
30,53+1,04 |
|
10 |
Даларгин 500 мкг+ишемия 60 мин+ реперфузия 90 мин |
33,96+1,34 |
Исследование фермента в постишемическом периоде показало, что снятие лигатуры и восстановление кровоснабжения мозга после 60 мин ишемии приводит к повышению активности Na, К-АТФазы. Через 60 мин реперфузии активность фермента возрастает на 45,9%, а после 90 мин -на 59,9% относительно ишемии. Таким образом, при ишемии/реперфузии происходит обратимое ингибирование Na, К-АТФазы. Это позволяет предположить, что ингибирование фермента при ишемии связано с изменением редокс-состояния тиоловых групп и/или фосфорилирования субъединиц, которое может привести к обратимой интернализации Na, К-АТФазы в клатрин окаймленные везикулы [12] и уменьшению количества ее молекул на синаптической мембране.
Введение даларгина в дозе 0,1 мг/кг за 30 мин до ишемии не оказало влияние на активность Na, К-АТФазы после 60 мин ишемии (рис.). В дозе 0,5 мг/кг активность фермента после 60 мин ишемии на 25% выше, чем при ишемии без введения пептида. Таким образом, даларгин, в дозе проникающей в головной мозг, защищает Na, К-АТФазу синаптических мембран от ишемического повреждения.
В связи с полученными нами результатами интерес представляют данные литературы о влиянии даларгина на сердечно-сосудистую систему. Внутривенное введение даларгина вызывало увеличение частоту сердечных сокращений как у человека (25-100 мкг/кг), так и у крыс (100 мкг/кг), и этот эффект не проявлялся в условиях блокады опиоидных рецепторов налоксоном [4, 6]. Показано, что курсовое введение даларгина вызывает снижение удельного периферического сопротивления [8], оказывает венодилятирующее действие, а также уменьшает потребление кислорода организмом. Считают, что даларгин, являясь р-агонистом опиоидных рецепторов, вызывает вазодилятацию и снижение артериального давления за счет увеличения продукции NO эндотелием [6]. Кроме того, внутривенная инфузия пептидных агонистов р-опиоидных рецепторов вызывала у наркотизированных крыс снижение общего периферического сопротивления и артериального давления. Подобных опиоид-индуцированных изменений показателей центральной гемодинамики не происходит в условиях блокады NO-синтазы. Исходя из этих данных можно предположить, что благоприятный эффект даларгина при ишемии связан как со снижением потребности клеток мозга в кислороде, так и с улучшением кровоснабжения мозга за счет интенсификации коллатерального кровоток благодаря сосудорасширяющему эффекту пептида.
Даларгин способен оказать и антиоксидантный эффект. Показано, что пептид при внутривенном введении способен снижать активность ксанти-ноксидазы мозга [2], катализирующей образование супероксиданионрадикала и пероксида водорода.
Таким образом, ишемия, в зависимости от ее длительности, приводит к ингибированию активности Na, К-АТФазы мембран синаптосом. В период реперфузии активность фермента восстанавливается. Внутрибрюшинное введение даларгина до ишемии в дозе 0,5 мг/кг, предотвращает ингибирование фермента при ишемии.
Список литературы Влияние даларгина на активность Na, K-АТФазы мембран синаптосом из коры головного мозга крыс при ишемии и реперфузии
- Казанцев В.В., Луцик А.А., Тюлькин О.Н. Защита головного мозга в хирургии экстракраниальных отделов сонных и позвоночных артерий/Сосудистые заболевания головного и спинного мозга: сб. науч. тр.; под ред. А. Ю. Савченко. Омск: Издательство ОмГПУ. 2000. С. 30-34.
- Короткина Р.Н., Шлозников Б.М., Донич С.Г., Гребенчиков О.А., Ситников А.В., Карелин А.А. Изучение активности ксантиноксидазы в ткани головного мозга на фоне миоплегии//Бюлл. экспер. биол. и мед. 1990. Т. 59, № 2. С. 145-146.
- Лишманов Ю.Б., Маслов Л.М. Опиатные нейропептиды, стресс и адаптационная защита сердца. Томск: Изд-во Том. ун-та. 1994. 352 с.
- Лишманов Ю.Б., Маслов Л.М. Опиатергическая регуляция состояния центральной гемодинамики//Пат. физиол. эксперим. терапия. 2003. №1. С. 2-10.
- Лопина О.Д. Взаимодействия каталитической субъединицы Na, К-АТРазы с клеточными белками и другими эндогенными регуляторами//Биохимия. 2001. Т. 66, вып. 10. С. 1389-1400.
- Маслов Л.В. Лишманов Ю.Б., Лопотухин Э.Ю. Даларгин -это пептидный агонист μ-и δ-опиоидных рецепторов//Клинич. фармакол. и терапия. 2004. № 4. С. 47-52.
- Маслов Л.М., Лишманов Ю.Б., Гросс Г.Дж., Стефано Дж. Феномен повышенной устойчивости сердца к аритмогенному действию ишемии и реперфузии при активации периферических опиатных рецепторов.//Вестн. аритмол. 2002. № 26. С. 77-90.
- Маслов Л.Н., Федорова Н.А., Дудко ВА., Карпов Р.С. Влияние агониста опиатных периферических рецепторов даларгина на толерантность к физической нагрузке пациентов с атеросклерозом коронарных и периферических артерий//Физиол. человека. 2002. Т. 28, № 4.С. 1-7.
- Полонский В.М., Ярыгин К.Н., Кривошеев И.Г. Место приложения (центральное или периферическое) противоязвенного действия синтетического аналога эндогенных опиоидов даларгина в экспериментальной модели цистеаминовых дуоденальных язв у крыс//Бюлл. экспер. биол. и мед. 1987. № 4. С. 433-434.
- Рожанец В.В., Козлова В.Н., Родина Р.И., Швец В.И., Глебов Р.Н. Действие противосудорожных веществ на Na, K-АТФазу синаптических мембран головного мозга животных//Биохимия. 1978. Т. 43, вып. 5. С. 892-898.
- Bogdanova A., Petrushanko I., Boldyrev A., Gassmann M. Oxygen-and redox-induced regulation of the Na/K ATPase//Current Enzyme Inhibition. 2006. Vol. 2. P. 37-59.
- Dada L. A., Chandel N.S., Ridge K. M., Pedemonte C., Bertorello A. M., Sznajder J. I. Hypoxia-induced endocytosis of Na, K-ATPase in alveolar epithelial cells is mediated by mitochondrial reactive oxygen species and PKC-ζ//J. Clin. Invest. 2003. Vol. 111. P. 1057-1064.
- Dobrota D., Matejovicova M., Kurella E.G., Boldyrev A.A. Na/K-ATPase under oxidative stress: molecular mechanisms of injury//Cell Mol. Neurobiol. 1999. Vol. 19. P. 141-149.
- Durukan A., Tatlisumak T. Acute ischemic stroke: overview of major experimental rodent models, pathophysiology, and therapy of focal cerebral ischemia//Pharmacol. Biochem. Behav. 2007. Vol. 87. P. 179-197.
- Fukuda S., Harada K., Kunimatsu M., Sakabe T., Yoshida K. Postischemic reperfusion induces α-fodrin proteolysis by m-calpain in the synaptosome and nucleus in rat brain//J. Neurochem. 1998. Vol. 70. P. 2526-2532.
- Hajos F. An improved method for the preparation of synaptosomal fractions in high purity//Brain Res. 1975. Vol. 93, №. 3. P. 484-489.
- Inserte J., Garcia-Dorado D., Hernando V., Soler-Soler J. Calpain-mediated impairment of Na+/K+-ATPase activity during early reperfusion contributes to cell death after myocardial ischemia//Circulation Res. 2005. Vol. 97. P.465-473.
- Mintorovitch J., Yang G.Y., Shimizu H., Kucharczyk J., Chan P.H., Weinstein P.R. Diffusion-weighted magnetic resonance imaging of acute focal cerebral ischemia: comparison of signal intensity with changes in brain water and Na+, K+-ATPase activity//J. Cereb. Blood Flow Metab. 1994. Vol. 14. P. 332-336.
- Wang X. Q., Xiao A. Y., Sheline C., Hyrc K., Yang A., Goldberg M.P. Apoptotic insults impair Na+, K+-ATPase activity as a mechanism of neuronal death mediated by concurrent ATP deficiency and oxidant stress//J. Cell Sci. 2003. Vol. 116. P. 2099-2110.


