Влияние дефицита кислорода на целостность ДНК клеток жабр двустворчатого моллюска Corbicula japonica
Автор: Слободскова Валентина Владимировна, Челомин Виктор Павлович
Журнал: Известия Самарского научного центра Российской академии наук @izvestiya-ssc
Рубрика: Биологические ресурсы: фауна
Статья в выпуске: 3-3 т.15, 2013 года.
Бесплатный доступ
В работе представлены результаты исследования по выявлению генотоксичности среды обитания Corbicula japonica. населяющего разные районы эстуария реки Артемовки (полноводная часть и обнажающаяся во время отливов отмель) залива Петра Великого. Для выявления генотоксических эффектов был использован метод ДНК-комет. Установлено, что дефицит кислорода в среде обитания (аноксия) приводит к деструкции ДНК клеток жабр С. japonica.
Мониторинг, двустворчатые моллюски corbicula japonica, метод днк-комет, повреждение днк
Короткий адрес: https://sciup.org/148201925
IDR: 148201925 | УДК: 577.1:577.41
Текст научной статьи Влияние дефицита кислорода на целостность ДНК клеток жабр двустворчатого моллюска Corbicula japonica
привести к изменениям в их поведении и устойчивости к воздействию других факторов окружающей среды, оказывая определенное влияние на популяционный и экосистемный уровень организации. Известно, что изменения в физиологических параметрах и поведении отдельного организма вызывают альтерации в структуре, плотности и пределах распространения популяции вида [7], а острое действие пониженной концентрации кислорода на организм может вызывать летальный исход. Известно, что у некоторых гидробионтов развиты физиологические и биохимические механизмы адаптивного ответа на действие низких концентраций кислорода (в частности, снижение скорости метаболизма, питания и роста), которые дают им возможность переживать такие неблагоприятные условия среды обитания, но ответ на молекулярном уровне на действие гипоксии/аноксии по большей части неизвестен [3].
Цель работы: с помощью метода ДНК-комет показать (выявить) уровень повреждения ДНК в клетках жабр моллюсков C. japonica , испытывающих воздействие низких концентраций кислорода в естественной среде обитания.
Материалы и методы исследования. В работе использовали половозрелых особей (30-34мм) двустворчатого моллюска C. japonica . Отбор животных выполняли в весеннее время при температуре воды 14-15оС в 2-х районах эстуария р. Арте-мовки: 1) в полноводной части и 2) на обнажающейся во время отливов отмели. В районе, прилегающем к эстуарию р. Артемовка характерен спад производства, что в значительной мере снижает негативное воздействие на водные экосистемы. Выловленных моллюсков доставляли в лабораторию в течение 2-х часов. После 2-х дневной адаптации при температуре воды 16-18оС проводили исследование степени повреждения ДНК клеток жабр и концентрацию МДА. Степень развития окислительного стресса оценивали по изменению концентрации малонового диальдегида (МДА) как конечного продукта перекисного окисления липидов (ПОЛ) [6].
При определении количества повреждений в молекуле ДНК использовали щелочной вариант кометного анализа [9], адаптированного к морским организмам [8]. В основе метода лежит опосредованная воздействием постоянного электрического поля миграция ДНК единичных клеток в агарозном геле. Наблюдаемый при этом во флуоресцентном микроскопе геном индивидуальной клетки представлен в виде электрофоретического следа, или так называемой «кометы». Критериями оценки степени фрагментации ДНК в клетке являются длина хвоста кометы и доля мигрировавшей ДНК [2]. Метод включает в себя следующие этапы: приготовление гель-слайда, лизис клеток, щелочную инкубацию, электрофорез, нейтрализацию, окраску слайдов, анализ и обработку данных. Визуализацию и регистрацию ДНК-комет осуществляли с помощью сканирующего флуоресцентного микроскопа (Zeiss, AxioImager A1), оснащенного цифровой фотокамерой AxioCam MRc. Для обработки цифровых изображений была использована компьютерная программа CometScore Freeware v1.5, которая позволяет вычислять различные параметры комет, указывающие на степень повреждения клеточной ДНК. В работе определяли в каждой комете два параметра: долю ДНК в хвосте кометы и длину хвоста кометы [1].
Результаты и обсуждение. Результаты экспериментов показали, что после электрофореза молекула ДНК клеток жабр корбикулы, собранной в 1-м районе не имела значительных повреждений, т.к. на микрофотографии отчетливо просматривается яркое ядро (рис. 1). Данные кометы можно отнести к двум классам С0 и С1, которые характеризуют клетки как жизнеспособные. В то же время у моллюсков, отобранных в литоральной зоне, наблюдаются кометы, которые принадлежали преимущественно к классам С2 и С3, что свидетельствует о более глубоком уровне фрагментации молекулы ДНК.
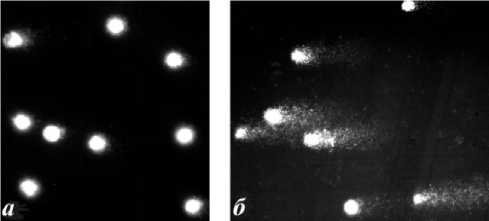
Рис. 1. Микрофотографии комет, формируемые клетками жабр C. japonica собранных в эстуарии р. Артемовки: а – полноводная часть эстуария (район 1); б – обнажающаяся отмель (район 2)
В приведенной ниже табл. 1 указаны параметры (доля ДНК в «хвосте» и длина «хвоста») полученных комет, отражающие степень повреждения ДНК клеток жабр корбикул, рассчитанные с использованием компьютерной программы. Также в табл. 1 приведена концентрация малонового диальдегида (МДА) в жабрах моллюсков, обитающих в разных районах эстуария р. Артемовки. Зависимость % поврежденности ДНК от содержания МДА в жабрах корбикулы показана на рис. 2.
Таблица 1. Основные параметры ДНК-комет клеток жабр и концентрация МДА жаберной ткани моллюсков C. japonica, собранных в разных районах эстуария р. Артемовка (среднее ± стандартное отклонение, n=15)
|
Места сбора моллюсков |
Длина «хвоста» комет |
% ДНК в «хвосте» комет |
МДА (нмоль/г сырой ткани) |
|
район 1 |
5,00±3,8 |
4,33±2,1 |
3,46±0,59 |
|
район 2 |
48,68±13,2* |
31,88±10,20* |
14,22±1,28* |
Примечание: * – достоверное отличие (Р ≤ 0,05) по сравнению с районом 1. Достоверность различий оценивалась с использованием непараметрического критерия Даннета
В ходе проведенного исследования было выявлено, что моллюски, обитающие в зоне влияния приливов и отливов, находятся в неблагоприятных условиях существования, т.к. практически 1/3 ДНК жабр C. japonica имеет выраженные деструктивные изменения (табл. 1). Следует отметить, что для корбикул из района 2 характерно значительное увеличение содержания МДА более, чем в 4 раза, относительно тех, которые обитают в районе 1. Важно подчеркнуть, что у животных, находящихся в относительно стабильных условиях (район 1), отмечено отсутствие ДНК-разрывов или слабое их проявление (рис. 2).
Известно, что массовые скопления C. japoni-ca в заливе Петра Великого формируются на глубине от 1 до 3 м. Обитание на литорали не является характерным для моллюсков и объясняется их случайным заносом во время паводков [4], что так же указывает на чувствительность корбикул к дефициту кислорода.
Выводы: колебание концентраций кислорода в среде действительно является одним из важнейших абиотических факторов для морских организмов. Исходя из полученных результатов, следует, что дефицит кислорода в среде обитания оказывает отрицательное воздействие на моллюсков, которое проявляется в виде нарушения целостности молекулы ДНК. Такая ответная реакция организма, в свою очередь, может привести к мутациям и злокачественным перерождениям клеток [5]. Генотоксичность аноксии зависит от времени отсутствия кислорода в среде. При этом, если не нарушается баланс между уровнем повреждения ДНК и эффективностью системы репарации ДНК, не появятся необратимые токсические эффекты.
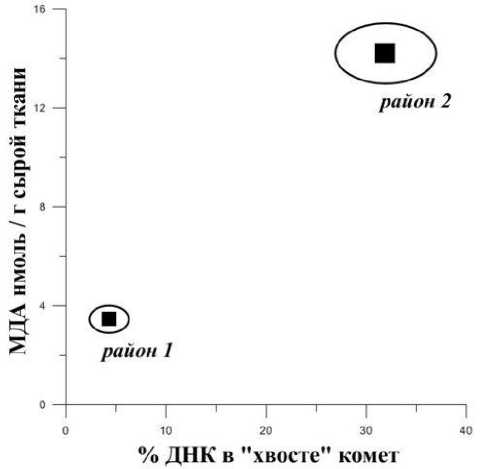
Рис. 2. Зависимость уровня повреждения ДНК жаберных клеток от содержания МДА в жабрах C. japonica собранной в 2-х районах эстуария р. Артемовка (n=15, P<0,05)
Список литературы Влияние дефицита кислорода на целостность ДНК клеток жабр двустворчатого моллюска Corbicula japonica
- Слободскова, В.В. Оценка генотоксичности кадмия в клетках жабр двустворчатого моллюска Corbicula japonica с помощью метода ДНК-комет/В.В. Слободскова, Е.Е. Солодова, Е.Н. Слинько, В.П. Челомин//Биол. моря. 2010 а. Т. 36, № 4. С. 303-308.
- Тронов, В.А. Метод ДНК-комет индивидуальных клеток. Принцип и применение метода/В.А. Тронов, И.И. Пелевина//Цитология. 1996. Т. 38, № 4/5. С. 427-439.
- Фокина, Н.Н. Липидный состав мидий Mytilus edulis L. Белого моря. Влияние некоторых фактров среды обитания/Н.Н. Фокина, З.А. Нефедова, Н.Н. Немова. -Петрозаводск: Карельский науч. центр РАН, 2010. 243 с.
- Явнов, С.В. Корбикула/С.В. Явнов, В.А. Раков. -Владивосток: ТИНРО-центр, 2002. 145 с.
- Bjelland, S. Mutagenicity, toxicity and repair of DNA base damage induced by oxidation/S. Bjelland, E. Seeberg//Mutat. Res. 2003. Vol. 531. P. 37-80.
- Buege, J.A. Microsomal lipid peroxidation/J.A. Buege, S.D. Aust//Methods in Enzymology. -N.Y., Academic Press, 1978. Vol. 52. P. 302-310.
- Burnett, L.E. Phisiological Responses to Hipoxia/L.E. Burnett, W.B. Stickle//Coastal Hypoxia: Consequences for Living Resourses and Ecosustems. -Coastal and Estuarine Studes. 2001. P. 101-114.
- Mitchelmore, C.L. Detection of DNA strand breaks in isolated mussels (Mytilus edulis) digestive gland cells using the “Comet” assay/C.L. Mitchelmore, C. Birmelin, D.R. Livingstone, J.K. Chipman//Ecotoxicology and Environmental Safety. 1998. Vol. 41. P. 51-58.
- Singh, N.P. A simple technique for quantitation of low levels of DNA damage in individual cells/N.P. Singh, M.T. McCoy, R.R. Tice, E.L. Schneider//Exp. Cell Res. 1988. Vol. 175. P. 184-191.


