Влияние длины интродьюсера на частоту окклюзии лучевой артерии при лечебных и диагностических эндоваскулярных процедурах: пилотное рандомизированное исследование
Автор: Сапожников Станислав Сталикович, Бессонов И.С., Зырянов И.П., Криночкин Д.В., Баскакова Т.Н.
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Эндоваскулярная хирургия
Статья в выпуске: 2 т.23, 2019 года.
Бесплатный доступ
Цель Изучить влияние длины интродьюсера при трансрадиальных лечебных и диагностических эндоваскулярных вмешательствах на частоту окклюзии лучевой артерии. Методы В исследование включены 100 пациентов, которым планировались коронароангиография или чрескожное коронарное вмешательство. Пациенты были рандомизированы на две группы в зависимости от длины интродьюсера. Основную группу исследования составили 50 пациентов, которым трансрадиальные коронароангиографию и/или чрескожное коронарное вмешательство выполняли с использованием интродьюсера длиной 25 см, диаметром 6 Fr (Radifocus Introducer II, Terumo, Япония), однако один пациент был потерян для анализа по причине экстренного перевода в другой стационар и не был учтен для сравнения исходов; n = 49. В группу сравнения вошли 50 пациентов, которым трансрадиальные эндоваскулярные процедуры проводили с использованием интродьюсера длиной 10 см, диаметром 6 Fr (Radifocus Introducer II, Terumo, Япония); n = 50. Первичной конечной точкой исследования являлась частота окклюзии лучевой артерии по данным ультразвуковой допплерографии в ближайшем госпитальном периоде (от 1 до 10 дней). Вторичными конечными точками были гематомы, перфорация или диссекция лучевой артерии, неврит срединного нерва, кровотечение места пункции, частота конверсии типа иглы во время пункции, время пункции, время процедуры от установки интродьюсера до его извлечения, продолжительность рентгеноскопии и величина поглощенной дозы total air kerma. Результаты Средний возраст пациентов составил 60,7 ± 10,6 года. Анализ первичной конечной точки исследования показал отсутствие статистически значимых различий по частоте возникновения окклюзии лучевой артерии в обеих группах наблюдения (8,2 против 4,0%, р = 0,436). Анализ вторичных конечных точек не показал различий по частоте постпункционных гематом (16,3 против 16,0%, р = 0,965) и локальных кровотечений (2,0 против 0,0%, р = 0,310). Также отмечено отсутствие таких осложнений, как перфорация/диссекция лучевой артерии либо неврит срединного нерва. Однако отмечено увеличение частоты конверсии типа иглы больным группы длинного интродьюсера (10,2 против 0,0%, р = 0,027). Также продемонстрировано увеличение продолжительности пункции (94,0 [67,5; 162,5] против 42,5 [33,0; 65,3] с, р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Окклюзия лучевой артерии, осложнение места доступа, трансрадиальный доступ, чрескожное коронарное вмешательство
Короткий адрес: https://sciup.org/142230696
IDR: 142230696 | DOI: 10.21688/1681-3472-2019-2-59-66
Текст научной статьи Влияние длины интродьюсера на частоту окклюзии лучевой артерии при лечебных и диагностических эндоваскулярных процедурах: пилотное рандомизированное исследование
Сапожников С.С., Бессонов И.С., Зырянов И.П., Криночкин Д.В., Баскакова Т.Н. Влияние длины интродьюсера на частоту окклюзии лучевой артерии при лечебных и диагностических эндоваскулярных процедурах: пилотное рандомизированное исследование. Патология кровообращения и кардиохирургия. 2019;23(2):59-66. http://
Ежегодно в нашей стране увеличивается число эндоваскулярных диагностических и лечебных процедур, таких как коронарная ангиография (КАГ) и чрескожное коронарное вмешательство (ЧКВ). При этом определяется увеличение частоты использования лучевого артериального доступа (ЛАД). Согласно данным за 2016 г., в Российской Федерации более 75% КАГ и более 74% ЧКВ выполнены с использованием лучевого артериального доступа [1].
Для эндоваскулярного вмешательства впервые ЛАД использован в 1989 г. [2]. Метод получил широкое распространение в клинической практике, так как обладает рядом преимуществ. В сравнении с бедренным, лучевой артериальный доступ позволяет значительно снизить количество осложнений места пункции [3]. Ввиду поверхностного расположения лучевой артерии существует возможность проведения эффективного гемостаза, даже на фоне приема антикоагулянтов и ингибиторов гликопротеиновых IIb/IIIa рецепторов тромбоцитов [4–7]. Так, у пациентов после ЛАД определяется очень низкая частота развития геморрагических осложнений (<1/1000) [2]. В соответствии с европейскими рекомендациями по реваскуляризации миокарда, использование ЛАД показано во всех случаях КАГ и ЧКВ (класс рекомендаций I, уровень доказательности А) [8].
Несмотря на все преимущества, в 1–10% случаев после трансрадиальной пункции у пациентов определяется окклюзия лучевой артерии (ОЛА). Зачастую ОЛА имеет бессимптомное клиническое течение [9]. Однако наличие ОЛА не позволяет использовать ЛАД для последующих вмешательств. Среди основных механизмов развития ОЛА выделяют эндотелиальное повреждение, а также снижение или полную остановку кровотока по артерии после введения интродью-сера. Это приводит к тромбообразованию и является предрасполагающим фактором для развития ОЛА [10–12]. Учитывая вышеописанные механизмы, можно предположить, что использование интродьюсера увеличенной длины позволит исключить возможность эндотелиального повреждения лучевой артерии при проведении и смене катетеров во время эндоваскулярных процедур и тем самым сократить частоту окклюзий лучевой артерии.
Целью исследования являлось изучение влияния длины интродьюсера при трансрадиальных лечебных и диагностических эндоваскулярных вмешательствах на частоту окклюзий лучевой артерии.
Методы
Представленная работа является проспективным пилотным простым слепым рандомизированным исследованием (рис. 1). Критериями включения были: возраст не менее 18 лет, техническая возможность использования ЛАД, подписанная форма информированного согласия. Критерием исключения являлась невозможность выполнения эндоваскулярной процедуры с использованием лучевого артериального доступа.
Для участия в исследовании скринированы 107 последовательных пациентов, которым в Тюменском кардиологическом научном центре в 2019 г. планировалось выполнение КАГ или ЧКВ. Далее 7 больных
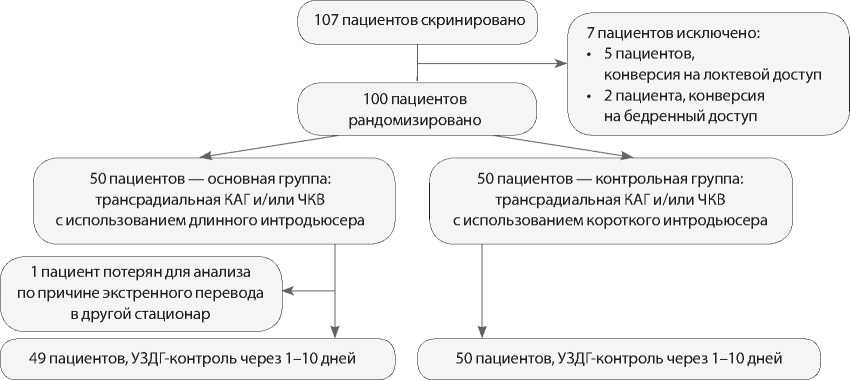
Рис. 1. Дизайн исследования. КАГ — коронарная ангиография; ЧКВ — чрескожное коронарное вмешательство; УЗДГ — ультразвуковая допплерография
исключены в связи с невозможностью ЛАД. Пациенты рандомизированы методом генерации случайных чисел на удаленном сайте непосредственно перед выполнением процедуры на две группы, в зависимости от длины интродьюсера. Основную группу исследования составили 50 пациентов, которым трансрадиальные КАГ и/или ЧКВ выполнялись с использованием длинного интродьюсера, однако один пациент потерян для анализа по причине экстренного перевода в другой стационар и не учтен для сравнения исходов. Группу сравнения составили 50 пациентов, которым трансрадиальные эндоваскулярные процедуры выполнялись с использованием короткого интродьюсера. В основной группе больных использовали интродьюсер Radifocus Introducer II (Terumo, Япония), длиной 25 см, диаметром 6 Fr, оснащенный внутренней металлической иглой вместе с пластиковой канюлей 20 G и гидрофильным проводником. В контрольной группе применяли ин-тродьюсер Radifocus Introducer II (Terumo, Япония), длиной 10 см, диаметром 6 Fr, оснащенный иглой 21 G и стальным проводником (рис. 2).
Первичной конечной точкой исследования являлась частота ОЛА по данным ультразвуковой допплерографии (УЗДГ) в ближайшем госпитальном периоде (от 1 до 10 дней). Вторичными конечными точками были: гематомы, перфорация или диссекция лучевой артерии, неврит срединного нерва, кровотечение места пункции, частота конверсии типа иглы во время пункции, время пункции, время процедуры от установки интродьюсера до его извлечения, продолжительность рентгеноскопии и величина поглощенной дозы total air kerma (мГр). Локальные гематомы классифицированы по следующей шкале: I — диаметр не более 5 см, II — не более 10 см, III — более 10 см, но не выше локтя, IV — выше локтя, V — с угрозой ишемии руки [13]. Исследование одобрено локальным этическим комитетом, протокол № 146, дата заседания 11.02.2019 г. Все пациенты подписали информированное согласие.
Все эндоваскулярные вмешательства выполнялись 5 опытными эндоваскулярными хирургами. Процедуры КАГ и ЧКВ выполняли на ангиографическом комплексе Allura Clarity (Phillips, Нидерланды). После установки интродьюсера вводили 10 мкг раствора нитроглицерина, а также при КАГ 5 000 ед. гепарина, а при ЧКВ 7 500 ед. гепарина. Затем последовательно выполняли катетеризацию и контрастирование левой и правой коронарных артерий диагностическими катетерами 6 Fr, либо при проведении ЧКВ выполняли катетеризацию и
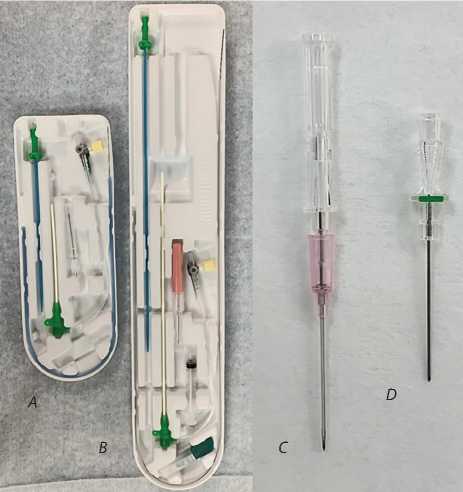
Рис. 2. Интродьюсер Radifocus Introducer II (Terumo, Япония), диаметром 6 Fr и длиной 10 см, оснащенный иглой 21 G и стальным проводником (А); интродьюсер Radifocus Introducer II (Terumo, Япония), диаметром 6 Fr, длиной 25 см, оснащенный внутренней металлической иглой вместе с пластиковой канюлей 20 G и гидрофильным проводником (B); внутренняя металлическая игла вместе с пластиковой канюлей 20 G (C); металлическая игла 21 G (D)
контрастирование при помощи проводниковых катетеров 6 Fr. После извлечения интродьюсера накладывали стандартную давящую повязку на 6 ч.
Контрольную УЗДГ выполняли на аппарате iE 33 (Phillips, Нидерланды) не ранее чем через 24 ч после процедуры. Анализ первичной и вторичных конечных точек осуществлен для всех пациентов группы короткого интродьюсера, а в группе длинного интродьюсе-ра один больной потерян для контроля из-за экстренного перевода в другой стационар.
Статистический анализ
Статистическую обработку полученных данных проводили с использованием пакета статистических прикладных программ (SPSS Inc., версия 21.0). Результаты представлены в виде М ± SD при нормальном распределении; при асимметричном распределении значения представлены медианой с интерквартильным размахом, Me (25%; 75%). Распределение количественных переменных оценивали с помощью критерия Колмогорова – Смирнова. При сопоставлении количественных переменных применяли непараметрический критерий Манна – Уитни. Для сопоставления качественных перемен-
Таблица1 Клиническая и процедурная характеристика обследованных пациентов
|
Исход лечения |
Все пациенты, n = 99 |
Основная группа, n = 49 |
Контрольная группа, n = 50 |
p |
|
Возраст, лет |
60,7 ± 10,6 |
58,0 ± 11,2 |
63,5 ± 9,3 |
0,025 |
|
Мужской пол |
63,0 (63,6) |
35,0 (71,4) |
28,0 (56,0) |
0,144 |
|
Индекс массы тела |
31,6 ± 5,8 |
31,5 ± 5,5 |
31,8 ± 6,2 |
0,682 |
|
Сахарный диабет в анамнезе |
21,0 (21,2) |
11,0 (22,4) |
10,0 (20,0) |
0,810 |
|
ЛАД в анамнезе |
33,0 (33,3) |
14,0 (28,5) |
19,0 (38,0) |
0,395 |
|
Прием антикоагулянтов |
29,0 (29,3) |
10,0 (20,4) |
19,0 (38,0) |
0,077 |
|
КАГ |
82,0 (82,8) |
43,0 (87,7) |
39,0 (78,0) |
0,287 |
|
ЧКВ |
9,0 (9,1) |
4,0 (8,1) |
5,0 (10,0) |
1,000 |
|
КАГ + одномоментное ЧКВ |
8,0 (8,1) |
2,0 (4,0) |
6,0 (12,0) |
0,269 |
|
1 |
32,0 (32,3) |
17,0 (34,7) |
15,0 (30,0) |
0,671 |
|
2 |
20,0 (20,2) |
9,0 (18,3) |
11,0 (22,0) |
0,803 |
|
Хирурги 3 |
21,0 (21,2) |
10,0 (20,4) |
11,0 (22,0) |
1,000 |
|
4 |
24,0 (24,2) |
12,0 (24,5) |
12,0 (24,0) |
1,000 |
|
5 |
1,0 (2,0) |
1,0 (2,0) |
1,0 (2,0) |
1,000 |
Примечание. Данные представлены в виде абсолютного числа больных (%), М ± SD или Me (интерквартильный размах в виде 25-го и 75-го процентилей); ЛАД — лучевой артериальный доступ; КАГ — коронароангиография, ЧКВ — чрескожное коронарное вмешательство
ных использовали критерий Фишера. Различия между группами считали статистически значимыми при р<0,05.
Результаты
При анализе исходных параметров выявлено, что пациенты основной группы были моложе, однако по другим исходным клиническим и процедурным ха- рактеристикам группы сопоставимы. Необходимо отметить, что количество больных с повторным ЛАД, а также эндоваскулярные хирурги, выполняющие вмешательства, распределились в сравниваемых группах без статистических различий (табл. 1).
При анализе первичной конечной точки исследования (частота ОЛА) выявлено отсутствие статистически
Таблица 2 Частота окклюзии лучевой артерии в ближайшем госпитальном периоде
|
Показатель |
Основная группа, n = 49 |
Контрольная группа, n = 50 |
p |
|
ОЛА |
4,0 (8,2) |
2,0 (4,0) |
0,436 |
|
УЗДГ-контроль, дней |
1,6 ± 1,7 |
1,3 ± 0,9 |
0,330 |
|
I 8,0 (16,3) |
8,0 (16,0) |
0,965 |
|
|
II – |
– |
||
|
Гематома, ст. |
III – |
– |
|
|
IV – |
– |
||
|
V– |
– |
||
|
Перфорации/диссекции |
– |
– |
|
|
Неврит срединного нерва |
– |
– |
|
|
Конверсия иглы |
5,0 (10,2) |
0 (0) |
0,027 |
|
Кровотечение места пункции |
1,0 (2) |
0 (0) |
0,310 |
|
Время пункции, с |
94,0 [67,5; 162,5] |
42,5 [33,0; 65,3] |
<0,001 |
|
Время процедуры, с |
448,0 [337,5; 633,0] |
350,5 [307,0; 506,8] |
0,040 |
|
Время рентгеноскопии, с |
82,0 [48,5; 133,0] |
69,5 [48,0; 118,3] |
0,672 |
|
Total air kerma, мГр |
140,8 ± 97,7 |
128,2 ± 71,3 |
0,721 |
Примечание. Данные представлены в виде абсолютного числа больных (%), М ± SD или Me (интерквартильный размах в виде 25-го и 75-го процентилей); ЛАД — лучевой артериальный доступ; КАГ — коронароангиография,
ЧКВ — чрескожное коронарное вмешательство
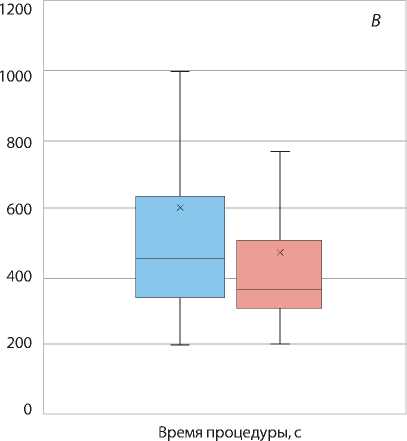
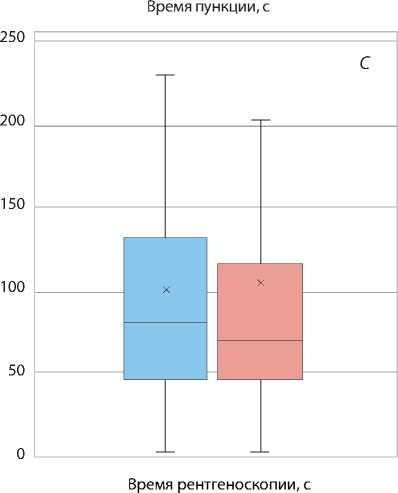
Рис. 3. Время пункции ( А ); время процедуры ( B ); время рентгеноскопии (C); total air kerma (D)
значимых различий между сравниваемыми группами (табл. 2). При этом УЗДГ-контроль в обеих группах проводился через одинаковый интервал времени после вмешательств.
При анализе вторичных конечных точек между группами не определялось различий по развитию локальных постпункционных гематом и частоте развития кровотечений из места пункции. В обеих группах не зафиксировано гематом выше I ст. Также отмечено отсутствие таких осложнений, как перфорация или диссекция лучевой артерии либо неврит срединного нерва. Однако выявлено увеличение частоты конверсии типа иглы больным группы длинного интродьюсера. Анализ временных характеристик эндоваскулярных процедур показал статистически значимое снижение времени пункции у пациентов в группе короткого интродьюсера и, соответственно, сокращение общего времени процедуры (рис. 3). Однако время рентгеноскопии статистически не различалось в обеих группах, а также показатель поглощенной дозы пациента total air kerma был сопоставим.
Обсуждение
По результатам нашего исследования, использование интродьюсеров длиной 25 см для диагностических и лечебных эндоваскулярных вмешательств не сопровождалось снижением частоты развития постоперационных ОЛА в сравнении с интродьюсерами длиной 10 см. Кроме того, применение более длинных интродью-серов характеризовалось увеличением времени пункции лучевой артерии и большей продолжительностью процедуры. На наш взгляд, во многом это обусловлено использованием пункционной иглы-канюли, которой комплектовались интродьюсеры длиной 25 см. По нашему опыту, применение этого типа пункционной иглы может представлять определенные трудности при сниженной пульсации или малом диаметре лучевой артерии. Подтверждением этого может являться тот факт, что в 10,2% случаев в основной группе пациентов проводилась конверсия иглы-канюли на стандартную пункционную иглу (20 G с металлическим проводником). Тем не менее в ряде проведенных исследований тип пункционной иглы не рассматривался как фактор, ассоциирующийся с развитием окклюзии лучевой артерии [14, 15].
Ранее изучены основные предикторы развития ОЛА после применения ЛАД. Среди них были выделены: возраст, женский пол, индекс массы тела и сахарный диабет в анамнезе [14, 15]. Диаметр интродьюсера и использование фармакологических препаратов, таких как антикоагулянты и вазодилататоры, также потенциально могут оказывать влияние на развитие ОЛА [16]. В исследовании C. Spaulding и соавт. диагностировали ОЛА у 71% пациентов, не получавших гепарин, у 24% пациентов, получавших 2 000–3 000 МЕ гепарина, и у 4,3% пациентов, получавших 5 000 МЕ гепарина (p<0,05) [17]. В недавно опубликованном метаанализе, включавшем три рандомизированных и восемь нерандомизированных исследований, сравненивалась частота развития ОЛА при использовании интродью-серов диаметром 5 и 6 F. Статистически значимой разницы в частоте ОЛА между двумя группами (отношение шансов 0,88 (0,50–1,56), р = 0,67) не обнаружено. Однако в метарегрессионном анализе наблюдалось увеличение преимуществ использования интродью-сера 5 Fr по мере возрастания процента женщин, включенных в исследование (р = 0,02) [18]. Следует отметить, что влияние длины интродьюсера на частоту ОЛА при транстрадиальных вмешательствах ранее не изучалось.
Основной причиной развития ОЛА является повреждение эндотелия во время вмешательства [10]. Данная гипотеза отчасти подтверждается в исследованиях, где применена безинтродьюсерная техника, когда специализированный проводниковый катетер SheathLessTM проводили непосредственно через прокол лучевой артерии до устья коронарной артерии. Эта методика исключает дополнительное повреждение лучевой артерии и статистически значимо сокращает частоту ОЛА в сравнении со стандартным ЛАД с использованием интродьюсера [19]. Однако безин-тродьюсерная методика не всегда может быть применена при выполнении лечебных и диагностических эндоваскулярных процедур. Теоретически интродью-сер длиной 25 см так же, как проводниковый катетер SheathLessTM, должен обеспечивать защиту лучевой артерии от эндотелиального повреждения. Однако полученные в нашем исследовании результаты продемонстрировали отсутствие влияния длины интродьюсера на развитие ОЛА. Таким образом, можно предположить, что наряду с повреждением эндотелия существуют дополнительные, требующие изучения механизмы развития окклюзий лучевой артерии.
Несмотря на все преимущества, при использовании ЛАД существует риск осложнений. Наряду с ОЛА в некоторых случаях развиваются кровотечения из места пункции, локальные и распространенные на предплечье гематомы, а также ложные аневризмы лучевой артерии [20]. Однако частота развития этих осложнений не превышает 5%, что подтверждают полученные нами данные [13]. В то же время при доступе через бедренную артерию у 4–9% больных возникают осложнения в виде кровотечений, гематом, ложных аневризм, артериовенозных фистул и ретроперитонеальных гематом. Это требует дополнительных вмешательств, приводит к задержке выписки пациента из стационара и удорожанию лечения [3, 21, 22].
Ограничения
Необходимо отметить, что наше исследование имеет ряд ограничений. Так, несмотря на рандомизированный характер исследования, пациенты основной группы были моложе. Исходные различия по возрасту в исследуемых группах в первую очередь связаны с включением в основную группу самого молодого (18 лет), а в группу сравнения самого пожилого пациентов (87 лет). Больные в группе сравнения чаще принимали антикоагулянты. Также для анализа результатов в основной группе был недоступен 1
пациент из-за перевода в другой стационар в связи с развившимся острым нарушением мозгового кровообращения.
Заключение
Применение интродьюсеров длиной 25 см не сопровождается снижением частоты развития окклюзии лучевой артерии в сравнении с интродьюсера-ми длиной 10 см. При этом использование более длинных интродьюсеров характеризуется увеличением времени пункции и общей продолжительности эндоваскулярных коронарных процедур.
Список литературы Влияние длины интродьюсера на частоту окклюзии лучевой артерии при лечебных и диагностических эндоваскулярных процедурах: пилотное рандомизированное исследование
- Алекян Б.Г., Григорьян А.М., Стаферов А.В. Рентгенэндоваскулярная диагностика и лечение заболеваний сердца и сосудов в Российской Федерации - 2016 год. М.: Ла График; 2017. 220 с.
- Campeau L. Percutaneous radial artery approach for coronary angiography. Cathet Cardiovasc Diagn. 1989; 16(1 ): 3-7. PMID: 2912567.
- Agostoni P., Biondi-Zoccai GG., de Benedictis M.L., Rigattieri S., Turri M., Anselmi M., Vassanelli C., Zardini P., Louvard Y., Hamon M. Radial versus femoral approach for percutaneous coronary diagnostic and interventional procedures: Systematic overview and meta-analysis of randomized trials. J Am Coll Cardiol. 2004; 44(2): 349-56. PMID: 15261930. DOI: 10.1016/j.jacc.2004.04.034
- Cooper C.J., El-Shiekh R.A., Cohen D.J., Blaesing L., Burket M.W., Basu A., Moore J.A. Effect of transradial access on quality of life and cost of cardiac catheterization: A randomized comparison. Am Heart J. 1999; 138(3 Pt 1): 430-6. PMID: 10467191. 10.1016/ s0002-8703(99)70143-2 DOI: 10.1016/s0002-8703
- Mann J.T. 3rd, Cubeddu M.G., Schneider J.E., Arrowood M. Right radial access for PTCA: a prospective study demonstrates reduced complications and hospital charges. J Invasive Cardiol. 1996; 8 Suppl. D: 40D-44D. PMID: 10785786.


