Влияние фармакотерапии на фармакокинетические параметры модельного субстрата антипирина - тест-свидетеля процессов элиминации ксенобиотиков в слюне у пациентов с психическими расстройствами
Автор: Шушпанова Т.В., Куприянова И.Е., Мандель А.И., Казенных Т.В., Новожеева Т.П., Счастный Е.Д., Перчаткина О.Э., Кисель Н.И., Украинцев И.И., Смирнова И.Н., Зайцев А.А., Селиванов Г.Ю., Васильева О.А.
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Психофармакотерапия
Статья в выпуске: 4 (125), 2024 года.
Бесплатный доступ
Актуальность. Лекарственные средства (ЛС), включая психотропные препараты, могут изменять активность микросомальных ферментов цитохром Р450-зависимой системы микросомального окисления (МОС) ксенобиотиков у пациента и приводить к изменению уровня ЛС за счет лекарственной интерференции, связанной с индукцией ключевых ферментов МОС, и к снижению эффективности терапии. Действие психотропных средств может в значительной степени зависеть от скорости их выведения из организма.
Психические расстройства, алкоголь, алпразолам, бромазепам, лития карбонат, галодиф, биотрансформация, фармакокинетика, антипирин, печень, ксенобиотик, цитохром р450, микросомальная система
Короткий адрес: https://sciup.org/142243741
IDR: 142243741 | УДК: 616.89-008.1:615.214:616-036.8:615:065:615.034 | DOI: 10.26617/1810-3111-2024-4(125)-66-81
Текст научной статьи Влияние фармакотерапии на фармакокинетические параметры модельного субстрата антипирина - тест-свидетеля процессов элиминации ксенобиотиков в слюне у пациентов с психическими расстройствами
В последние годы анализ фармакокинетических параметров (ФК) окислительного метаболизма ЛС приобретает всё большее значение при создании, исследовании и разработке оптимальных режимов фармакотерапии лекарственными препаратами с учетом взаимосвязи фармакокинетики и фармакодинамики в развитии фармакологических эффектов ЛС [1, 2, 3, 4, 5, 6]. Целью фармакокинетических исследований ЛС является: анализ скорости и интенсивности процессов биотрансформации, путей и скорости элиминации из организма для повышения эффективности терапии. Действие психотропных средств в значительной степени может зависеть от скорости их выведения из организма.
Механизмы лекарственных взаимодействий психотропных средств связаны с процессами биотрансформации препаратов ферментами микросомального окисления (МОС) цитохромов Р450 в печени. Ксенобиотики и многие психотропные препараты подвергаются метаболизму в результате МОС, связываясь с цитохромами Р450 – первичным звеном в окислительной ферментной системе. Различные ЛС могут повышать или снижать активность микросомальных ферментов моноокси- дазной цитохром Р450-зависимой системы [4, 5, 6, 7, 8, 9, 10]. Изменчивость цитохрома P450 (CYP) играет ведущую роль в метаболизме психотропных средств и подвержен изменению активности [11, 12, 13, 14]. Известно 18 семейств CYP450, из них в метаболизме ЛС наиболее активно участвуют CYP1, CYP2, CYP3, в том числе 43 подсемейства, включая CYP1A2, CYP3A4 и CYP2D6 [15].
Доля цитохрома 2D6 составляет всего 2% от всех ферментов CYP450, экспрессируемых в печени, однако он участвует в метаболизме примерно 20-25 % ЛС и большинства психотропных препаратов [16]. Данный ген имеет более 100 различных аллельных вариантов [17]. Эффективный уровень ЛС в организме больного может быть изменен за счет ингибирования или стимулирования индукции ключевых печеночных ферментов [14]. Эффективность психофармакотерапии может снижаться при совместном назначении психотропных средств ‒ индукторов микросомальных ферментов (барбитураты, рифампицин, изониазид, карбамазепин, фенитоин) в связи с усилением метаболизма препаратов [1, 12, 18, 19]. Использование психотропных препаратов, метаболизируемых CYP2D6, может потребовать корректировки дозы назначаемого препарата [20].
Фармакотерапия непсихотических психических расстройств включает различные психотропные ЛС: транквилизаторы, антидепрессанты, препараты лития [21, 22]. В целях воздействия на комплекс симптомов и быстрого достижения терапевтического эффекта используется полифармация. Однако при назначении разных препаратов могут иметь место лекарственные взаимодействия – фармакокинетическая интерференция, которая часто опосредуется микросомальной монооксигеназной ферментной системой печени, если какой-либо из препаратов, назначаемых совместно, воздействует на этот полиферментный комплекс. Для исключения подобных нежелательных взаимодействий следует учитывать влияние назначаемых психотропных ЛС на цитохром Р450-зависимый окислительный метаболизм ксенобиотиков в печени [5, 7, 9, 10, 14, 18, 23, 24, 25].
Изофермент CYP 2D6 участвует в метаболизме ЛС, экспрессируется в печени, тканях головного мозга, легких, сердце. Высокая межиндивидуальная вариабельность CYP 2D6 обусловлена генетическим полиморфизмом; описано более 100 аллелей, оказывающих различное влияние на активность данного изофермента [1]. Фермент также метаболизирует несколько эндогенных веществ, таких как гидрокситриптамины, нейростероиды, м-тирамин и п-тирамин, которые CYP2D6 метаболизирует в дофамин в мозге и печени. В гладком эндоплазматическом ретикуломе астроцитов и нейронов локализованы тканеспецифичные цитохромы Р450 [25], определяющие метаболизм лекарственных субстратов, проникающих через гематоэнцефалический барьер. Терапевтический эффект таких препаратов и величина клиренса (скорости выведения препарата) зависят от активности, в том числе МОС мозга. Тканеспецифичные цитохромы могут изменить метаболизм ЛС, что приводит к образованию токсичных или терапевтически неактивных метаболитов. Метаболизм разных психотропных ЛС в печени человека катализируют клинически важные цитохромы CYP2D6 и CYP3A4 [11]. Показано, что цитохром CYP2D6 экспрессируется в коре головного мозга человека, в черной субстанции (Substantia nigra – группа нейронов в среднем мозге, богатых темным пигментом нейромеланином), влияя на синтез дофамина [25, 27, 28]. Выяснение роли отдельных клинически важных цитохромов Р450 мозга или общего пула цитохромов в метаболизме каждого ЛС, выявление активности и регуляции активности МОС под воздействием ингибиторов и индукторов цитохромов Р450, определение скорости образования субстрат-ферментного комплекса, скорости элиминации ЛС – всё это является главным для предсказания механизма действия ЛС в организме пациента [18, 25].
Современные исследования отражают противоречивые данные воздействия различных бензодиазепинов на активность МОС печени. Выявлено воздействие хлозепида, диазепама, клоназепама и флунитразепама на активность изофермента цитохрома Р450 2D6. На фермент-индуцирующую активность данных препаратов указывает снижение их концентрации в крови при длительном применении [19, 28, 29].
В последние годы активно изучается протек-тивная роль микроэлементов, в частности лития, с профилактической и лечебной целью [30]. Литий обладает широким спектром биологической активности, не имеющим аналогов. Карбонат лития является «золотым стандартом» лечения аффективных расстройств. Современные исследования подтверждают нейропротекторный и нейро-регенеративный эффекты лития [31, 32, 33, 34, 35]. Литий ослабляет активность сигнальных каскадов, активируемых посредством NMDA-рецепторов [36, 37], блокирует апоптоз, защищая нейроны от глутаматной эксайтотоксичности [38]. Лития карбонат является препаратом выбора в терапии аффективных расстройств [39, 40, 41, 42]. В литературе недостаточно сведений относительно влияния соли лития на активность МОС печени. Несмотря на все положительные эффекты, препараты лития достаточно ограниченно применяются в клинической практике из-за сложностей в подборе терапевтической дозы и необходимости мониторирования его концентрации.
Использование психотропных препаратов, метаболизируемых CYP2D6, в современной клинической практике требует проведения исследований возможной фармакокинетической интерференции совместно назначаемых препаратов. Изучение динамики фармакокинетических параметров инновационного антиконвульсанта галодифа и уровень цитохром Р450-зависимой МОС печени крыс линии Вистар в дозе 100 мг/кг массы тела при различных сроках длительности введения обнаружило фермент-индуцирующие действие галодифа на МОС [9, 10].
В связи с вышеизложенным следует отметить, что важной задачей для проведения рациональной фармакотерапии при совместном назначении нескольких препаратов является определение влияния этих препаратов на функцию биотрансформации ксенобиотиков печени у пациентов.
ЦЕЛЬ ИССЛЕДОВАНИЯ
Оценить влияние психофармакотерапии традиционно используемых психотропных препаратов и оригинального антиконвульсанта галодифа (мета-хлорбензгидрилмочевины) на скорость метаболизма модельного субстрата антипирина в слюне у пациентов с психическими расстройствами.
МАТЕРИАЛЫ И МЕТОДЫ
Исследование проведено на базе отделений пограничных и аддиктивных состояний НИИ психического здоровья Томского НИМЦ РАН. В исследование было включено 34 пациента с непсихотическими психическими расстройствами. Клиническую верификацию проводили согласно критериям МКБ-10. В соответствии с диагнозом по МКБ-10 пациенты с непсихотическими психическими расстройствами были распределены по 3 группам: 1-я группа (n=12) – расстройство адаптации с преобладанием других эмоций (F43.23) и расстройство адаптации со смешанным нарушением эмоций и поведения (F43.25), 2-я группа (n=12) – органическое эмоционально лабильное (астеническое) расстройство в связи с сосудистым заболеванием головного мозга (F06.61), 3-я группа (n=10) – смешанное тревожное и депрессивное расстройство (F41.2). У пациентов с алкогольной зависимостью (n=36) выставлены диагнозы: синдром зависимости от алкоголя, в настоящее время воздержание на фоне лечения (F10.232) и синдром отмены алкоголя, неосложненный (F10.302). Все пациенты клинической выборки были мужского пола, проживали в Томске, их средний возраст составил 42,73±4,39 года. В основной группе исследования проводили оценку фермент-индуцирующего действия оригинального антиконвульсанта галодифа на ФК параметры модельного субстрата АП.
Группу сравнения составили 20 здоровых добровольцев, стандартизированных по полу и возрасту с пациентами основной группы, которым назначали разовую дозу АП для определения фармакокинетических параметров препарата в качестве тест-свидетеля процессов элиминации.
Из исследования исключались пациенты с сопутствующими психическими расстройствами психотического регистра: шизофрения (F20), биполярное аффективное расстройство (F31), психические и поведенческие расстройства (F00-F99, F10-F19), с заболеваниями нервной системы: эпизодические и пароксизмальные расстройства, включающие эпилепсию (G40), болезни нервной системы (G00-G99), с болезнями системы кровообращения (I00-I99), с болезнями мочеполовой системы (N00-N99) и болезнями печени (К70-К77) , в состоянии острого течения или обостре ния хронических соматических заболеваний, а также в случае отказа от участия (отсутствие информированного согласия).
С целью дифференциальной диагностики при поступлении в клинику пациентам проводили УЗИ сердца и ЭКГ. У больных не обнаружены признаки органического поражения сердечно-сосудистой системы. Наблюдалась умеренная синусовая тахикардия – увеличение частоты сердечных сокраще- ний (90-100 в мин), повышение интервала РQ (увеличение времени проведения импульса до 0,4-0,6 с), что является характерным признаком, связанным с проявлением вегетативной реакции. По результатам ЭЭГ, у обследуемых больных не было данных, подтверждающих эпиактивность, и не регистрировались очаги патологической активности. Наблюдались умеренные общемозговые изменения с усилением восходящего активирующего влияния срединно-стволовых структур на кору головного мозга, гиперреактивность на внешние сенсорные стимулы, косвенные признаки вегетативной лабильности.
У пациентов 1-й группы с расстройством адаптации наблюдались эмоциональные и поведенческие нарушения, тенденция к фиксации на стрессовой ситуации с драматизацией, переживанием неспособности с ней справиться, принять или приспособиться к ней. Психический статус характеризовался пониженным настроением, тревогой и беспокойством в обыденных ситуациях, психовегетативными нарушениями в виде повышения АД, учащения пульса, головными болями, нарушениями сна. У пациентов 2-й группы органические психические расстройства сопровождались эмоциональной нестабильностью, утомляемостью с указанием на слабость, вялость или разнообразными неприятными физическими ощущениями (головокружение, тяжесть в голове), болями, связанными с метеозависимым компонентом, высоким уровнем внутреннего напряжения, конфликтностью, снижением когнитивного функционирования. Пациенты 3-й группы со смешанным тревожным и депрессивным расстройством характеризовались быстрой утомляемостью, чрезмерной слабостью, сниженным настроением и/или резкой сменой настроения, рассеянностью, неспособностью сосредоточиться, агрессивностью, раздражительностью. Пациенты с алкогольной зависимостью в абстинентном и постабстинентном состоянии характеризовались упадком сил, снижением физической и психической активности, эмоциональной нестабильностью, нарушением концентрации внимания, забывчивостью, невнимательностью, склонностью к деструктивному поведению.
Основу фармакотерапии невротических, связанных со стрессом и соматоформных расстройств, протекающих с аффективными проявлениями, составляли анксиолитики, антидепрессанты, нормотимические и вегетостабилизирую-щие средства (алпразолам, бромазепам, лития карбонат). Согласно поставленным диагнозам, пациентам 1-й группы в качестве средства основной терапии назначали алпразолам 0,5-1,5 мг/сут, 2-й группы – бромазепам 6-12 мг/сут, 3-й группы – лития карбонат 500-1000 мг/сут.
Продолжительность терапии во всех группах пациентов составила 21 день. Пациентам 2-й группы дополнительно назначали при инфузионном введении сосудистую терапию (винпоцетин), ноотропный препарат (пирацетам), а также витаминотерапию на протяжении всего курса лечения.
Оценку фермент-индуцирующего действия инновационного антиконвульсанта галодифа на параметры фармакокинетики АП проводили в слюне у добровольцев с назначением препарата в дозе 200 мг/сут, курсом 21 день, у пациентов с алкогольной зависимостью в дозе 300 мг/сут, курсом 21 день.
Процессы окислительной биотрансформации в печени исследуемых лиц оценивали по оценке уровня тест-свидетеля АП в слюне. Скорость метаболического клиренса АП не связана строго с количеством цитохрома Р450 в микросомах печени, однако в значительной степени связана с активностью печеночных ферментов, метаболизирующих лекарства. Проба с АП проводилась для определения фармакокинетических параметров препарата в качестве тест-свидетеля процессов элиминации из организма пациентов и добровольцев перед назначением исследуемых препаратов и после окончания курса терапии.
АП добровольцам и пациентам в дозе 10 мг/кг назначали однократно натощак. Пробы слюны собирали через 0,5; 1,0; 2,0; 3,0; 6,0; 12,0; 24,0 ч после приема тест-лекарства. Полученные образцы слюны хранили при температуре -200 С. Концентрацию АП оценивали по методике антипири-нового теста (Горштейн Э.С., Семенюк А.В., 1988) спектрофотометрически [43]. Содержание АП рассчитывали по графику, построенному по растворам АП возрастающей концентрации (0,5100 мкг/мл). Расчёт модельно-независимых параметров фармакокинетики: период полувыведения (Т1/2, ч), общий клиренс (CLt, мл/мин), площадь под фармакокинетической кривой (AUC, мкг^мин/мл) осуществляли по методу статистических моментов и интегральных модельнонезависимых параметров ФК (Пиотровский В.К., 1986) [44], что позволяло получить характеристику фармакокинетических процессов без применения структурных моделей путём оценки общих параметров, относящихся к организму в целом и не зависящих от типа и структуры модели (системных параметров).
Все обследуемые были информированы о цели проводимых исследований и дали информированное согласие. Статистическую обработку данных проводили с использованием стандартного программного обеспечения Statistika 12 для Windows на основе непараметрического критерия X Колмогорова-Смирнова. Выборки на нормальность распределения проверяли по тесту Шапи- ро–Вилкоксона. Полученные данные представлены в виде М±SD. Различия считали статистически значимыми при p<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Исследование влияния фармакотерапии психотропными препаратами бензодиазепинового ряда (алпразолам и бромазепам) у пациентов с расстройством адаптации и солей лития (лития карбонат) у пациентов со смешанным тревожнодепрессивным расстройством в качестве основных лечебных средств на фармакокинетические параметры элиминации тест-свидетеля препарата антипирина представило следующие результаты.
Приём алпразолама в качестве основной терапии пациентами 1-й группы в дозе 0,5-1,5 мг/сут, курсом 21 день статистически значимо не влиял на ФК параметры АП: период полувыведения АП (Т1/2), общий клиренс (CLt), площадь под фармакокинетической кривой (AUC). Алпразолам не изменял элиминацию АП из слюны пациентов как показатель состояния окислительного метаболизма ксенобиотиков в печени у пациентов 1-й группы. Полученные данные достаточно иллюстративны: параметры фармакокинетики антипирина при их оценке до проведения курса терапии с использованием алпразолама и после её завершения практически не различаются (табл. 1, рис. 1-3). Статистически значимых различий фармакокинетических параметров АП при проведении курсовой терапии с применением алпрозолама у пациентов не выявлено. Таким образом, в данной дозировке у исследуемых пациентов алпразолам не изменял фармакокинетику АП, что свидетельствует об отсутствии влияния на активность микросомальной монооксигеназной системы печени.
В литературе практически отсутствуют данные о влиянии алпрозолама на окислительный метаболизм ксенобиотиков в печени. Показано, что алпразолам может вызывать умеренную гепатомегалию, однако эта способность у препарата выражена слабо [28]. В эксперименте авторами не обнаружено значимых различий по общему количеству микросомального белка, общему содержанию микросомального цитохрома Р450 между группами животных, получавших алпразолам, и контролем. Таким образом, наши данные согласуются с литературными о безопасности применения алпразолама в терапевтически используемых дозах в связи с отсутствием индук-ции/ингибирования МОС печени у пациентов при проведении курса терапии.
У пациентов 2-й группы, получавших сосудистую и витаминотерапию по медицинским показаниям, до начала проведения исследования и назначения бромазепама наблюдалась ускоренная элиминация АП в сравнении с показателями в группе добровольцев, что связано с проведени- ем данной терапии, ускоряющей метаболизм ксенобиотиков. Некоторые витамины способны индуцировать цитохром Р450, а также использование сосудистой и витаминотерапии способно изменить кинетику АП, по-видимому, за счёт увеличения диуреза, повышения объема циркулирующей крови или вследствие изменения жидкостных объемов в организме. АП равномерно распределяется во всём объеме внеклеточной жидкости, и изменение этого объема может повлечь за собой соответствующее изменение фармакокинетики препарата.
При проведении курса терапии пациентам 2-й группы, получавших в качестве основной терапии бромазепам, отмечено изменение значений ФК параметров: увеличение параметра Clt (общий клиренс) АП и сокращение Т1/2 (время полувыведения), а также некоторое уменьшение параметра АUС (площадь под фармакокинетической кривой, концентрация ‒ время) (табл. 1, рис. 1-3). Статистически значимых различий исследуемых фармакокинетических параметров Т1/2, АUС антипирина на фоне терапии пациентов с применением бромазепама не выявлено, однако отмечено более значимое увеличение параметра Clt. Таким образом, применение бромазепама в используемой нами терапевтической дозировке не оказывало значимого влияния на активность микросомальной монооксигеназной системы печени у исследуемых пациентов.
Согласно данным H. Fukazawa et al. (1975) [45] относительно влияния бромазепама на активность цитохром Р450-зависимых монооксигеназ печени крыс при длительном введении препарата (14-28 дней) зарегистрированы ускорение собственной элиминации препарата, гепатомегалия и возрастание активности микросомальных монооксигеназ печени. Авторы считают, что бромазепам можно считать умеренной силы индуктором фенобарбиталового типа. Однако следует отметить, что индукция ферментов не наблюдалась в дозах ниже
-
5 мг/кг массы тела у экспериментальных крыс. Клинических исследований элиминации бромазепама авторами не проводилось. В нашем исследовании дозы, назначаемые пациентам в пересчёте на кг массы тела, были ниже минимальных индуцирующих доз, используемых в эксперименте у крыс по H. Fukazawa et al. (1975), длительность назначения препарата была сопоставима.
Таким образом, согласно полученным нами в ходе исследования данным и сведениям, имеющиеся в современной литературе, можно сделать вывод об отсутствии у бензодиазепиновых транквилизаторов алпразолама и бромазепама в используемых дозах у данного контингента больных значимого влияния на окислительный метаболизм ксенобиотиков в печени.
Внемодельные ФК параметры АП до и после курсовой терапии с применением лития карбоната у пациентов 3-й группы существенно не изменялись. Рхзница по периоду полувыведения практически отсутствует (Т1/2 ) , незначительно увеличивается общий клиренс (Cl tot ) АП после проведения терапии, уменьшаются среднее время элиминации и площадь под фармакокинетической кривой (AUC) (табл. 1, рис. 1-3). Таким образом, нами установлено, что терапия с применением лития карбоната в дозе 500-1000 мг у пациентов со смешанным тревожным и депрессивным расстройством статистически значимо не влияла на ФК параметры элиминации АП.
Фармакокинетические параметры антипирина на момент поступления пациентов на стационарное лечение и после курсового назначения алпразолама, бромазепама и лития карбоната приведены в таблице 1.
Полученные нами данные при обследовании пациентов с непсихотическими психическими расстройствами свидетельствуют об отсутствии у изучаемых психотропных препаратов в указанных дозировках влияния на активность микросомальной монооксигеназной системы печени.
Т а б л и ц а 1. Влияние фармакотерапии психотропными препаратами на параметры фармакокинетики тест-свидетеля антипирина в слюне пациентов с непсихотическими психическими расстройствами
|
Группа пациентов |
Т1/2, ч |
Cl tot , мл/мин |
AUC, мкг·мин/мд |
|
Пациенты с расстройством адаптации (п=12) до проведения терапии алпразоламом |
9,20±2,81 |
50,4±4,68 |
10,94±5,49 |
|
Пациенты на фоне терапии алпразоламом |
10,30±4,77 |
57,60±10,07 |
9,91±3,83 |
|
Пациенты с органическими психическими расстройствами (п=12) до проведения терапии бромазепамом |
4,46±1,25 |
109,60±40,80 |
12,08±6,27 |
|
Пациенты на фоне терапии бромазепамом |
3,27±1,74 |
282,21±85,96* |
10,0±4,01 |
|
Пациенты со смешанным тревожным и депрессивным расстройством (п=12) до проведения терапии лития карбонатом |
11,31±0,85 |
107,43±44,50 |
10,94±5,49 |
|
Пациенты на фоне терапии лития карбонатом |
11,26±3,82 |
129,24±48,32 |
9,91±3,83 |
П р и м е ч а н и е. Статистически значимые различия с показателями до лечения по λ -критерию Колмогорова-Смирнова: * ‒ р<0,05.
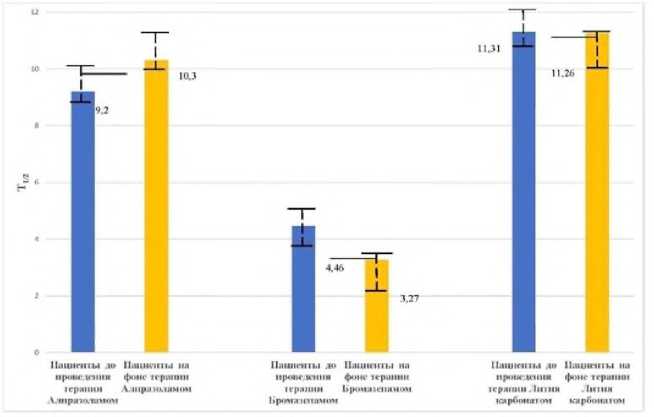
Р и с у н о к 1. Влияние фармакотерапии психотропными препаратами на период полувыведения (Т1/2) тест-свидетеля антипирина в слюне пациентов с непсихотическими психическими расстройствами
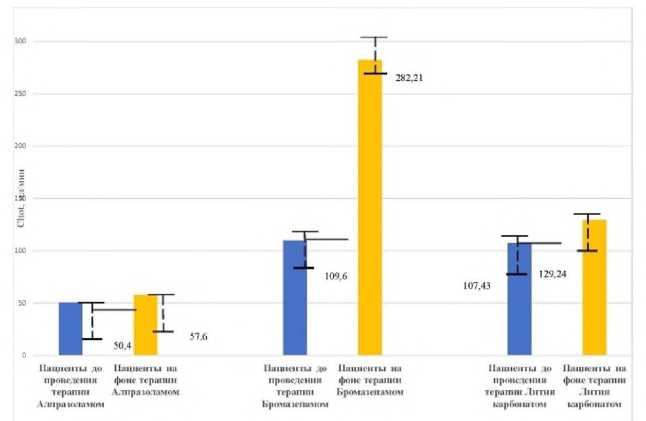
Рисунок 2. Влияние фармакотерапии психотропными препаратами на общий клиренс (CLt) тест-свидетеля антипирина в слюне пациентов с непсихотическими психическими расстройствами
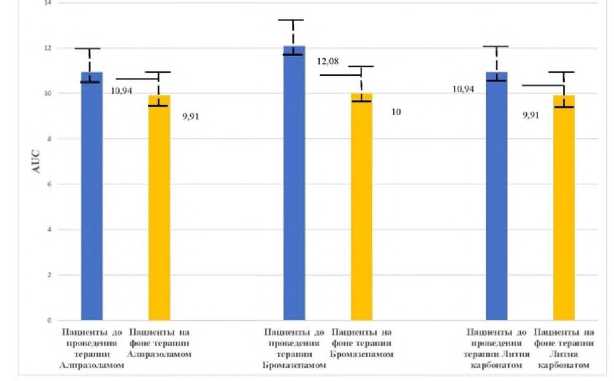
Рисунок 3. Влияние фармакотерапии психотропными препаратами на площадь под фармакокинетической кривой - «концентрация-время» (AUC) тест-свидетеля антипирина в слюне пациентов с непсихотическими психическими расстройствами
Механизмы взаимодействия данных ЛС с другими препаратами не связаны с индукцией или ингибированием печеночных ферментов. Следовательно, у этих препаратов имеются достаточно большие возможности варьирования дозировок в пределах терапевтического диапазона без риска вызвать аутоиндукцию метаболизма и снижение терапевтического действия. Полученные нами данные подтверждают отсутствие влияния алпразолама, бромазепама и лития карбоната на активность микросомальной монооксигеназной системы печени у пациентов с непсихотическими психическими расстройствами в исследуемых группах. Это позволяет более гибко подходить к проведению психофармакотерапии и повысить её эффективность.
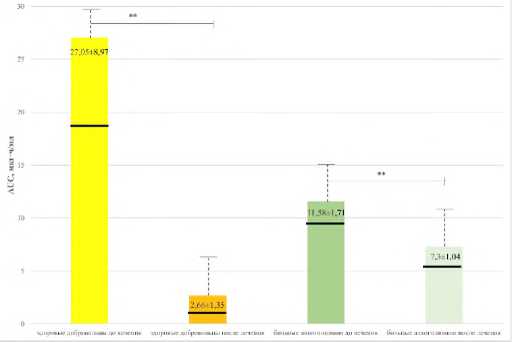
Исследование ФК параметров АП в слюне здоровых добровольцев после приема инновационного антиконвульсанта галодифа в дозе 200 мг/сут и у пациентов с алкогольной зависимостью в дозе 300 мг/сут в течение 21-дневной курсовой терапии обнаружило статистически значимое снижение периода полувыведения антипирина Т1/2 более чем в 2 раза из организма добровольцев, у пациентов с алкогольной зависимостью почти в 5 раз, значимое увеличение общего клиренса антипирина Clt, сокращение площади под фармакокинетической кривой AUC (табл. 2, рис. 4-6). Следует отметить, что у пациентов значительно повышен показатель клиренс антипирина (Clt) и снижен показатель «концентрация-время» (АUС), поскольку система МОС под влиянием алкоголя активируется и стимулирует детоксикационную функцию в организме.
Полученные результаты свидетельствуют об ускорении элиминации АП как у исследуемых добровольцев, так у и пациентов с алкогольной зависимостью вследствие активации микросомальной цитохром-Р450 оксидазной системы печени.
Таблица 2. Влияние фармакотерапии галодифом на параметры фармакокинетики тест-свидетеля антипирина в слюне здоровых добровольцев и пациентов с алкогольной зависимостью
|
Исследуемый параметр |
Здоровые добровольцы (n=20) |
Пациенты с алкогольной зависимостью (n=36) |
|
T1/2, ч до лечения T1/2, ч после лечения |
9,78±2,88 4,31±1,80** |
11,19±2,95 2,57±0,69* |
|
Clt, мл/мин до лечения Clt, мл/мин после лечения |
25,37±5,57 116,23±19,40** |
71,108±11,58 331,53±220,43** |
|
AUC, мкг^ч/мл до лечения AUC, мкг^ч/мл после лечения |
27,05±8,97 2,66±1,35** |
11,58±1,71 7,30±1,04** |
Примечание. Статистически значимые различия: * - с показателями до лечения по Х-критерию Колмогорова-Смирнова (р<0,01), ** - с показателями до лечения по Х-критерию Колмогорова-Смирнова (р<0,05).
Таким образом, у галодифа выявлено фермент-индуцирующее действие на систему МОС печени человека, он является индуктором МОС. Длительное применение галодифа может сопровождаться изменением фармакокинетики не только самого препарата, но и назначаемых совместно с ним ЛС в комплексной терапии, метаболизируемых цитохромом CYP2D6, что может привести к фармакокинетической лекарственной интерференции и потребовать корректировки используемой дозы препарата [24, 46]. В связи с этим при проведении психофармакотерапии и назначении галодифа пациентам необходима оценка активностей цитохромов Р450, отвечающих за биотрансформацию соответствующих препаратов в целях предупреждения взаимодействия последних на уровне системы микросомального окисления печени. Полученные нами результаты могут использоваться для оптимизации дозирования при терапии галодифом, обеспечивая терапевтический эффект при отсутствии или при минимальной выраженности побочного действия. Скорость метаболического клиренса АП не связана строго с количеством цитохрома Р450 в микросомах печени, однако он в значительной степени ассоциирован с активностью печеночных ферментов, метаболизирующих лекарства [23].
Изучение влияния индукции/ингибирования ферментов CYP450 необходимо учитывать в комплексной терапии в клинической практике в связи с вариабельной активностью этих ферментов и тесным взаимодействием с метаболизмом ЛС. Важной задачей при назначении ЛС является исследование фармакокинетических и фармакодинамических свойств препаратов и их взаимодействия для проведения эффективной терапии пациентам. У человека только одна изоформа CYP2D6 экспрессируется в различных тканях: печени, почках, плаценте, мозге, молочных железах, легких и тонком кишечнике. Генетический полиморфизм семейства CYP2D определяет вариации функциональной активности в метаболизме ЛС у человека, известно более 70 форм CYP2D6. Всего лишь 4% CYP2D6 от общего количества CYP экспрессируется в печени человека, вместе с тем этот фермент участвует в биотрансформации 30% ЛС в целом и в большей части психотропных препаратов [23, 47, 48, 49, 50, 51, 52].
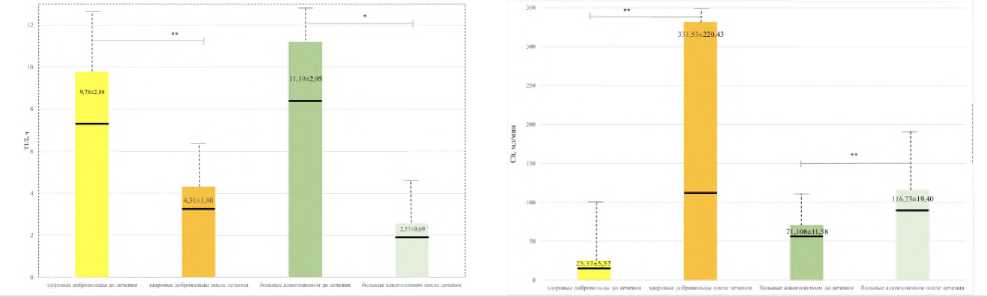
Р и с у н о к 4. Период полувыведения антипирина, Т1/2 Р и с у н о к 5. Общий клиренс антипирина, Clt
Р и сун о к 6. Площадь под фармакокинетической кривой антипирина в координатах «концентрация – время», АUС
П р и м е ч а н и е. На рисунках 4, 5, 6 приведены фармакокинетические параметры на фоне терапии галоди-фом в слюне в исследуемых группах здоровых добровольцев и пациентов с алкогольной зависимостью.
Статистически значимые различия с показателями до лечения по λ-критерию Колмогорова-Смирнова: * ‒ р<0,01, ** ‒ р<0,05.
Изоферменты микросомального окисления печени метаболизируют различные ЛС и многие ксенобиотики. В связи с этим свойством при одновременном назначении препаратов, обладающих индукцией МОС, возможно их лекарственное взаимодействие на уровне фармакокинетической интерференции с потенциальными нежелательными последствиями. Активность метаболизма каждого из препаратов в этом случае снижается в связи с конкурентным ингибированием микросомальных ферментов печени, что может приводить к повышению концентрации ЛС в крови пациентов, влиять на клиническую эффективность терапии, частоту и выраженность развития нежелательных эффектов. Детоксицирующая функция печени осуществляется при нормальном функционировании цитохром Р450-зависимой МОС гепатоцитов, метаболизирующей эндогенные токсины и ксенобиотики (в том числе и ЛС) и являющейся одним из ключевых механизмов детоксикации организма. Это является важным в связи с тем, что пациенты с непсихотическими психическими и аддиктивны-ми расстройствами принимают психотропные пре- параты либо в течение продолжительного времени, либо пожизненно, что может приводить к развитию лекарственного поражения печени и развитию печеночной недостаточности. В отличие от лекарственных препаратов, являющихся средствами активации МОС (фенобарбитал, пентобарбитал, бензонал и др.) и используемых в клинической практике, разрабатываемый нами препарат гало-диф воздействует на МОС печени, вызывая индукцию цитохрома Р450 [53], приводя к активации детоксицирующей функции печени при токсическом повреждении, обеспечивая защитные реакции гепатоцитов на окислительный стресс. Исследованные нами препараты алпразолам, бромазепам, лития карбонат не являются индукторами МОС, поэтому назначение данных препаратов не будет вызывать фармакокинетическую интерференцию ЛС и является безопасным.
ЗАКЛЮЧЕНИЕ
Полученные данные свидетельствуют об отсутствии у психотропных ЛС алпразолама, бромазепама, лития карбоната влияния на ФК параметры элиминации тест-свидетеля модельного субстрата
АП и, следовательно, на активность ферментов МОС печени у исследуемых пациентов. Механизмы взаимодействия данных психотропных ЛС у пациентов исследуемых групп не связаны с индукцией или ингибированием ферментов МОС, что свидетельствует об отсутствии лекарственной фармакокинетической интерференции. Результаты собственных исследований позволяют сделать вывод о том, что можно не опасаться непредсказуемых фармакокинетических взаимодействий при совместном назначении изученных препаратов с другими психотропными ЛС.
Сравнительное изучение влияния инновационного антиконвульсанта галодифа на ФК параметры АП у здоровых добровольцев и пациентов с алкогольной зависимостью обнаружило значимое влияние на ФК параметры элиминации АП и, следовательно, на активность ферментов МОС печени в отличие от исследуемых нами психотропных препаратов у пациентов с непсихотическими психическими расстройствами. Данная особенность галодифа стимулирует ускоренное выведение ксенобиотиков и продуктов их метаболизма из организма человека, что имеет особое значение при алкогольной интоксикации. Гало-диф не имеет существенного ограничения в сфере использования, поскольку не вызывает нежелательные побочные эффекты. Галодиф воздействует на МОС печени, вызывая индукцию цитохромов Р450, и обладает комплексным действием, связанным с противосудорожной и детоксикационной активностью, а также рекомендован при проведении длительной терапии в качестве средства, обладающего антипароксизмальной, нормотимической и антиалкогольной активностью.
Список литературы Влияние фармакотерапии на фармакокинетические параметры модельного субстрата антипирина - тест-свидетеля процессов элиминации ксенобиотиков в слюне у пациентов с психическими расстройствами
- Кукес В.Г., Иванец Н.Н., Сычев Д.А., Псарева Н.А. Фармакогенетика системы цитохрома Р450 и безопасность терапии антидепрессантами. Биомедицина. 2014. № 1. С. 57-80.
- Фаттахова А.Н. Методы молекулярной фармакологии. Казань: Изд-во Казан. ун-та, 2002. С. 21-22.
- Хоронько В.В., Макляков Ю.С., Сергеева С.А., Сафроненко А.В. Особенности фармакокинетики распределения актопротекторов бромантана и хлодантана у крыс. Биомедицина. 2005. № 1. С. 76-80.
- Coleman M.D. Human drug metabolism. Third Edition. New York: John Wiley & Sons, 2020:688.
- Li Y, Meng Q, Yang M, Liu D, Hou X, Tang L, Wang X, Lyu Y, Chen X, Liu K, Yu AM, Zuo Z, Bi H. Current trends in drug metabolism and pharmacokinetics. Acta Pharm Sin B. 2019 Nov;9(6):1113-1144. doi: 10.1016/j.apsb.2019.10.001. Epub 2019 Oct 18. PMID: 31867160; PMCID: PMC6900561.
- Manikandan P, Nagini S. Cytochrome P450 Structure, function and clinical significance: a review. Curr Drug Targets. 2018;19(1):38-54. doi: 10.2174/1389450118666170125144557. PMID: 28124606.
- Новожеева Т.П., Смагина М.И., Черевко Н.А., Фатеева С.Н. Бензобарбитал и фторбензобарбитал ‒ индукторы фенобарбиталового типа монооксигеназной системы печени. Бюллетень сибирской медицины. 2011. № 5. С. 78-81.
- Садырханова У.Ж., Байжанова К.Т., Садырханова Г.Ж., Несмеянова Е.П. Активность монооксигеназной и нитрергической систем в микросомах печени при действии на организм индукторов и ингибиторов лекарственного метаболизма. Вестник КазНМУ. 2016. № 1. С. 74-77.
- Shushpanova TV, Bokhan NA, Stankevich KS, Novozheeva T P, Mandel AI, Schastnyi ED, Kisel NI, Shushpanova OV, Udut VV, Safronov SM, Boev RS, Knyazeva EM. An innovatory GABA receptor modulator and liver oxidase system microsomal cytochrome P450 activator in patients with alcoholism. Pharmaceutical Chemistry Journal. 2021;54(11):1093-1100. https://doi.org/10.1007/s11094-021-02327-x
- Shushpanova TV, Bokhan N A, Kuksenok V Yu, Shtrykova VV, Shushpanova OV, Udut VV.A novel urea derivative anticonvulsant: in vivo biological evaluation, radioreceptor analysis of GABAA receptors and molecular docking studies of enantiomers. Mendeleev Communications. 2023;33(4):546-549. https://doi.org/10.1016/j.mencom.2023.06.034
- Грибакина О.Г., Колыванов Г.Б., Литвин А.А., Виглинская А.О., Жердев В.П. Фармакокинетические взаимодействия лекарственных веществ, метаболизируемых изоферментом цитохрома P450 CYP2C9. Фармакокинетика и фармакодинамика. 2016. № 1. С. 21-32.
- Смирнов В.В., Абдрашитов Р.Х., Егоренков Е.А., Гильдеева Г.Н., Раменская Г.В., Пермяков Р.А. Влияние изофермента CYP2D6 на метаболизм лекарственных препаратов и методы определения его активности. Ведомости Научного центра экспертизы средств медицинского применения. 2015. № 3. С. 32-35.
- Zanger UM, Turpeinen M, Klein K, Schwab M. Functional pharmacogenetics/genomics of human cytochromes P450 involved in drug biotransformation. Anal Bioanal Chem. 2008 Nov;392(6):1093-108. doi: 10.1007/s00216-008-2291-6. Epub 2008 Aug 10. PMID: 18695978.
- Zanger UM, Schwab M. Cytochrome P450 enzymes in drug metabolism: regulation of gene expression, enzyme activities, and impact of genetic variation. Pharmacol Ther. 2013 Apr;138(1):103-41. doi: 10.1016/j.pharmthera.2012.12.007. Epub 2013 Jan 16. PMID: 23333322.
- Thümmler S, Dor E, David R, Leali G, Battista M, David A, Askenazy F, Verstuyft C. Pharmacoresistant severe mental health disorders in children and adolescents: Functional abnormalities of cytochrome P450 2D6. Front Psychiatry. 2018 Jan 24;9:2. doi: 10.3389/fpsyt.2018.00002. PMID: 29472872; PMCID: PMC5810290.
- Kapur BM, Lala PK, Shaw JL. Pharmacogenetics of chronic pain management. Clin Biochem. 2014 Sep;47(13-14):1169-87. doi: 10.1016/j.clinbiochem.2014.05.065. Epub 2014 Jun 7. PMID: 24912048.
- Hicks JK, Swen JJ, Thorn CF, Sangkuhl K, Kharasch ED, Ellingrod VL, Skaar TC, Müller DJ, Gaedigk A, Stingl JC; Clinical Pharmacogenetics Implementation Consortium. Clinical Pharmacogenetics Implementation Consortium guideline for CYP2D6 and CYP2C19 genotypes and dosing of tricyclic antidepressants. Clin Pharmacol Ther. 2013 May;93(5):402-8. doi: 10.1038/clpt.2013.2. Epub 2013 Jan 16. PMID: 23486447; PMCID: PMC3689226.
- Иващенко Д.В., Терещенко О.В., Темирбулатов И.И., Акмалова К.А., Гришина Е.А., Застрожин М.С., Савченко Л.М., Брюн Е.А., Сычев Д.А. Фармакогенетика безопасности феназепама при синдроме отмены алкоголя: гаплотипический и комбинаторный анализ полиморфных вариантов генов фармакокинетических факторов. Неврология, нейропсихиатрия, психосоматика. 2020. Т. 12, № 2. C. 7-22doi: 10.14412/2074-2711-2020-2-17-22
- Малин Д.И., Рывкин П.В.Клинически значимые лекарственные взаимодействия при лечении антипсихотиками второго поколения. Современная терапия психических расстройств. 2021.№ 2. C. 36-45. doi: 10.21265/PSYPH.2021.57.2.005
- Bogni A, Monshouwer M, Moscone A, Hidestrand M, Ingelman-Sundberg M, Hartung T, Coecke S. Substrate specific metabolism by polymorphic cytochrome P450 2D6 alleles. Toxicol In Vitro. 2005 Aug;19(5):621-9. doi: 10.1016/j.tiv.2005.04.001. PMID: 15893449.
- ЛебедевА.А., ЛукашковаВ.В., ПшеничнаяА.Г., БычковЕ.Р., ЛебедевВ.А., РусановскийВ.В., ШабановП.Д. Эмоциогенные эффекты анторекса, нового антагониста OX1R, на проявления тревожности и компульсивности у крыс. Обзоры клинической фармакологии и лекарственной терапии. 2023. Т. 21, № 2. С. 151-158. doi:10.17816/RCF.212
- Васильева С.Н., Симуткин Г.Г., Счастный Е.Д., Лебедева Е.В., Бохан Н.А. Аффективные расстройства при коморбидности с алкогольной зависимостью: клинико-динамические особенности, уровень социальной адаптации больных. Бюллетень сибирской медицины. 2020. Т. 19, № 1. С. 29-35. doi:10.20538/1682-0363-2020-1-29-35
- Мирошников М.В., Султанова К.Т., Макарова М.Н., Макаров В.Г. Сравнительный обзор активности ферментов системы цитохрома P450 человека и лабораторных животных. Прогностическая ценность доклинических моделей in vivo. Трансляционная медицина. 2022. Т. 9, № 5. C. 44-77. doi: 10.18705/2311-4495-2022-9-5-44-77
- Сычёв Д.А., Отделенов В.А., Денисенко Н.П., Смирнов В.В. Изучение активности изоферментов цитохрома Р450 для прогнозирования межлекарственных взаимодействий лекарственных средств в условиях полипрагмазии. Фармакогенетика и фармакогеномика. 2016. № 2. С. 4-11.
- Фаттахова А.Н., Абдульянов А.В., Хакимова А.Ф., Мингалеева Э.Р. Цитохром-зависимый метаболизм психотропных лекарственных субстратов в микросомах коры головного мозга человека. Ученые записки Казанского государственного университета 2005. Т. 147, кн. 3. С. 111-115.
- Bertilsson L, Dahl ML, Dalén P, Al-Shurbaji A. Molecular genetics of CYP2D6: clinical relevance with focus on psychotropic drugs. Br J Clin Pharmacol. 2002 Feb;53(2):111-22. doi: 10.1046/j.0306-5251.2001.01548.x. PMID: 11851634; PMCID: PMC1874287.
- Chinta SJ, Pai HV, Upadhya SC, Boyd MR, Ravindranath V. Constitutive expression and localization of the major drug metabolizing enzyme, cytochrome P4502D in human brain. Brain Res Mol Brain Res. 2002 Jun 30;103(1-2):49-61. doi: 10.1016/s0169-328x(02)00177-8. PMID: 12106691.
- Pai HV, Upadhya SC, Chinta SJ, Hegde SN, Ravindranath V. Differential metabolism of alprazolam by liver and brain cytochrome (P4503A) to pharmacologically active metabolite. Pharmacogenomics J. 2002;2(4):243-58. doi: 10.1038/sj.tpj.6500115. PMID: 12196913.
- Pachecka J, Wegiełek J, Kobylińska K, Bicz W. Struktura benzodiazepin a ich działanie na mikrosomalne monooksygenazy watroby szczurów w podwyzszonej temperaturze otoczenia [Structure and effects of benzodiazepines on hepatic microsomal monooxygenases in rats exposed to environmental temperature]. Folia Med Cracov. 1990;31(3):217-24. Polish. PMID: 2097288.
- Rybakowski JK, Suwalska A, Hajek T. Clinical Perspectives of Lithium's Neuroprotective Effect. Pharmacopsychiatry. 2018 Sep;51(5):194-199. doi: 10.1055/s-0043-124436. Epub 2017 Dec 21. PMID: 29270949.
- Громова О.А., Торшин И.Ю., Гоголева И.В., Пронин А.В., Стельмашук Е.В., Исаев Н.К., Генрихс Е.Е., Демидов В.И., Волков А.Ю., Хаспеков Г.Л., Александрова О.П. Фармакокинетический и фармакодинамический синергизм между нейропептидами и литием в реализации нейротрофического и нейропротективного действия церебролизина. Журнал неврологии и психиатрии им. С.С. Корсакова. 2015. Т. 115, № 3. С. 65 72. https://doi.org/10.17116/jnevro20151153165-72
- Emamghoreishi M, Keshavarz M, Nekooeian AA. Acute and chronic effects of lithium on BDNF and GDNF mRNA and protein levels in rat primary neuronal, astroglial and neuroastroglia cultures. Iran J Basic Med Sci. 2015 Mar;18(3):240-6. PMID: 25945236; PMCID: PMC4414989.
- Chuang DM, Priller J. Potential use of lithium in neurodegenerative disorders. Lithium in Neuropsychiatry: The Comprehensive Guide / M Bauer, P Grof, B Muller-Oerlinghausen, ed. Abingdon, Oxon: Informa UK Ltd, 2006:381-398.
- Hillert MH, Imran I, Zimmermann M, Lau H, Weinfurter S, Klein J. Dynamics of hippocampal acetylcholine release during lithium-pilocarpine-induced status epilepticus in rats. J Neurochem. 2014 Oct;131(1):42-52. doi: 10.1111/jnc.12787. PMID: 24909269.
- van Enkhuizen J, Milienne-Petiot M, Geyer MA, Young JW. Modeling bipolar disorder in mice by increasing acetylcholine or dopamine: chronic lithium treats most, but not all features. Psychopharmacology (Berl). 2015 Sep;232(18):3455-67. doi: 10.1007/s00213-015-4000-4. Epub 2015 Jul 5. PMID: 26141192; PMCID: PMC4537820.
- Basselin M, Chang L, Bell JM, Rapoport SI. Chronic lithium chloride administration attenuates brain NMDA receptor-initiated signaling via arachidonic acid in unanesthetized rats. Neuropsychopharmacology. 2006 Aug;31(8):1659-74. doi: 10.1038/sj.npp.1300920. Epub 2005 Nov 9. PMID: 16292331.
- Basselin M, Chang L, Seemann R, Bell JM, Rapoport SI. Chronic lithium administration to rats selectively modifies 5-HT2A/2C receptor-mediated brain signaling via arachidonic acid. Neuropsychopharmacology. 2005 Mar;30(3):461-72. doi: 10.1038/sj.npp.1300611. PMID: 15562295.
- Ma JK, Barros E, Bock R, Christou P, Dale PJ, Dix PJ, Fischer R, Irwin J, Mahoney R, Pezzotti M, Schillberg S, Sparrow P, Stoger E, Twyman RM; European Union Framework 6 Pharma-Planta Consortium. Molecular farming for new drugs and vaccines. Current perspectives on the production of pharmaceuticals in transgenic plants. EMBO Rep. 2005 Jul;6(7):593-9. doi: 10.1038/sj.embor.7400470. PMID: 15995674; PMCID: PMC1369121.
- Geddes JR, Miklowitz DJ. Treatment of bipolar disorder. Lancet. 2013 May 11;381(9878):1672-82. doi: 10.1016/S0140-6736(13)60857-0. PMID: 23663953; PMCID: PMC3876031.
- Cipriani A, Hawton K, Stockton S, Geddes JR. Lithium in the prevention of suicide in mood disorders: updated systematic review and meta-analysis. BMJ. 2013 Jun 27;346:f3646. doi: 10.1136/bmj.f3646. PMID: 23814104.
- Musetti L, Del Grande C, Marazziti D, Dell'Osso L. Treatment of bipolar depression. CNS Spectr. 2013 Aug;18(4):177-87. doi: 10.1017/S1092852912001009. Epub 2013 Feb 8. PMID: 23391164.
- Шушпанова Т.В., Новожеева Т.П., Мандель А.И., Князева Е.М. Молекулярные мишени действия инновационного антиконвульсанта галодиф в терапии алкогольной зависимости. Сибирский вестник психиатрии и наркологии. 2018. № 2 (99). С. 120-126. doi:10.26617/1810-3111-2018-2(99)-120-126
- Горштейн Э.С., Семенюк А.В., Майоре А.Я. Антипириновый тест и его использование в клинике. Успехи гепатологии. 1988. Вып. 14. С. 128-147.
- Пиотровский В.К. Метод статистических моментов и внемодельные характеристики распределения и элиминации лекарственных средств. Химико-фармацевтическийжурнал. 1984. Т. 18, № 7. С. 845-849.
- Fukazawa H, Iwase H, Ichishita H, Takizawa T, Shimizu H. Effects of chronic administration of bromazepam on its blood level profile and on the hepatic microsomal drug-metabolizing enzymes in the rat. Drug Metab Dispos. 1975 Jul-Aug;3(4):235-44. PMID: 240652.
- Bahar MA, Hak E, Bos JHJ, Borgsteede SD, Wilffert B. The burden and management of cytochrome P450 2D6 (CYP2D6)-mediated drug-drug interaction (DDI): co-medication of metoprolol and paroxetine or fluoxetine in the elderly. Pharmacoepidemiol Drug Saf. 2017 Jul;26(7):752-765. doi: 10.1002/pds.4200. Epub 2017 Mar 26. PMID: 28345306.
- Pelkonen O, Turpeinen M, Hakkola J, Honkakoski P, Hukkanen J, Raunio H. Inhibition and induction of human cytochrome P450 enzymes: current status. Arch Toxicol. 2008 Oct;82(10):667-715. doi: 10.1007/s00204-008-0332-8. Epub 2008 Jul 11. PMID: 18618097.
- Danielson PB. The cytochrome P450 superfamily: biochemistry, evolution and drug metabolism in humans. Curr Drug Metab. 2002 Dec;3(6):561-97. doi: 10.2174/1389200023337054. PMID: 12369887.
- Lewis DF. 57 varieties: the human cytochromes P450. Pharmacogenomics. 2004 Apr;5(3):305-18. doi: 10.1517/phgs.5.3.305.29827. PMID: 15102545.
- Tompkins LM, Wallace AD. Mechanisms of cytochrome P450 induction. J Biochem Mol Toxicol. 2007;21(4):176-81. doi: 10.1002/jbt.20180. PMID: 17936931.
- Zaccara G, Perucca E. Interactions between antiepileptic drugs, and between antiepileptic drugs and other drugs. Epileptic Disord. 2014 Dec;16(4):409-31. doi: 10.1684/epd.2014.0714. PMID: 25515681.
- Johannessen Landmark C, Patsalos PN. Drug interactions involving the new second- and third-generation antiepileptic drugs. Expert Rev Neurother. 2010 Jan;10(1):119-40. doi: 10.1586/ern.09.136. PMID: 20021326.
- Шушпанова Т.В., Новожеева Т.П., Васильева О.В., Удут В.В. Фермент-индуцирующее действие оригинального антиконвульсанта галодиф ‒ модулирующий временной фактор, перспективы клинического применения при терапии пароксизмальных расстройств. Сибирский вестник психиатрии и наркологии. 2023. № 4 (121). С. 61-69. doi:10.26617/1810-3111-2023-4(121)-61-69


