Влияние ферментативного гидролизата лимфоидной ткани цыплят-бройлеров на морфофункциональное состояние макрофагов
Автор: Кольберг Н. А., Московенко Н. В., Тихонов С. Л., Тихонова Н. В.
Журнал: Вестник Мурманского государственного технического университета @vestnik-mstu
Рубрика: Технология продовольственных продуктов
Статья в выпуске: 3 т.25, 2022 года.
Бесплатный доступ
Цель исследования механизмов действия клеток, структурирующих иммунную систему, – получение дополнительных данных о влиянии иммуномодулирующих пептидов природного происхождения на возможность регуляции иммунных процессов. Изучено влияние ферментативного гидролизата лимфоидной ткани цыплят-бройлеров (ФГЛТЦБ) на жизнеспособность культуры перитонеальных и альвеолярных макрофагов, на морфологическую характеристику и функциональную активность макрофагов. Исследовано влияние ФГЛТЦБ на жизнеспособность культуры перитонеальных и альвеолярных макрофагов. Приведена морфометрическая характеристика макрофагов при воздействии на них ФГЛТЦБ. Дана оценка функциональной активности перитонеальных и альвеолярных макрофагов на фоне введения ферментативного гидролизата лимфоидной ткани цыплят-бройлеров. ФГЛТЦБ в концентрациях 1,5 и 10 % не оказывает токсического действия на культуру альвеолярных и перитонеальных макрофагов. ФГЛТЦБ усиливает фагоцитарную активность перитонеальных макрофагов, что способствует усилению их роли в хемотаксисе и иммунном ответе. Выявлено стимулирующее влияние ФГЛТЦБ на способность макрофагов к адгезии.
Ферментативный гидролизат лимфоидной ткани цыплят-бройлеров, перитонеальные и альвеолярные макрофаги, фагоцитарное число, индекс распластывания, индекс прикрепления, ядерно-цитоплазматическое отношение, enzymatic hydrolysate of lymphoid tissue of broiler chickens, peritoneal and alveolar macrophages, phagocytic number, spreading index, attachment index, nuclear-cytoplasmic ratio
Короткий адрес: https://sciup.org/142234716
IDR: 142234716 | УДК: 579.6 | DOI: 10.21443/1560-9278-2022-25-3-168-182
Текст статьи Влияние ферментативного гидролизата лимфоидной ткани цыплят-бройлеров на морфофункциональное состояние макрофагов
e-mail: , ORCID:
Kolberg, N. A. et al. 2022. The effect of enzymatic hydrolysate of broiler chickens' lymphoid tissue on the morphofunctional state of macrophages. Vestnik of MSTU, 25(3), pp. 168–182. (In Russ.) DOI:
Вопросы участия иммунной системы в регуляции физиологических функций организма поднимаются в научных кругах достаточно давно. В настоящее время сформулировано научное представление о значении иммунной системы в регуляции гомеостаза наравне с нервной и эндокринной систем, что дало основу для выделения соответствующей науки – иммунофизиологии. Актуальным является изучение роли лимфоцитов, макрофагов, тучных клеток в регуляции процессов адаптации и регенерации ( Danilova et al., 2017; Арташян и др., 2006 ), обмена веществ ( Toso et al., 2008 ), сосудистого тонуса и деятельности сердца ( Юшков и др., 2011 ), пищеварения ( Неиммунологические…, 2011; Dahan et al., 2007 ) и т. д.
Иммунная система представляет собой интегрированную сеть взаимодействия клеточных элементов и химических веществ, от эффективности и баланса которых зависит работа всего организма в целом. Правильное функционирование иммунной системы позволяет предотвращать возникновение большого количества заболеваний. Динамика иммунологических заболеваний на данный момент имеет положительную тенденцию. Решение вопроса расшифровки молекулярно-клеточных механизмов действия клеток иммунной системы позволит вплотную подойти к пониманию способов управления данными процессами и возможностей их коррекции. В этой связи особую важность представляет поиск новых фармакологических средств, оказывающих модулирующее действие на функционирование иммунных клеток. Одними из них являются иммуномодуляторы.
Иммуномодуляторы восстанавливают работу иммунной системы. Отдельные иммуномодуляторы оказывают избирательное действие на звенья иммунной системы, но конечный эффект приводит к активности всей иммунной системы. Клетками-мишенями для данных веществ служат антигенпрезентирующие клетки (дендритные клетки, макрофаги), распознающие Т-лимфоциты и эффекторные клетки (моноциты/макрофаги, цитотоксические Т-лимфоциты, естественные киллеры) ( Фёдоров и др., 2015 ). Отдельные препараты способствуют восстановлению уровня иммуноглобулинов, оказывают антиоксидантное действие ( Бурков и др., 2008 ).
Применение иммуномодуляторов оказывает более эффективное влияние как в комплексе с другими терапевтическими средствами (антибиотиками, противовирусными, противогрибковыми), так и включается в терапию самостоятельно ( Сепиашвили, 2015 ).
В зависимости от природы происхождения иммуномодуляторы подразделяются на экзогенные и эндогенные. Сложность в классификации иммуномодуляторов связана с их механизмом действия на иммунную систему, так как избирательно действующие на гуморальное или клеточное звено препараты могут оказывать влияние и на другие звенья иммунной системы ( Kumar et al., 2012 ).
Классификация иммуномодулирующих препаратов представлена следующим образом (по Р. И. Сепиашвили):
Экзогенные:
-
1. Препараты бактериального происхождения:
-
1.1. Естественные бактериальные препараты.
-
1.2. Полусинтетические бактериальные препараты.
-
-
2. Препараты растительного происхождения.
Эндогенные:
-
1. Пептидные препараты.
-
2. Цитокины и препараты на их основе:
-
2.1. На основе интерферонов.
-
2.2. На основе интерлейкинов.
-
2.3. Препараты комплексов цитокинов.
-
-
3. Препараты антител:
-
3.1. Иммуноглобулины.
-
3.2. Препараты сверхмалых доз антител.
-
3.3. Препараты моноклональных антител.
-
-
4. Иммунодепрессанты.
-
5. Нуклеиновые кислоты.
Значительное внимание ученых сосредоточено на разработке экзогенных иммуномодуляторов растительного и бактериального происхождения, способных модулировать иммунный ответ. В мире существует огромная потребность в новых эффективных методах лечения. Одной из многообещающих тенденций является использование натуральных компонентов в качестве интегративной, дополнительной и профилактической терапии ( Kumar et al., 2012 ).
Так, с фитохимической точки зрения были исследованы свойства лекарственных растений Echinacea spp. и Curcuma longa , которые обладают иммуномодулирующей и противовоспалительной активностью. Авторы пришли к выводу о возможности использования куркумина и эхинацеи в качестве новых агентов в дополнение к существующим методам лечения ( Catanzaro et al., 2018 ).
И. Богданов совместно с Институтом биоорганической химии АН СССР исследовал структуру активных компонентов бластолизина, выделенного из культуры молочнокислых бактерий, который показал определенную противоопухолевую активность ( Bogdanov et al., 1975 ). Изучение биологических свойств бластолизина, определение его химической структуры привело к идентификации и синтезу ряда производных мурамилдипептидного ряда и в конечном итоге к получению глюкозаминилмурамилдипептида ( Andronova et al., 1991 ). На основе глюкозаминилмурамилдипептида был создан лекарственный препарат ликопид ( Хаитов, 2020 ).
Встречаются сведения о наличии иммуномодулирующих свойств у пищевых и морских растений. Проведенные исследования выявили способность уникальных компонентов растений, таких как флавоноидов, гликозидов, полисахаридов, терпеноидов, эфирных масел активировать врожденную иммунную систему через стимуляцию макрофагов и лимфоцитов, стимулируя выработку цитокинов ( Tiwari et al., 2018 ).
Клинические испытания, проведенные на мышах, показывают противоопухолевую активность экстракта Plantago major . При этом введение подорожника приводит к увеличению перитонеальных макрофагов и Т-киллеров.
Имеются исследования, сообщающие, что иммуномодулирующие агенты действуют в основном на клеточные, а не на гуморальные иммунные ответы и восстанавливают иммунокомпетентность клеток в случае ослабленной иммунной системы. Эти агенты усиливают хемотаксис макрофагов и способствуют взаимодействию с другими иммунорегуляторными лимфоидными клетками. Активация макрофагов и других клеток, таких как фибробласты и эндотелиальные клетки, приводит к реакции острой фазы. Некоторые растительные иммуномодуляторы способны контролировать выработку провоспалительных медиаторов, управляя, таким образом, многими воспалительными процессами. Например, препарат септилин содержит травы, которые обладают иммуномодулирующими и противовоспалительными свойствами, укрепляя иммунную систему ( Deore et al., 2014 ).
Изучено получение иммуномодулирующих пептидов из экстрагированного овальбумина в белке утиных яиц. Среди гидролизатов, катализируемых пятью протеазами, гидролизат папаина проявляет наибольшую степень гидролиза и наибольшую иммуномодулирующую активность. Гидролизат папаина может значительно повышать фагоцитарную способность. После очистки было синтезировано девять идентифицированных пептидов для подтверждения иммуномодулирующего эффекта, и пять из них проявляют сильную активность. Пептид TQIDKVVHFDKLPGF обладает самой высокой иммуномодулирующей активностью. Для анализа карты сайта взаимодействия были выбраны три пептида с высокой аффинностью и сильной иммунной активностью. Три пептида могут образовывать водородные связи с рецептором и стабильно связываться, что способствует иммуномодулирующей активности пептида. Результаты показывают, что белок утиных яиц может быть многообещающим источником иммуномодулирующих пептидов ( He et al., 2021 ).
Исследовались пептиды, играющие важную роль во врожденном иммунном ответе против инфекций, – кателицидины-B1 (CATH-B1) курицы. Они обладают широкой антивирусной активностью в отношении гриппа А по сравнению с другими кателицидинами (CATH-1, -2, -3, LL-37, PMAP-23 и K9CATH) с ингибированием вирусной инфекции до 80 %. В соответствии с этим CATH-B1 влиял на экспрессию индуцированных вирусом воспалительных цитокинов (IFN-β, IL-1β, IL-6 и IL-8). Инкубация клеток с CATH-B1 до или после их инокуляции вирусом не уменьшала вирусную инфекцию, что указывает на то, что для противовирусной активности CATH-B1 необходимо прямое взаимодействие вируса с пептидом. Эксперименты с использованием комбинированного исключения размера и разделения вируса и пептида на основе аффинности также показали, что CATH-B1 связывается с вирусными частицами. Кроме того, с помощью электронной микроскопии не было обнаружено морфологических изменений самого вируса при инкубации с CATH-B1, но наблюдались большие агрегаты CATH-B1 и вирусных частиц, что указывает на то, что агрегация может быть механизмом действия, снижающим инфекционность вирусом гриппа А. Анализ активности нейраминидазы с использованием моновалентных или поливалентных субстратов показал, что CATH-B1 отрицательно влиял на способность вирусных частиц взаимодействовать с поливалентными рецепторами, предположительно, нарушая активность гемагглютинина. Таким образом, CATH-B1 обладает хорошей противовирусной активностью, связываясь с вирусной частицей и тем самым блокируя проникновение вируса ( Peng et al., 2020 ).
Антимикробные белки и пептиды составляют важную часть врожденной иммунной системы всех организмов и защищают хозяина от вторжения патогенных бактерий, вирусов, грибков и паразитов, взаимодействуя с отрицательно заряженными мембранами патогенов ( Nazeer et al., 2021 ).
Другие иммунокомпетентные клетки, например, естественные киллеры (NK) активируются и увеличивают свое количество за счет секреции Т-клетками цитокинов в результате действия иммуномодулятора талидомида. Ключевую роль играет вырабатываемый интерлейкин (IL)-2, усиливающий цитотоксичность NK-клеток ( Hayashi et al., 2005 ).
Иммуномодулирующие препараты прямо или опосредованно могут оказывать влияние на дендритные клетки. Опосредованное влияние осуществляется через макрофаги, которые синтезируют IL-12 и через
NK-клетки, синтезирующие интерферон-γ и необходимые для созревания дендритной клетки. Непосредственно прямой эффект приводит к высокой экспрессии рецепторов для презентации антигена Т-киллерам и Т-хелперам, а также усиливает продукцию IL-12, интерферон-γ и цитокинов для взаимодействий между клетками. Созревшие дендритные клетки обеспечивают полноценный иммунный ответ с привлечением Т- и В-лимфоцитов ( Караулов и др., 2007 ).
Проведенные исследования показывают, что иммуномодуляторы растительного и бактериального происхождения приводят к изменению структуры паренхиматозных, гемопоэтических и лимфоидных органов. Направленное действие на клетки лимфоидного и макрофагального рядов усиливает кровоснабжение в паренхиматозных органах, влияет на разрастание лимфоидной ткани в органах гемиммунопоэза ( Русскова и др., 2010 ).
Следует отметить отрицательные стороны иммуномодуляторов: в качестве иммуномодулирующих препаратов часто используются гомеопатические средства, у которых нет побочных эффектов, что привлекает пациентов, хотя лечебные свойства данных лекарственных средств не доказаны. Поэтому при подборе иммуномодуляторов следует основываться не только на их побочных действиях, а в первую очередь полагаться на их доказательность и эффективность ( Новикова, 2016 ).
Одним из потенциально иммунологических средств является ферментативный гидролизат лимфоидной ткани цыплят-бройлеров, полученный из фабрициевой бурсы цыплят-бройлеров в возрасте 35–42 дней. Фабрициевая бурса (рис. 1) – это центральный лимфоидный орган у птиц, ответственный за созревание клеток-продуцентов антител B-лимфоцитов (прямых потомков стволовой клетки). Главной функцией В-лимфоцитов является специфическое распознавание антигенов, которое ведет к их активации, пролиферации и дифференцировке в плазматические клетки-продуценты специфических антител – иммуноглобулинов, т. е. к гуморальному иммунному ответу ( Исмаилов и др., 2017 ).
а
б
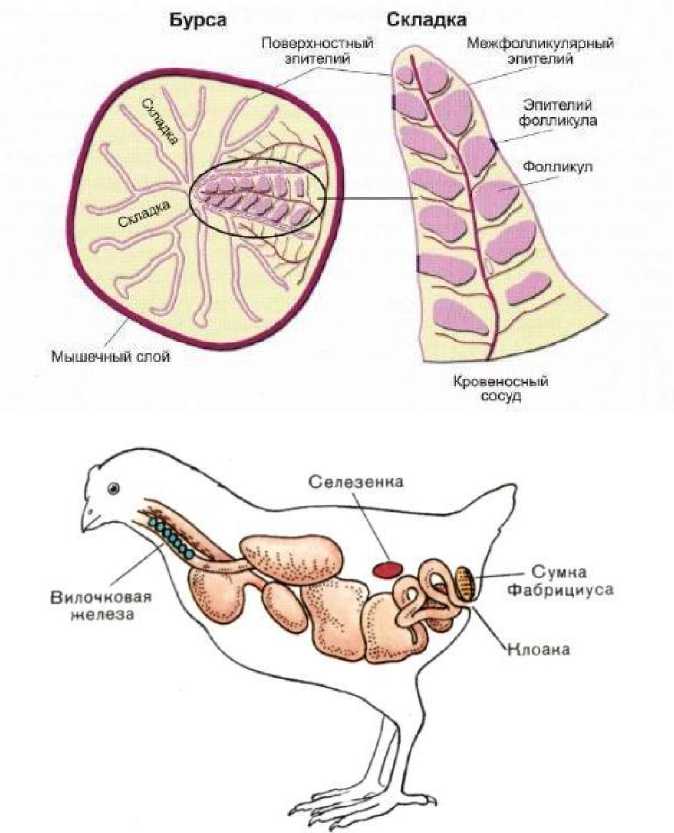
Рис. 1. Анатомическое строение ( а ) и расположение ( б ) фабрициевой сумки Fig. 1. Anatomical structure ( a ) and location ( б ) of the bursa of Fabricius
Имеются исследования о сочетании данного иммуномодулятора с вакцинами. Введение комплекса иммуностимулирующих средств телятам с выявленным хламидиозным артритом способствовало увеличению Т- и В-лимфоцитов и повышению титра специфических антител ( Кольберг, 2017 ). Однако еще не изучены механизмы действия ферментативного гидролизата лимфоидной ткани цыплят-бройлеров на культуры клеток, тканей и в целом на системы органов. Ферментативный гидролизат лимфоидной ткани цыплят-бройлеров необходимо исследовать, поскольку он является потенциально иммуномодулирующим средством. Поэтому для выяснения детальных аспектов действия исследование важно проводить на клеточных культурах.
Макрофаги повсеместно присутствуют в организме и играют важную роль в иммунном ответе. Нарушения функции макрофагов могут привести к аберрантной репарации, такой, что неконтролируемая продукция медиаторов воспаления и факторов роста, недостаточная генерация противовоспалительных макрофагов или недостаточная связь между макрофагами и эпителиальными клетками, эндотелиальными клетками, фибробластами и стволовыми или тканевыми клетками-предшественниками способствуют состоянию стойкого повреждения, и это может привести к развитию патологического фиброза ( Wynn et al., 2016 ).
Альвеолярные макрофаги – это фагоциты, которые играют решающую роль в гомеостазе и ремоделировании тканей. Альвеолярные макрофаги являются наиболее распространенным типом клеток и вместе с интерстициальными макрофагами играют важную роль в защите хозяина и модуляции фиброза. Альвеолярные макрофаги также участвуют в фагоцитозе апоптотических и некротических клеток. Для борьбы с инфекцией фагоциты облегчают работу многих рецепторов распознавания образов (PRR), которые помогают распознавать ассоциированные с патогенами молекулярные структуры (PAMP) на поверхности патогенных микроорганизмов. Все PAMP обладают общими чертами уникальности для группы патогенов, но инвариантны по своей основной структуре и необходимы для патогенности (способности организма вызывать инфекционное заболевание в другом организме). Они способны высвобождать IL-6 и множество медиаторов, подобных активированным нейтрофилам, включая TNF-α и IL-8 в ответ на растяжение, и могут усиливать повреждение легких. Макрофаги также высвобождают такие факторы, как TGF-α и PDGF, которые стимулируют пролиферацию фибробластов, отложение коллагена и гликозаминогликанов, ангиогенез и фиброз легких ( Bersten, 2013 ).
Эффективность уничтожения микробов альвеолярными макрофагами зависит от конкретного вовлеченного организма и размера исходного инокулята. Небольшие количества организмов (105) могут быть устранены только альвеолярными макрофагами. Для несколько большего количества организмов (106–107) требуется дополнительная помощь (приток) полиморфноядерных гранулоцитов, но крупные инокулы (108 организмов) преодолевают этот фагоцитарный барьер. Различные виды вторгающихся организмов очищаются и уничтожаются альвеолярными макрофагами с разной эффективностью.
Перитонеальные макрофаги (ПМ) являются основным типом клеток брюшины, которые участвуют во многих аспектах врожденного и приобретенного иммунитета в брюшной полости. ПМ обладают способностью высвобождать большое количество провоспалительных и противовоспалительных цитокинов и, следовательно, играют решающую роль в регуляции дифференцировки врожденных иммунных клеток и воспалительных Т-клеток. Исследования показывают, что иммунологические реакции и воспалительные реакции при ПМ тесно связаны с патогенетическими процессами различных воспалительных заболеваний и рака брюшной полости. Следовательно, регуляция активации ПМ постепенно стала перспективной мишенью для иммунотерапии, и лучшее понимание биологической функции ПМ при отдельных заболеваниях имеет решающее значение для разработки конкретных и эффективных терапевтических средств ( Liu et al., 2018 ).
Актуальность работы заключается в выяснении механизмов действия ферментативного гидролизата лимфоидной ткани цыплят-бройлеров на жизнеспособность культуры перитонеальных и альвеолярных макрофагов, на морфологическую характеристику и функциональную активность макрофагов для его дальнейшего применения человеком в качестве лекарственного средства.
Целью исследования является изучение влияния ферментативного гидролизата лимфоидной ткани цыплят-бройлеров на жизнеспособность культуры перитонеальных и альвеолярных макрофагов, на морфологическую характеристику и функциональную активность макрофагов. Для достижения поставленной цели были решены следующие задачи:
-
1) исследовано влияние ферментативного гидролизата лимфоидной ткани цыплят-бройлеров на жизнеспособность культуры перитонеальных и альвеолярных макрофагов;
-
2) дана морфологическая характеристика макрофагов при воздействии на них ферментативного гидролизата лимфоидной ткани цыплят-бройлеров;
-
3) дана оценка функциональной активности перитонеальных и альвеолярных макрофагов на фоне введения ферментативного гидролизата лимфоидной ткани цыплят-бройлеров.
Материалы и методы
Объектом исследований является ферментативный гидролизат лимфоидной ткани цыплят-бройлеров. Он представляет собой непрозрачную водную суспензию со слабым специфическим запахом, которую используют с целью повышения иммунитета у птиц. Для проведения эксперимента ферментативный гидролизат лимфоидной ткани цыплят-бройлеров использовали в следующих концентрациях: 1, 5 и 10 %.
Выделение альвеолярных и перитонеальных макрофагов
Материалами эксперимента послужили альвеолярные и перитонеальные макрофаги, выделенные из брюшной полости и бронхоальвеолярной лаважной жидкости крыс линии Wistar массой тела 180–210 г.
Перитонеальные и альвеолярные макрофаги получали по стандартной методике. В перитонеальную область производили инъекцию 3,5 мл охлажденной культуральной среды RPMI-1640 и 1,5 мл воздуха ( Поздина и др., 2018 ). Отсасывание суспензии производили 5-миллилитровым стерильным шприцом. Из бронхоальвеолярной жидкости альвеолярные макрофаги получали методом альвеолярного лаважа при использовании теплого раствора Хэнкса в объеме 3–4 мл. Полученные суспензии клеток центрифугировали в течение 5 мин. В результате образовывалась надосадочная жидкость, которую отбрасывали. Клеточный осадок повторно суспензировали в 5 мл культуральной среды и разливали по 0,5 мл на покровные стекла в 6-луночный планшет. Далее клетки выдерживали в инкубаторе с концентрацией углекислого газа, равной 5 %, при температуре 37 °С. Затем клетки промывались раствором Хенкса, после этого в лунку планшета заливалась культуральная среда RPMI-1640. Клетки повторно инкубировали в условиях углекислой газовой среды.
Далее исследовали морфометрические показатели, жизнеспособность и фагоцитарную активность макрофагов.
Определение жизнеспособности клеток
Для определения жизнеспособности использовали витальный краситель трипановый синий. Подсчет живых и погибших клеток производили в камере Горяева, предназначенной для подсчета количества клеток в заданном объеме жидкости. Камера представляет собой монолитное 7-предметное стекло, разделенное бороздками, с углублением (0,1 мм) в центральной части. На дне углубления нанесена микроскопическая сетка, расчерченная на большие (0,4 × 0,4 мм), средние (0,2 × 0,2 мм) и малые (0,05 × 0,05 мм) квадраты. Количество клеток в 1 мл3 на 25 квадратах вычисляется по формуле
N 25 = A × 250 × V × K / 25 = A × 2 × 104, (1)
где N – число клеток в 1 мл3; А – число клеток в одном большом квадрате камеры Горяева; V – объем суспензии; К – коэффициент разведения.
Количество клеток по всей сетке вычисляется по формуле
N сет = A × 1111 × 2.
Подсчет индекса жизнеспособности (ИЖ) произведен по формуле
ИЖ = количество живых клеток × 100 % / N 25.
Суспензии клеток вносили на предметные стекла, фиксацию производили посредством этилового спирта, окрашивание происходило по методу Романовского – Гимза.
Определение ядерно-цитоплазматического отношения
Для определения морфологических показателей были получены данные о площади клетки, ее ядер и цитоплазмы, и вычислено ядерно-цитоплазматическое отношение (ЯЦО). Ядерно-цитоплазматическое отношение между площадью цитоплазмы и площадью ядра живой клетки рассчитывали по формуле
ЯЦО = S ядра
цитоплазмы ,
где ЯЦО – ядерно-цитоплазматическое отношение; S ядра – площадь ядра живой клетки; S цитоплазмы – площадь цитоплазмы.
Определение адгезии клеток
С целью определения адгезии клеток использовали такие показатели, как индекс распластанности (ИР) и индекс прикрепления (ИП). Данные индексы определяли по следующим формулам:
ИП = количество клеток, прикрепившихся к стеклу × 100 % / количество клеток, нанесенных на стекло; (5)
ИР = число клеток с отростками × 100 % / общее число клеток на стекле. (6)
Определение фагоцитарной активности
Оценку поглотительной активности фагоцитов проводили на модели поглощения частиц латекса. Для этого учитывали фагоцитарное число, которое показывает количество захваченных частиц на одну фагоцитарную клетку и рассчитывается как количество фагоцитов, поглотивших частицы латекса, и фагоцитарный индекс, который показывает процент клеток, участвующих в фагоцитозе. Отношение произведения фагоцитарного индекса и фагоцитарного числа к 100 показывает интегральный фагоцитарный индекс. Процент активных фагоцитов рассчитывали по числу латекса на одну клетку, общее количество фагоцитарных частиц делили на 100 ( Уразаева, 2018 ).
Полученные данные обрабатывались посредством статистического анализа с помощью программы STATISTICA.10. Были проведены вычисления доверительного интервала, дисперсии, среднего квадратического отклонения и отклонения от контроля. Достоверность различий рассчитывали по критерию Манна – Уитни.
Результаты и обсуждение
Технология производства ферментативного гидролизата из лимфоидной ткани птицы (фабрициевая сумка цыплят-бройлеров) с последующим выделением биопептидов состоит из промывки сырья проточной водой, куттерования, гомогенизации, обработки ферментом, ультрафильтрации, обработки сверхвысоким давлением, сушки и упаковки. Для получения ферментативного гидролизата отбирают фабрициевую сумку после убоя цыплят-бройлеров в возрасте 35 дней. Затем сырье помещают в емкость и промывают проточной водой в течение 10 мин при температуре от +15 до +25 ° С.
Следующим этапом производства ферментативного гидролизата является куттерование сырья в течение 3 мин при частоте вращения ножей 2 400 об/мин с последующей гомогенизацией. Сырье загружают в емкость гомогенизатора, оборудованного рубашкой, наполненной дистиллированной водой и имеющей встроенный нагревательный элемент, гомогенизируют при скорости вращения насадки L5M компании Сильверсон (МВ) 6000 об/мин при температуре 4 °С и гидролизуют в течение 6–12 ч. Указанную температуру задают с помощью насоса и компрессора холодильной установки, имеющихся в гомогенизаторе. Затем полученную массу нагревают до температуры оптимума активности фермента папаина (40 °С) и вносят фермент Papain, КФ 3.4.22.2, растворенный в фосфатно-буферном растворе с рН 6,0 из расчета 0,15 % к основному сырью (фабрициева сумка). Выдерживают в течение 8 ч. Оценку степени гидролиза белка проводят по аминному азоту.
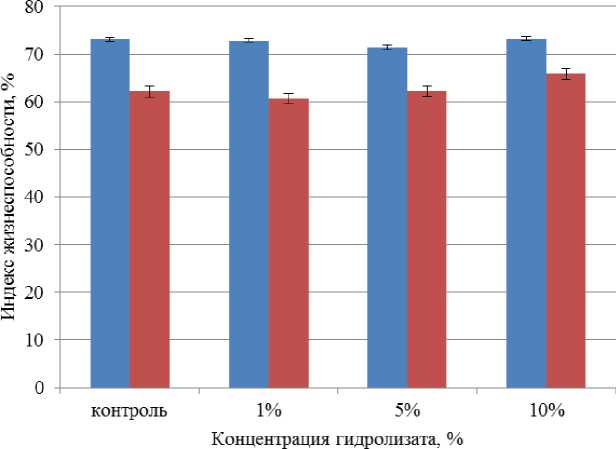
Воздействие ферментативного гидролизата из лимфоидной ткани птицы на жизнеспособность перитонеальных и альвеолярных макрофагов представлено на рис. 2.
■ Альвеолярные макрофаги
■ Перитонеальные макрофаги
Рис. 2. Воздействие ферментативного гидролизата из лимфоидной ткани птицы на жизнеспособность перитонеальных и альвеолярных макрофагов.
Примечание: различие между выборками по критерию Манна – Уитни недостоверно ( p > 0,05), на доверительных интервалах отложены значения ошибки среднего
Fig. 2. The effect of enzymatic hydrolyzate from avian lymphoid tissue on the viability of peritoneal and alveolar macrophages. Note: the difference between samples according to the Mann – Whitney test is not significant ( p > 0.05), error values of the mean are plotted at confidence intervals
Индекс жизнеспособности в отношении перитонеальных и альвеолярных микрофагов при внесении ферментативного гидролизата из лимфоидной ткани птицы в различных концентрациях не выявил существенную разницу по сравнению с контролем. Индекс жизнеспособности перитонеальных микрофагов варьировался в диапазоне от 60,70 до 65,81 %, альвеолярных макрофагов – от 71,4 до 74,1 %.
Воздействие ферментативного гидролизата из лимфоидной ткани птицы на морфометрические показатели альвеолярных макрофагов представлено на рис. 3.
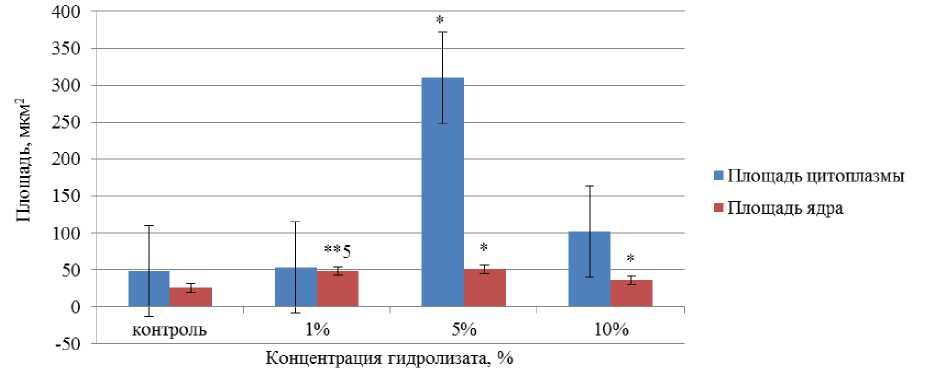
Рис. 3. Воздействие ферментативного гидролизата из лимфоидной ткани птицы на морфометрические показатели альвеолярных макрофагов.
Примечание: * – различие с группой контроля достоверно ( p < 0,05); **5 – различие между группами с концентрацией 1–5 % и 5–10 % препарата достоверно ( p < 0,05)
Fig. 3. Effect of enzymatic hydrolyzate from poultry lymphoid tissue on morphometric parameters of alveolar macrophages. Note: * – significant difference with the control group ( p < 0.05);
**5 – the difference between groups with concentration of 1–5 % and 5–10 % of the drug is significant (p < 0.05)
Выявлена тенденция увеличения площади цитоплазмы и площади ядра при внесении ферментативного гидролизата из лимфоидной ткани птицы в различных концентрациях. Площадь цитоплазмы альвеолярных макрофагов при концентрации ферментативного гидролизата из лимфоидной ткани птицы, равной 5 %, составила 310,48 мкм2, что в 6,75 раз превышает контроль.
Воздействие ферментативного гидролизата из лимфоидной ткани птицы на морфометрические показатели перитонеальных макрофагов представлено на рис. 4.
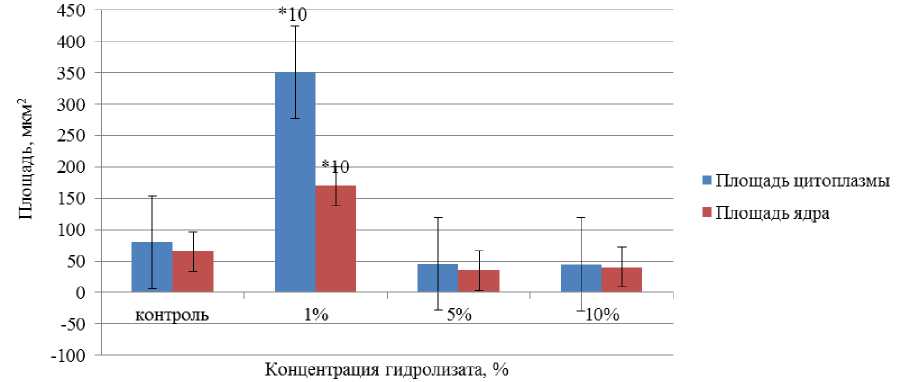
Рис. 4. Воздействие ферментативного гидролизата из лимфоидной ткани птицы на морфометрические показатели перитонеальных макрофагов. Примечание: *10 – различие между группами с концентрацией 1%-го и 10%-го Бурсанатала достоверно ( p < 0,05)
Fig. 4. Effect of enzymatic hydrolyzate from poultry lymphoid tissue on morphometric parameters of peritoneal macrophages. Note: *10 – the difference between groups with a concentration of 1 % and 10 % Bursanatal is significant ( p < 0.05)
При внесении ферментативного гидролизата из лимфоидной ткани птицы в концентрации 1 % площадь цитоплазмы перитонеальных макрофагов возросла в 3,38 раза по сравнению с контрольных образцом, площадь ядра – на 100 %.
Воздействие ферментативного гидролизата из лимфоидной ткани птицы на морфометрические показатели перитонеальных макрофагов через 24 ч после начала культивирования представлено на рис. 5.
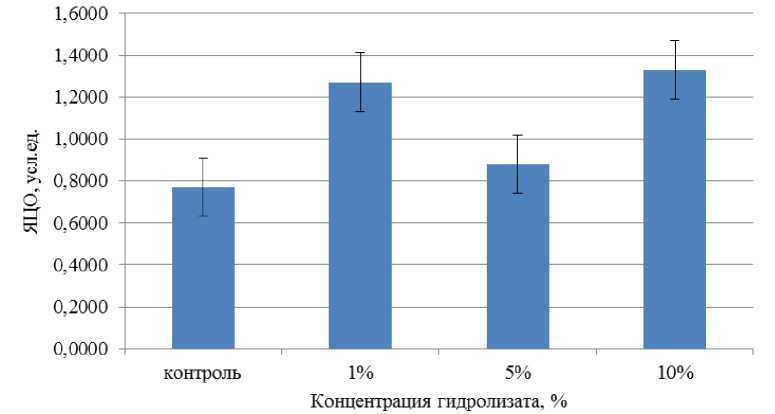
Рис. 5. Воздействие ферментативного гидролизата из лимфоидной ткани птицы на морфометрические показатели перитонеальных макрофагов через 24 ч после начала культивирования.
Примечание: различие между выборками по критерию Манна – Уитни недостоверно ( p > 0,05), на доверительных интервалах отложены значения ошибки среднего
Fig. 5. The effect of enzymatic hydrolyzate from poultry lymphoid tissue on the morphometric parameters of peritoneal macrophages 24 hours after the start of cultivation. Note: the difference between samples according to the Mann – Whitney test is not significant ( p > 0.05), error values of the mean are plotted at confidence intervals
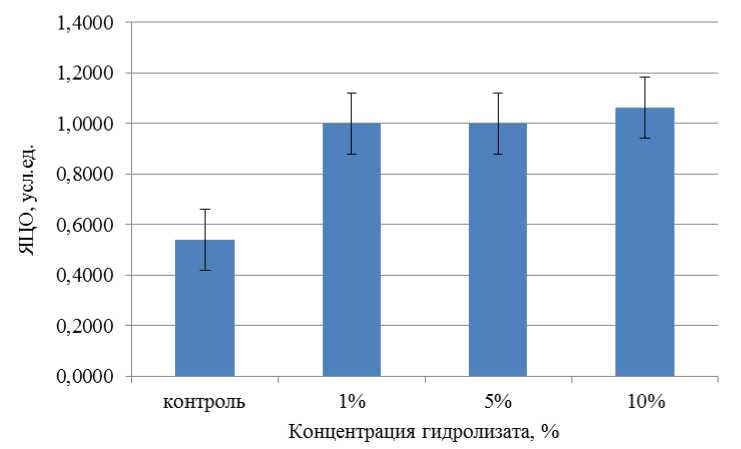
Рис. 6. Воздействие ферментативного гидролизата из лимфоидной ткани птицы на морфометрические показатели альвеолярных макрофагов через 24 ч после начала культивирования.
Примечание: различие между выборками по критерию Манна – Уитни недостоверно ( p > 0,05), на доверительных интервалах отложены значения ошибки среднего
Fig. 6. The effect of enzymatic hydrolyzate from poultry lymphoid tissue on the morphometric parameters of alveolar macrophages 24 hours after the start of cultivation. Note: the difference between samples according to the Mann – Whitney test is not significant ( p > 0.05), error values of the mean are plotted at confidence intervals
При концентрации ферментативного гидролизата из лимфоидной ткани птицы, равной 1 %, выявлено отклонение ядерно-цитоплазматического отношения перитонеальных макрофагов от контрольного образца на 77,12 % в сторону увеличения, при концентрации, равной 10 %, отклонение составило 92,86 %. Существенной разницы между контрольным образцом и образцом с 5%-м содержанием гидролизата не наблюдается, однако площадь ядра живой клетки явно выше площади контроля.
Воздействие ферментативного гидролизата из лимфоидной ткани птицы на морфометрические показатели альвеолярных макрофагов через 24 ч после начала культивирования представлено на рис. 6.
Ядерно-цитоплазматическое отношение альвеолярных макрофагов при внесении ферментативного гидролизата из лимфоидной ткани птицы в концентрациях, равных 1 и 5 %, составило 1 усл. ед. Таким образом, выявлено увеличение на 45 %. При концентрации гидролизата, равного 10 %, – на 50 %.
Воздействие ферментативного гидролизата из лимфоидной ткани птицы на количество фагоцитированных частиц латекса альвеолярными и перитонеальными макрофагами представлено на рис. 7.
На рис. 7 можно наблюдать положительную тенденцию увеличения фагоцитарного числа, характеризующего среднее количество частиц в 1 клетке, в отношении перитонеальных макрофагов. Так, при концентрациях гидролизата 5 и 10 % фагоцитарное число увеличилось по сравнению с контролем в 0,78 раза. Возрастание фагоцитарного числа альвеолярных макрофагов выявлено только при введении 10%-й концентрации ферментативного гидролизата из лимфоидной ткани птицы.
Способность макрофагов к адгезии анализировали благодаря индексам распластанности и прикрепления альвеолярных и перитонеальных макрофагов. Индекс распластанности альвеолярных и перитонеальных макрофагов представлен на рис. 8.
Показатель распластанности альвеолярных и перитонеальных макрофагов при введении ферментативного гидролизата лимфоидной ткани цыплят-бройлеров в концентрациях 5 и 10 % не имеет значительных отличий в сравнении с контролем. Наивысшая точка показателя распластанности 7,83 % выявлена при концентрации гидролизата, равной 5 %.
Показатель прикрепления альвеолярных и перитонеальных макрофагов представлен на рис. 9.
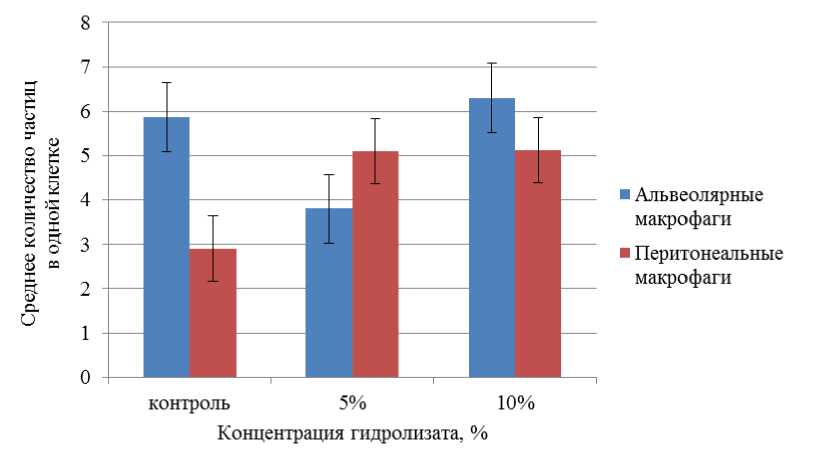
Рис. 7. Воздействие ферментативного гидролизата из лимфоидной ткани птицы на количество фагоцитированных частиц латекса альвеолярными и перитонеальными макрофагами.
Примечание: различие между выборками по критерию Манна – Уитни недостоверно ( p > 0,05), на доверительных интервалах отложены значения ошибки среднего
Fig. 7. Effect of enzymatic hydrolyzate from poultry lymphoid tissue on the number of phagocytosed latex particles by alveolar and peritoneal macrophages. Note: the difference between samples according to the Mann – Whitney test is not significant ( p > 0.05), error values of the mean are plotted at confidence intervals
Показатель распластывания, %
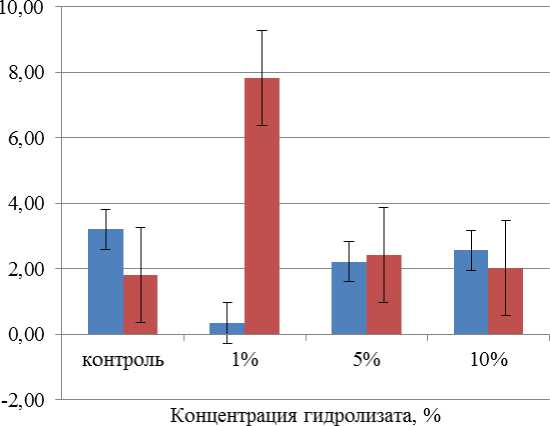
■ Альвеолярные макрофаги
■ Перитонеальные макрофаги
Рис. 8. Воздействие ферментативного гидролизата из лимфоидной ткани птицы на показатель распластанности альвеолярных и перитонеальных макрофагов.
Примечание: различие между выборками по критерию Манна – Уитни недостоверно ( p > 0,05), на доверительных интервалах отложены значения ошибки среднего
Fig. 8. The effect of enzymatic hydrolyzate from poultry lymphoid tissue on the spreading index of alveolar and peritoneal macrophages. Note: the difference between samples according to the Mann – Whitney test is not significant (p > 0.05), error values of the mean are plotted at confidence intervals
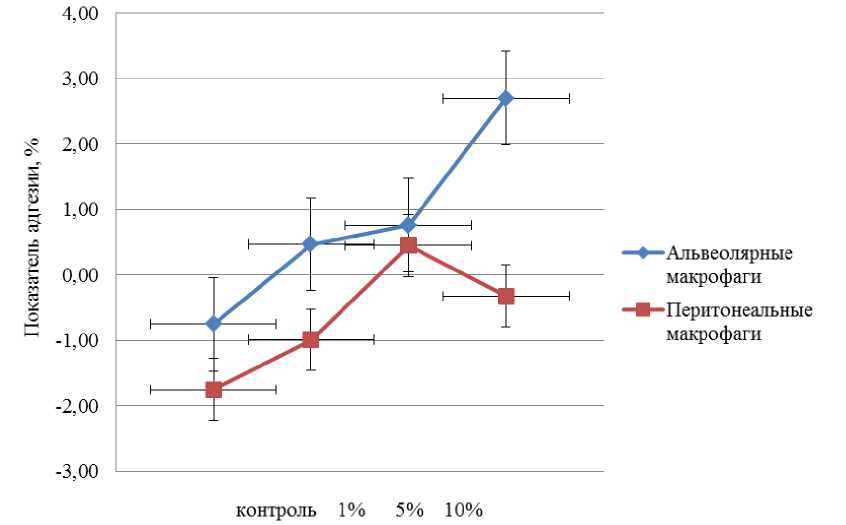
Концентрация гидролизата, %
Рис. 9. Воздействие ферментативного гидролизата из лимфоидной ткани птицы на показатель прикрепления альвеолярных и перитонеальных макрофагов.
Примечание: различие между выборками по критерию Манна – Уитни недостоверно ( p > 0,05), на доверительных интервалах отложены значения ошибки среднего
Fig. 9. Effect of enzymatic hydrolyzate from poultry lymphoid tissue on the rate of attachment of alveolar and peritoneal macrophages. Note: the difference between samples according to the Mann – Whitney test is not significant ( p > 0.05), error values of the mean are plotted at confidence intervals
Установлена положительная тенденция индекса прикрепления при увеличении концентрации ферментативного гидролизата лимфоидной ткани цыплят-бройлеров у альвеолярных макрофагов. Показатель прикрепления 0,76 % выявлен при концентрации гидролизата, равной 5 %.
Межклеточная адгезия определяет полярность и физиологическую функцию клеток в тканях. В каждой клетке молекулы адгезии облегчают взаимодействие внутри клеточного микроокружения, состоящего из других клеток и внеклеточного матрикса. Поскольку рецепторы клеточной адгезии подключены к путям передачи сигналов, эти взаимодействия между клетками и клеточным матриксом модулируют фенотип клеток, выживание, дифференцировку и миграцию. Как следствие, изменения в клеточной адгезии непосредственно способствуют опухолевому генезу и метастазированию. При развивающейся опухоли наблюдается общая потеря стабилизации клеточных спаек между клетками, позволяющая им приобрести миграционный фенотип, необходимый для инвазивности и метастазирования. Напротив, инвазивная способность метастатической опухоли клетки зависит от эффективной адгезии клеток во время транзита в кровообращении, колонизации отдаленных органов и взаимодействия с внеклеточным матриксом во вторичных местах метастазирования. Метастатическое распространение опухолевых клеток является основной причиной смерти у онкологических больных. Таким образом, понимание механизмов клеточной адгезии при раке позволит разработать новые целевые методы лечения. Наконец, клеточная адгезия играет важную роль в иммунном ответе на рак и может быть модулирована для улучшения иммунотерапии рака.
Заключение
В результате проведенных исследований можно сделать вывод, что ферментативный гидролизат из лимфоидной ткани птицы усиливает фагоцитарную активность перитонеальных макрофагов, что способствует усилению их роли в хемотаксисе и иммунном ответе.
Ферментативный гидролизат из лимфоидной ткани птицы в концентрациях 1, 5 и 10 % не оказывает токсического действия на культуру альвеолярных и перитонеальных макрофагов.
Под воздействием ферментативного гидролизата из лимфоидной ткани птицы наблюдается выраженная гипертрофия альвеолярных и перитонеальных макрофагов, что, возможно, связано с увеличением их секреторной активности. Ядерно-цитоплазматическое отношение не нарушается, что характерно для высокодифференцированных и активно функционирующих клеток. Перитонеальные макрофаги более чувствительны к воздействию гидролизата на морфологические характеристики клеток.
Выявлено стимулирующее влияние ферментативного гидролизата из лимфоидной ткани птицы на способность макрофагов к адгезии. Перитонеальные макрофаги более чувствительны к воздействию препарата на данную функцию, что проявляется усилением их способности к распластыванию, которая у альвеолярных макрофагов не изменяется.


