Влияние фетальных костномозговых мезенхимальных клеток на течение хронического пиелонефрита у крыс
Автор: Кирпатовский В.И., Хряпенкова Т.Г., Казаченко А.В., Голованов С.А., Плотников Е.Ю., Кудрявцев Ю.В., Тарасова Н.Н., Рогачева Н.В., Зоров Д.Б., Сухих Г.Т.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Экспериментальная урология
Статья в выпуске: 4, 2010 года.
Бесплатный доступ
Хронический пиелонефрит, клеточная терапия, мезенхимальные стволовые клетки костного мозга
Короткий адрес: https://sciup.org/142188241
IDR: 142188241
Текст статьи Влияние фетальных костномозговых мезенхимальных клеток на течение хронического пиелонефрита у крыс
ЭКСПЕРИМЕНТАЛЬНАЯ И КЛИНИЧЕСКАЯ УРОЛОГИЯ №4 2010
ЭКСПЕРИМЕНТАЛЬНАЯ И КЛИНИЧЕСКАЯ УРОЛОГИЯ №4 2010
Таблица 4. Изменения в общем анализе мочи у крыс с индуцированным хроническим пиелонефритом в разные сроки после ведения физиологического раствора.
За время наблюдения в опытной серии (1-я серия) все животные выжили, тогда как в контрольной серии (2-я серия) умерло 2 крысы (1 – через 2 недели и 1 – через 2 месяца) от прогрессирующей почечной недостаточности (летальность 16%).
В 1-й серии опытов в общем анализе мочи после пересадки клеток у большинства животных по ряду показателей выявлялась положительная динамика. В частности, уменьшалась мутность мочи, уменьшался рН мочи, сдвигаясь из нейтральных или щелочных значений в кислую сторону, достоверно уменьшалась протеинурия (таблица 3). В осадке мочи через 2 недели отмечалось снижение лейкоциту-рии, однако в более поздние сроки количество лейкоцитов снова нарастало, практически достигая исходных значений. Бактериурия у большинства животных сохранялась на прежнем уровне и лишь у 20% уменьшалась. Интересным фактом явилось уменьшение содержания солевого осадка мочи, особенно выраженное спустя 1,5 месяца после введения КМ-МСК.
Во 2-й серии (контрольной) в общем анализе мочи существенных изменений не происходило (таблица 4). Сохранялась высокая мутность мочи, сдвиг рН в щелочную сторону возрастал, протеинурия не уменьшалась, лейкоциту-рия и бактериурия сохранялись на прежнем уровне.
При оценке функциональных параметров у всех крыс опытной серии отмечено достоверное улучшение основных показателей функционального состояния почек. Если динамика концентрации креатинина крови в обеих группах была практически одинаковой, то уровень мочевины крови после введения КМ-МСК был более стабильным и ближе к нормальным значениям, чем в контрольной серии, особенно при поздних сроках наблюдения (рисунок 2).
Клиренс креатинина в опытах с КМ-МСК постепенно возрастал, достигая нормальных значений к 1,5 месяцам, но позднее имел тенденцию к снижению, оставаясь к концу срока наблюдения все же выше исходных значений (рисунок 3А). В контрольной серии после кратковременного улучшения клиренс креатинина прогрессивно снижался и через 3-4 месяца был ниже исходных значений и достоверно ниже, чем в опытах с введением КМ-МСК. Канальцевая реабсорбция натрия
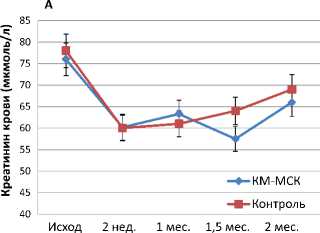
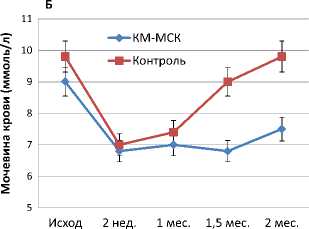
Рисунок 2. Динамика концентрации креатинина (А) и мочевины (Б) в крови крыс с хроническим пиелонефритом после интрапаренхиматозного введения КМ-МСК в сравнении с контролем.
в опытах с введением КМ-МСК постепенно возрастала, достигая максимальных значений через 1-2 месяца (рисунок 3Б). В конце срока наблюдения (3-4 месяца) этот показатель существенно снижался, достигая субнормальных значений. В контрольной серии реабсорбция натрия в первые 2 недели возрастала, но потом отмечался период снижения и стабилизации на значениях, более a
ЭКСПЕРИМЕНТАЛЬНАЯ И КЛИНИЧЕСКАЯ УРОЛОГИЯ №4 2010
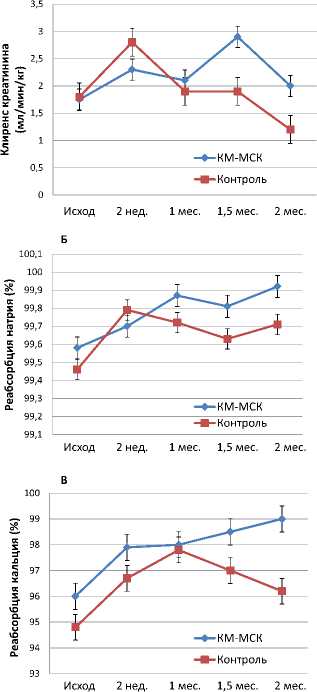
Рисунок 3. Динамика клиренса креатинина (А), реабсорбции натрия (Б) и реабсорбции кальция (В) у крыс с хроническим пиелонефритом после интрапаренхиматозного введения КМ-МСК в сравнении с контролем.
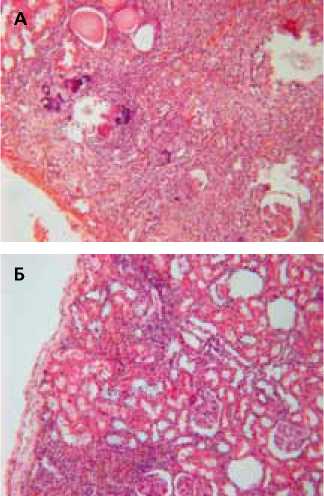
Рисунок 4. Почка крысы с хроническим пиелонефритом через 3 месяца после введения КМ-МСК.
А – склероз и умеренная клеточная инфильтрация интерстиция, деформированные почечные канальцы, частично заполненные эозинофильным содержимым. Окраска гематоксилином и эозином. Ув. 200х.
Б – относительно сохранная паренхима. Очаговая лимфогистиоци-тарная инфильтрация интерстиция. Окраска гематоксилином и эозином. Ув. 200х.
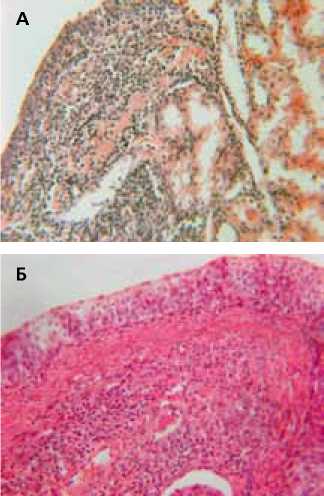
Рисунок 5. Почка крысы с хроническим пиелонефритом через 3 месяца поле введения КМ-МСК.
А – выраженная лимфогистиоци-тарная инфильтрация подслизистого слоя почечной лоханки. Относительно сохранные прилежащие почечные канальцы. Окраска гематоксилином и эозином. Ув. 200х.
Б – выраженный склероз и клеточная инфильтрация подслизистого слоя. Окраска гематоксилином и эозином. Ув. 200х.
низких, чем в группе с введением КМ-МСК. Реабсорбция кальция в почечных канальцах в серии опытов с введением КМ-МСК во все сроки наблюдения была выше, чем в контрольной серии (рисунок 3В).
Гистологическое исследование почек проведенное через 3 месяца после введения стволовых клеток показало, что выявляемые изменения достаточно гетерогенны. В одной и той же почке в разных участках выявляются зоны склероза с умеренной инфильтрацией лимфогистиоцитарными элементами. В этих участках выявляются как относительно сохранные клубочки, так и клубочки с разной степенью склерозирования. Большинство почечных канальцев расширено, деформировано, часть из них заполнена гомогенным эозинофильным содержимым. Эпителий отдельных почечных канальцев кальцифицирован (рисунок 4А). В то же время встречаются участки с относительно сохранной паренхимой и лишь диффузно-очаговой инфильтрацией интерстициального пространства лимфомононуклеарными элементами. Большинство клубочков и канальцев в этих участках мало изменены, и лишь отдельные канальцы расширены, но не имеют белкового содержимого (рисунок 4Б). В некоторых почках выявлялись только морфологические признаки пиелита без выраженных воспалительных изменений прилежащей паренхимы почки. На рисунке 5А видна выраженная лейкоцитарная инфильтрация подслизистого слоя почечной лоханки, затрагивающая лишь прилежащие к нему почечные канальцы, тогда как в более отдаленной зоне инфильтративных изменений не выявлено. В других экспериментах выявлялся выраженный склероз подслизистого слоя почечной лоханки, как следствие длительно текущего воспалительного процесса, и его массивная лимфогистиоцитарная инфильтрация (рисунок 5Б).
Оценка параметров гуморального иммунитета выявила уменьшение уровня иммуноглобулина G (IgG) и С3-компонента комплемента в крови крыс с хроническим пиелонефритом. Введение КМ-МСК способствовало нормализации этих показателей и возрастание содержания IgM (таблица 5).
ЭКСПЕРИМЕНТАЛЬНАЯ И КЛИНИЧЕСКАЯ УРОЛОГИЯ №4 2010
Таблица 5. Изменения показателей гуморального иммунитета у крыс с хроническим пиелонефритом после введения КМ-МСК (г/л).
|
Показатель |
Интактные крысы |
Крысы с хроническим пиелонефритом |
Крысы с хроническим пиелонефритом + КМ-МСК |
|
IgA |
0 |
0,1 ± 0,1 |
0 |
|
IgG |
5,34 ± 0,54 |
3,99 ± 0,23* |
6,18 ± 0,69 |
|
IgM |
0,40 ± 0,03 |
0,43 ± 0,02 |
0,56 ± 0,4* |
|
C 3 |
0,88 ± 0,06 |
0,62 ± 0,04* |
0,81 ± 0,05 |
|
C 4 |
0,11 ± 0,1 |
0,11 ± 0,1 |
0,12 ± 0,1 |
|
Примечание: * – достоверность разницы результатов по сравнению с контролем – p < 0,05. |
|||
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
Полученные нами данные свидетельствуют, что введенные в пиелонефритическую почку КМ-МСК, приводят к кратковременному (2 недели) уменьшению признаков, характеризующих выраженность воспалительного процесса (лейкоцитурия, бакте-риурия), но при этом вызывают длительное улучшение функционального состояния поврежденного органа (ацидификация мочи, уменьшение протеинурии, улучшение азотовыделительной функции почек, фильтрационной функции клубочков и канальцевой реабсорбции). По всей видимости, КМ-МСК, не оказывая прямого действия на возбудитель, вызвавший пиелонефрит, уменьшают выраженность воспалительной реакции и сглаживают негативные последствия длительно текущего воспаления. Механизм их действия точно не установлен, но ряд авторов его связывают с иммуномодулирующими свойствами этих клеток и их способностью секретировать комплекс противовоспалительных цитокинов и факторов роста [7, 10, 16]. Отмечают способность МСК подавлять пролиферацию Т- и В-лимфоцитов, дендритных клеток и цитотоксических NK-клеток, а также секрецию ими провоспалительных цитокинов [13, 17], что оказывает иммуносупрессивный эффект и подавляет аутоиммунный компонент хронического воспаления [11]. В то же время имеются указания, что неактивированные МСК не оказыва- ют иммуносупрессивного эффекта и для его проявления необходима активация этих клеток митогенами (конкавалина А в высокой дозе, супернатант культуры активированных лимфоцитов) или комплексом провоспалительных цитокинов (интерферон-γ + фактор некроза опухолей-α + интерлейкин-1α или β) [18, 19]. Исходя из этих данных, складывается представление, что терапевтическое действие КМ-МСК при хроническом пиелонефрите может реализоваться следующим образом. Инъецированные в почку КМ-МСК активируются комплексом провоспалительных цитокинов, выделяемых стромальными клетками почки в ответ на действие бактериального агента (а возможно, и бактериальным эндотоксином), что ведет к секреции ими комплекса цитокинов с противовоспалительным действием и факторов роста, которые, с одной стороны, способствуют уменьшению выраженности воспалительной реакции и вызываемого ею клеточного повреждения, а с другой стороны, стимулирует регенерацию поврежденных клеточных структур. Подавление пролиферации активированных Т-лимфоцитов и NK-клеток с цитотоксическим действием препятствует дальнейшему повреждению паренхимы органа. Именно действие этих факторов способствует сохранению или улучшению функционального состояния почки, несмотря на персистенцию микробного агента в паренхиме органа.
Изменения показателей гуморального иммунитета свидетель- ствуют о повышенном расходовании С3-компонента комплемента в иммунных реакциях с цитотоксическим эффектом и уменьшении концентрации IgG, участвующих во вторичном иммунном ответе и нейтрализации эндотоксинов, в крови крыс с хроническим пиелонефритом. С3-компонент комплемента является ключевым звеном в каскаде иммунологических реакций, приводящих к образованию мембраноатакующего комплекса, способного при взаимодействии с клеткой-мишенью вызвать ее лизис. Уменьшение концентрации IgG в крови также может свидетельствовать о повышенном его расходовании в реакциях, связанных с активаций С3-комплемента и нейтрализации бактериальных эндотоксинов. Дефицит IgG ослабляет вторичный иммунный ответ и может способствовать персистенции воспалительного процесса. Введение КМ-МСК способствовало нормализации этих показателей, что может служить свидетельством уменьшения аль-теративного эффекта хронической воспалительной реакции и восстановления защитных возможностей гуморального звена иммунитета.
Проведенное нами гистологическое исследование через 3 месяца после введения КМ-МСК в пие-лонефритическую почку выявило гетерогенную картину. Наряду с участками с выраженным склерозированием ткани и дегенерацией клубочков и канальцев выявляли зоны, где воспалительные изменения и склероз были вы- a
ЭКСПЕРИМЕНТАЛЬНАЯ И КЛИНИЧЕСКАЯ УРОЛОГИЯ №4 2010 ражены в минимальной степени. По-видимому, эта гетерогенность может быть объяснена ограниченной способностью к миграции введенных в почку КМ-МСК от места инъекции, поскольку выделяемые клетками гуморальные факторы действуют лишь в ближайшем окружении. Кроме того, в отдельных участках дегенеративные изменения могут перейти в необратимую фазу с полным замещением функциональных структур соединительной тканью еще до введения КМ-МСК, что, конечно, исключает возможность восстановления нормальной тканевой структуры.
ЗАКЛЮЧЕНИЕ
Список литературы Влияние фетальных костномозговых мезенхимальных клеток на течение хронического пиелонефрита у крыс
- Восстановление биорегуляторных резервов аутологичных клеток костного мозга как способ повышения сократительной функции миокарда у больных хронической сердечной недостаточностью (опыт клинического исследования)/Шумаков В.И., Темнов А.А., Гуреев С.В., Казаков Э.Н., Остроумов Е.Н., Онищенко Н.А.//В кн. Биологические резервы клеток костного мозга и коррекция органных дисфункций. Под ред. Шумакова В.И., Онищенко Н.А., М. 2009. С. 227-261.
- Применение клеток костного мозга, иммобилизированных на матриксе, для устранения дефицита костной ткани в пораженных конечностях./Быстров А.В., Шумаков В.И., Исаев И.В., Крашенинников М.Е.//В кн. Биологические резервы клеток костного мозга и коррекция органных дисфункций. Под ред. Шумакова В.И. и Онищенко Н.А. М. 2009. С. 283-296.
- Первый опыт применения мезенхимальных стволовых клеток костного мозга для лечения больных с глубокими ожоговыми ранами кожи./Расулов М.Ф., Васильченков А.В., Онищенко Н.А., Крашенинников М.Е., Кравченко В.И., Горшенин Т.Л., Пидцан Р.Е., Потапов И.В.//Клеточн. технол. в биол. и мед. 2005. № 1. С. 42-46.
- Аскаров М.Б. Трансплантация аутологичных клеток костного мозга для лечения длительно незаживающих язв желудка: Дисс…. д-ра мед. наук. М. 2009.
- Онищенко Н.А., Крашенинников М.Е. Клеточная трансплантация -перспективное направление регенерационной медицины.//В кн. Биологические резервы клеток костного мозга и коррекция органных дисфункций. Под ред. Шумакова В.И. и Онищенко Н.А. М. 2009. С. 49-76.
- Функциональные последствия интрапаренхиматозного введения фетальных стволовых и прогениторных клеток человека при хронической и острой почечной недостаточности у крыс/Кирпатовский В.И., Казаченко А.В., Плотников Е.Ю., Марей М.В., Мусина Р.А., Конькова Т.А., Дрожжева В.В., Надточий О.Н., Сухих Г.Т.//Клеточн. технол. в биол. и мед. 2006. № 2. С. 70-76.
- Iwatani H., Imai E. Kidney repair using stem cells: myth or reality as a therapeutic option?//Nephrol. 2010. Vol. 23. № 2. P. 143-146.
- Онищенко Н.А., Темнов А.А., Никольская А.О. Участие системы крови и иммунной системы в формировании адаптационной стратегии организма//В кн. Биологические резервы клеток костного мозга и коррекция органных дисфункций. Под ред. Шумакова В.И. и Онищенко Н.А. М. 2009. C. 15-48.
- Шевченко О.П., Орлова О.В., Гуреев С.В. Результаты 6-месячного наблюдения пациентов после трансплантации аутологичных клеток костного мозга: связь динамики маркеров воспаления и апоптоза с эффективностью лечения//Вестник трансплантологии и искусственных органов. 2005. № 3. C. 52-53.
- Immunosuppression by mesenchymal stem cells: mechanism and clinical application/Ghannam S., Bouf C., Djouad F., Jorgensen C, Noël D.//Stem Cell Res. Ter. 2010. Vol. 15. № 1. P. 2.
- Treatment of infammatory diseases with mesenchymal stem cells/Newman R.E., Yoo D., LeRoux M.A., Danilkovitch-Miagkova A.//Infam. Allergy Drug Targets. 2009. Vol. 8. № 2. P. 110-123.
- Tyndal A., Gratwohi A. Adult stem cell transplantation in autoimmune disease//Curr. Opin. Hematol. 2009. Vol. 16. № 4. P. 285-291.
- Siegel G., Schafer R., Dazzi F. Te immunosuppressive properties of mesenchymal stem cells//Transplantation. 2009. Vol. 87. № 9, suppl. S. 45-49.
- Спонтанное развитие хронического пиелонефрита у животных с экспериментально вызванным нарушением уродинамики верхних мочевых путей/Кирпатовский В.И., Мудрая И.С., Кудрявцев Ю.В., Обухова Т.В., Котлярова Г.А.//В сб. Экспериментальная урология и нефрология. Общие проблемы патологии. М. 1996. C. 11-17.
- Мусина Р.А., Бекчанова Е.С., Сухих Г.Т. Сравнение мезенхимальных стволовых клеток, полученных из различных тканей человека//Кле-точн. технол. в биол. и мед. 2005. № 2. C. 89-94.
- Трансплантация аутологичных стволовых клеток костного мозга у кардиологических больных: иммунофенотипическая и цитокиновая характеристика аутотрансплантатов/Сускова В.С., Онищенко Н.А., Шальнев Б.И., Емец В.И., Ермакова Л.П., Сусков С.И., Темнов А.А., Казаков Э.Н., Гуреев С.В.//Вестник трансплантологии и искусственных органов. 2005. № 3. C. 42-43.
- Pistola V., Rafaghello L. Potential of mesenchymal stem cells for the therapy of autoimmune diseases//Expert Rev. Clin. Immunol. 2010. Vol. 6. № 2. P. 211-218.
- Mesenchymal stem cells: a new strategy for immunosuppression and tissue repair/Shi Y., Hu G., Su J., Shi Y., Hu G., Su J., Li W., Chen Q., Shou P., Xu C,. Chen X., Huang Y., Zhu Z., Huang X., Han X., Xie N., Ren G.//Cell Res. 2010. Vol. 20. № 5. P. 510-518.
- Renner F., Eggenhofer E., Rosenauer A. Mesenchymal stem cells require a sufcient, ongoing immune response to exert their immunosuppressive function//Transplant. Proc. 2009. Vol. 41. № 6. P. 2607-2611.


