Влияние физико-химических параметров на окисление фенола пероксидом водорода в присутствии Fe/Al-монтмориллонита
Автор: Ханхасаееа С.Ц., Бадмаееа С.В.
Журнал: Вестник Бурятского государственного университета. Философия @vestnik-bsu
Рубрика: Химия
Статья в выпуске: 3, 2010 года.
Бесплатный доступ
Изучено влияние различных факторов в реакции окисления фенола пероксидом водорода на активность и стабильность Fe/Al-монтмориллонита, таких как рН, концентрация фенола, катализатор, пероксид водорода и температура. Определены оптимальные условия окисления фенола в присутствии Fe/Al-MM в водных растворах.
Fe/al-монтмориллонит, окисление, фенол
Короткий адрес: https://sciup.org/148179518
IDR: 148179518 | УДК: 544.472.3
Текст научной статьи Влияние физико-химических параметров на окисление фенола пероксидом водорода в присутствии Fe/Al-монтмориллонита
Фенольные соединения относятся к стойким органическим загрязнениям, которые обладают низкой биодеструкцией, и представляют серьезную угрозу окружающей среде. Перспективными способами очистки фенолсодержащих сточных вод являются процессы глубокого каталитического окисления с использованием экологически чистых окислителей, таких как озон, кислород, пероксид водорода или их комбинирование [1]. Преимуществами данных способов по сравнению с такими методами очистки промышленных стоков, как биодеструкция и сорбционные методы [2], являются возможность обезвреживания широкого спектра фенольных соединений и высокая скорость проведения процесса. Окислительные процессы с применением пероксида водорода по сравнению с другими окислителями предоставляют возможность обработки сточных вод в широком диапазоне значений концентраций, температур и рН и обладают сравнительной простотой аппаратурного оформления. Сочетание пероксида водорода с катализатором делает процесс окисления более привлекательным для достижения высокой конверсии и/или высокой скорости реакции при низких температурах и давлении и находит все более широкое применение в практике очистки сточных вод от органических соединений. Благодаря высокой активности чаще всего в качестве катализаторов используются гомогенные соединения железа Fe2+ и Fe3+ (системы Фентона и Раффа), но при этом возникает необходимость дополнительной обработки водных растворов для удаления из них ионов железа, кроме того, система Fe2+ (Fe3+) - H 2 O 2 активна в ограниченном диапазоне рН (1.5-3.0) [3]. Применение же гетерогенных катализаторов, содержащих активные компоненты (цеолит FeZSM-5, синтетические материалы Fe-MMM, Fe-глины и др.) [4], позволяет избежать процессов вымывания активного компонента в раствор и регенерации катализатора.
Целью настоящей работы является исследование кинетических закономерностей каталитического окисления фенола в зависимости от условий проведения реакции, а также исследование стабильности катализатора Fe/Al-ММ.
Экспериментальная часть
Исходным сырьем для синтеза Fe/Al-катализатора (Fe/Al-MM) служил монтмориллонит Мухорталинского месторождения Республики Бурятия. Катализатор готовили по методике, описанной в работе [5], и подвергали термообработке при 500оС.
Удельную поверхность (Sуд) катализатора определяли методом низкотемпературной адсорбции азота при 77К, содержание железа - фотометрическим методом с о-фенантролином [6]. Каталитическую активность полученного материала определяли по убыли концентрации фенола в реакции его окисления (спектрофотометр Agilent 845 UV-VIS при длине волны 274 нм), а устойчивость - по степени вымывания ионов железа в раствор.
Результаты и обсуждение
Методом низкотемпературной адсорбции азота была определена общая удельная поверхность катализатора, которая составляет 218.9 м2/г. Содержание железа в катализаторе Fe/Al-ММ, определенное о-фенантролиновым методом, составило 1.56%.
Полученный катализатор был исследован в реакции окисления водного раствора фенола пероксидом водорода:
С 6 Н 5 ОН + 14Н 2 О 2 → 6СО 2 + 17Н 2 О
Кинетические закономерности реакции окисления фенола пероксидом водорода в присутствии Fe/Al-ММ были изучены при различных рН и концентраций реагентов (катализатора, пероксида водорода и фенола).
При варьировании рН было установлено, что максимальная скорость окисления фенола достигается при рН = 3.7 (рис. 1), что соответствует низкой скорости реакции разложения пероксида водорода и максимальной стабильности ионов железа в виде ионов [FeIII(OH)]2+ и [FeII]2+ [7], которые взаимодействуют с пероксидом водорода с образованием ˙ОН - радикалов.
[FeIII(OH)]2+ + H 2 O 2 [FeII]2+ + HO 2 + H 2 O (1)
[FeII]2+ + H 2 O 2 [FeIII(OH)]2+ + HO* (2)
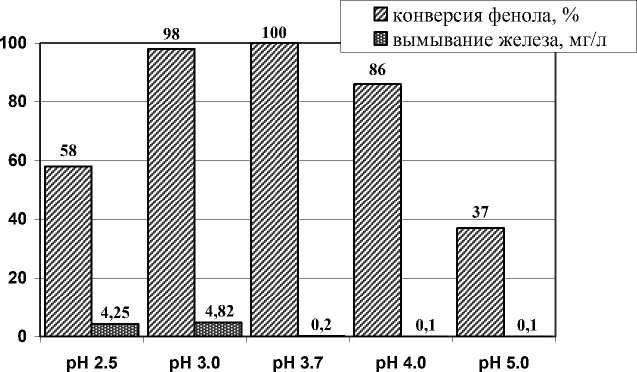
Рис. 1. Конверсия фенола и вымывание железа при различных рН (50оC, [фенол] – 1мМ, [H 2 O 2 ] – 14 мМ, [Fe/Al-MM] – 0.5 г/л)
При низких значениях рН вымывание ионов железа из катализатора Fe/Al-MM в раствор увеличивается, но при этом конверсия фенола падает, что связано с тем, что ионы Fe 3+ находятся в гидратированном виде, которые ускоряют не только разложение пероксида водорода, но и конкурируют с образовавшимися гидроксильными радикалами [8]. Каталитическая активность Fe/Al-MM при рН > 5.0, может быть связана с большой поверхностной кислотностью интеркалированных слоистых силикатов [9].
При исследовании влияния концентрации пероксида водорода на скорость окисления фенола (рис. 2) было установлено, что при увеличении концентрации H2O2 от 3.5 до 14 мМ скорость реакции возрастает. Дальнейшее увеличение до 25 мМ приводит к незначительному возрастанию скорости реакции, что объясняется увеличением скорости разложения H 2 O 2 в результате протекания побочных реакций и увеличением степени вымывания ионов железа из катализатора (рис. 2). Проведение реакции при концентрации H 2 O 2 3.5 мМ, что в 4 раза меньше стехиометрически необходимого количества, приводит к неполной конверсии фенола (77.6%) из-за недостаточного количества пероксида водорода.
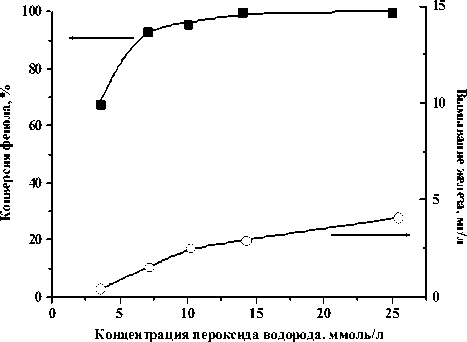
Рис. 2. Конверсия фенола и вымывание железа в зависимости от концентрации пероксида водорода в присутствии катализатора Fe/Al-MM (50оС, рН - 4, [фенол] – 1 мМ, [кат] – 1 г/л, 90 мин)
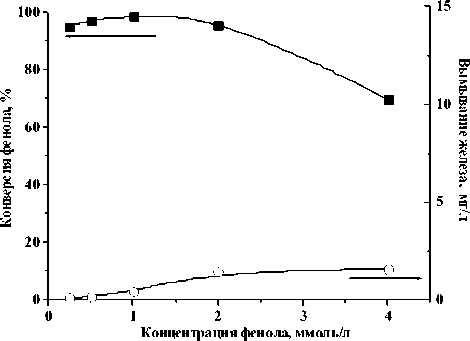
Рис. 3. Конверсия фенола и вымывание железа в зависимости от концентрации фенола в присутствии катализатора Fe/Al-MM (50оС, рН - 4, [Н2О2] – 14 мМ, [кат] – 1 г/л, 67 мин)
=f i £ os s a
8 5
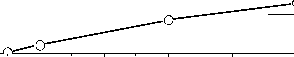
Концентрация катализатора , г / л
Рис. 4. Конверсия фенола и вымывание железа в зависимости от загрузки катализатора (рН - 4, [фенол] – 1 мМ, [Н2О2] – 14 мМ, 50оС, 70 мин)
Влияние концентрации фенола (0.25-4.0 мМ) на его конверсию представлено на рис. 3. Установлено, что увеличение концентрации фенола от 0.25 до 1.0 мМ приводит к повышению скорости реакции. При дальнейшем увеличении концентрации фенола до 4 мМ начальная скорость реакции слабо зависит от его концентрации, но при этом конверсия фенола уменьшается (до 70%), что связано с недостаточным количеством пероксида водорода. Степень вымывания ионов железа из катализатора возрастает при увеличении концентрации фенола (рис. 3).
Исследование влияния загрузки катализатора на скорость реакции окисления фенола показало (рис. 4), что скорость реакции на начальной стадии возрастает при увеличении загрузки катализатора. Однако конверсия фенола за время > 90 мин не зависит от загрузки катализатора, что может быть
связано с тем, что при увеличении загрузки катализатора увеличивается разложение пероксида водорода [10]. Степень вымывания ионов железа в раствор также увеличивается.
На основе полученных данных были определены оптимальные условия проведения реакции окисления фенола в присутствии катализатора на основе Мухорталинского монтмориллонита: Т = 50 o С, рН = 4, [фенол] = 1 мМ, [Н 2 О 2 ] = 14 мМ, [Fe/Al-MM] = 1 г/л, т.к. при данных условиях достигается достаточно высокая скорость окисления фенола и низкая степень вымывания ионов железа в раствор.


