Влияние гельминтной инвазии на сенсибилизирующие свойства тканей и продуктов переработки байкальского омуля
Автор: Лебедева С.Н., Жамсаранова С.Д., Забалуева Ю.Ю., Аюржанаева А.Б., Кутырев И.А., Мазур О.Е.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Рубрика: Технология мясных, молочных и рыбных продуктов и холодильных производств (технические науки)
Статья в выпуске: 2 (77), 2020 года.
Бесплатный доступ
Рыба и рыбопродукты являются важной группой продуктов в рационе современного человека. При этом рыба может являться источником заражения гельминтами. Целью настоящего исследования явился сравнительный анализ выраженности реакции гиперчувствительности замедленного типа при введении экстрактов, полученных из мышечной ткани омуля селенгинской популяции, инвазированного плероцеркоидами D. dendriticum, рыбных полуфабрикатов и готового продукта - рыбных котлет, полученных из филе омуля разной степени инвазивности. Установлен сенсибилизирующий эффект изучаемых экстрактов, который зависел от степени зараженности омуля. Наибольшим эффектом обладал экстракт из плероцеркоидов, выделенных из инвазированного омуля. Из рыбного филе омуля разных экспериментальных групп были изготовлены фарш и рыбные котлеты по традиционной рецептуре. После температурной обработки продукта (варка на пару) при введении экстракта из готовых к употреблению котлет индекс реакции гиперчувствительности замедленного типа снижался. Полученные данные свидетельствуют о взаимосвязи гельминтной инвазии с выраженностью сенсибилизирующих свойств экстрактов из тканей инвазированных рыб. Котлеты «Школьные», изготовленные из филе рыб разной степени инвазивности, проявляли подобный эффект и взаимосвязь, однако выраженность реакции была несколько ниже.
Экстракт, мышечная ткань омуля, инвазивность, полуфабрикаты, котлеты, гельминты, сенсибилизация
Короткий адрес: https://sciup.org/142228785
IDR: 142228785 | УДК: 616-093/-098
Текст научной статьи Влияние гельминтной инвазии на сенсибилизирующие свойства тканей и продуктов переработки байкальского омуля
Эпидемиологические исследования, проведенные в разных странах мира, свидетельствуют о том, что от пищевой аллергии страдают 10% детей и 2% взрослых. В исследованиях отмечено, что чаще сенсибилизация к продуктам питания наблюдается у больных аллергией (поллинозы, крапивница, аллергический ринит, бронхиальная астма, атопический дерматит и др.). По данным исследований Российской академии медицинских наук, пищевая сенсибилизация встречается у 36 % больных аллергией. Группой риска, у которых часто наблюдается пищевая аллергия, являются люди с заболеваниями желудочно-кишечного тракта, печени и мочевыделительной системы. Пациенты могут также испытывать перекрестные реакции между продуктами питания и пищевыми, а также бытовыми и другими аллергенами [1-4].
Наряду с превалированием гиперчувствительности немедленного типа в механизме развития пищевой аллергии большое значение имеют иммунокомплексные реакции и реакции замедленного типа [5, 6].
Оральная толерантность, которая предупреждает гиперчувствительность и обусловливает ареактивность к пищевым аллергенам, является ведущим механизмом защиты организма от пищевых аллергенов [7].
Используя феномен оральной толерантности, ученые разрабатывают принципы профилактики пищевой аллергии. Она достигается применением модифицированных белков, пробиотиков, различных диет, режимов питания и кулинарной обработки. Получению более низкой молекулярной массы белков и снижению их аллергенности способствуют ферментативный гидролиз и термическая обработка сырья [8, 9].
Важной группой в питании современного человека являются рыба и рыбопродукты. Потребление рыбы и рыбных продуктов на душу населения россиянами в среднем в два раза меньше объема потребления мясной продукции, но при этом превышает потребление говядины, свинины и мяса птицы [10].
При рассмотрении вопросов безопасности питания следует учитывать, что рыба может стать источником заражения гельминтами. Возбудителями дифиллоботриоза в Байкальском регионе являются лентец широкий и лентец чаечный. Установлено, что заражение человека, обусловленное лентецом широким, связано с употреблением рыбы из рек Лена, Ангара и ее притоков, а также Иркутского и Братского водохранилищ. В частности, очаг заболевания, обусловленный чаечным лентецом, сформировался на оз. Байкал и связан с употреблением в пищу омуля, хариуса и сига [11].
Именно дифиллоботриоз занимает ведущее место среди других гельминтозов человека в Республике Бурятия. Особенно широко он распространен у населения Прибайкалья (Кабан-ский, Селенгинский, Прибайкальский и Северо-Байкальский районы) [12]. Эпидемиологическое (медицинское) значение в этих районах имеет только D. dendriticum. Абсолютно доминантным промежуточным хозяином лентеца D. dendriticum в Байкальском природном очаге дифиллоботриоза является байкальский омуль Coregonus migratorius. Установлено, что на его долю приходится около 99 % всей популяции лентеца в фазе плероцеркоида, при этом уровень зараженности байкальского омуля может достигать 70-100 % [12]. В исследованиях послед- них лет отмечено наличие устойчивой тенденции к росту напряженности эпизоотической ситуации в популяции омуля - промежуточного хозяина D. dendriticum, а также эпидемической ситуации по дифиллоботриозу среди населения Прибайкалья [13].
Известно, что гельминты являются мощными иммунорегуляторами. Их существование в организме хозяина длительное время обеспечивается способностью регулировать его иммунный ответ. Результаты клинических и экспериментальных исследований также указывают на то, что гельминтные инвазии влияют на выраженность сенсибилизации к различным аллергенам, распространенность и клиническое течение аллергических заболеваний [14].
Цель настоящего исследования - оценка выраженности реакций гиперчувствительности замедленного типа (ГЗТ), в которых были использованы экстракты, полученные из мышечной ткани омуля селенгинской популяции, инвазированного плероцеркоидами D. dendriticum , рыбных полуфабрикатов и готового продукта - рыбных котлет из омуля разной степени инвазивности.
Материалы и методы исследования
Исследования были проведены в двух сериях экспериментов. Были использованы 35 белых крыс линии Wistar обоих полов с исходной массой 250-300 г. Первая серия экспериментов включала изучение выраженности реакции ГЗТ при введении экстрактов из мышечной ткани омуля с низкой степенью инвазии (1-я группа), с высокой степенью инвазии (2-я группа) и из свежезамороженных плероцеркоидов D. dendriticum (3 группа). Низкая степень инвазии омуля составляла 2-3 экз. плероцеркоидов, высокая степень инвазии - 18-31 экз. Экстенсивность инвазии составила 100%, поэтому не было возможности постановки отрицательного контроля.
Вторая серия экспериментов включала изучение выраженности реакции ГЗТ при введении экстрактов из рыбного полуфабриката, приготовленного из омуля с низкой степенью (1-я группа) и высокой степенью инвазии (2-я группа), а также экстрактов из готового рыбного продукта - рыбных котлет, изготовленных на пару, из филе омуля с низкой степенью (3-я группа) и высокой степенью инвазии (4-я группа), хранившихся в замороженном виде в условиях морозильной камеры (-18 ° С) в течение 10 мес.
Экстракты получали при соотношении объекта исследования и физиологического раствора 1:3. Исследуемый объект растирали пестиком в ступке, затем полученный гомогенат центрифугировали в течение 30 мин при 3000 об./мин. В эксперименте использовали надосадочную жидкость (экстракт).
Рыбные котлеты «Школьные» были приготовлены по традиционной технологии. Рыбное филе без кожи промывали, обсушивали, пропускали через мясорубку. Белый хлеб вымачивали в молоке, отжимали и добавляли к фаршу, перемешивали. Всю массу еще раз пропускали через мясорубку и солили. Яйцо взбивали и аккуратно вводили в фарш. Всю массу перемешивали до однородности и пышности. Из рыбной смеси формовали котлеты и готовили их на пару (расчет продуктов: рыба - 500 г, хлеб - 60 г, молоко - 100 мл, яйцо - 1 шт.).
Изучение сенсибилизирующих (аллергизирующих) свойств экстрактов проводили в реакции ГЗТ в соответствии с Методическими указаниями по оценке аллергизирующих свойств фармакологических веществ [15].
Сенсибилизацию крыс осуществляли однократно внутрикожным введением в основание хвоста 60 мкл эмульсии соответствующего экстракта в полном адъюванте Фрейнда (соотношение 1:1). Через 5 сут крысам для выявления сенсибилизации в подушечку задней (опытной) лапки вводили 40 мкл соответствующего экстракта, а в другую (контрольную) лапку - физиологический раствор в том же объеме. Через 24 ч у животных измеряли величину отека с помощью инженерного микрометра МК-0-25. Величина отека, по которой можно судить об интенсивности реакции ГЗТ, определялась разницей в толщине обеих лапок.
После эвтаназии у животных отсекали по голеностопному суставу задние лапки и взвешивали. Выделяли подколенные лимфатические узлы из опытной и контрольной лапок, которые также взвешивали и определяли клеточность (количество ядросодержащих клеток).
По всем показателям рассчитывали относительное значение (индекс реакции – ИР) с использованием формулы:
ИР = О – К х 100%,
К где О – показатель лапки опытной; К – показатель лапки контрольной.
Из хвостовой вены крыс брали кровь и для подсчета количества эозинофилов готовили мазки. Данный показатель определялся у интактных животных (кровь брали у животных до постановки реакции ГЗТ), а также у животных перед выведением из опыта (после постановки реакции ГЗТ).
Содержание животных соответствовало «Правилам лабораторной практики» (GLP) и Приказу МЗ РФ № 708Н от 23.08.2010 «Об утверждении правил лабораторной практики». Экспериментальную работу осуществляли в соответствии с «Правилами проведения работ с использованием экспериментальных животных» (Приложение к приказу МЗ СССР № 755 от 12.08.1977), Правилами, принятыми в Европейской конвенции по защите позвоночных животных (Страсбург, 1986). Эвтаназию животных осуществляли с использованием хлороформного наркоза.
Статистическая обработка полученных результатов проводилась с помощью пакета программ «Biostat-2006». Полученные результаты исследования представлены в виде медианы Ме , верхнего и нижнего квартилей Q 1 –Q 3 , достоверность различий оценивали с помощью непараметрического критерия Манна – Уитни. Результаты считали достоверными при достижении уровня значимости различий ( р ≤0,05).
Результаты исследования и их обсуждение
Полученные экспериментальные данные по оценке сенсибилизирующих свойств экстрактов представлены на рисунках 1 (первая серия экспериментов) и 2 (вторая серия экспериментов).
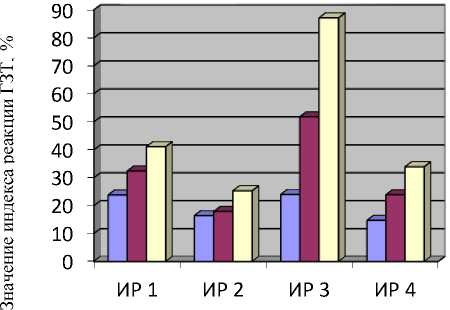
□ 1 группа - экстракт из мышечной ткани омуля с низкой степенью инвазии
□ 2 группа - экстракт из мышечной ткани омуля с высокой степенью инвазии
□ 3 группа - экстракт из плероцеркоидов
Рисунок 1 – Влияние экстрактов из мышечной ткани омуля разной степени инвазии на выраженность реакции ГЗТ (первая серия экспериментов):
ИР 1 - индекс реакции по величине отека; ИР 2 – индекс реакции по массе конечностей;
ИР 3 - индекс реакции по массе лимфоузлов; ИР 4 - индекс реакции по клеточности лимфоузлов
Как следует из данных, представленных на рисунке 1, по показателям величины отека, массы конечностей, массы и клеточности лимфоузлов индекс реакции ГЗТ в наибольшей степени был выражен в 3-й группе (р≤0,05) и уменьшался во 2-й и 1-й группах животных, т.е.
зависел от уровня зараженности рыб. Наибольшие изменения значений индекса реакции ГЗТ отмечены при определении массы подколенных лимфатических узлов (ИР 4).
Как известно, эозинофилия является одним из маркерных показателей при паразитарных инвазиях [16]. В наших исследованиях степень выраженности эозинофилии соответствовала уровню инвазированности. Проведенный анализ мазков крови показал, что введение исследуемых экстрактов вызывало эозинофилию, выраженность которой также зависела от уровня зараженности омуля. Сильнее всего она была выражена у животных 3-й группы, в которой количество эозинофилов составило 12,8 (12,0-13,6). Показатели количества эозинофилов во 2-й и 1-й группах составили соответственно 10,5 (9,3-11,7) и 7,5 (7,0-8,0) (р≤0,05). При этом в крови у интактных животных количество эозинофилов составляло 3,4 (2,8-4,0).
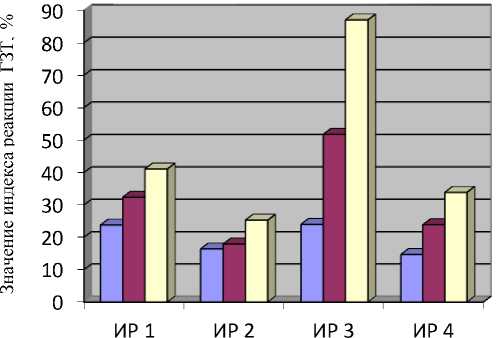
-
1 группа - экстракт
из мышечной ткани омуля с низкой степенью инвазии
-
2 группа - экстракт
из мышечной ткани омуля с высокой степенью инвазии
-
3 группа - экстракт
из плероцеркоидов
Рисунок 2 – Влияние экстрактов из рыбного полуфабриката (фарша) и котлет из филе омуля разной степени инвазии на выраженность реакции ГЗТ (вторая серия экспериментов): ИР 1 - индекс реакции по величине отека; ИР 2 - индекс реакции по массе конечностей; ИР 3 - индекс реакции по массе лимфоузлов; ИР 4 - индекс реакции по клеточности лимфоузлов
Как следует из данных рисунка 2, экстракты, полученные из готового рыбного продукта (3-й и 4-й групп, р≤0,05), хотя и обладали аллергизирующим действием по показателям величины отека, массы конечностей, массы и клеточности лимфоузлов, но степень его выраженности (т.е. после температурной обработки) была достоверно ниже, чем у рыбного полуфабриката (1-й и 2-й групп). Возможно, полученные результаты связаны как с длительным хранением объекта исследования (-18 ° С в течение 10 мес.), так и с воздействием температурной обработки.
Таким образом, экспериментально установлено, что экстракты мышечной ткани рыб, ин-вазированные плероцеркоидами D. dendriticum, обладали достаточно выраженным сенсибилизирующим эффектом. Его уровень зависел от степени зараженности омуля. Температурная обработка продукта (варка на пару) снижала степень выраженности реакции замедленного типа при введении экстракта из готового рыбного продукта.
А.M. Tejada et al. (2015) отмечают, что термическая обработка, используемая в пищевой промышленности для стерилизации рыбных консервов ( Thunnus obesus, Thunnus albacares ), приводила к существенному снижению реакций распознавания антигенов Anisakis ssp. , но остаточная антигенность, однако, присутствовала [17].
По данным P.M. Pitres et al. (2015), экстракты гельминтов ( Angiostrongylus costaricensis, Angiostrongylus cantonensis, Ascaris lumbricoides ), введенные в разные сроки (до, в период сенсибилизации и после), ингибировали аллергическое воспаление легких на модели мышиной астмы [18].
На очевидную способность гельминтов к иммунорегуляции, контролирующей аллерген-специфические и воспалительные реакции, указывают многочисленные исследования [14, 19]. Установлено, что быстрого развития и высокой степени выраженности достигает повышенная чувствительность замедленного типа к тем возбудителям, которые способны к длительному персистированию [16].
Исследования других авторов указывают на то, что хронические инвазии гельминтов защищают людей от аллергической сенсибилизации [20, 21]. По данным одних авторов, секреты гельминтов могут снижать TH1 ответ, который повышается при аутоиммунных заболеваниях [22], других - могут вызывать модификацию TH2 ответа и индуцировать образование Treg (Т-регуляторных клеток, ответственных за гомеостаз в иммунной системе, а также за контроль аутоиммунных и опухолевых заболеваний). Это может быть результатом одновременного уменьшения соотношения TH1/TH17 (субпопуляций T-хелперов) и соответственно снижения патологических аутоиммунных заболеваний [23, 24, 25].
И.А. Кутыревым и др. были проведены исследования по выявлению и распределению липидных иммуномодуляторов - простагландинов E 2 и D 2 - в организме плероцеркоидов байкальского омуля. Их действие, как известно, сказывается на всех уровнях регуляции физиологических функций [19].
Среди различных гипотез, объясняющих действие гельминтных инвазий на развитие аллергических реакций, заслуживает внимания индуцированный IL-10 TH2 ассоциированный иммунный ответ, сопровождающийся эозинофилией и заметным повышением уровня IgE [26].
По всей видимости, гельминты, воздействуя на дендритные клетки секретами/продук-тами своей жизнедеятельности, обусловливают формирование пула регуляторных Т-клеток, которые угнетают активность ТН2, что, в свою очередь, приводит к подавлению аллергического воспаления [27].
Заключение
Таким образом, экстракты, полученные из мышечной ткани рыб, инвазированных плероцеркоидами D. dendriticum, обладали достаточно выраженным сенсибилизирующим эффектом, уровень которого зависел от степени зараженности. Температурная обработка (варка на пару) продукта, изготовленного из рыбного филе омуля разной степени инвазии, снижала степень выраженности реакции гиперчувствительности замедленного типа при введении экстракта из готового рыбного продукта.
Выделение, идентификация и характеристика соединений, которые способны модулировать иммунную систему хозяина и реализовывать иммунорегуляторный потенциал гельминтов, являются чрезвычайно актуальными. Эти иммуномодуляторы могут открыть новое направление клеточных технологий для разработки лекарственных средств нового поколения.
Работа проведена при финансовой поддержке РФФИ (грант 16-04-00666).
Список литературы Влияние гельминтной инвазии на сенсибилизирующие свойства тканей и продуктов переработки байкальского омуля
- Федорович С.В., Арсентьева Н.Л., Орлович Г.И. Пищевая аллергия: эпидемиология, иммуногенетика, профилактика // Проблемы здоровья и экологии. – 2006. - № 4 (10). – С. 12-18.
- Жарин В.А., Федорович С.В. Пищевая аллергия и пищевая непереносимость, методы диагностики // Медицинский журнал. – 2017. - № 2 (60). – С. 141-145.
- Дордина С.Г., Кожевников А.А., Ветохин А.Л. Основные причины лекарственной и пищевой аллергии // Аллергология и иммунология. – 2001. – Т. 2., № 2. – С. 83.
- Караулов А.В., Сидоренко И.В., Нутузина А.Ю. Пищевая аллергия у больных с атопическим дерматитом // Аллергология и иммунология. – 2001. – Т. 2, № 2. – С. 94-95.
- Федорович С.В. [и др.]. Дерматологические синдромы пищевой аллергии // Здоровье и окружающая среда: сб. науч. тр. – Минск: Друк-С, 2006. – Вып. 6. – С. 466-471.
- Федорович С.В. [и др.]. Аллергия – болезнь столетия // Беларусская думка. – 2006. - № 5. – С. 177-184.
- Хацкель С.Б. Аллергология в схемах и таблицах. – СПб.: Спецтлит, 2000. – 715 с.
- Лусс Л.В. Принципы терапии и профилактики пищевой аллергии // Русский медицинский журнал. - М.: Волга-Медиа, 2005. – Т. 13, № 3. – С. 140-143.
- Довнар Т.Е. Пищевая аллергия и безопасность продуктов питания. – М., 2001. – 75 с.
- Неуймин Д.С. Современное состояние и особенности развития рынка рыбы и рыбной продукции // Технологии пищевой и перерабатывающей промышленности АПК-продукты здорового питания. – 2017. - № 1. – С. 122-130.
- Савченков М.Ф., Чумаченко И.Г., Турчинова Д.А. Дифиллоботриоз в байкальском регионе (эпидемиологическое наблюдение) // Сибирский медицинский журнал. – 2008. - № 3. – С. 88-90.
- Пронина С.В., Пронин Н.М. Байкальский природный очаг дифиллоботриоза (структура, эпизоотология и эпидемиология). - Улан-Удэ: Изд-во Бурятского гос. ун-та, 2010. - 44 с.
- Пронин Н.М., Пронина С.В., Амагзаева Г.С. и др. Динамика зараженности селенгинской популяции омуля Coregonus migratorius (Coregonidae) плероцеркоидами Diphyllobothrium dendriticum и заболеваемости дифиллоботриозом населения Республики Бурятия // Бюллетень ВСНЦ СО РАМН. 2012. – С. 296-299.
- Smits H.H., Everts B., Hartgers F.C. et al. Chronic helminth infections protect against allergic diseases by active regulatory processes // Current Allergy and Asthma Reports. - 2010. - Vol. 10, N 1. - P. 3–12.
- Руководство по экспериментальному (доклиническому) изучению новых фармакологических веществ / под общ. ред. Р.У. Хабриева. – 2-е-изд. – М.: Медицина, 2005. – С. 54-69.
- Беклемишев Н.Д. Иммунопатология и иммунорегуляция (при инфекциях, инвазиях и аллергиях). – М.: Медицина, 1986. – 256 с.
- Tejada M., Olivares F., de las Heras C. et al. Antigenicity of Anisakis simplex s.s. L3 in parasitized fish after heating conditions used in the canning processing // J. Sci. Food Agric. - 2015. – N 95 (5). P. 922-927.
- Pitrez P.M., Gualdi L.P., Barbosa G.L. et al. Effect of different helminth extracts on the development of asthma in mice: The influence of early-life exposure and the role of IL-10 response // Exp. Parasitol. 2015. - N 156. – P. 95-103.
- Кутырев И.А., Бисерова Н.М., Куртц Й. и др. Иммунологические аспекты взаимоотношений в системе «цестоды-рыбы» // Современные проблемы теоретической и морской паразитологии. – Севастополь, 2016. – С. 90-93.
- Erb K.J. Can helminths or helminth-derived products be used in humans to prevent or treat allergic diseases? // Trends in Immunology. - 2009. - Vol. 30, N 2. - P. 75–82.
- Khan A.R., Fallon P.G. Helminth therapies: translating the unknown unknowns to known knowns // International Journal for Parasitology. – 2013. – Vol. 43, N. 3-4. – P. 293–299.
- Miller C.M.D., Smith N.C., Ikin R.J. et al. Immunological interactions between 2 common pathogens, Th1-inducing protozoan Toxoplasma gondii and the Th2-inducing helminth fasciola hepatica // PLoS ONE. – 2009. – Vol. 4, N 5. - Article ID e5692.
- Cooke A., Tonks P., Jones F. M. et al. Infection with Schistosoma mansoni prevents insulin dependent diabetes mellitus in non-obese diabetic mice // Parasite Immunology. – 1999. – Vol. 21, N 4. – P. 169–176.
- Zaccone P., Burton O. T., Cooke A. Interplay of parasite driven immune responses and autoimmunity // Trends in Parasitology. – 2008. – Vol. 24, N 1. – P. 35–42.
- Cooke A. Th17 cells in inflammatory conditions // The Review of Diabetic Studies. – 2006. – Vol. 3, N 2. – P. 72–75.
- Gazzinelli-Guimarães P.H., Bonne-Année S., Fujiwara R.T. et al. Allergic Sensitization Underlies Hyperreactive Antigen-Specific CD4+ T Cell Responses in Coincident Filarial Infection // J. Immunol. – 2016. – N 197 (7). – P. 2772-2779.
- Елисеева О.В. Бронхиальная астма и гельминтные инвазии: особенности клеточного иммунного ответа // Бюллетень сибирской медицины. – 2011. - № 3. – С. 93-99.


