Влияние гена лейкоцидина Пантона – Валентайна Staphylococcus aureus на течение инфекционного процесса у пациентов ортопедического профиля
Автор: Шахматова А.Д., Туфанова О.С., Гордина Е.М., Касимова А.Р., Шабанова В.В., Божкова С.А.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 6 т.31, 2025 года.
Бесплатный доступ
Введение. Staphylococcus aureus является ведущим возбудителем инфекций костно-суставной системы. Лейкоцидин Пантона – Валентайна (PVL) рассматривается как один из ключевых факторов вирулентности, однако его роль в течение ортопедических инфекций изучена недостаточно. Цель работы — оценить встречаемость гена PVL у штаммов S. aureus, его влияние на лабораторные маркеры воспаления и на течение инфекционного процесса у пациентов ортопедического профиля. Материалы и методы. Проведен ретроспективный анализ 130 штаммов S. aureus, выделенных от 100 пациентов. Методом ПЦР определяли наличие генов lukS-PV и lukF-PV. Оценивали лабораторные показатели (СРБ, СОЭ, лейкоциты, нейтрофилы, прокальцитонин) и отдаленные исходы лечения. Результаты. Ген PVL выявлен у 15 % штаммов S. aureus. Не обнаружено статистически значимого влияния PVL на уровни рутинных маркеров воспаления. Ключевой находкой стало то, что повышенный риск неблагоприятного исхода связан с наличием гена PVL. Обсуждение. Полученные данные вносят вклад в разрешение дискуссии о клинической значимости PVL. Отсутствие выраженных различий в системных маркерах воспаления при наличии значимого влияния на исход позволяет предположить, что негативный эффект PVL опосредован не глобальной активацией воспаления, измеряемого рутинными тестами, а другими механизмами. К ним относятся прямое цитотоксическое повреждение тканей, нарушение функций иммунных клеток и индукция специфических иммунологических каскадов. Выявленная ассоциация PVL с MRSA-фенотипом согласуется с общемировой эпидемиологической картиной, где данный токсин является маркером гипервирулентных внебольничных штаммов. Заключение. Наличие гена PVL является значимым фактором риска неблагоприятного исхода ортопедической инфекции, что указывает на необходимость его детекции для стратификации риска и оптимизации тактики ведения пациентов.
Staphylococcus aureus, лейкоцидин Пантона – Валентайна, ортопедическая инфекция, факторы вирулентности, исход лечения
Короткий адрес: https://sciup.org/142246508
IDR: 142246508 | УДК: 616.71-089-022.1:615.371:616-036.8 | DOI: 10.18019/1028-4427-2025-31-6-764-772
Текст научной статьи Влияние гена лейкоцидина Пантона – Валентайна Staphylococcus aureus на течение инфекционного процесса у пациентов ортопедического профиля
Staphylococcus aureus остается одним из наиболее значимых патогенов, вызывающих инфекции костно-суставной системы. По нашим данным, с 2011 г. по 2022 г. на протяжении 12 лет наблюдения на первом месте по частоте выделения оставался S. aureus (31,3 %) [1]. Аналогичные сведения представили А.В. Цискарашвили с соавт., показав, что в течение шести лет в структуре ведущих возбудителей пери-протезной инфекции доля S. aureus составляла более 30 % [2]. S. aureus характеризуются способностью образовывать биопленки и наличием различных механизмов устойчивости к антибактериальным препаратам, что осложняет борьбу с инфекцией и требует длительного назначения препаратов или их комбинаций [3]. В ряде исследований продемонстрирована тропность стафилококков к клеткам костной ткани [4, 5], такое сродство обеспечивается наличием различных факторов вирулентности, позволяющих S. aureus адсорбироваться на поверхности костного матрикса и проникать внутрь клеток костной ткани.
Одним из значимых факторов вирулентности, реализующих патогенный потенциал S. aureus , является цитотоксин лейкоцидин Пантона – Валентайна ( PVL ). Этот двухкомпонентный белок вызывает лизис клеток крови, включая нейтрофилы, моноциты и макрофаги, что приводит к некрозу тканей и усиливает системный воспалительный ответ организма [6]. Компоненты PVL кодируют гены lukS-PV и lukF-PV , расположенные на мобильных генетических элементах, способствуя распространению этого гена среди штаммов бактерий [7].
Несмотря на имеющиеся данные, роль PVL в патогенезе ортопедических инфекций остается недостаточно изученной. Инфекции других локализаций, обусловленные S. aureus , содержащие PVL , обычно протекают в более тяжелой форме, склонны к более частым рецидивам, сопровождаются риском повторного заражения и характеризуются образованием более крупных абсцессов [8, 9]. Учитывая, что токсин PVL опосредует свое действие через прямую цитотоксичность и модуляцию воспаления, можно предположить, что с его продукцией стафилококками будут ассоциированы не только изменения профиля лабораторных маркеров системного воспаления (таких как С-реактивный белок, лейкоциты, нейтрофилы и прокальцитонин), но и более частое развитие неблагоприятных клинических исходов [10].
Цель работы — оценить встречаемость гена PVL у штаммов S. aureus , его влияние на лабораторные маркеры воспаления и на течение инфекционного процесса у пациентов ортопедического профиля.
МАТЕРИАЛЫ И МЕТОДЫ
С 1 января 2023 г. по 31 декабря 2023 г. изолировано 104 штамма S. aureus от 75 пациентов с инфекцией костей конечностей и крупных суставов, прооперированных в отделениях Центра. Также в исследование включены 26 штаммов S. aureus , выделенные из крови 25 пациентов отделения гнойной остеологии за период 1 января 2012 г. по 31 декабря 2024 г.
Отбор пациентов в исследование проводили с использованием программы микробиологического мониторинга «Микроб–2» и ЛИС «Акросс–Инжениринг» на основании анализа результатов микробиологического исследования биоматериала, полученного от пациентов.
У всех пациентов ортопедическая инфекция была вызвана S. aureus . На основе медицинской документации после выписки сформирована база данных, в которую включены:
-
— антропометрические данные (возраст, пол);
-
— локализацию инфекционного процесса;
-
— результаты лабораторного исследования крови на момент поступления (количество лейкоцитов, нейтрофилов, СОЭ (скорость оседания эритроцитов), уровень СРБ (С-реактивного белка), ПКТ (прокальцитонина) у пациентов с бактериемией).
Пациенты разделены на две группы в зависимости от наличия или отсутствия гена PVL у возбудителя инфекции: группа 1 ( n = 19) — PVL -позитивные S. aureus , группа 2 ( n = 81) — PVL -негативные S. aureus .
Далее отдельно проводили сравнение лабораторных маркеров воспалительного процесса у пациентов с бактериемией, вызванной S. aureus , и с раневой инфекцией без бактериемии. Для этого пациенты с бактериемией поделены на две подгруппы по наличию у S. aureus гена PVL : подгруппа 1 ( n = 7) — пациенты с бактериемией, вызванной PVL -положительными штаммами, подгруппа 2 ( n = 18) — пациенты с бактериемией, вызванной PVL -отрицательными штаммами.
Далее для 47 пациентов (47 %) оценен характер исхода. Для этого проводили телефонное анкетирование, в ходе которого пациентам задавали стандартные вопросы о том, были ли у них в течение двух лет после проведения индексной операции клинические или лабораторные признаки рецидива инфекционного процесса, проводились ли повторные санирующие операции. В случае летального ис- хода беседу проводили с родственниками пациента. Под благоприятным исходом (по критериями Делфи) понимали отсутствие клинико-лабораторных признаков рецидива инфекционного процесса и проведения санирующего хирургического вмешательства в течение двух лет с момента проведения индексной операции [11]. В результате пациенты были поделены на две подгруппы: группа A (n = 29) — с благоприятным исходом, и группа B (n = 18) — с неблагоприятным исходом.
Проводили сравнение половозрастных параметров и результатов лабораторного исследования (уровень лейкоцитов, нейтрофилов, СОЭ, СРБ, долю MR-штаммов среди S. aureus , долю пациентов с PVL -штаммами S. aureus ) на момент поступления, а так же оценивали долю пациентов с бактериемией S. aureus . у пациентов групп сравнения.
Лабораторные методы
Микробиологическое исследование биоматериала пациентов выполняли в соответствии с международными стандартами. До 2021 г. идентификацию бактерий проводили биохимическим методом на панелях Microlatest (Erba Lachema) с помощью iEMS Reader MF (Labsistems, Финляндия), с 2021 года — методом MALDI-TOF-MS с использованием системы FlexControl и программного обеспечения MBT Compass 4.1. (Bruker Daltonics, Германия), Score ≥ 2,0. Чувствительность культур бактерий к антибактериальным препаратам оценивали в соответствии с требованиями EUCAST (v.2-14).
Выделение нуклеиновых кислот (НК) осуществляли следующим образом: концентрацию S. aureus , необходимую для выделения НК, разбавляли дистиллированной водой до достижения мутности 1 мкФ (BioSan, Латвия). Затем отбирали 200 мкл суспензии и проводили дополнительный лизис бактериальной культуры в присутствии 20 мг/мл лизостафина (Sigma Aldrich, США) и 50 мг/мл лизоцима (Amresco, США) в трис-ЭДТА буфере в течение 60 минут при 37 °С. В соответствии с протоколом производителя Магно-Сорб (Амплисенс, Россия) выделяли нуклеиновые кислоты с использованием системы Auto-Pure S32 для автоматического выделения и очистки нуклеиновых кислот (Allsheng, Китай). Удаление РНК из образцов ДНК проводили при помощи фермента РНКазы А (Biolabmix, Россия) в соответствии с протоколом производителя. Концентрацию выделенных ДНК и РНК измеряли на спектрофотометре Implen NP80-Touch (Implen, Германия). Образец считался чистым при соотношении 260/280 — 1,8–2,0 и 260/230 ~ 2,0. Проведение ПЦР в реальном времени осуществляли в соответствии с протоколом производителя БиоМастер HS-qPCR SYBR Blue (2X) (Биолабмикс, Россия) с использованием амплифика-тора CFX-96 (BioRad, США). Праймерами для обнаружения PVL были luk-PV-f (ATCATTAGGTAAAATGT CTGGACATGATCCA) и luk-PV-r (GCATCAAGTGTATTGGATAGCAAAAGC), которые амплифицируют фрагмент длиной 433 пары оснований, специфичный для генов l ukS/F–P V, кодирующих двухкомпонентный белок PVL S/F , как описано J.A. McClure et al. [12]. Синтез олигонуклеотидов осуществлялся компанией «Евроген» (Россия). Температурные режимы ПЦР: начальная денатурация при 94 °C в течение 4 мин; 30 циклов амплификации (денатурация при 94 °C в течение 45 с, отжиг при 56 °C в течение 45 с и элонгация при 72 °C в течение 30 с); и финальная элонгация при 72 °C в течение 2 мин. Для визуализации 5 мкл ПЦР-ампликона наносили красителем в 1,2 % агарозный гель, содержащий бромистый этидий, после чего проводили электрофорез при напряжении 100 В в течение 1 ч и визуализировали с помощью системы гель-документации ChemiDoc MP Imaging System (BioRad, США).
Статистический анализ
Полученные данные регистрировали в виде электронных таблиц программы MS Office Excel, 2007 (Microsoft, США), визуализацию структуры данных и их анализ проводили с помощью программы GraphPad Prism 9.0 (США) и IBM SPSS STATISTICS (версия 27). Количественные показатели оценивали на предмет соответствия нормальному распределению с помощью критерия Колмогорова – Смирнова. В случае отсутствия нормального распределения количественные данные описывали с помощью медианы (Me) и нижнего и верхнего квартилей (Q1–Q3). Категориальные данные описывали с указанием абсолютных значений и процентных долей. Сравнение двух групп по количественному показателю, распределение которого отличалось от нормального, выполняли с помощью U-критерия Манна – Уитни. Для оценки риска в группах сравнения выполняли расчет отношения шансов (OR, 95 % ДИ). Сравнение процентных долей при анализе четырехпольных таблиц сопряженности выполняли с помощью критерия хи-квадрат ( χ 2) Пирсона (при значениях ожидаемого явления более 10) или точного критерия Фишера (при значениях ожидаемого явления менее 10), оценку связи проводили по критерию Крамера. Различия показателей между группами считали статистически значимыми при p < 0,05.
Этические нормы
При поступлении в стационар все пациенты подписывали информированное добровольное согласие на обработку персональных данных с научной и образовательной целью, возможное присутствие обучающихся во время выполнения медицинских вмешательств и на использование сведений о пациенте, составляющих врачебную тайну, в образовательных и научных целях.
РЕЗУЛЬТАТЫ
Частота выделения PVL-положительных S. aureus из биоматериала пациентов с ортопедической инфекцией
В исследованной когорте ген PVL был детектирован у 15 % ( n = 19) штаммов S. aureus . Стоит отметить, что большинство PVL-положительных изолятов характеризовались устойчивостью к цефокситину — 58 % ( n = 11). Среди штаммов MSSA доля PVL -положительных культур составила 12 %, среди MRSA — 17 %.
Анализ связи наличия гена PVL с полом пациентов
Ген PVL определяли среди штаммов S. aureus без статистически значимых различий между группами мужчин и женщин ( χ ² = 0,455; p = 0,500). PVL -положительные S. aureus были выделены от 11 из 51 пациента мужского пола (21,6 %), среди 49 женщин — у восьми (16,3 %) (табл. 1).
Таблица 1
Распределение гена PVL в зависимости от пола пациентов
|
Группа |
Мужчины ( n = 51) |
Женщины ( n = 49) |
p |
||
|
абс. |
% |
абс. |
% |
||
|
Группа 1 |
11 |
21,6 |
8 |
16,3 |
0,500 |
|
Группа 2 |
40 |
78,4 |
41 |
83,7 |
|
Анализ связи наличия гена PVL с возрастом пациентов
Анализ проведен для 99 пациентов, один пациент с отсутствующими данными о возрасте был исключен. Статистически значимой разницы в среднем возрасте между группами 1 и 2 не выявлено ( t = ,03; p = 0,306). Средний возраст в группе PVL + составил (58,2 ± 12,7) года (Me = 58), в группе PVL – — (54,6 ± 15,3) года (Me = 54) (табл. 2).
Таблица 2
Сравнение возраста пациентов в группах с наличием и отсутствием гена PVL
|
Группа |
n |
Средний возраст ± SD |
Медиана [Q1–Q3] |
p |
|
Группа 1 |
18 |
58,2 ± 12,7 |
58 [49–66] |
0,306 |
|
Группа 2 |
80 |
54,6 ± 15,3 |
54 [41–64] |
Анализ локализации инфекции в зависимости от наличия гена Пантона-Валентайна
У пациентов с инфекцией, вызванной PVL + штаммами, в половине случаев регистрировали поражение коленного сустава ( n = 9), реже — тазобедренного. Напротив, в группе PVL – преобладала тенденция к поражению тазобедренного сустава, — 45 % случаев ( n = 35) (рис. 1). Распределение по локализациям у обеих групп показывает схожие тенденции с преобладанием поражения крупных суставов.
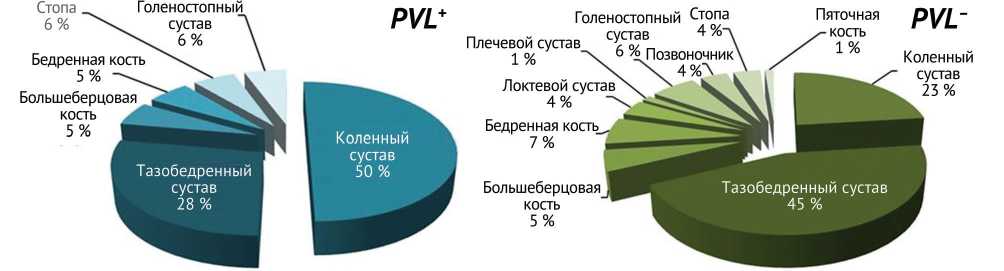
Рис. 1. Локализации инфекционного процесса в зависимости от наличия гена PVL
Сравнение результатов лабораторных анализов у пациентов PVL-положительными и PVL-отрицательными S. aureus
Сравнительный анализ маркеров воспалительного процесса не выявил статистически значимых различий между исследуемыми группами, несмотря на ожидаемое значительное снижение уровней лейкоцитов и нейтрофилов под потенциальным воздействием PVL , обладающим цитотоксическим действием. При этом выявлен тренд на более высокую медиану уровня СРБ у пациентов группы 1 по сравнению группой 2 (на 60 %), не имеющий статистической значимости (табл. 3).
Таблица 3
Сравнение лабораторных показателей воспалительного процесса у пациентов PVL-положительными (группа 1) и PVL-отрицательными S. aureus (группа 2)
|
Показатель |
Группа 1 ( n = 19) |
Группа 2 ( n = 83) |
p |
|
Лейкоциты, 109/л, Me [Q1–Q3] |
9,7 [6,9–13,6] |
8,6 [6,9–11] |
0,587 |
|
Нейтрофилы (% от уровня лейкоцитов), Me [Q1–Q3] |
5,7 [4,5–8,7] |
5,5 [3,8–8,9] |
0,713 |
|
СРБ, мг/л, Me [Q1–Q3] |
67 [12,0–215,0] |
42 [12,0–117,0] |
0,358 |
|
СОЭ, мм/час, Me [Q1–Q3] |
46,0 [40,0–70,0] |
48,0 [27,0–74,5] |
0,649 |
Оценка влияния гена лейкоцидина Пантона – Валентайна на тяжесть системного воспаления по лабораторным показателям в группах пациентов с бактериемией
Для оценки влияния гена лейкоцидина Пантона – Валентайна на тяжесть системного воспаления пациенты с бактериемией, вызванной S. aureus , поделены на две подгруппы: подгруппа 1 ( n = 7) — пациенты с бактериемией, вызванной PVL -положительными штаммами и подгруппа 2 ( n = 18) — пациенты с бактериемией, вызванной PVL -отрицательными штаммами (табл. 4).
Таблица 4
Сравнение лабораторных показателей системного воспаления у пациентов с PVL -положительной и PVL -отрицательной бактериемией S. aureus
|
Показатель |
Подгруппа 1 ( n = 7) |
Подгруппа 2 ( n = 18) |
p |
|
ПКТ, нг/мл, Me [Q1–Q3] |
0,9 [0,3–1,9] |
0,7 [0,2–1,6] |
0,622 |
|
Лейкоциты, 109/л, Me [Q1–Q3] |
14,0 [9,9–17,0] |
14,4 [8,9–17,6] |
0,949 |
|
Нейтрофилы (% от уровня лейкоцитов), Me [Q1–Q3] |
8,7 [3,1–12,8] |
10,3 [5,5–14,4] |
0,467 |
|
СРБ, мг/л, Me [Q1–Q3] |
215,0 [179,5–290,0] |
200,0 [145,5–310,0] |
0,727 |
|
СОЭ, мм/час,Me [Q1–Q3] |
85,0 [43,0–85,0] |
78,5 [29,5–84] |
0,260 |
Несмотря на отсутствие статистической значимости, в подгруппе 1 по сравнению с подгруппой 2 мы наблюдали устойчивую тенденцию к более высоким медианным значениям уровня прокальцитонина (на 28 %), СРБ (на 7,5 %), СОЭ (на 8 %). При этом медиана уровня лейкоцитов практически идентична, а уровень нейтрофилов выше у пациентов подгруппы 2. Отсутствие статистических различий в группах сравнения можно объяснить, в том числе, их небольшой численностью.
Оценка влияния гена лейкоцидина Пантона – Валентайна на на исход комплексного лечения ортопедической инфекции
Сравнительный анализ лабораторных показателей системного воспаления не выявил статистически значимых различий между группами ( p > 0,05 во всех случаях). Количество лейкоцитов в группе 1 составило 7,7×109/л [6,7–9,8], в группе 2 — 8,2×109/л [6,6–9,7] ( p = 0,964). Абсолютное число нейтрофилов было сопоставимым: 5,4×109/л (группа 1: 4,5–7,1; группа 2: 3,7–7,1; p = 0,587).
Уровень СРБ в группе 1 достигал 25 мг/л [5,5–66,3], в группе 2 — 25 мг/л [6,3–54,5] ( p = 0,940). Показатель СОЭ не продемонстрировал значимых различий: 45,5 мм/час [39,3–56,5] в группе 1 и 45 мм/час [24–71] в группе 2 ( p = 0,958).
Оценка влияния гена лейкоцидина Пантона – Валентайна на тяжесть системного воспаления по лабораторным показателям в группах пациентов с раневой инфекцией без бактериемии
Проведена оценка влияния различных факторов у пациентов с известным характером исхода ( n = 47) (табл. 5), пациенты поделены на две группы: группа A — благоприятный исход ( n = 62 %), группа B — неблагоприятный исход ( n = 38 %).
Таблица 5
Сравнение лабораторных показателей в исследуемых группах A и B
|
Показатель |
Группа A ( n = 29) |
Группа B ( n = 18) |
p |
|
Лейкоциты, 109/л, Me [IQR] |
8,5 [6,7–12,4] |
9,7 [7,0–13,5] |
0,450 |
|
Нейтрофилы (% от уровня лейкоцитов), Me [IQR] |
5,6 [4,5–8,1] |
5,7 [4,2–10,5] |
0,609 |
|
СОЭ, мм/час, Me [IQR] |
52 [39,3–70,0] |
45 [27,0–76,0] |
0,740 |
|
СРБ, мг/л, Me [IQR] |
42,0 [17,0–82,0] |
55,0 [16,0–219,0] |
0,279 |
|
Доля пациентов с PVL штаммами S. aureus , n (%) |
7 (24,1) |
10 (55,6) |
0,029* |
При сравнении различных параметров результатов лабораторного исследования на момент поступления мы не получили статистически значимых различий в исследуемых группах. Однако важной находкой является то, что наличие гена лейкоцидина Пантона – Валентайна у штаммов S. aureus в 4 раза увеличивало риск неблагоприятного исхода (p = 0,029, 95 % ДИ: 1,114–13,851, V Крамера 0,318, связь средней силы). Среди пациентов группы 1 доля пациентов с бактериемией была статистически значимо ниже, чем среди пациентов группы 2: 10,7 против 38,9 % (p = 0,02).
ОБСУЖДЕНИЕ
В настоящее время роль гена PVL как фактора вирулентности остается дискутабельной. Ряд исследований связывают его наличие с развитием тяжелых некротизирующих инфекций кожи и мягких тканей, а также некротизирующей пневмонии [13, 14, 15]. В то же время другие работы не выявили значимой ассоциации между носительством гена PVL и тяжестью системного воспалительного ответа или летальностью [16]. Проведенное нами исследование определило, что наличие гена PVL у S. aureus является значимым фактором риска развития неблагоприятного клинического исхода, увеличивая его шансы почти в четыре раза (OR = 3,93, 95 % ДИ: 1,11–13,85, p = 0,029). Этот вывод является центральным обнаружением нашего исследования и согласуется с фундаментальными представлениями о PVL как о мощном цитотоксине, повреждающем мембраны нейтрофилов и других иммунокомпетентных клеток, что потенциально может приводить к более тяжелому течению инфекции и нарушению работы врожденного иммунитета [17, 18, 19].
Полученные нами данные, согласно которым 57,9 % ( n = 11) всех PVL -положительных штаммов были представлены метициллин-резистентными изолятами (MRSA), полностью согласуются с общемировой эпидемиологической картиной и могут быть объяснены современными эволюционными концепциями [20]. Несмотря на то, что в общей структуре нашей когорты доля MRSA-изолятов была ожидаемо ниже, чем доля MSSA, ген PVL был ассоциирован преимущественно с MRSA-фенотипом. Это наблюдение не является случайным и отражает процесс клональной селекции и успешного распространения специфических штаммов [21].
Ключевым объяснением служит то, что ген PVL является маркером так называемых «внебольничных» штаммов MRSA (Community-associated MRSA) [22, 23]. Эти клоны , так называемые биоварианты, в отличие от «госпитальных» (Hospital-associated MRSA) приобрели эволюционные преимущества для распространения в условиях сообщества при отсутствии выраженного давления антибиотиков. Таким преимуществом стала гвирулентность, обеспечиваемая, в том числе, лейкоцидином Пантона – Валентайна.
Интересной и несколько противоречивой находкой стало отсутствие статистически значимого влияния гена PVL на уровни отдельных лабораторных маркеров системного воспаления (СРБ, СОЭ, лейкоциты, нейтрофилы, прокальцитонин) при их изолированном рассмотрении. Несмотря на четкие тенденции к повышению медианных значений в группе PVL + по всем параметрам, различия не достигли уровня значимости, что, вероятно, связано с ограниченным объемом выборки и высокой вариабельностью показателей. Однако данный результат не опровергает основного вывода, а указывает на то, что негативное влияние гена PVL на исход, вероятно, опосредовано не столько глобальной активацией системного воспаления, измеряемой рутинными методами, сколько другими механизмами, к которым можно отнести:
-
— прямое цитотоксическое повреждение тканей и органов-мишеней [10, 24],
-
— нарушение функций нейтрофилов (хемотаксиса, фагоцитоза, образования NETs) даже без их количественного изменения [25, 26];
-
— индукцию специфических не измеряемых в рутине противовоспалительных каскадов [27, 28].
Это предположение согласуется с работой Y. Motomura et al. [29], которые показали, что PVL -ассоциированная некротизирующая пневмония характеризуется тяжелейшим течением с выраженным повреждением легких при лишь умеренном повышении системных маркеров воспаления.
Наши данные вносят вклад в разрешение существующей дискуссии о клинической значимости PVL . С одной стороны, наш вывод о значимой ассоциации с исходом согласуется с рядом исследований, связывающих PVL с тяжелыми некротизирующими инфекциями кожи, мягких тканей и пневмониями [13, 14]. С другой стороны, наши данные о вариабельности воспалительного ответа перекликаются с работами, в которых не было найдено прямой корреляции между PVL и уровнем лабораторных маркеров или летальностью [15]. Это противоречие может объясняться гетерогенностью изучаемых популяций (тип инфекции, коморбидный фон), различиями в дизайне исследований и преобладающим влиянием иных факторов вирулентности (например, α -токсина), которые могут маскировать или модулировать эффект PVL [30].
Основным ограничением нашего исследования является небольшой объем выборки, что могло привести к недостижению статистической значимости в анализе отдельных лабораторных параметров (ошибка II рода) и к широким доверительным интервалам в оценке риска. Кроме того, ретроспектив- ный дизайн исследования не позволяет полностью исключить влияние неучтенных смешивающих факторов. Для подтверждения полученных результатов необходимы проспективные исследования на более крупных когортах.
ЗАКЛЮЧЕНИЕ
Наличие гена PVL у штаммов Staphylococcus aureus является отягощающим фактором риска развития неблагоприятных клинических исходов при ортопедических инфекциях. Этот факт подтверждает роль PVL как важного вирулентного фактора, способствующего более тяжелому течению заболевания и ухудшению прогноза у пациентов.
Несмотря на значимость PVL в определении риска, его влияние на исход инфекции не всегда сопровождается статистически значимыми изменениями в уровнях рутинных лабораторных маркеров системного воспаления, таких как СРБ, СОЭ, лейкоциты или прокальцитонин. Это свидетельствует о том, что патогенетические механизмы, лежащие в основе влияния PVL на клинический исход, могут опосредоваться не только глобальной активацией воспалительных процессов, измеряемых стандартными маркерами, а также другими путями.
Определение статуса наличия PVL у клинических изолятов S. aureus представляет собой перспективный инструмент для стратификации риска и оптимизации клинического менеджмента. Такой подход может способствовать более точному прогнозированию течения заболевания и принятию обоснованных решений о тактике лечения.
В дальнейшем особое значение приобретает исследование влияния PVL на специфические иммунологические профили пациентов и его взаимодействия с другими факторами вирулентности бактерий. Изучение этих аспектов позволит лучше понять патогенетические механизмы, лежащие в основе тяжелых инфекционных исходов, и разработать новые стратегии профилактики и терапии.


