Влияние Helicobacter pylori на дифференцировку Т-регуляторных клеток
Автор: Матвеичев А.В., Талаева М.В., Талаев В.Ю., Неумоина Н.В., Перфилова К.М., Лапаев Д.Г., Мохонова Е.В., Цыганова М.И., Коптелова В.Н., Никитина З.И., Лапин В.А., Мелентьев Д.А.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Медико-биологические аспекты оценки воздействия факторов риска
Статья в выпуске: 1 (17), 2017 года.
Бесплатный доступ
Оценка риска возникновения инфекций, вызываемых грамотрицательной бактерией Helicobacter pylori, является актуальной проблемой для здравоохранения в связи с широтой распространения возбудителя, обширным спектром вызываемых патологий, включающим злокачественные новообразования желудочно-кишечного тракта. Возбудитель склонен к длительному, хроническому персистированию, несмотря на его «хрупкость» и высокую требовательность к условиям культивирования. Проблема персистенции при этом представляет особенный интерес в связи с наличием данных о способности Helicobacter pylori изменять протекание иммунного ответа у инфицированных лиц в сторону благоприятных для себя супрессивных, регуляторных форм иммунных реакций как на уровне желудка, так и на уровне всего организма в целом. Цель работы cостояла в оценке способности Helicobacter pylori стимулировать дифференцировку Т-регуляторных CD4+CD25+FoxP3+клеток человека - основных медиаторов регуляции иммунного ответа - в условиях прямого контакта между бактериями и Т-клетками, без участия наиболее профессиональных антигенпрезентирующих клеток. Объектами исследования являлись клинические изоляты Helicobacter pylori и образцы Т-лимфоцитов лиц, не имевших в анамнезе Helicobacter pylori-инфекции, совместно культивируемые в условиях in vitro. Изменение содержания Т-регуляторных клеток оценивали цитофлюорометрически. Установлено, что при 18-часовом сокультивировании Т-лимфоцитов и Helicobacter pylori в соотношениях от 1: 10 до 1: 50 в культурах повышается содержание Т-регуляторных клеток в среднем в 2,12 раза. Данный эффект не требует наличия в культуре дендритных клеток и, по-видимому, затрагивает Т-лимфоциты, исходно коммитированные в своем развитии в сторону Т-регуляторных клеток. Также, по мнению авторов, влияние на дифференцировку Т-регуляторных клеток является специфическим свойством Helicobacter pylori.
Лимфоциты, т-регуляторные клетки, дифференцировка, костимуляция, антитела, проточная цитофлюорометрия, клеточные культуры
Короткий адрес: https://sciup.org/14237988
IDR: 14237988 | УДК: 616.98: | DOI: 10.21668/health.risk/2017.1.03
Текст научной статьи Влияние Helicobacter pylori на дифференцировку Т-регуляторных клеток
APC, антитела к FoxP3, меченные PE, все – производства eBioscience, США. Пермеабилизацию мембран, необходимую для мечения FoxP3, производили набором «Foxp3 / Transcription Factor Staining Buffer Set» (eBioscience, США) согласно инструкциям производителя. Анализ осуществляли на цитофлюориметре FacsCalibur (Beckton Dickinson, США). Для статистической обработки данных использовался критерий Ньюмена–Кейлса.
Результаты и их обсуждение. Данные оценки влияния H. pylori на дифференцировку лимфоцитов в сторону Т-рег при отсутствии в культурах дендритных клеток представлены на рис. 1 и 2. Как можно видеть, добавление H. pylori к культуре Т-клеток приводило к достоверному повышению числа Т-регуляторных CD4+CD25+FoxP3+ клеток через 18 часов совместного культивирования (среднее содержание Т-рег в культурах без стимуляции бактериями составляло 6,01 ± 0,72 % от всех CD4+ клеток, при добавлении H. pylori в соотношении 1:10 содержание Т-рег увеличивалось до 15,04 ± 1,97 %, p <0,01).
Содержание клеток в культурах с соотношением лимфоцитов к бактериям 1:20 и 1:50 также было достоверно выше контрольных значений нестимулированных лимфоцитов (12,7 ± 1,53 % для 1:20 и 10,42 ± 1,97 % для 1:50, отличие от контроля достоверно, p <0,01).
В то же время, как можно видеть, в ряду соотношений наблюдалась тенденция к обратной дозовой зависимости. Соотношение 1:10 показало наибольший прирост содержания Т-рег, который понижался при увеличении числа бактерий в культурах. Однако данная тенденция осталась статистически недостоверной. Таким образом, полученные данные свидетельствуют о наличии действия H. pylori на отвечающие Т-лимфоциты, не зависимо от присутствия в культуре наиболее профессиональных антигенпрезентирующих клеток – дендритных, и, по нашему мнению, опосредуемых прямым контактом между бактериями и отвечающими Т-лимфоцитами. В то же время в данных условиях эксперимента не исключена роль присутствующих в культурах B-лимфоцитов, также имеющих антигенпрезентирующие свойства. Для исключения их влияния в дальнейшем будут произведены работы с деплецией B-клеток.
Для проверки значимости костимуляции нами были поставлены дополнительные варианты культур с применением не только бактерий,
FoxP3 PE CD25 APC SSC-H
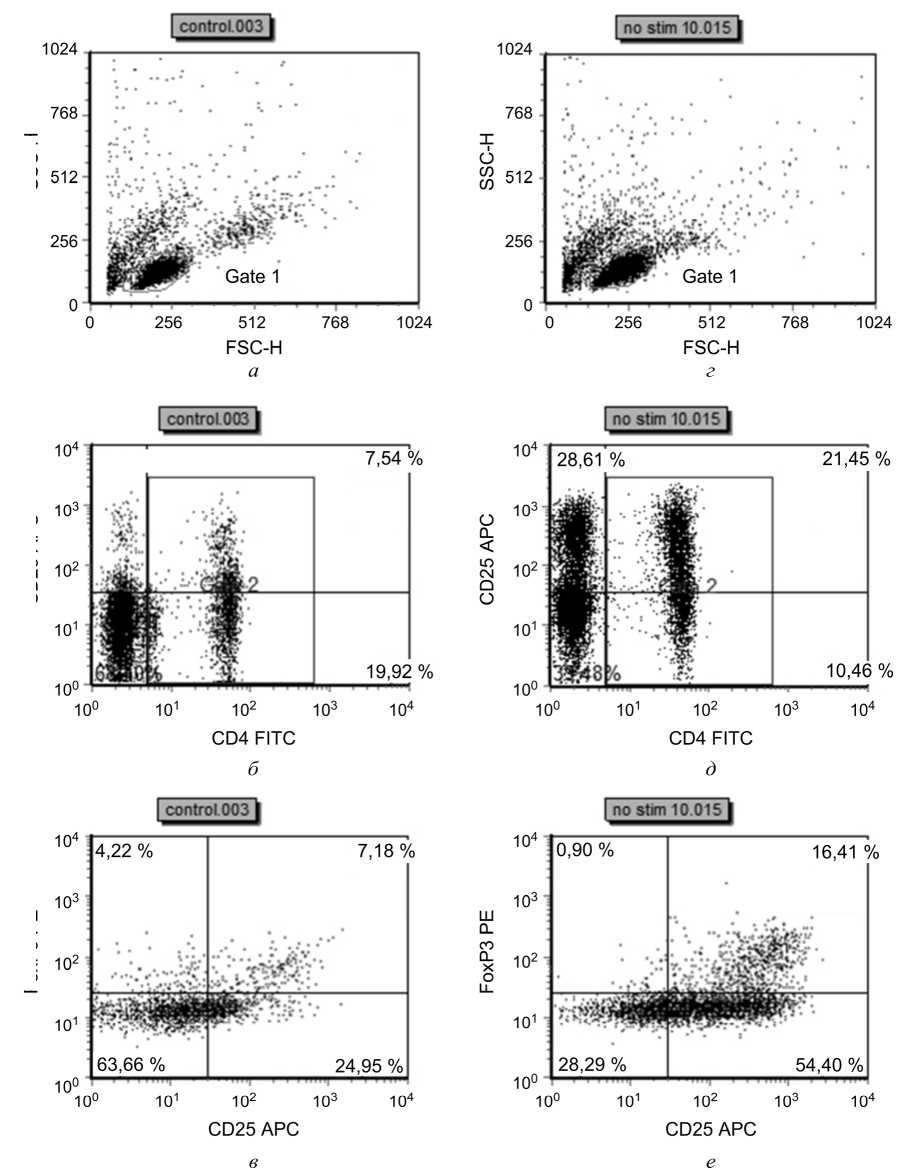
Рис. 1. H. pylori повышает содержание Т-регуляторных клеток при прямом сокультивировании с лимфоцитами: а – в – данные репрезентативного эксперимента, содержание Т-регуляторных клеток в контрольных культурах без H. pylori ( а – распределение клеток по светорассеиванию, б – выделение CD4+CD25+ клеток, в – выделение FoxP3+ Т-регуляторных клеток, оцениваемая популяция находится в верхнем правом квадранте); г – е – данные репрезентативного эксперимента, содержание Т-регуляторных клеток в культурах, росших в присутствии H. pylori ( г – распределение клеток по светорассеиванию, д – выделение CD4+CD25+ клеток, е – выделение FoxP3+ Т-регуляторных клеток, оцениваемая популяция находится в верхнем правом квадранте). Оцениваемые маркеры и регистрируемые параметры указаны по осям, процентное соотношение клеток – в углах квадрантов
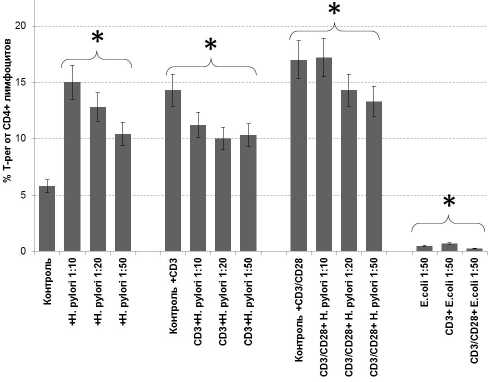
Рис. 2. Влияние H. pylory на дифференцировку Т-регуляторных клеток. Варианты стимуляции обозначены под диаграммой. Контороль – лимфоциты без добавления бактерий и антител;
* достоверные отличия от контрольной культуры, p <0,01
но и стимулирующих антител к CD3 и CD28, предоставляющих Т-клеткам сигнал, подобный стимуляции от АПК. Данные анализа культур с добавлением антител также приведены на рис. 2. Как можно видеть, стимуляция антителами сразу приводила к появлению в культуре достаточно высоких уровней содержания Т-рег (14,0 ± 1,29 % Т-рег для культур с добавлением только CD3 без H. pylori, 16,54 ± 2,13 % для культур с добавлением смеси CD3 и CD28 – модель более полной стимуляции, опять же без добавления H. pylori ). Введение в культуры H. pylori не приводило к увеличению содержания Т-рег (для культур с CD3 содержание Т-рег составляло 11,25 ± 1,06 % для соотношения 1:10, 10,04 ± 1,14 – для соотношения 1:20, 10,28 ± 1,54 % – для соотношения 1:50, достоверных отличий от культуры с CD3 без H. pylori нет; для культур со смесью CD3 и CD28 содержание Т-рег 16,93 ± 3,74 % для соотношения 1:10, 13,95 ± 2,13 % – для соотношения 1:20, 12,82 ± ± 1,28 % – для соотношения 1:50, достоверных отличий от культуры со смесью CD3+CD28 без H. pylori нет). Как и в случае с культурами, стимулированными только H. pylori , наблюдалась тенденция к обратной дозовой зависимости между дозой микроба в культуре и содержанием Т-рег.
Все значения содержания Т-рег в культурах с CD3 и CD3+CD28 достоверно отличались от содержания Т-рег в культурах лимфоцитов без антител и H. pylori (p<0,01) и не отличались от культур, стимулированных H. pylori без антител. Таким образом, H. pylori стимулирует дифференцировку лимфоцитов в сторону Т-рег на уровне активации антителами. Отсутствие повышения числа Т-рег в культурах, стимулированных одновременно H. pylori и антителами, по-видимому, объясняется поликлональным характером активирующего действия антител, которые вызвали дифференцировку всех CD4+ Т-клеток, исходно имевших коммитирование к развитию в сторону Т-рег.
Для проверки специфичности действия H. pylori нами применялись культуры лимфоцитов, стимулированные другим микроорганизмом, обитающим в желудочно-кишечном тракте человека – Escherichia coli (E.coli).
Используемые нами культуры лимфоцитов и E. coli росли как в отсутствии, так и в присутствии антител к CD3 и CD28. Соотношение лимфоцитов и E. coli составляло 1:50. Как можно видеть из рис. 1, E. coli не вызывала созревания Т-рег в культурах и препятствовала стимулирующему действию антител. Таким образом, полученные данные свидетельствуют о том, что стимулирующее дифференцировку Т-рег влияние является свойством именно H. pylori и, по всей видимости, не опосредуется паттернами патогенов (сходными у H. pylori и E.coli – подвижных грамотрицательных микроорганизмов).
Выводы. Оценка способности микроорганизмов модулировать иммунный ответ, в особенности, если подобное модулирование способствует выживанию микроорганизма во внутренней среде хозяина, является актуальной фундаментальной и практической задачей. Понимание данных механизмов, несомненно, может способствовать как прогнозированию возможных рисков, обусловленных микроорганизмом, так и повышению эффективности терапевтических подходов к патологиям, обусловленным данным микроорганизмом. В представленной работе нами показана способность H. pylori оказывать дифференцировочное действие на Т-лимфоциты, направляющее их развитие в сторону Т-регуляторных клеток. При отсутствии в культурах дендритных клеток – популяции иммуно-цитов, процесс, по современным данным, имеет наиболее выраженную способность управлять течением иммунного ответа. В пределах исследуемой группы данное действие наблюдалось при соотношениях микробов и Т-клеток от 1:10 до 1:50, не требовало присутствия в куль- турах АПК или стимулирующих антител. В среднем рост процентного содержания Т-регулятор-ных CD4+CD25+FoxP3+ клеток среди CD4+лим-фоцитов составлял 2,12 раза. По всей видимости, в условиях данного эксперимента воздействие H. pylori затрагивало клетки, исходно коммитированные к развитию в сторону Т-рег, так как поликлональная стимуляция антителами к CD28 и/или CD3 «поглощала» эффект от введения бактерий – культуры, стимулированные только антителами, а также антителами одновременно с H. pylori, статистически не отличались по содержанию Т-рег. Дифференцирующее действие, по всей видимости, являлось специфическим свойством именно H. pylori, так как стимуляция лимфоцитов с помощью другого микроорганизма, способного длительно выживать в условиях ЖКТ – E. coli – не вызывала повышения содержания Т-регуляторных клеток. Таким образом, нами была принципиально продемонстрирована способность H. pylori оказывать влияние на дифференцировку регуляторных Т-клеток, не опосредуемая презентацией микробных антигенов дендритными клетками, но, по всей видимости, зависящая именно от прямого воздействия микроба на Т-клетки. Понимание данного механизма может позволить выделить действующее начало, индуцирующее развитие Т-рег и, таким образом, потенциально являющееся естественным толерогенным фактором, применимым в качестве лекарственного средства.
Список литературы Влияние Helicobacter pylori на дифференцировку Т-регуляторных клеток
- Методы лабораторной диагностики инфекции, обусловленной Helicobacter pylori: пособие для врачей/А.Б. Жебрун, А.В. Сварваль, Р.С. Ферман, Л.Б. Гончарова. -СПб.: ФБУН НИИЭМ имени Пастера, 2014. -60 с.
- Evidence for transepithelial dendritic cells in human H. pylori active gastritis/V. Necchi, R. Manca, V. Ricci, E. Solcia//Helicobacter. -2009. -Vol. 14, №. 3. -P. 208-222.
- Helicobacter pylori induces activation of human peripheral γδ+ T lymphocytes/B. Romi, E. Soldaini, L. Pancotto, F. Castellino, G. Del Giudice, F. Schiavetti//PLoS One. -2011. -Vol. 6, № 4. -P. e19324.
- Helicobacter pylori induces miR-155 in T Cells in a cAMP-Foxp3-dependent manner/L.F Fehri, M. Koch, E. Belogolova, H. Khalil //PLoS One. -2010. -Vol. 5, № 3. -P. e9500.
- Helicobacter pylori infection prevents allergic asthma in mouse models through the induction of regulatory T cells/I.C. Arnold, N. Dehzad, S. Reuter, H Martin //Journal Clin. Invest. -2011. -Vol. 121, № 8. -P. 3088-3093.
- Helicobacter pylori polyclonally activates murine CD4 (+) T cells in the absence of antigen-presenting cells / C. Rosenplänter, F. Sommer, P. Kleemann, A. Belkovets // Eur. J. Immunol. 2007, 37 (7): 1905-1915.
- Human peripheral and gastric lymphocyte responses to Helicobacter pylori NapA and AphC differ in infected and uninfected individuals/H.J. Windle, Y.S. Ang, V. Athie-Morales, R. McManus //Gut. -2005. -Vol. 54, № 1. -P. 25-32.
- Involvement of Toll-like receptors on Helicobacter pylori-induced immunity/R. Käbisch, R. Mejías-Luque, M. Gerhard, C. Prinz//PLoS One. -2014. -Vol. 9, № 8. -P. e104804.
- Mucosal FOXP3-expressing CD4+ CD25high regulatory T cells in Helicobacter pylori-infected patients/A. Lundgren, E. Stromberg, A. Sjoling, C. Lindholm //Infect. Immun. -2005. -Vol. 73, № 1. -P. 523-531.
- Pachathundikandi S.K., Müller A., Backert S. Inflammasome activation by Helicobacter pylori and its Implications for persistence and immunity//Curr. Top. Microbiol. Immunol. -2016. -Vol. 397. -P. 117-131.
- Raghavan S., Quiding-Järbrink M. Immune modulation by regulatory T cells in Helicobacter pylori-associated diseases//Endocr. Metab. Immune. Disord. Drug. Targets. -2012. -Vol. 12, № 1. -P. 71-85.
- Sakaguchi S., Wing K., Yamaguchi T. Dynamics of peripheral tolerance and immune regulation mediated by Treg//Eur. J. Immunol. -2009. -Vol. 39, № 9. -P. 2331-2336.
- Sanchez A.M., Yang Y. The role of natural regulatory T cells in infection//Immunol. Res. -2011. -Vol. 49, № 1-3. -P. 124-134.
- Shiu J., Blanchard T.G. Dendritic cell function in the host response to Helicobacter pylori infection of the gastric mucosa//Pathog. Dis. -2013. -Vol. 67, № 1. -P. 46-53.
- The effect of Helicobacter pylori on asthma and allergy/A. Amedei, G. Codolo, G. Del Prete, M. de Bernard, M.M. D'Elios//Journal Asthma. Allergy. -2010. -Vol. 3. -P. 139-147.
- Whiteside T.L. The role of regulatory T cells in cancer immunology//Immunotargets. Ther. -2015. -Vol. 4. -P. 159-171.


