Влияние хорионического гонадотропина на фагоцитарную активность эозинофилов периферической крови женщин. Роль Са2+-акцептирующих белков
Автор: Заморина С.А., Ширшев С.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Медико-биологические науки
Статья в выпуске: 6, 2005 года.
Бесплатный доступ
Изучено влияние хорионического гонадотропина (ХГ), основного гормона беременности, на фагоцитарную активность эозинофилов в периферической крови женщин. Установлено, что в эозинофилах, полученных от женщин в фолликулярной фазе, высокая доза ХГ (100 МЕ/мл) снижала процент фагоцитирующих клеток и их поглотительную активность. В лютеиновую фазу менструального цикла гормон в дозе 100 МЕ/мл угнетал только поглотительную активность эозинофилов. Однако на фоне блокады Са^^-акцептирующих белков циклоспорином А депрессивный эффект ХГ в высокой дозе отменялся независимо от фазы цикла. В то же время в сочетании с циклоспорином А ХГ в низкой дозе (10 МЕ/мл) оказывал супрессивный эффект на фагоцитоз, который был более вьфажен в фолликулярную фазу. Таким образом, ХГ угнетает фагоцитарную активность эозинофилов в периферической крови женщин, при этом эффективна только высокая доза гормона (100 МЕ/мл), а реализация эффектов зависит от функционирования Са2+-акцептирующих белков
Короткий адрес: https://sciup.org/147204370
IDR: 147204370 | УДК: 612.017.1
Текст научной статьи Влияние хорионического гонадотропина на фагоцитарную активность эозинофилов периферической крови женщин. Роль Са2+-акцептирующих белков
Введение '
Одна из функций эозинофилов - обеспечение противогельминтного иммунитета, при этом ключевым моментом их активации является дегрануляция (Giembycz, Lindsay, 1999). Эозинофилы также могут функционировать как антигенпрезентирующие клетки, модулируя иммунный ответ в сторону ТН2-типа (Shi, 2004). Известна также способность этих клеток фагоцитировать патогены благодаря экспрессии С1- ,СЗ- и С4-рецепторов комплемента (Giembycz, Lindsay, 1999). На поверхности большей части эозинофилов экспрессируется FCy-рецептор (Beeken et al., 1987), а также Fc^g,^-рецепторы (Giembycz, Lindsay, 1999). Кроме того, на поверхности эозинофилов присутствуют интег-рины, селектины и рецепторы к компонентам комплемента С4- и Clq (Giembycz, Lindsay, 1999). В отношении окислительной активности эозинофилов выявлено, что IgG-, IgE-комплексы и ФМА стимулируют продукцию Н2О2 (Rossi, 1989), а ИЛ-5 повышает уровень люминол-зависимой хемилюминесценции (Tsai, Yu, Wang, 1993). В то же время эозинофилы являются эстрогензависимыми клетками (Giembycz, Lindsay, 1999), которые аккумулируются из периферической крови в эндометрий, где выполняют иммунорегуляторную и фагоцитарную функции.
Регуляция фагоцитарной активности эозинофилов хорионическим гонадотропином (ХГ) - основным гормоном беременности - практически не изучена. ХГ помимо регуляции стероидогенеза плаценты и плода активно участвует в контроле иммунных процессов (Hammarstrom et al., 1979; Yagel et al., 1989; Magnie et al., 1990; Ширшев 1997; 1998), что обусловлено необходимостью одновременного обеспечения процессов беременности и защиты полуаллогенного плода от атаки иммунокомпетентных клеток матери. Таким образом, целью работы являлось изучение влияния ХГ на фагоцитарную активность эозинофилов.
Известно, что в период гестации и в течение 711 месяцев после родов биологически активный ХГ синтезируется NK-клетками, моноцитами и в меньшей степени лимфоцитами периферической крови, причем пик секреции приходится на 9-16 неделю беременности (Alexander et al., 1998). Флуориметрическими исследованиями с использованием антител к ХГ выявлено связывание гормона этими клетками, реализуемое через ЛГ/ХГ-рецептор (Alexander et al. 1998). Однако на гранулоцитах этот рецептор не идентифицирован, что позволяет предположить, что ХГ реализует свои
О С. А. Заморина, С. В. Ширшев, 2005
эффекты в данном случае через «альтернативную» мембранную структуру - TLRs (toll-like receptors), внеклеточные домены которых гомологичны гор-монсвязывающему сайту ЛГ/ХГ-рецептора (Takahashi et al, 1985). Известно, что эозинофилы конститутивно экспрессируют TLR1, TLR4, TLR7, TLR9 и TLR10 mRNAs (Nagase, 2003) и способны к ЛПС-зависимой активации с вовлечением CD 14 (Plotz et al. 2001), вследствие чего мы предполагаем, что гормон реализует свои модулирующие эффекты через TLRs.
Материалы и методы
В работе использовали цельную кровь небеременных женщин в возрасте 19-48 лет. Обследуемые женщины были разделены на две группы в зависимости от фазы менструального цикла: первая («фолликулярная фаза») состояла из женщин, у которых кровь забирали на 5-9 день менструального цикла (п=8); вторая («лютеиновая фаза») группа состояла из женщин, у которых кровь брали на 1825 день цикла (п=8).
Использовался XT («profasi», Serano, Италия) в дозах 10, 50 и 100 МЕ/мл, что соответствует разным срокам беременности. На 50-й день (7 нед.) беременности концентрация гормона достигает 50 МЕ/мл, на 70-й день (10 нед.) - 100 МЕ/мл, в последующие П-Ш триместры концентрация гормона снижается до 10 МЕ/мл и держится на таком уровне до конца беременности (Wide, 1962; Jaffe, 1969). Гормон разводили ex tempore средой 199 (НПО «Биомед», Россия).
В качестве ингибитора кальмодулина (Carsten, 1982) использовали циклоспорин А (ЦсА) “San-dimmun” (Sandos, Швейцария) в среднетерапевтической дозе 0,05 мг/мл (Обух, 1988).
Фагоцитарную активность лейкоцитов оценивали с помощью светового микроскопа, регистрируя поглощение объектов фагоцитоза. В качестве объектов использовали формалинизированные эритроциты барана (ФЭБ) (Каплин, 1996), трижды отмытые в избытке среды 199 центрифугированием при 400 g. Концентрацию ФЭБ в суспензии доводили до 108/мл.
Для оценки фагоцитарной активности лейкоцитов периферической крови в капроновых пробирках смешивали 0,1 мл цельной гепаринизированной крови и 0,1 мл отмытых ФЭБ. Пробы инкубировали 20 мин при 37°С. Затем содержимое пробирок ресуспендировали и готовили мазки, которые фиксировали метанолом и окрашивали по Романовскому-Гимзе. Время окрашивания (15-20 мин) подбирали таким образом, чтобы ФЭБ имели сине-фиолетовую окраску, а собственные эритроциты - розовую. Подсчет вели под иммерсией (объектив х90), просчитывали не менее 300 клеток на мазке. Рассчитывали следующие показатели:
-
1) процент фагоцитоза - количество клеток, за
хвативших один и более объектов фагоцитоза (ФЭБ^на 100 потенциальных фагоцитов;
-
2) фагоцитарный индекс (ФИ) - количество объектов фагоцитоза, которое приходится на одну фагоцитирующую клетку («истинный» фагоцит), что характеризует индивидуальную поглотительную активность фагоцитов.
Парциальную фагоцитарную активность оценивали в цельной крови, рассчитывая указанные показатели отдельно для эозинофилов.
Статистическая обработка результатов проводилась с использованием /-критерия Стьюдента, как парного (а), так и непарного (Ь).
Результаты и обсуждение
Известно, что функционально менструальный цикл может быть разделен на фазы, в динамике которых уровень циркулирующих гонадотропинов, эстрогенов, андрогенов и прогестинов изменяется (Midgley, Jaffe, 1968). Фолликулярная фаза характеризуется низким уровнем прогестерона и 17-оксипрогестерона, но относительно высокой концентрацией гонадотропинов и эстрогенов. Наиболее существенным эндокринным проявлением лютеиновой фазы является выраженное увеличение секреции прогестерона. Параллельно, но в меньшей степени, нарастает уровень 17-оксипрогесте-рона, эстрадиола и эстрогена, снижаются уровни ЛГ и ФСГ в плазме (Judd, Yen, 1973).
Для расшифровки механизма действия ХГ на фагоцитоз эозинофилов использовали циклоспорин А (ЦсА). Известно, что ХГ реализует иммуномодулирующие эффекты через Са2+-зависимые механизмы (Ширшев, 1998). Ввиду селективной активности ЦсА в отношении Са2+-акцептирующих белков предполагается следующий механизм действия в этих клетках: взаимодействие препарата с циклофилинами (O’Neil et al, 1995) приводит к образованию комплекса с кальцийневрином, что необходимо для реализации эффекта на уровне экспрессии цитокиновых генов (Morris, 1981; Borel, 1986). Выявлено наличие циклофилинов в нелимфоидных клетках, в частности эозинофилах (Giembycz, Lindsay, 1999). Помимо кальцийневри-на ЦсА блокирует работу кальмодулина (Carsten, 1982), участвующего в фосфорилировании протеинов, и других Са2+-акцептирующих белков (Morris, 1981; Borel, 1986).
Установлено, что в эозинофилах, полученных в фолликулярной фазе, высокая доза ХГ(100МЕ/мл) угнетала все исследуемые показатели фагоцитоза (рис. 1). ЦсА оказывал самостоятельный депрессивный эффект на все исследуемые показатели фагоцитарной активности эозинофилов. Депрессивный эффект ХГ100 МЕ/мл на фоне блокады Са2+-акцептирующих белков полностью снимался, что может объясняться повышением уровня (Са2‘),. В то же время на фоне применения ЦсА проявился депрессивный эффект низкой дозы ХГЮМЕ/мл на фагоцитоз, причем угнетались все исследуемые показатели (рис. 1).
фолликулярная фаза
% фагоцитоза

ФИ О 0.2 0,4 0.6 0,8 1 1,2 1,4
контроль инкубации контроль гормона
ХГ10 МЕ/мл
ХГ50 МЕ/мл
ХГ 100 МЕ/мл
• ЦсА
XTlOME/wn-ЦсА ХГ50 МЕ/мл+ЦсА
ХГ1 ОО МЕ/мл+ЦсА

Рис. 1. Влияние ХГ на фагоцитарную активность эозинофилов периферической крови, находящихся в фолликулярной фазе цикла у женщин. Роль
■ Са2+-акцептирующих белков
В лютеиновую фазу менструального цикла гормон в дозе Ю0МЕ/мл угнетал только поглотительную активность эозинофилов (ФИ), но не фагоцитарную активность. ЦсА оказывал аналогичное действие. Низкая доза ХГЮМЕ/мл на фоне блокады кальмодулина, напротив, оказывала супрессивное влияние на уровень фагоцитирующих эозинофилов (рис. 2).
Таким образом, в эозинофилах депрессивный эффект ХГ реализуется по-разному. В фолликулярной фазе гормоном предположительно модулируется конформация мембран посредством изменения уровней внутриклеточного цАМФ и Са2+, в результате чего происходит маскировка, блокада или утрата рецепторов, в том числе и для ХГ. В лютеиновую фазу, напротив, число распознающих поверхностных структур, по-видимому, не меняется, но депрессивный эффект гормона затрагивает функционирование актин-миозинового комплекса. На фоне блокады кальмодулина и других Са2+-акцептирующих белков гормон реализует разнона правленные дозозависимые эффекты.
лютеиновая фаза
Ve^Dn-mnrzlJ
0 20 40 60 60 100
контроль инкубации контроль горное
ХГЮМЕ/мл
ХГ50 МЕ/мл
ХГЮОМЕАш
ЦсА
ХГ 10 МЕ/мл* ЦсА
ХГ50 МЕ/мл+ЦсА
ХГ100 МЕ/мл+ЦсА

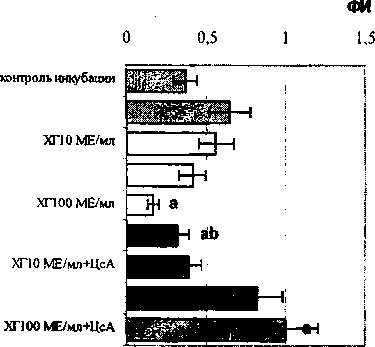
Рис. 2. Влияние ХГ на фагоцитарную активность эозинофилов периферической крови, находящихся в лютеиновой фазе цикла у женщин. Роль Са2+-акцептирующих белков
В фагоцитирующих клетках, особенно на периферии цитоплазмы, содержится большое количество актина и миозина. Образование псевдоподий вокруг объекта фагоцитоза связано с мобилизацией ионов Са2+, которые стимулируют энергозависимую сборку и функционирование сократительных белков (Jonhson, Kitogawa, 1985). Вероятно, избыточный уровень (Са2+); в условиях применения ЦсА нарушает текучесть мембран и адекватное функционирование ферментных комплексов, локализуемых в них, вследствие этого ЦсА оказывает преимущественно депрессивное влияние на фагоцитарную активность эозинофилов.
Однако при пересечении эффектов ЦсА с действием ХГ фагоцитоз может стимулироваться за счет вовлечения активационного сигнала с TLRs. Известно, что сигналы с TLRs могут регулировать фагоцитарную активность клеток, способствуя поглощению микробных объектов на разных стадиях фагоцитоза (Blander, Medzhitov, 2004). В то же время разница эффектов в разные фазы цикла объясняется стероид-зависимой экспрессией TLRs на клетках.
Таким образом, ХГ способен угнетать фагоцитарную активность эозинофилов в крови человека, при этом наиболее выраженный эффект наблюдался по отношению к эозинофилам, полученным из крови женщин в фолликулярной фазе менструального цикла. Направленность эффекта гормона зависит от функционирования Са2+-акцептирующих белков, таких как кальмодулин и кальцийневрин. ХГ на фоне блокады вышеназванных белков оказывает преимущественно стимулирующий эффект на фагоцитарную активность эозинофилов, вероятно, за счет включения активационного сигнала с TLRs. Возможно, гормон взаимодействует на поверхности эозинофилов с TLRs, потому как внеклеточные домены этих белков гомологичны гор-монсвязывающему сайту ЛГ/ХГ-рецептора. Однако нельзя исключать вероятности прямого контакта эозинофилов с другими лейкоцитами в условиях цельной крови, вследствие чего происходит модуляция фагоцитарной активности эозинофилов.
Список литературы Влияние хорионического гонадотропина на фагоцитарную активность эозинофилов периферической крови женщин. Роль Са2+-акцептирующих белков
- Каплин В.Н. Нетрадиционная иммунология инфекции. Пермь: Изд.-во Перм. мед. акад., 1996. 163 с.
- Обух КБ. Фармакологические особенности циклоспорина А. Применение при трансплантации почки//Терапевтический архив. 1988. № 5. С. 136-143.
- Ширшев СВ. Молекулярные механизмы иммуно-модулирующего действия хорионического гонадотропина на Т-и В-лимфоциты интактной селезенки//Биохимия. 1997. Т. 62, вып. 5. С. 603-612.
- Ширшев СВ. Клеточные и молекулярные механизмы иммуномодулирующего действия хорионического гонадотропина//Успехи соврем, биологии. 1998. Т. 118, № 1. С. 69-85.
- Ширшев СВ. Механизмы иммуно-эндокринного контроля процессов репродукции. В 2 т. Т. 2. Екатеринбург, 2002. 557 с.
- Alexander Н. et al. HCG Secretion by periperal mononuclear cells during pregnancy//Domest. An. Endocrinol. 1998. V. 15, № 15. P. 377-387.
- Batiuk T.D., Pazderka F., Halloran P.F. Calcineurin activity is only partially inhibited in leukocytes of cyclosporine-treated patients//Transplantantation. 1995. V. 59, № 10. P. 1400-1404.
- Beeken W.L. et al. Eosinophils of human colonic mucosa: C3b and Fc gamma receptor expression and phagocytic capabilities II Clin. Immunol. Immunopathol. 1987. V. 43, № 3. P. 289-300.
- Blander J.M., Medzhitov R. Regulation ofphago-some maturation by signals fi-om toll-like receptors II Science. 2004. V. 304, № 5673. P. 1014-1018,
- Borel J.F. (ed.) Cyclosporine II Progress in Allergy. Basel: Karger, 1986. V. 38.
- Carsten N. Cyclosporine A/Diss. Dokt. Med./Fak. Techn. Univ. Munchen, 1982.
- Giembycz M.A., Lindsay M.A. Pharmacology of the eosinophil II Pharmacological reviews. 1999. V. 51, №2. P. 213-339.
- Hammarstrom L, Fuchs Т., Smith CLE. The immunodepressive effect of human glicoproteins and their possible role in the honrejection process during pregnancy II Acta Obstet. Gynecol. Scand. 1979. V. 58, №5. P. 417-422.
- Jaffe R.B., Lee P.A., Midgley A.R. Serum gonadotropin before, at the inception of, and following human pregnancy II J. Clin. Endocrinol. Metab. 1969. V. 29. P. 1022-1031,
- Johnson R.B.Jr., Kitagawa S. Molecular basis for the enhanced respiratory burst of activated macrophages II Fed Proc, 1985.V. 44. P. 2927-2932.
- Judd H.L., Yen S.S.C. Serum androstendione and testosterone levels during the menstrual cycle II J. Clin. Endocrinol Metab. 1973. V. 36. P. 475-479.
- Lin J. et al. Lymphocytes from pregnant women express human chorionic gonadotropin/luteinizing hormone receptor gene II Mol. Cell. Endocrinol. 1995. V. 111,№. l.P. 13-17.
- Magnie M. et al. Effects of chorionic gonadotropin (hCG) therapy on the immune system II Medicina (Firenze). 1990. V. 10, № 2. P. 148-149.
- Midgley A.R.Jr., Jaffe R.B. Regulation of human gonadortopins: VL Correlation of serum concentrations of follicle-stimulating and luteinizing hormones during the menstrual cycle II J. Clin. Endocrinol Metab. 1968, V. 28. P. 1699-1709.
- Morris P.J. Cyclosporine A. Overview II Transplantation. 1981. V. 32. P, 349-354.
- Nagase H. et al. Expression and flinction of Toll-like receptors in eosinophils: activation by Toll-like receptor 7 ligand II J. Immunol. 2003. V. 171, № 8. P. 3977-3982.
- O'Neill E.A. et al. The FK-506-and CSA-sensitive phosphatase, calcineurin, enchances activation of NF-kB in several cell types: Abstr. Keystone Symp. Contr. And Manipul. Immune Response, Taos, N.M., March 16-22, 1995 II J. Cell. Biochem. (Suppl. 21a). P. 81-87.
- Plotz S.G. et al. The interaction of human peripheral blood eosinophils with bacterial lipopolysaccharide is CD14 dependent II Blood. 2001. V. 97, № l.P. 235-241.
- Rossi G.A. et al. Oxidative metabolism of human peripheral blood eosinophils and neutrophils: H2O2 production after stimulation with phorbol myristate acetate and immune complexes II Eur. Respir. J. Suppl. 1989. V. 6. P. 435-440.
- Shi H.-Z. Eosinophils function as antigen presenting cells II J. Leuk. Biol. 2004. V. 76. P. 1-8.
- TakahashiN., Takahashi Y., Putnam F.W. Periodicity of leucine and tandem repetition of a 24-amino acid segment in the primary structure of leucinerich alpha 2-glycoprotein of human serum II Proc. Natl. Acad. Sci. USA. 1985. V. 82. P. 1906-1910.
- Tsai J.J., Yu L.N., Wang S.R. Enhanced eosinophil luminol-dependent chemi-luminescence and complement receptor expression by platelet-activating factor and interleukin-5 II Asian Рас. J. Allergy Immunol.1993. V. l l,№ l.P.5-11.
- Wide L. An immunological method for the assay of human chorionic gonadotrophin II Acta Endocrinol. (Kbh). 1962. V. 41, suppl. 70. P. 1-100.
- Yagel S. Parhar R.S. Lala P.K. Trophic effect of firsttrimester human trophoblasts and human chorionic gonadortopin on lymphocyte proliferation II Am. J. Obstet. Gynecol. 1989. V.160, № 4. P. 946-953.


