Влияние хронического эмоционально-стрессового воздействия на поведение мышей с мутациями Q31l и L100P в гене DISC1
Автор: Смирнова Кристина Вячеславовна, Чижова Надежда Дмитриевна, Амстиславская Тамара Геннадьевна
Журнал: Сибирский вестник психиатрии и наркологии @svpin
Рубрика: Биологические исследования
Статья в выпуске: 1 (118), 2023 года.
Бесплатный доступ
В этиологию психических заболеваний зачастую вовлекаются как генетические, так и средовые факторы, вызывающие стресс. Мутации в гене DISC1 сами по себе являются предикторами развития психопатологий,в то же время нет данных о влиянии хронического стресса на эмоционально обусловленное (аффективное) поведение организма с мутациями в этом гене. Цель: изучение особенностей поведенческого ответа мышей с точечными мутациями в гене Disci после непредсказуемого эмоционально-стрессового воздействия разной продолжительности. Материалы и методы. Проведено тестирование самцов мышей трех генетических линий: C57BL/6, Disc1-Q31L-/- (Q31L) и DISC1-L100P-/- (L100P), в возрасте 3-4-месяцев. Для изучения особенностей поведенческого реагирования мышей Q31L и L100P, характеризующихся депрессивно-подобными шизофреноподобным поведением, подвергали хроническому непредсказуемому мягкому стрессу (ХНМС) длительностью 2 и 4 недели соответственно. После этого оценивали их тревожность, двигательную и исследовательскую активность, эмоциональность, депрессивно-подобное и обсессивно-компульсивное поведение, социальную мотивацию и предпочтение. Установлено, что 2-недельный стресс усиливал тревожность и депрессивно-подобное поведение у мышей Q31L, а 4-недельный стресс повышал их двигательную активность, но не оказывал влияния на тревожный и депрессивно-подобный статус. У мышей L100P стресс длительностью как 2, так и 4 недели приводил к проявлению депрессивно-подобного поведения. Кроме того, 2-недельный стресс усиливал эмоциональность и социальное взаимодействие, тогда как 4-недельный снижал исследовательскую активность мышей. Таким образом, генетически обусловленное депрессивно-подобное состояние у мышей Q31L усиливается в результате стрессорного воздействия протяженностью 2 недели, тогда как мыши L100P с генетически обусловленным шизофреноподобным фенотипом формируют депрессивно-подобный статус после хронического стресса разной продолжительности.
Ген disc1, хронический стресс, депрессия, шизофрения, моделирование психопатологий, мыши
Короткий адрес: https://sciup.org/142238068
IDR: 142238068 | УДК: 569.323-028.77:165.195:591.555.15 | DOI: 10.26617/1810-3111-2023-1(118)-104-113
Текст научной статьи Влияние хронического эмоционально-стрессового воздействия на поведение мышей с мутациями Q31l и L100P в гене DISC1
Психические расстройства широко распространены в мире, в соответствии с опубликованными данными на 2017 г. около 970 миллионов человек страдают какой-либо психиатрической патологией [1]. Этиология психических заболеваний включает различные генетические и средовые факторы [2, 3]. Мутации в гене Disc1 (Disrupted-In-Schizophrenia-1) являются предиктором развития психопатологий, в том числе депрессии [4]. Существует широкий пласт модельных систем на основе нарушений в гене Disc1, которые показывают поведенческие фенотипы, схожие с психическими расстройствами людей [5, 6]. Одна из таких моделей – мыши Disc1-Q31L-/- (Q31L) и Disc1-L100P-/- (L100P), полученные путем ENU-мутагенеза на основе линии C57BL/6(WT). Мыши Q31L и L100P имеют точечную мутацию во втором экзоне гена Disc1, которая в первом случае приводит к замене в белке DISC1 глутамина на лейцин по аминокислоте 31, а во втором случае ‒ к замене лейцина на пролин в аминокислоте 100. На поведенческом уровне мутация Q31L обусловливает появление депрессивно-подобного фенотипа: увеличенное время дрейфа в тесте принудительного плавания и выраженную анге-донию [7, 8]. Недавние исследования также выявили повышенную эмоциональность у самок мышей, высокую импульсивность и агрессию у самцов и слабое угашение памяти о страхе у мышей обоих полов [9]. Представлены данные, что мыши L100P характеризуются большей склонностью к шизофреноподобному поведению, что выражается в дефиците сенсорной фильтрации, рабочей памяти и гиперактивности [7, 10].
Модели психопатологий, основанные на факторе воздействия неблагоприятной среды, включают в себя разнообразный спектр протоколов. Среди них хорошо зарекомендовала себя модель хронического непредсказуемого стресса (ХНМС), который приводит к развитию у животных депрессивно-подобного фенотипа [11, 12].
Влияние внешних факторов, в том числе стрессоров, может быть опосредовано за счет эпигенетических модификаций определенных генов [13] . Кроме того, влияние внешних факторов может наслаиваться на уже имеющиеся генетические нарушения, вызывая поведенческие аномалии. Так, на гетерозиготах Disc1-Q31L+/-и Disc1-L100P+/- показано, что стресс социальных поражений разнообразно влияет на поведение животных в зависимости от генотипа [14]. Длительная социальная изоляция, применяемая к мышам Disc1-L100P-/- в юном возрасте, нарушала социальную память у взрослых животных [15]. Однако эффекты ХНМС на животных с мутациями в гене Disc1 до сих пор не исследовались.
ХНМС разной длительности может влиять на степень проявления поведенческих нарушений у животных, что подтверждается противоречивыми сведениями. В одном исследовании у мышей WT более короткий ХНМС длительностью 18 дней вызывал больший поведенческий ответ, чем более продолжительный 36-дневный ХНМС [16]. В другом исследовании, наоборот, выявлено, что 56 дней ХНМС эффективнее для формирования выраженного поведенческого ответа, чем стандартный 4-недельный протокол [17]. Обсуждаемые данные обосновывают актуальность изучения эффекта разной длительности ХНМС на животных с мутациями в гене Disc1 .
Исходя из вышесказанного, целью данной работы являлось изучение особенностей поведенческого ответа мышей с мутациями в гене Disc1 после непредсказуемого эмоционально-стрессового воздействия разной продолжительности.
МАТЕРИАЛЫ И МЕТОДЫ
В работе использовали самцов трех генетических линий (WT и с точечной мутацией в гене Disc1, Q31L и L100P), выведенные на основе мышей WT с помощью ENU-мутагенеза. Животные получены из уникальной научной установки «Биологическая коллекция ‒ генетические биомодели нейропсихических заболеваний» (№ 493387) НИИ нейронаук и медицины. Выполняли тестирование 3-4-месячных мышей со средним весом 30±5 г. Критерием исключения из эксперимента было наличие видимых внешних повреждений, нарушение двигательной активности, яркое агрессивное поведение особи (исключение всей клетки из эксперимента), выраженная гипотрофия или ожирение.
Содержание мышей соответствовало стандартным требованиям ухода за лабораторными животными согласно руководству ГОСТ 332162014, цикл освещенности составлял 12:12 часов (свет включали в 5:00, выключали в 17:00). Животные содержались в пластиковых клетках размером 37х21х15 см, не более 5 мышей в одной клетке, имели постоянный доступ к пище и воде. Температура помещения 22-25оС. Группы контроля и группы стресса содержались в разных комнатах.
Всего в работе было использовано 90 самцов мышей, по 10 животных в каждой экспериментальной группе. Дизайн эксперимента представлен в таблице 1.
Т а б л и ц а 1. Дизайн эксперимента стрессового воздействия на поведение мышей с мутациями
|
Мыши (самцы) |
WT |
Q31L |
L100P |
|
Условия содержания |
I S2 S4 |
I S2 S4 |
I S2 S4 |
|
Обозначения |
I – интактный контроль. S2 – ХНМС длительностью 2 недели. S4 – ХНМС длительностью 4 недели |
||
Протокол ХНМС основывался на предыдущих исследованиях и включал в себя следующие стресс-факторы: заключение в бутылку на 1 час, раскачивание клеток в течение 10 минут, лишение воды на 18 часов, купание в небольшом количестве воды в течение получаса, влажный подстил в течение 18 часов, наклон клетки на 45о в течение двух часов, троекратный удар током силой 0,1 мА, нагревание комнаты содержания до 40оС, троекратное обдувание горячим воздухом, выставление клеток на холод (+2оС) в течение получаса, нахождение в темноте в течение 24 часов и в условиях инвертированного освещения [11, 12].
Тестирование проводили по стандартным протоколам в порядке от менее к более стрессирующему воздействию. Автоматический трекинг и сбор данных осуществляли с помощью оборудования и программного обеспечения Ethovision XT 10 (Noldus International Technology).
Тест закапывания шариков – популярный тест для оценки стереотипного поведения. В клетку размером 37х21х15 см насыпали подстил (опилки) слоем 4 см, на поверхности подстила размещали 20 стеклянных шариков диаметром 1 см. В подготовленные клетки помещали мышей по одному, накрывали такой же пластиковой клеткой и оставляли на 30 минут. Затем мышей убирали в домашние клетки и подсчитывали количество шариков, которые были полностью закопаны в опилки [15].
Стандартный тест Открытое поле проводили для оценки двигательной и исследовательской активности, эмоциональности и тревожности животных в условиях новизны. Для этого использовали квадратную арену размером 40х40 см с прозрачными пластиковыми стенками высотой 50 см и непрозрачным дном. Тестирование проводили в течение 5 минут, фиксировали пройденный путь, активность, время в центре арены, площадь исследованной арены, число стоек и замираний, количество дефекаций. Между тестированиями каждой мыши арену очищали 70% раствором этанола для удаления запахов [15].
Тест Черно-белая камера использовали для оценки тревожного поведения самцов мышей. Установка представляла собой камеру размером 21,5х78,1х40,0 см, разделенную на два отсека. На тёмное отделение приходилась одна треть общей площади, его стенки были закрыты крышкой черного цвета. Остальные две трети представляли собой освещенный отсек с белыми стенками, отделенный от темного отсека дверцей размером 7х7 см. Белая камера освещалась двумя направленными лампами, расположенными рядом с аппаратом. Темная камера оставалась неосвещенной. Тестирование проводили в течение 5 минут. Автоматически отслеживались следующие параметры: длительность пребывания в белой камере, латентное время до выхода из черной камеры, среднее удаление от входа в черную камеру [20].
Социальное поведение животных оценивали с помощью теста Социальное предпочтение с использованием оборудования для теста ОП и двух металлических цилиндров с прорезями диаметром 8 см и высотой 15 см. Протокол теста включал в себя 5-минутную габитуацию, в течение которой животное привыкало к обстановке теста и двум металлическим стаканам в углах. После габитуации мышь отсаживали в отдельную клетку, а в камеру для тестирования под один стакан помещали социальный объект (мышь, объект А), под другой – несоциальный объект (муляж, объект Б). После чего снова запускали тестируемую мышь на 10 минут в установку. После каждого тестирования установку и стаканы протирали 70% спиртом. Наиболее информативными параметрами считаются общее время обнюхивания объектов, среднее расстояние от носа до объекта А или Б, а также время, проведенное в области рядом с объектами А или Б [21].
Поведенческое отчаяние оценивалось с помощью теста Принудительное плавание. Установка представляет собой цилиндр высотой 45 см и диаметром 20 см, в который наливали воду комнатной температуры до отметки 35 см. Мышь помещали в воду на 6 минут, в течение этого времени велась запись параметров. Основным пара- метром данного теста является длительность дрейфа за последние 4 минуты тестирования [22]. На следующий день после выполнения последнего теста животных умерщвляли декапитацией.
Работу с животными осуществляли согласно биоэтическим нормам Директивы Евросоюза (ECC Directive 86/609/EEC) и в соответствии с приказом Министерства здравоохранения РФ от 1 апреля 2016 г. № 199н «Об утверждении Правил надлежащей лабораторной практики».
Статистический анализ проводили с использованием программного обеспечения STATISTICA для Windows (Statsoft 10). Нормальность распределения оценивалась с помощью W-критерия Шапиро-Уилка, где p>0,05 характеризует нормальное распределение. Для выборок с нормальным распределением данных использовался двухфакторный дисперсионный анализ ANOVA для независимых выборок, в котором исследовалось влияние факторов генотипа и стресса. Для зависимых выборок использовали ANOVA для повторных измерений. Post-hoc анализ проводили с применением критерием Фишера (LSD), где значение p<0,05 указывает на статистически значимую разницу. Данные на рисунках представлены как среднее значение и стандартная ошибка среднего. Для независимых выборок, распределение в которых не соответствует нормальному, проводили анализ с применением теста Манна-Уитни (M-U), для зависимых – с применением теста Уилкоксона (W) для попарных сравнений. Данные на рисунках представлены как медиана, межквартальный размах, минимальное и максимальное значение.
РЕЗУЛЬТАТЫ
Влияние ХНМС различной длительности на двигательную и исследовательскую активность мышей Q31L и L100P и их эмоциональность
Анализ пройденной дистанции в тесте Открытое поле (рис. 1А) показал, что ХНМС длительностью 4 недели усиливал двигательную активность мышей Q31L (M-U, p<0,05). Вместе с тем на двигательную активность мышей L100P стресс не повлиял, в то время как ХНМС 2- и 4-недельной продолжительности статистически значимо снижал двигательную активность мышей WT (M-U, p<0,01 и p<0,05 соответственно).
ANOVA анализ длительности замираний в тесте Открытое поле (рис. 1Б) обнаружил значимый эффект генотипа [F(2,77)=22,995, p<0,001)] и стресса [F(2,77)=8,884, p<0,001)]. Показано усиление фризинга у мышей Q31L и WT после ХНМС длительностью 2 недели (LSD, p<0,001 и p<0,05 соответственно). В то же время у мышей L100P не обнаружено статистически значимого влияния стресса разной длительности на изменение продолжительности фризинга в тесте.
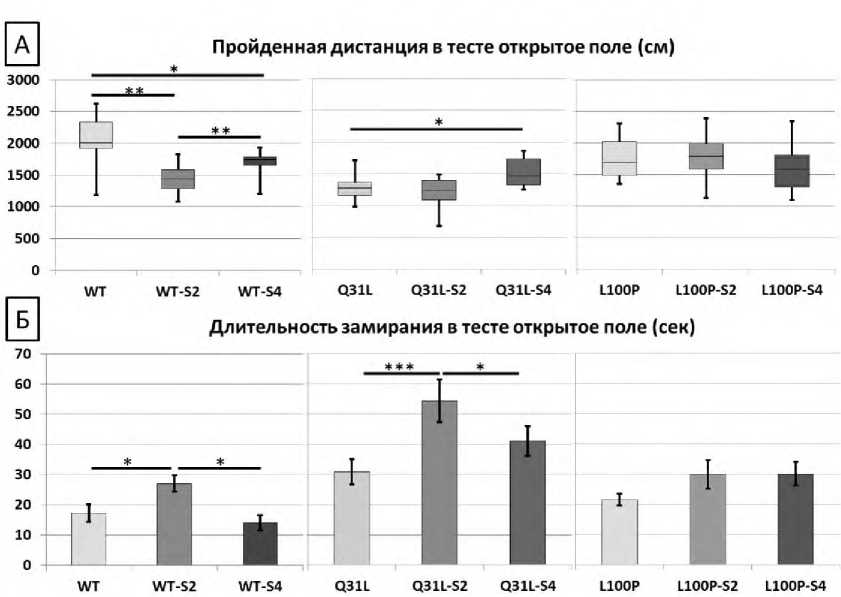
Р и с у н о к 1. Результаты теста Открытое поле. Двигательная активность А – пройденная дистанция в тесте (см), Б – длительность замираний (с)
П р и м е ч а н и е к рисункам 1, 2, 3, 4 и 5. Статистическая значимость различий: * ‒ р<0,05, ** ‒ p<0,01, *** ‒ p<0,001. WT – С57BL/6 интактные, Q31L – Disc1-Q31L-/- интактные, L100P – Disc1-L100Р-/- интактные; -S2 – группы после 2-недельного ХНМС, -S4 – группы после 4-недельного ХНМС.
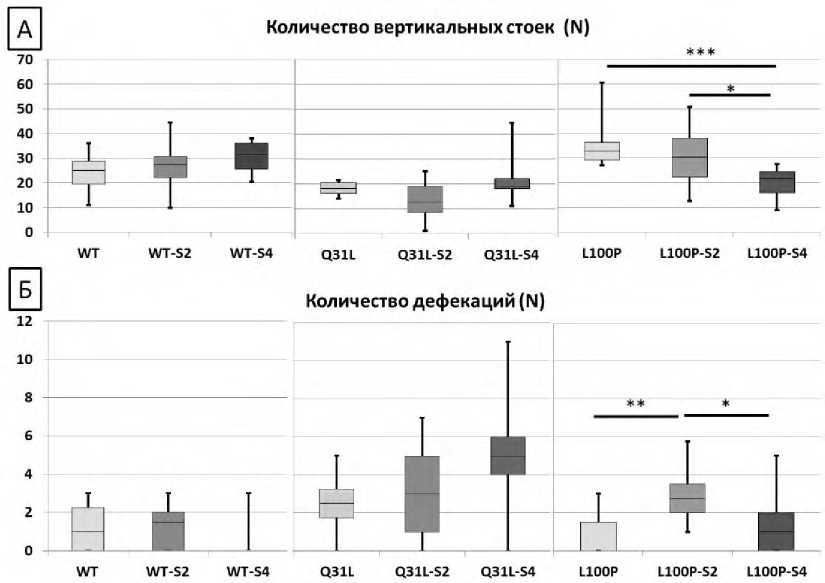
Р и с у н о к 2. Результаты теста Открытое поле. Исследовательская активность и эмоциональность А – количество вертикальных стоек (N), Б – количество дефекаций (N)
Анализ выявленного количества вертикальных стоек в тесте Открытое поле (рис. 2А) продемонстрировал снижение исследовательской активности мышей L100P после воздействия ХНМС длительностью 4 недели (M-U, p<0,001). В то же время стресс различной длительности не оказывал влияние на самцов мышей с другими генотипами.
Эмоциональность животных оценивали по количеству дефекаций в тесте Открытое поле. Установлено, что воздействие ХНМС длительностью 2 недели усиливало эмоциональность мышей L100P (M-U, p<0,01). Однако на эмоциональность мышей WT и Q31L стресс различной длительности не оказывал влияния (рис. 2Б).
Влияние ХНМС разной длительности на тревожность мышей Q31L и L100P
По результатам теста Открытое поле было показано, что ХНМС длительностью 2 недели повышает длительность нахождения мышей Q31L в центре открытого поля (M-U, p<0,001; рис. 3А).
ANOVA анализ длительности нахождения в белой камере по данным теста Черно-белая камера обнаружил значимый эффект генотипа [F(2,76)=15,704, p<0,001)]. Так, у мышей L100P ХНМС длительностью 4 недели усиливал тревожность на уровне тенденции (LSD, p=0,053; рис. 3Б). Однако в этой группе не выявлено изменений по длительности пребывания в центре открытого поля.
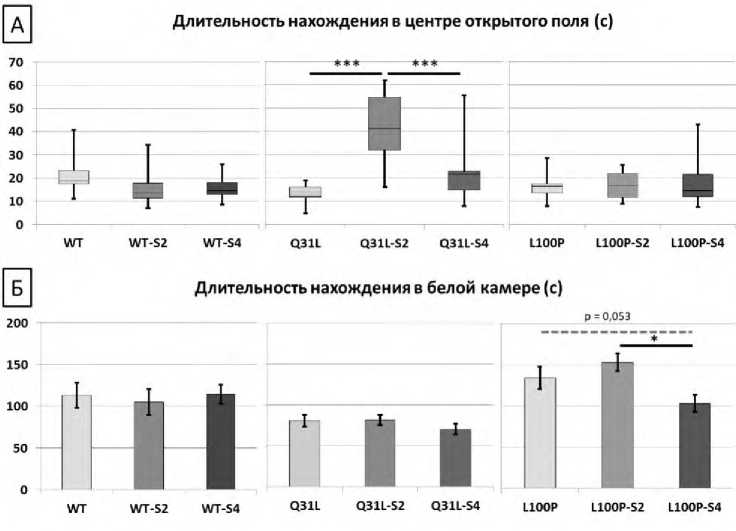
Р и с у н о к 3. Результаты теста Открытое поле. Тревожность
А – время в центре по тесту Открытое поле (с), Б – время в светлой зоне по тесту Черно-белая камера (с)
Влияние стресса на депрессивно-подобное и обсессивно-компульсивное поведение мышей Q31L и L100P
ANOVA анализ результатов теста Принудительное плавание по определению признаков депрессивно-подобного поведения (рис 4А) показал статистически значимый эффект генотипа [F(2,77)=3,546, p<0,05)] и стресса [F(2,77)=7,273, p<0,01)] на длительность дрейфа. Так, ХНМС длительностью 2 недели увеличивал его у мышей всех трех генотипов (LSD, p<0,05), тогда как ХНМС длительностью 4 недели повышал длительность дрейфа только у мышей WT и L100P (LSD, p<0,01 и p<0,05). Стресс разной длительности не приводил к появлению обсессивно-компульсивного поведения у самцов мышей всех трех генотипов в тесте закапывания шариков (рис 4Б).
Влияние ХНМС разной длительности на социальное предпочтение и выраженность социальной мотивации мышей Q31L и L100P
Социальное предпочтение животных оценивали по количеству проведенного времени рядом с интрудером и муляжом. ХМНС различной длительности не влиял на социальное предпочтение самцов мышей всех генотипов (W, p<0,001, для Q31L-S4 p<0,01; рис. 5А). Установлено, что мыши всех групп большую часть времени проводили рядом с интрудером. Однако более детальный анализ показал, что ХНМС длительностью 2 недели статистически значимо увеличивает время нахождения L100P мышей рядом с социальным объектом (M-U, p<0,05), что отражает произошедшие изменения в социальной мотивации (рис. 5Б).
Этот результат противоположен показателям мышей WT, у которых 2-недельный ХНМС статистически значимо снижает длительность социального взаимодействия (M-U, p<0,05). ANOVA анализ частоты подходов к социальному объекту показал значимый эффект генотипа [F(2,76)=3,686, p<0,05)] и взаимодействие факторов стресса и генотипа [F(4,76)=2,549, p<0,05)].
Показано статистически значимое увеличение количества подходов к социальному объекту после воздействия 4-недельного ХНМС у мышей Q31L (LSD, p<0,05). В то время как у мышей WT обнаружено статистически значимое снижение количества подходов к социальному объекту (LSD, p<0,05) после ХНМС длительностью 2 недели (рис. 5В).
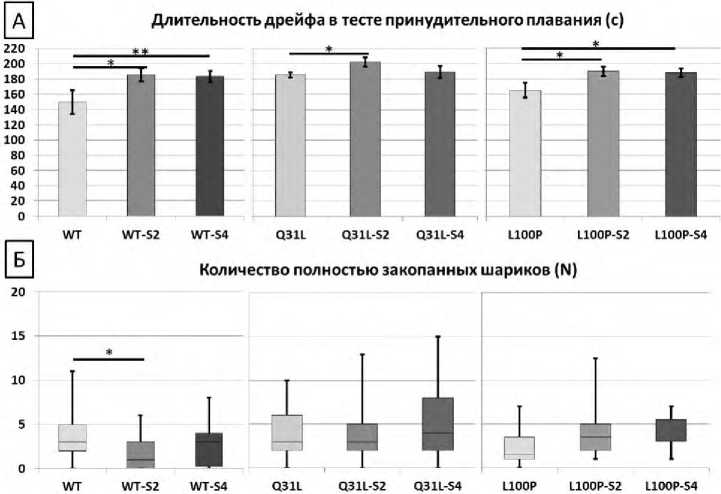
Рисунок 4. Проявления депрессивно-подобного и обсессивно-компульсивного поведения
А - длительность дрейфа (с), Б - количество закопанных шариков (N)
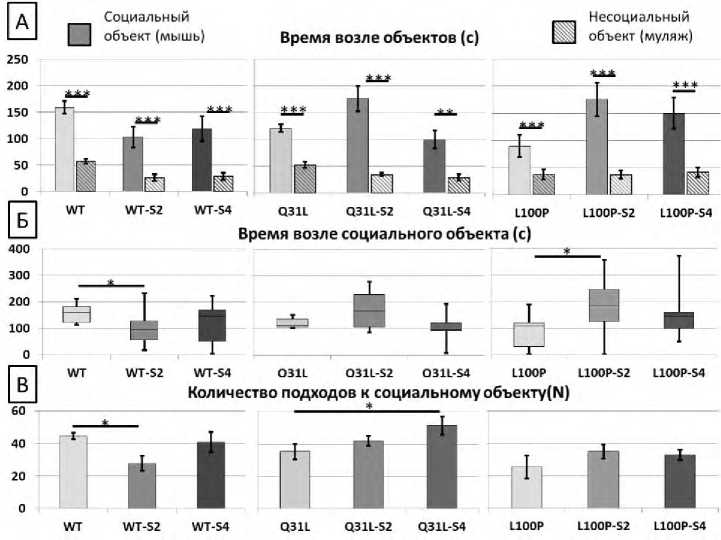
Рисунок 5. Результаты теста Социальное предпочтение и социальная мотивация
А – время возле социального и несоциального объектов (с), заштрихованные столбцы – время возле несоциального объекта, Б – время возле социального объекта (с), В – количество подходов к социальному объекту
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
По результатам собственного исследования представлено, что точечные мутации в гене Disc1 приводят к изменению чувствительности вследствие эмоционально-стрессового воздействия разной длительности на поведенческом уровне.
Анализ двигательной активности мышей в тесте Открытое поле обнаружил значимое снижение показателей у мышей WT, что осложняет интерпретацию результатов. Тем не менее такой результат встречается в ряде исследований и объясняется авторами как проявление апатии и сниженной мотивации животных [23, 24]. С этой точки зрения, изменение двигательной активности мышей WT после 2-недельного ХНМС в совокупности со снижением времени исследования социального объекта в тесте Социальное предпочтение свидетельствует о наличии подобного нарушения. Изучение целенаправленного поведения выявило снижение мотивации у мышей вследствие хронического стресса социальных поражений, что связано с изменением активности вентрального гиппокампа [25]. Однако подобных исследований на мышах после воздействия ХНМС до настоящего времени не проводилось, что является предпосылкой для продолжения исследований в этом направлении.
У мышей Q31L показано усиление двигательной активности после ХНМС длительностью 4 недели, что подтверждается увеличением количества подходов к социальному объекту в тесте Социальное предпочтение и стабилизацией времени дрейфа в тесте Принудительное плавание. Таким образом, мыши с мутацией Q31L после длительного стресса оказались более суетливыми и беспокойными, нежели животные остальных генотипов. Обращает на себя внимание показатель времени замираний в тесте Открытое поле, который рассматривается как защитная реакция на опасные стимулы [26]. У мышей Q31L зафиксировано значимое повышение этого показателя после ХНМС длительностью 2, но не 4 недели. Это может свидетельствовать о том, что животные с мутацией Q31L после 2-недельного стресса реагируют на опасные стимулы замиранием, тогда как после 4-недельного ХНМС используют стратегию бегства. В то же время у мышей L100P ХНМС разной продолжительности не влиял на их двигательную активность. При этом показано, что воздействие 2-недельного ХНМС вызывало усиление эмоциональности, а 4-недельный стресс снижал исследовательскую активность этих мышей.
В тесте Открытое поле при определении уровня тревожности были получены противоречивые результаты. С одной стороны, выявлено усиление замираний у мышей WT и Q31L после ХНМС длительностью 2 недели. Кроме того, повышение количества замираний у мышей Q31L сопровождалось увеличением времени, проведенного в центре поля. Это позволяет предположить, что именно в этой зоне животные испытывали наибольший испуг. При этом в более специфичном тесте Черно-белая камера, использованном для оценки тревожности у мышей Q31L и WT, не выявлено изменений показателей тревожности. В то же время у мышей L100P по результатам этого теста установлено незначительное усиление тревожности после 4-недельного стресса, но без изменения времени нахождения в центре открытого поля. В ранее опубликованных работах также не выявлялось тревожного поведения по данным специфических тестов у мышей WT после воздействия ХНМС [11, 27].
В отличие от мышей Q31L, 2- и 4-недельный стресс приводит к появлению депрессивноподобного поведения у мышей L100P, с такими же поведенческими признаками, что у мышей WT. У мышей Q31L усиление депрессивно-подобного поведения происходит только после стресса длительностью 2 недели. Стресс различной длительности у мышей всех трех генотипов не приводил к появлению обсессивно-компульсивного поведения и изменению социального предпочтения. Однако показано, что у мышей L100P 2-недельный ХНМС повышает продолжительность времени социального взаимодействия.
Обращает на себя внимание тот факт, что именно 2-недельный стресс влияет на большее количество поведенческих признаков у мышей всех генотипов, что подтверждает гипотезу о более выраженном влиянии хронического стресса меньшей длительности [16].
ЗАКЛЮЧЕНИЕ
Таким образом, мыши с мутациями в гене Disc1 по-разному реагируют на воздействие хронического стресса длительностью 2 и 4 недели. Мыши Q31L в меньшей степени подвержены влиянию стресса, чем мыши L100P. Короткий стресс вызывает у мышей Q31L усиление реакции замирания на потенциально опасные стимулы и усиление депрессивно-подобного поведения, тогда как более длительный стресс повышает их двигательную активность. В отношении мышей L100P показано, что 2-недельный стресс усиливает эмоциональность, депрессивно-подобное поведение и выраженность социальной мотивации, тогда как более длительный стресс так же способствует появлению депрессивно-подобного фенотипа, определяет показатели тревожности и снижает исследовательское поведение.
Список литературы Влияние хронического эмоционально-стрессового воздействия на поведение мышей с мутациями Q31l и L100P в гене DISC1
- GBD 2017 Disease and Injury Incidence and Preva-lence Collaborators. Global, regional, and national incidence, prevalence, and years lived with disability for 354 diseases and injuries for 195 countries and territories, 1990-2017: a systematic analysis for the Global Burden of Disease Study 2017. Lancet. 2018 Nov 10;392(10159):1789-1858. doi: 10.1016/S0140-6736(18)32279-7. Epub 2018 Nov 8. Erratum in: Lancet. 2019 Jun 22;393(10190):e44. PMID: 30496104; PMCID: PMC6227754.
- Knafo A, Jaffee SR. Gene-environment correlation in developmental psychopathology. Dev Psycho-pathol. 2013 Feb;25(1):1-6. doi: 10.1017/ S0954579412000855. PMID: 23398748.
- Pinto RQ, Soares I, Carvalho-Correia E, Mesquita AR. Gene-environment interactions in psycho-pathology throughout early childhood: a systematic review. Psychiatr Genet. 2015 Dec;25(6):223-33. doi: 10.1097/YPG.0000000000000106. PMID: 26313931.
- Thomson PA, Malavasi EL, Grünewald E, Soares DC, Borkowska M, Millar JK. DISC1 genetics, biol-ogy and psychiatric illness. Front Biol (Beijing). 2013 Feb 1;8(1):1-31. doi: 10.1007/s11515-012-1254-7. PMID: 23550053; PMCID: PMC3580875.
- Tomoda T, Sumitomo A, Jaaro-Peled H, Sawa A. Utility and validity of DISC1 mouse models in bio-logical psychiatry. Neuroscience. 2016 May 3;321:99-107. doi: 10.1016/j.neuroscience. 2015.12.061. Epub 2016 Jan 6. PMID: 26768401; PMCID: PMC4803604.
- Lipina TV, Roder JC. Disrupted-In-Schizophrenia-1 (DISC1) interactome and mental disorders: impact of mouse models. Neurosci Biobehav Rev. 2014 Sep;45:271-94. doi: 10.1016/j.neubiorev. 2014.07.001. Epub 2014 Jul 9. PMID: 25016072.
- Clapcote SJ, Lipina TV, Millar JK, Mackie S, Chris-tie S, Ogawa F, Lerch JP, Trimble K, Uchiyama M, Sakuraba Y, Kaneda H, Shiroishi T, Houslay MD, Henkelman RM, Sled JG, Gondo Y, Porteous DJ, Roder JC. Behavioral phenotypes of Disc1 missense mutations in mice. Neuron. 2007 May 3;54(3):387-402. doi: 10.1016/j.neuron.2007.04.015. PMID: 17481393.
- Lipina TV, Fletcher PJ, Lee FH, Wong AH, Roder JC. Disrupted-in-schizophrenia-1 Gln31Leu poly-morphism results in social anhedonia associated with monoaminergic imbalance and reduction of CREB and β-arrestin-1,2 in the nucleus accumbens in a mouse model of depression. Neuropsychopharma-cology. 2013 Feb;38(3):423-36. doi: 10.1038/npp.2012.197. Epub 2012 Sep 26. PMID: 23011268; PMCID: PMC3547193.
- Serykh A, Khrapova MV, Dubrovina NI, Petrova ES, Mikhnevich N, Starostina MV, Amstislavskaya TG, Lipina TV. The increased density of the habenu-lar neurons, high impulsivity, aggression and re-sistant fear memory in Disc1-Q31L genetic mouse model of depression. Behav Brain Res. 2020 Aug 17;392:112693. doi: 10.1016/j.bbr.2020.112693. Epub 2020 May 15. PMID: 32422236.
- Lipina TV, Niwa M, Jaaro-Peled H, Fletcher PJ, Seeman P, Sawa A, Roder JC. Enhanced dopamine function in DISC1-L100P mutant mice: implications for schizophrenia. Genes Brain Behav. 2010 Oct;9(7):777-89. doi: 10.1111/j.1601-183X. 2010.00615.x. Epub 2010 Aug 12. PMID: 20618446.
- Mineur YS, Belzung C, Crusio WE. Effects of un-predictable chronic mild stress on anxiety and de-pression-like behavior in mice. Behav Brain Res. 2006 Nov 25;175(1):43-50. doi: 10.1016/ j.bbr.2006.07.029. Epub 2006 Oct 4. PMID: 17023061.
- Lu Q, Mouri A, Yang Y, Kunisawa K, Teshigawara T, Hirakawa M, Mori Y, Yamamoto Y, Libo Z, Na-beshima T, Saito K. Chronic unpredictable mild stress-induced behavioral changes are coupled with dopaminergic hyperfunction and serotonergic hypo-function in mouse models of depression. Behav Brain Res. 2019 Oct 17;372:112053. doi: 10.1016/j.bbr.2019.112053. Epub 2019 Jul 6. PMID: 31288060.
- Lee RS, Sawa A. Environmental stressors and epige-netic control of the hypothalamic-pituitary-adrenal axis. Neuroendocrinology. 2014;100(4):278-87. doi: 10.1159/000369585. Epub 2014 Nov 18. PMID: 25427939; PMCID: PMC4428760.
- Haque FN, Lipina TV, Roder JC, Wong AH. Social defeat interacts with Disc1 mutations in the mouse to affect behavior. Behav Brain Res. 2012 Aug 1;233(2):337-44. doi: 10.1016/j.bbr.2012.05.037. Epub 2012 May 30. PMID: 22659396.
- Li N, Cui L, Song G, Guo L, Gu H, Cao H, Li GD, Zhou Y. Adolescent isolation interacts with DISC1 point mutation to impair adult social memory and synaptic functions in the hippocampus. Front Cell Neurosci. 2018 Aug 2;12:238. doi: 10.3389/ fncel.2018.00238. PMID: 30116177; PMCID: PMC6082952.
- Pałucha-Poniewiera A, Podkowa K, Rafało-Ulińska A, Brański P, Burnat G. The influence of the dura-tion of chronic unpredictable mild stress on the be-havioural responses of C57BL/6J mice. Behav Pharmacol. 2020 Sep;31(6):574-582. doi: 10.1097/FBP.0000000000000564. PMID: 32433245.
- Monteiro S, Roque S, de Sá-Calçada D, Sousa N, Correia-Neves M, Cerqueira JJ. An efficient chronic unpredictable stress protocol to induce stress-related responses in C57BL/6 mice. Front Psychiatry. 2015 Feb 2;6:6. doi: 10.3389/fpsyt.2015.00006. PMID: 25698978; PMCID: PMC4313595.
- Taylor GT, Lerch S, Chourbaji S. Marble burying as compulsive behaviors in male and female mice. Acta Neurobiol Exp (Wars). 2017;77(3):254-260. PMID: 29182616.
- Seibenhener ML, Wooten MC. Use of the Open Field Maze to measure locomotor and anxiety-like behavior in mice. J Vis Exp. 2015 Feb 6;(96):e52434. doi: 10.3791/52434. PMID: 25742564; PMCID: PMC4354627.
- Campos-Cardoso R, Godoy LD, Lazarini-Lopes W, Novaes LS, Dos Santos NB, Perfetti JG, Garcia-Cairasco N, Munhoz CD, Padovan CM. Exploring the light/dark box test: Protocols and implications for neuroscience research. J Neurosci Methods. 2023 Jan 15;384:109748. doi: 10.1016/j.jneumeth. 2022.109748. Epub 2022 Nov 21. PMID: 36410541.
- Rein B, Ma K, Yan Z. A standardized social prefer-ence protocol for measuring social deficits in mouse models of autism. Nat Protoc. 2020 Oct;15(10):3464-3477. doi: 10.1038/s41596-020-0382-9. Epub 2020 Sep 7. PMID: 32895524; PMCID: PMC8103520.
- Can A, Dao DT, Arad M, Terrillion CE, Piantadosi SC, Gould TD. The mouse forced swim test. J Vis Exp. 2012 Jan 29;(59):e3638. doi: 10.3791/3638. PMID: 22314943; PMCID: PMC3353513.
- Gross M, Pinhasov A. Chronic mild stress in sub-missive mice: Marked polydipsia and social avoid-ance without hedonic deficit in the sucrose preference test. Behav Brain Res. 2016 Feb 1;298(Pt B):25-34. doi: 10.1016/j.bbr.2015.10.049. Epub 2015 Nov 6. PMID: 26522843.
- Tianzhu Z, Shihai Y, Juan D. Antidepressant-like effects of cordycepin in a mice model of chronic un-predictable mild stress. Evid Based Complement Al-ternat Med. 2014;2014:438506. doi: 10.1155/2014/438506. Epub 2014 Dec 23. PMID: 25587342; PMCID: PMC4284936.
- Yoshida K, Drew MR, Kono A, Mimura M, Takata N, Tanaka KF. Chronic social defeat stress impairs goal-directed behavior through dysregulation of ven-tral hippocampal activity in male mice. Neuropsy-chopharmacology. 2021 Aug;46(9):1606-1616. doi: 10.1038/s41386-021-00990-y. Epub 2021 Mar 10. PMID: 33692477; PMCID: PMC8280175.
- Koutsikou S, Crook JJ, Earl EV, Leith JL, Watson TC, Lumb BM, Apps R. Neural substrates underly-ing fear-evoked freezing: the periaqueductal grey-cerebellar link. J Physiol. 2014 May 15;592(10):2197-213. doi: 10.1113/jphysiol. 2013.268714. Epub 2014 Mar 17. PMID: 24639484; PMCID: PMC4027863.
- Wang S, Huang G, Yan J, Li C, Feng J, Chen Q, Zheng X, Li H, Li J, Wang L, Li H. Influence of ag-ing on chronic unpredictable mild stress-induced de-pression-like behavior in male C57BL/6J mice. Be-hav Brain Res. 2021 Sep 24;414:113486. doi: 10.1016/j.bbr.2021.113486. Epub 2021 Jul 22. PMID: 34302872.


