Влияние импульсных магнитных полей на экспрессию генов онкосупрессоров в эксперименте на культуре клеток глиобластомы человека T98G
Автор: Сидоренко Юрий Сергеевич, Кит Олег Иванович, Попов Иван Александрович, Шихлярова Алла Ивановна, Росторгуев Эдуард Евгеньевич, Тимошкина Наталья Николаевна, Гусарева Марина Александровна, Арапова Юлия Юрьевна, Потемкин Дмитрий Сергеевич, Пушкин Антон Андреевич, Стасов Виталий Викторович
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 т.18, 2019 года.
Бесплатный доступ
Цель исследования - изучить влияние импульсного магнитного поля (ИМП) на экспрессию ключевых генов онкосупрессоров APC, MLH, MGMT клеточной линии глиобластомы человека T98G. Материал и методы. На культуре клеток T98G проведено воздействие ИМП с параметрами индукции 15 и 300 mT как самостоятельно, так и в сочетании с воздействием ионизирующего излучения (РОД 10 Гр). Ионизирующее излучение проводилось на аппарате TheratronEquinox фирмы BestTheratronics, где в качестве источника излучения использовался 60Со. Источником импульсного магнитного поля служил аппарат «Нейро-МС/Д терапевтический расширенный» компании «Нейрософт». Определение живых/мертвых клеток проводили в счетчике клеток NanoEnTekJuliFl (Корея) с использованием 0,4 % раствора трипанового синего для окраски мертвых клеток. Экстракцию тотальной РНК проводили по протоколу изготовителя Trizol с изменениями: водную фазу сепарировали с реагентом Trizol дважды. Количественное измерение выделенной РНК проводили на флюориметре Qubit 2.0 с использованием набора реактивов с РНК-интеркалирующим красителем Quant-iT RNA AssayKit (LifeTechnologies, США). Оценку экспрессии генов MLH, APC, MGMT проводили методом RT-PCR на амплификаторе CFX96 (BioRad, США). Данные анализировали с использованием метода порогового значения цикла (Ct) с нормализацией по экспрессии гена TBP в каждом образце. Относительную экспрессию генетического локуса (Exp) рассчитывали по методу 2-ACt. Статистический анализ результатов осуществляли с помощью пакета программ Statictica v10. Результаты. Установлено, что через сутки после воздействия ИМП индукцией 15 mT и 300 mT отношение уровня экспрессии MGMT к контролю имело значимые различия (p function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Глиобластома t98g, импульсное магнитное поле, ионизирующее излучение, экспрессия генов онкосупрессоров
Короткий адрес: https://sciup.org/140254305
IDR: 140254305 | УДК: 616-006.484:537.612:613.648.4:575.113 | DOI: 10.21294/1814-4861-2019-18-6-57-66
Текст научной статьи Влияние импульсных магнитных полей на экспрессию генов онкосупрессоров в эксперименте на культуре клеток глиобластомы человека T98G
Ежегодно во всем мире отмечается рост числа новообразований головного мозга. По данным CBTRUS, в 2018 г. в США число вновь выявленных больных с установленным диагнозом глиобластомы составляет 14,7 % от общего количества больных с первичными новообразованиями ЦНС [1]. В Российской Федерации за 2018 г. выявлено 32100 больных с первичными опухолями ЦНС, из них глиобластомы составили 15,6 % [2].
При лечении таких больных отдается предпочтение комплексному подходу, в котором внимание уделено не только этапам хирургического и химиолучевого лечения, но и воздействию на перифокальную зону ложа удаленной опухоли, которая является источником до 80 % всех рецидивов. В связи с этим в мире ведется разработка различных вспомогательных методик, одной из которых является бесконтактная транскраниальная импульсная электромагнитотерапия. В мире накоплен большой опыт по изучению механизмов влияния постоянного и сверхнизкочастотного переменного электромагнитных полей на рост опухолей и организм животных и человека [3–9]. За рубежом проведены исследования, которые доказали, что ИМП не только не оказывает стимулирующего влияния на клеточные культуры карциномы легкого (А549), карциномы протоков поджелудочной железы (MiaPaca2), колоректального рака (LDD1), но и увеличивает чувствительность клеток этих культур к ионизирующему излучению [10]. Однако имеющиеся данные относительно влияния импульсных магнитных полей на злокачественные глиальные опухоли головного мозга немногочисленны или практически отсутствуют. Ранее нами были проведены исследования и получены данные об ингибирующем влиянии импульсных магнитных полей на жизнеспособность мультиформных клеток глиобластомы человека линии T98G [11].
Представлялось необходимым дальнейшее изучение механизма такого влияния на уровне молекулярных изменений генетического аппарата клеток глиобластомы.
Изменения экспрессии генов супрессоров опухолевого роста рассматривают как важный механизм онкогенеза. Изменения в ДНК, продуцируемые во время репликации и рекомбинации, восстанавливаются системой репарации неспаренных оснований (MMR), частью которой является MLH1 . В то же время белковый продукт гена MGMT является ключевым элементом системы прямой репарации ДНК. Многофункциональный белок АРС играет критическую роль во многих клеточных процессах: регуляции деления через контроль Wnt сигнального пути, клеточной адгезии и полярности, контроле количества хромосом после деления и т. д. Клетки, лишенные функций репарации и/ или активности ключевых онкосупрессоров, приобретают мутантный фенотип, который может реализоваться в онкотрансформации. С другой стороны, в ходе лучевой и лекарственной терапии опухолей пониженная активность репарационных систем в злокачественных клетках может играть проонкогенную роль и быть положительным фактором течения заболевания.
Целью исследования было изучение влияния импульсного магнитного поля на экспрессию ключевых генов онкосупрессоров APC, MLH, MGMT в условиях эксперимента на клеточной линии T98G.
Материал и методы
В эксперименте использовали культуру глиобластомы человека T98G. Культивирование клеток T98G проводили в 12-луночном планшете (JetBio-Fil, Китай) при 37 ºС в условиях контролируемого 5 % CO2 и 95 % влажности в инкубаторе CB 150 (Binder, Германия) с использованием среды RPMI-1640 (Биолот, Россия), содержащей 10 % фетальной телячьей сыворотки (Биолот, Россия) и 50 мкг/мл гентамицина (Биолот, Россия).
При достижении 75–80 % уровня конфлюэнт-ности во всех лунках заменяли питательную среду. Ионизирующее излучение проводили на аппарате TheratronEquinox фирмы BestTheratronics, где в качестве источника излучения использовался 60Со. Поле излучения 12×18 см соответствовало параметрам планшета, при этом доза излучения для каждой лунки составила 10 Гр. Воздействие импульсным магнитным полем проводилось с учетом принципов активационной терапии в режимах частот, близких к эндогенным ритмам мозга. Процедуру выполняли на аппарате «Нейро-МС/Д терапевтический расширенный» компании «Нейрософт» в режиме частот F=0,3Hz(5 min.)3,0Hz(1 min.)9,0 Hz (1 min.), t общее = 7 min при различных параметрах индукции – B=300 mT и 15 mT. После 3 и 24 ч инкубирования проводили микроскопирова-
Таблица 1
Нуклеотидная последовательность использованных праймеров
Затем клетки глиобластомы снимали с подложки путем трипсинизации раствором Трипсин/ Версена 1:1 (Биолот, Россия). Определение жи-вых/мертвых клеток проводили в счетчике клеток NanoEnTekJuliFl (Корея) с использованием 0,4 % раствора трипанового синего для окраски мертвых клеток. После подсчета клетки отмывали раствором DPBS и осаждали центрифугированием с последующим ресуспензированием в Trizol (ThermoFisherScientific, США). Экстракцию тотальной РНК проводили по протоколу изготовителя Trizol с изменениями: водную фазу сепарировали с реагентом Trizol дважды. Количественное измерение выделенной РНК проводили на флюориметре Qubit 2.0 с использованием набора реактивов с РНК-интеркалирующим красителем Quant-iT RNA AssayKit (LifeTechnologies, США).
Для наработки библиотеки кДНК проводили реакцию обратной транскрипции набором «Реверта-L» с использованием гексамерных рандомных праймеров (Синтол, Россия). Оценку экспрессии генов MLH, APC, MGMT проводили методом ПЦР в реальном времени (RT-PCR) на амплификаторе CFX96 (BioRad, США) в присутствии праймеров, которые были разработаны нами с использованием базы NCBI GenBank (табл. 1).
После предварительной оценки стабильности экспрессии в программе geNorm из 8 кандидатных локусов в качестве референсного был выбран TBP. Проверка праймеров включала оценку градиента температур для определения оптимальной температуры отжига (56–64 ºС) с последующей визуализацией ампликонов с помощью электрофореза в агарозном геле, анализ кривых плавления (рис. 1).
Матрицу комплементарной ДНК нормализовали до 2–3 нг на реакцию. Каждая постановка ПЦР включала контрольные образцы без матрицы (NTC), исходные образцы РНК (NRT) и образцы кДНК в трех повторах для отдельного генетического локуса. Режим ПЦР был следующим: 95b°С
300 сек, 60 °С 40 сек, 95 °С 15 сек, 40 циклов. В качестве красителя был использован интеркали-рующий флуоресцентный краситель EvaGreenI (Евроген, Россия).
Данные анализировали с использованием метода порогового значения цикла (Ct) с нормализацией по экспрессии гена «домашнего хозяйства» TBP в каждом образце. Относительную экспрессию генетического локуса (Еxp) рассчитывали по методу 2-ΔCt.
Статистический анализ результатов осуществляли с помощью пакета программ Statictica 10. Для оценки значимости различий в группах, включая уровни экспрессии, применяли тест Вилкоксона–Манна–Уитни для порогового уровня статистической значимости p<0,05. Характер влияния факторов ИИ и ИМП по выживаемости клеток изучен с помощью метода общих линейных моделей Main Effects ANOVA.
Результаты и обсуждение
Характер роста монослоя клеток линии T98G после однократного воздействия импульсным магнитным полем при 3- и 24-часовой экспозиции проиллюстрирован на рис. 2. Несмотря на незначительность визуальных различий при микроскопировании культуры клеток в разных вариантах эксперимента, количественный анализ продемонстрировал четко выраженные различия абсолютного числа клеток в контроле от опытных вариантов (табл. 2, 3).
Анализ относительных показателей летальности клеток T98G, представленный в табл. 3, характеризовал следующие изменения. Через 3 ч после воздействия импульсного магнитного поля с индукцией 15 mT уровень летальности клеток превысил контрольный уровень в 2,5 раза, а магнитного поля с индукцией 300 mT – в 2,75 раза. Использование радиоактивного излучения увеличило летальность по отношению к контролю в 3,6 раза. После сочетанного воздействия импульсным магнитным полем 15 mT с ионизирующим излучением на культуру клеток глиобластомы (табл. 2, 3) индуцировало аналогичный эффект гибели клеток T98G.
Увеличение экспозиции до 24 ч после воздействия существенно не повлияло на регистрируемый уровень гибели клеток. Только моно-воздействие импульсного магнитного поля с индукцией 15 mT повысило показатель летальности до 13,6 %. Гибель клеток во всех вариантах эксперимента статистически значимо превышала фоновый уровень нежизнеспособных клеток в контроле, составивший 5,7 % (p<0,01). В целом летальность
Рис. 1. Анализ кривых плавления ампликонов, полученных на матрице кДНК: а) TBP; б) APC; в) MGMT ; г) MLH 1
Таблица 2
Результаты раздельного и сочетанного влияния ионизирующего и неионизирующего излучения на жизнеспособность клеток линии T98g
|
Условия эксперимента |
Живые |
Кол-во клеток Мертвые |
Общее кол-во клеток |
|
|
Экспозиция |
Режим облучения |
|||
|
Контроль |
720000 ± 44497,2 |
39850 ± 10589,2 |
759850 ± 51665,6 |
|
|
10 Гр |
680000 ± 46904,2 |
157000 ± 11687,6 |
837000 ± 51386,8 |
|
|
p=0,57 |
p=0,0002* |
p=0,42 |
||
|
15 mТ |
711666 ± 90642,8 |
104833 ± 13653,9 |
816500 ± 102953 |
|
|
p=0,68 |
p=0,01* |
p=0,7 |
||
|
3 ч |
300 mТ |
686666,7 ± 34608,9 |
114833,314265,2 |
801500 ± 45975,2 |
|
p=0,74 |
p=0,006* |
p=0,93 |
||
|
15mТ + 10 Гр |
666666,7 ± 79148,2 p=0,47 |
152833,3 ± 23465,5 p=0,005* |
819500 ± 100969,5 p=0,69 |
|
|
300mТ + 10 Гр |
686666,7 ± 31797,9 |
123500 ± 11032,5 |
810166,7 ± 29690 |
|
|
p=0,63 |
p=0,0003* |
p=0,4 |
||
|
Контроль |
961667 ± 67499 |
58166 ± 10637,7 |
1019833 ± 7508,5 |
|
|
10 Гр |
510000 ± 85945,7 |
116833 ± 21769,1 |
626833 ± 103784,5 |
|
|
p=0,008* |
p=0,04* |
p=0,03* |
||
|
15 mТ |
975000 ± 100124,9 |
153833 ± 19964 |
1128833 ± 110610 |
|
|
p=0,6 |
p=0,01* |
p=0,69 |
||
|
24 ч |
300 mТ |
1148000 ± 85229,1 |
156400 ± 23936,6 |
1304400 ± 105220,5 |
|
p=0,2 |
p=0,008* |
p=0,06 |
||
|
15mТ + 10 Гр |
760000 ± 115441,2 |
165500 ± 16694,8 |
925500 ± 114519,5 |
|
|
p=0,1 |
p=0,005* |
p=0,4 |
||
|
300mТ + 10 Гр |
813333 ± 52578 p=0,17 |
143333 ± 9489,2 p=0,005* |
956666 ± 58759,8 p=0,5 |
|
Примечание: * – различия статистически значимы по сравнению с контролем (р≤0,05).
Таблица 3
Относительные показатели летальности клеток глиобластомы T98g в разные сроки после воздействий ИИ и ИМП
Проведенное с помощью метода общих линейных моделей «Основные эффекты ANOVA» сравнительное изучение монофакторного влияния ИИ, ИМП (15 mT), ИМП (300 mT), а также их сочетания – ИИ + ИМП (15 mT) и ИИ + ИМП (300 mT) на выживаемость клеток глиомы при экспозиции 3 и 24 ч подтвердило значимое влияние на выживаемость клеток (табл. 4). Установлено, что при монофакторном воздействии ИИ так же, как и при сочетании ИИ с ИМП (15 mT), выживаемость клеток глиомы наименьшая. Очевидно, что сочетание ИИ и ИМП (15 mT) проявляет индифферентный характер влияния на выживаемость клеток глиомы.
В отличие от этого, добавление ИМП 300 mT к ИИ ослабляет влияние последнего.
Согласно полученным данным, экспрессия генов APC и MLH при воздействии импульсным магнитным полем не изменилась. Увеличение экспозиции также не отразилось на транскрипционной активности указанных локусов (табл. 5). Статистически достоверное снижение относительной экспрессии было зафиксировано для гена MGMT после 24-часовой экспозиции (рис. 3).
После воздействия импульсным магнитным полем мощностью 15 mT и экспозиции в 24 ч экспрессия гена MGMT снизилась в 1,7 раза по сравнению с контролем (t=4,33 при р=0,012). При воздействии импульсным магнитным полем индукцией 300 mT и экспозицией 24 ч экспрессия снизилась в 1,9 раза по сравнению с контролем
Таблица 4
Сравнительная эффективность влияния используемых в эксперименте факторов и их сочетания на выживаемость клеток линии T98g
Примечания: * – статистически значимые различия, р≤0,05; p1 – уровень достоверности по отношению к контролю по критерию Вилкоксона–Манна–Уитни, p2 – уровень достоверности по отношению к ИИ (10 Гр) по критерию Вилкоксона–Манна–Уитни; SS – сумма квадратов, Df – число степеней свободы, MS – средний квадрат ошибки, F – критерий Фишера, p – уровень достоверности влияния режима облучения с помощью метода общих линейных моделей Main Effects ANOVA.
Таблица 5 Относительная экспрессия генетических локусов в эксперименте (Еxp)
Условия эксперимента Среднее значение Ехр (M ± m) генетических локусов
|
Экспозиция |
Воздействие |
APC |
MLH |
MGMT |
|
Контроль |
0,3879 ± 0,0064 |
0,8105 ± 0,0121 |
3,2541 ± 0,0190 |
|
|
3 ч |
15 mT |
0,4269 ± 0,0181 р=0,228 |
0,8160 ± 0,0285 р=0,400 |
3,5103 ± 0,0291 p=0,628 |
|
300 mT |
0,4463 ± 0,0142 р=0,057 |
0,7278 ± 0,0076 р=0,857 |
2,9019 ± 0,0195 р=0,400 |
|
|
контроль |
0,3849 ± 0,0054 |
0,7819 ± 0,0084 |
2,9201 ± 0,0175 |
|
|
24 ч |
15 mT |
0,3844 ± 0,0,034 р=0,718 |
0,6325 ± 0,0,120 р=0,207 |
1,6737 ± 0,0260 р=0,041 |
|
300 mT |
0,3383 ± 0,0373 р=0,592 |
0,6392 ± 0,0138 р=0,692 |
1,4952 ± 0,0119 р=0,049 |
Примечание: р – статистические различия значений Еxp контроля и опыта.

Рис. 2. Микрофото. Клеточные линии Т98G после 3 ч экспозиции (вверху): а) без воздействия (контроль), б) 15 mТ, в) 300 mТ; после 24 ч экспозиции (внизу): г) без воздействия (контроль); д) 15 mТ; е) 300 mТ. ×100
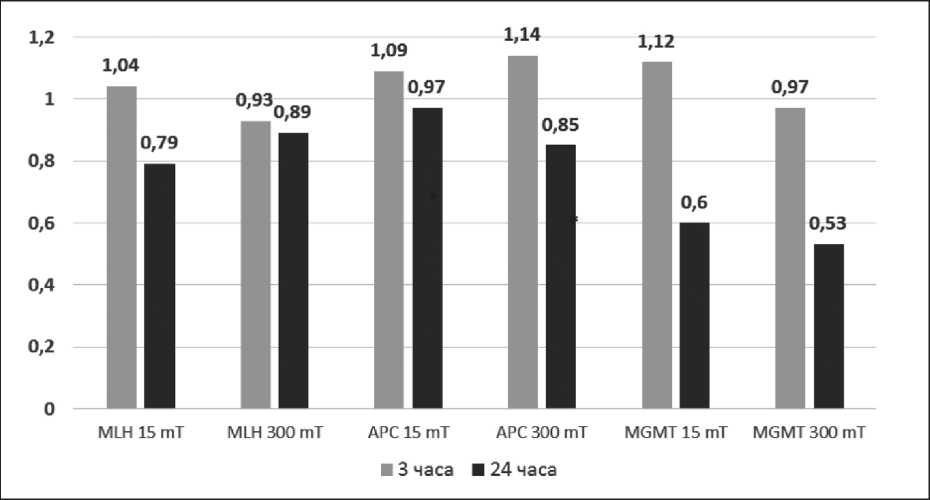
Рис. 3. Отношение уровня экспрессии генов в опыте к контролю (Еxp опыт / Еxp контроль ), Примечание: * – различия статистически значимы (р≤0,05)
(t=4,24 при р=0,014). Наблюдается ассоциация между уровнем экспрессии гена MGMT и индукцией магнитного излучения.
Белок О6-метилгуанин-ДНК-метилтрансфераза, кодируемый геном MGMT, участвует в репарации первичных повреждений ДНК, вызванных действием алкилирующих соединений. Алкилирование азотистых оснований может происходить в разных положениях, но наиболее канцерогенный эффект происходит при алкилировании гуанина в О6-позиции. О6-алкилгуанин с высокой частотой приводит к ошибочному спариванию азотистых оснований при репликации ДНК [12, 13]. Недостаточный уровень экспрессии генов репарации часто встречается при онкологических заболеваниях и способствует развитию большего числа мутаций и генетической нестабильности. Однако ДНК-повреждающая активность алкилирующих агентов часто используется для достижения противоопухолевого эффекта. В этом случае увеличение генетической нестабильности и индукция апоптоза в опухолевых клетках будут более выражены на фоне снижения уровня экспрессии MGMT, повышая чувствительность клеток к действию химиопрепаратов, имеющих в своем составе алкилирующие группы [14].
По данным литературы, ген MGMT является предиктивным маркером для опухолей центральной нервной системы, что обусловлено ассоциацией высокого уровня экспрессии гена в клетках глиобластомы с резистентностью опухоли к терапии темозоломидом и другими алкилирующими препаратами [15, 16]. На уровень экспрессии могут влиять различные факторы: факторы транскрипции, однонитевые разрывы ДНК и другие. Аберрантная регуляция экспрессии гена MGMT в опухоли часто осуществляется через эпигенетическое гиперметилирование регуляторного региона гена [17, 18].
В нашем исследовании физическое воздействие ионизирующего излучения и магнитного поля привело к достоверному увеличению гибели злокачественных клеток линии T98G без аккумулирующего эффекта при сочетании воздействий. Оценка экспрессии четырех онкосупрессоров, активность которых важна для процессов ДНК-репарации и выживаемости клетки, продемонстрировала эффект в отношении одного локуса MGMT . Магнитное поле в исследованных режимах (15 mT, 300 mT) повлияло на относительную экспрессию гена MGMT , вызвав снижение его транскрипционной активности более чем в 1,7 раза. Отметим, что данный эффект наблюдался отсроченно и был зафиксирован через 24 ч.
Важно отметить, что самостоятельное действие импульсного магнитного поля может оказывать ингибирующее влияние на жизнеспособность злокачественных глиальных клеток. Однако в условиях сочетания ИИ с воздействием ИМП разной интенсивности по-разному проявляется характер их взаимовлияния: при ИМП 15 мТл остаётся устойчивым (статистически не изменяется) уровень летальности, достигнутый ИИ, т.е. проявляется индифферентный характер взаимодействия.
Список литературы Влияние импульсных магнитных полей на экспрессию генов онкосупрессоров в эксперименте на культуре клеток глиобластомы человека T98G
- Ostrom Q.T., Gittleman H., Truitt G., Boscia A., Kruchko C., Barnholtz-Sloan J.S. CBTRUS Statistical Report: Primary Brain and Other Central Nervous System Tumors Diagnosed in the United States in 2011-2015. Neuro Oncol. 2018 Oct 1; 20(suppl_4): iv1iv86. 10.1093/ neuonc/noy131. DOI: 10.1093/neuonc/noy131
- Первичные опухоли центральной нервной системы. Клинические рекомендации Министерства здравоохранения Российской Федерации, 2018. [Интернет]. URL: http://cr.rosminzdrav.ru/#!/recomend/853. (дата обращения: 17.05.2019).
- Zhu P., Zhu J.J. Tumor treating fields: a novel and effective therapy for glioblastoma: mechanism, efficacy, safety and future perspectives. Chin Clin Oncol. 2017 Aug; 6(4): 41. DOI: 10.21037/cco.2017.06.29
- Улащик В.С. Магнитотерапия: современные представления о механизмах действия магнитных полей на организм. Здравоохранение (Минск). 2015; 11: 2129.
- Гурко Т.С. Применение магнитотерапии в реабилитации больных с рассеянным склерозом. Вестник Тамбовского университета. Серия: Естественные и технические науки. 2015; 20(3): 545-546.


