Влияние инкубации в гипертонических растворах хлорида натрия на повреждаемость ДНК лимфоцитов периферической крови человека Y-излучением и перекисью водорода
Автор: Воробьева Н.Ю., Архангельская Е.Ю., Бушманов А.Ю., Осипов А.Н.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Генетика
Статья в выпуске: 4 т.10, 2014 года.
Бесплатный доступ
Цель: изучить влияние инкубации в гипертонических растворах NaCI на относительный количественный выход однонитевых разрывов (ОР) и щелочно-лабильных сайтов (ЩС) ДНК, индуцированных у-излучением и перекисью водорода в лимфоцитах периферической крови человека in vitro. Материал и методы. Для исследований использовали лимфоциты, выделенные из периферической крови физически здоровых женщин-доноров в возрасте 21-26 лет. Облучение клеток в дозах 1, 2, 3 и 5 Гр проводили на установке «АГАТ-Р1» (Россия, источник у-излучения 60Со, мощность дозы 1 Гр/мин) при 4°С. С перекисью водорода (25, 50 и 100 мкмоль/л) клетки инкубировали 15 мин при 4°С. Анализ ОР и ЩС ДНК проводили с помощью метода ДНК-комет в щелочных условиях. Результаты. Инкубация клеток в 0,35 моль/л растворе NaCI (диссоциация негистоновых белков) приводит к увеличению выхода ОР и ЩС ДНК, индуцируемых у-излучением и перекисью водорода, приблизительно в 1,3 раза. Увеличение концентрации NaCI до 0,6 моль/л (диссоциация линкерного гистона Н1) приводит почти к двойному увеличению выхода повреждений ДНК (~ в 1,7-1,8 раза). Дальнейшее повышение концентрации NaCI, ведущее к нарушению структуры нуклеосом (1,2 моль/л) и почти полной депротеинизации хроматина (2 моль/л), увеличивает выход повреждений ДНК не столь выраженно, как предполагалось (~ в 2,2 раза при концентрации 2 моль/л). Заключение. Результаты исследований показали, что инкубация в гипертонических растворах NaCI значительно увеличивает чувствительность ДНК лимфоцитов к повреждающему действию свободных радикалов.
Гипертонические растворы хлорида натрия, гистоны, лимфоциты, метод днк-комет, однонитевые разрывы днк, перекись водорода, у-излучение, хроматин
Короткий адрес: https://sciup.org/14918043
IDR: 14918043
Текст научной статьи Влияние инкубации в гипертонических растворах хлорида натрия на повреждаемость ДНК лимфоцитов периферической крови человека Y-излучением и перекисью водорода
1 Введение. Согласно современным радиобиологическим представлениям радиочувствительность клеточных популяций обусловлена способностями клеточных систем: 1) предотвращать возникновение повреждений ДНК; 2) репарировать индуцированные радиацией повреждения ДНК; 3) эффективно элиминировать клетки, в которых репарация повреждений ДНК невозможна. Как правило, при рассмотрении первого «эшелона» клеточной защиты от ионизирующего излучения основное внимание обращают на механизмы нейтрализации / детоксикации свободных радикалов, в которые вовлечены ферменты (супероксиддисмутаза, каталаза, глутатионпероксидаза и др.), хелаторы редокс-активных металлов, низкомолекулярные антиоксиданты (витамины Е и С, каротин, глутатион и др.), белки с высоким содержанием SH-групп (например, металлотионеины) и т.д.. Однако еще на заре развития радиационной биологии было известно, что чувствительность клеток к воздействию ионизирующего излучения, как правило, зависит от степени дифференцировки, длительности клеточного цикла и пролиферативной активности клеток (закон Ж. Бергонье и Л. Трибондо, сформулированный авторами в 1906 г.). Позднее показано, что перечисленные процессы так или иначе связаны с изменениями конформационной структуры и соотношением активных и неактивных участков хроматина. Так, активный хроматин (эухроматин) в большей степени повреждается свободными радикалами, образующимися при радиолизе воды, чем неактивный (гетерохроматин) [1]. Предполагается, что это обусловлено тем, что активно транскрибируемые последовательности не защищены от атак свободных радикалов структурными белками хроматина. При репликации ДНК наблюдается аналогичная ситуация (снижение «конформационной» защиты хроматина). В результате выход радиационно-индуцированных повреждений ДНК максимален именно в фазе синтеза ДНК (S-фаза клеточного цикла) [2].
Известно, что изменение ионной силы, например, с помощью гипертонических растворов NaCl приводит к нарушению этих взаимодействий и депротеинизации хроматина [3]. Использование растворов NaCl c постепенно повышающейся тоничностью позволяет проводить своеобразное, ступенчатое «раздевание» хроматина: при концентрации NaCl 0,35 моль/л происходит диссоциация негистоновых белков; 0,5–0,6 моль/л — негистоновых белков и линкерного гистона; 1,2 моль/л — негистоновых белков, линкерного гистона и коровых гистонов H2A-Н2B; 2 моль/л — полная депротеинизация хроматина [4]. Использование этого подхода позволяет изучать роль структурных белков хроматина в его организации и конформационном изменении доступа свободных радикалов к ДНК.
Цель: изучение влияния гипертонических растворов NaCl, вызывающих ступенчатую депротеинизацию хроматина, на выход однонитевых разрывов
(ОР) и щелочно-лабильных сайтов (ЩС) ДНК, индуцированных γ-излучением и перекисью водорода в лимфоцитах периферической крови человека in vitro.
Материал и методы. Для исследований использовалась кровь пяти физически здоровых женщин-доноров в возрасте 21–26 лет. Забор периферической крови проводили в вакутейнеры с литий-гепарином в качестве антикоагулянта (Vacuette). У всех доноров получено согласие на проведение данного исследования. Выделение лимфоцитов из гепаринизированной крови человека проводили путем центрифугирования в градиенте плотности фиколл-верографин (Histopaque-1077, Sigma-Aldrich) в соответствии с прилагаемой инструкцией. После выделения лимфоциты отмывали и ресуспензировали в фосфатносолевом буфере (рН 7,4) до конечной концентрации 1x106 клеток/мл.
500 мкл суспензии клеток смешивали с 500 мкл 1 % раствора легкоплавкой агарозы (тип IV) в фосфатно-солевом буфере (рН 7,4) при температуре 37,5ºС. 75 мкл полученной смеси наносили на предварительно покрытые слоем 1 % нормоплавкой агарозы предметные стекла, накрывали покровными стеклами и оставляли на 10 мин при 4ºC до образования плотного геля.
Полученные агарозные слайды с иммобилизированными в них клетками (далее — агарозные слайды) инкубировали 1 час при 4°С в 20 ммоль/л Тris-HCl буфере, рН 7,4, содержащем NaCl в разных концентрациях (0,14; 0,35; 0,6; 1,2; 2,0 моль/л).
Облучение агарозных слайдов в среде инкубации проводили на установке «АГАТ-Р1» (Россия, источник гамма-излучения 60Co) при мощности дозы 1 Гр/ мин и температуре 4˚C.
Для обработки агарозных слайдов Н2О2 добавляли Н2О2 до конечной концентрации 25, 50 или 100 ммоль/л и инкубировали 15 мин при 4°С. Анализ однонитевых разрывов ДНК и щелочно-лабильных сайтов проводили с помощью метода ДНК-комет в щелочных условиях [5]. Сразу после облучения или инкубации с Н2О2 агарозные слайды переносили в холодный (4˚C) лизирующий буфер (2.5 моль/л NaCl, 100 ммоль/л Na2EDTA, 20 ммоль/л Tris-HCl, pH 10.0, 1% Triton X-100 и 10% DMSO) и выдерживали в течение 1 ч в темноте при 4˚C. После лизиса клеток слайды переносили в холодный (4˚C) щелочной раствор (300 ммоль/л NaOH, 1 ммоль/л EDTA, рН>13) и выдерживали 20 мин для расплетания (щелочной денатурации) нитей ДНК. Электрофорез проводили в щелочном буфере при напряжении 0,75 В/см при комнатной температуре в течение 10 мин. После электрофореза проводили нейтрализацию для рена-турации (восстановления нативности) ДНК (3-кратная промывка в 0,4 моль/л Трис-НСl буфере, рН 7,4). После этого слайды слегка подсушивали и фиксировали в 70%-ном этаноле в течение 10 мин. Для окраски ДНК использовали акридиновый оранжевый (2 мкг/мл в фосфатно-солевом буфере, рН 7,4). Визуализацию ДНК-комет проводили с помощью люминесцентного микроскопа Axioscop-40 FL (Carl Zeiss) и видеосистемы на основе цифровой камеры MRс 5
(Carl Zeiss) с программой AxioVision 4.8 (Carl Zeiss). На каждом слайде регистрировали по 100 комет. Обрабатывали по 3 слайда от каждого донора на экспериментальную точку. Для анализа и обработки микрофотоизображений ДНК-комет использовали программу СASP 1.2.2 (СASPlab).
Статистическая обработка результатов проводилась с использованием пакета статистических программ Statistica 8.0 (StatSoft). Результаты исследований представлены как среднее арифметическое результатов серии независимых экспериментов и стандартной ошибки.
Результаты. На предварительном этапе работы исследованы зависимости изменений относительного количества ОР и ЩС в выделенных лимфоцитах периферической крови здоровых доноров от дозы γ-излучения и концентрации перекиси водорода при воздействии in vitro.
Хорошо известно, что при проведении электрофореза ДНК в геле агарозы доля (%) ДНК, мигрирующей в область «хвоста», зависит от степени ее фрагменти-рованности. При щелочном значении рН (рН~12), когда происходит денатурация / расплетание двунитевых молекул ДНК до однонитевых нитей, этот показатель будет зависеть преимущественно от количества ОР ДНК, как доминирующего по сравнению с двунитевы-ми разрывами типа повреждений ДНК. Повышение рН (>13) приводит к дополнительному образованию ОР по щелочно-лабильным участкам ДНК, представляющим собой апуриновые и апиримидиновые сайты [6]. В работе использовалась наиболее часто применяемая в генотоксикологических исследованиях модификация ДНК-комет при рН>13, позволяющая оценивать преимущественно сумму ОР и ЩС.
На рис. 1 представлены результаты исследований изменения уровня ОР и ЩС в лимфоцитах периферической крови человека при их облучении in vitro в дозах 1, 2, 3 и 5 Гр c мощностью дозы 1 Гр/мин при 4°С. Каждая точка, представленная на рисунке, представляет собой среднее из пяти независимых экспериментов. Было показано, что в области доз до 5 Гр кривая «доза — эффект» образования ОР и ЩС в лимфоцитах периферической крови человека при воздействии γ-излучения апроксимируется линейной функцией у =2,14+6, 91x ( R 2=0.99), где у — % ДНК в хвосте ДНК-комет; х — доза облучения в Гр.
Используемые в экспериментах условия, а именно относительно короткое время облучения (до 5 мин) и низкая (4°С) температура, значительно снижающая эффективность работы клеточных систем репарации повреждений ДНК, позволяют предположить, что наблюдаемые нами изменения % ДНК в хвосте комет зависят преимущественно от количества первичных ОР и ЩС, индуцированных γ-излучением. Линейный характер зависимостей образования первичных ОР и ЩС ДНК от дозы облучении при остром, кратковременном воздействии является характерным для живых клеток [7]. Считается, что при воздействии на клетки млекопитающих γ-излучения в дозе 1 Гр в среднем в одной клетке образуется примерно 1000 ОР ДНК [6]. Анализ дозовой кривой, представленной на рис. 1, позволят заключить, что при использованных нами экспериментальных условиях каждые 1000 ОР и ЩС ДНК увеличивают долю ДНК, мигрирующей во время электрофореза в область хвоста ДНК-комет, примерно на 7%.
Ионизирующее излучение повреждает ДНК как при прямом попадании кванта или частицы в молекулу ДНК (непосредственная передача энергии молекуле ДНК и молекулам воды, вплотную прилегающим к ДНК), так и косвенно, индуцируя свободные радикалы (преимущественно HO• радикал), повреждающие ДНК. Хорошо известно, что около 70% повреждений ДНК можно предотвратить добавлением низкомолекулярных антиоксидантов, нейтрализующих HO• радикал, что свидетельствует о существенной роли свободных радикалов в индукции повреждений ДНК в живых клетках при воздействии редкоионизирую-щего излучения. Поэтому представлялось интересным сравнить эффекты, вызванные воздействием ионизирующего излучения, с ДНК-повреждающим действием агентов, индуцирующих свободные радикалы, но не вызывающих прямых повреждений ДНК. В качестве такого агента была выбрана перекись водорода. В живых клетках перекись водорода в реакциях с ионами металлов переменной валентности и супероксиданион радикалом (реакции Фентона и Габер-Вейса) приводит к образованию повреждающего ДНК HO• радикала. Для того чтобы снизить эффективность работы ферментов, разлагающих перекись водорода (каталаза, глютанионпероксидазы), а также ферментов репарации ДНК, инкубацию клеток проводили при 4°С. Усредненные результаты пяти независимых экспериментов представлены на рис. 2.
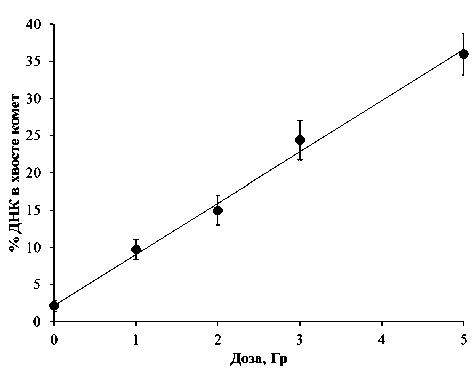
Рис. 1. Зависимость изменений уровня однонитевых разрывов и щелочно-лабильных сайтов ДНК (% ДНК в хвосте комет) в лимфоцитах периферической крови человека от дозы γ-излучения при облучении in vitro
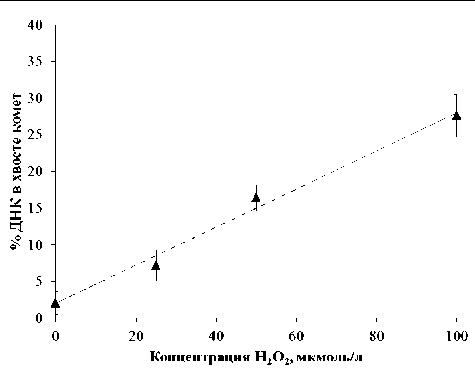
Рис. 2. Зависимость изменений уровня однонитевых разрывов и щелочно-лабильных сайтов ДНК (% ДНК в хвосте комет) в лимфоцитах периферической крови человека от концентрации перекиси водорода при инкубации клеток in vitro
Как видно из рис. 2, кривая «доза — эффект» образования ОР и ЩС в лимфоцитах периферической крови человека при воздействии перекиси водорода в концентрациях 25, 50 и 100 мкмоль/л апроксимиру-ется линейной функцией у =2,03+0,26 x ( R 2=0,99), где у — % ДНК в хвосте ДНК-комет, х — концентрация перекиси водорода в мкмоль/л.
Сравнительный анализ дозовых кривых, полученных при воздействии на клетки γ-излучения и перекиси водорода (см. рис. 1 и 2 соответственно), показывает, что при использованных нами экспериментальных условиях количество ОР и ЩС индуцированных в лимфоцитах γ-излучением в дозе 1 Гр соответствует эффекту действия перекиси водорода в концентрации ~25 мкмоль/л.
Для исследований роли структуры хроматина в клеточной радиочувствительности, с учетом результатов исследований дозовых зависимостей индукции ОР и ЩС ДНК, выбрана доза 2 Гр. При облучении в этой дозе лимфоцитов крови, находящихся в изотоническом растворе NaCl, наблюдалось ~5 кратное увеличение доли ДНК в хвосте комет.
Усредненные результаты трех независимых экспериментов, представленные на рис. 3, свидетельствуют о том, что депротеинизация хроматина в растворах со ступенчато увеличиваемой тоничностью (от 0,14 до 2,0М), увеличивает чувствительность ДНК к повреждающему действию свободных радикалов, индуцируемых ионизирующим излучением с ростом тоничности среды. Из рис. 3 видно, что кривая фактически делится на 2 участка с разными линейными угловыми коэффициентами 13,5 — до и 4,4 — после 0,6 моль/л NaCl. Именно при этой концентрации происходит полная диссоциация линкерного гистона H1, играющего ключевую роль в компактной укладке нуклеосом в тонкую фибриллу хроматина.
Подобная зависимость получена и при воздействии перекиси водорода на лимфоциты крови, инкубированные в растворах NaCl разной тоничности (рис. 4). Диссоциация негистоновых белков (0,35 моль/л NaCl) приводит к увеличению выхода ОР и ЩС ДНК ~в 1,3 раза. Увеличение тоничности среды до концентрации 0,6 моль/л, вызывающей диссоциацию линкерного гистона Н1, приводит почти к двойному увеличению выхода повреждений ДНК (~в 1,7–1,8 раза). Дальнейшее повышение концентрации NaCl, ведущее к нарушению структуры нуклеосом (1,2 моль/л) и почти полной депротеинизации хроматина (2 моль/л), увеличивает выход повреждений ДНК не столь выраженно, как предполагалось (~ в 2,2 раза при концентрации 2 моль/л).
Обсуждение. Основой процесса самоорганизации хроматина являются слабые взаимодействия его базовых структурных компонентов — ДНК и белков. Белки хроматина обеспечивают его сложную конформационную структуру, лимитируя тем самым доступ свободных радикалов к ДНК. Это существенно снижает количество индуцируемых свободными радикалами повреждений ДНК. Гипертонические растворы вызывают диссоциацию белков хроматина и тем самым увеличивают выход повреждений ДНК, индуцированных ионизирующим излучением и перекисью водорода. При этом ключевым белком, обеспечивающим корректную сборку нуклеосом в компактные архиструктуры хроматина, по всей видимости, является линкерный гистон Н1. Удаление этого белка приводит к серьезным нарушениям структуры хроматина, снижению компактности, образованию глыбчатой структуры и резкому увеличению
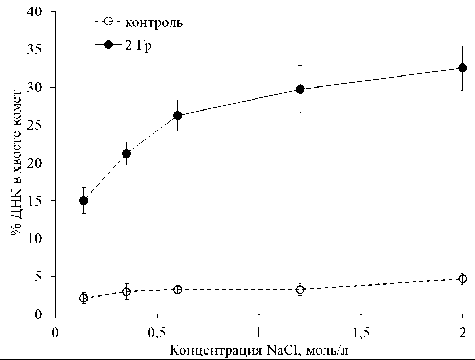
Рис. 3. Влияние изменения конформации хроматина лимфоцитов крови человека с помощью гипертонических растворов NaCl на уровень однонитевых разрывов ДНК щелочнолабильных сайтов ДНК при воздействии γ-излучения в дозе 2 Гр
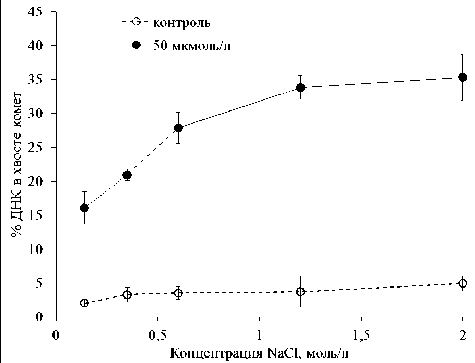
Рис. 4. Влияние изменения конформации хроматина лимфоцитов крови человека с помощью гипертонических растворов NaCl на уровень однонитевых разрывов ДНК щелочнолабильных сайтов ДНК при воздействии перекиси водорода в концентрации 50 мкмоль/л доступа свободных радикалов к ДНК. Показано, что инкубация клеток линии СНО-1 в среде, содержащей 0,5 моль/л NaCl и вызывающей диссоциацию гистона Н1, увеличивает выход повреждений ДНК, индуцированных γ-излучением, примерно в два раза [8], что близко к значениям, полученных в результате наших экспериментов. Инкубация лимфоцитов периферической крови человека в 0,5 моль/л растворе NaCl приводит к статистически достоверному увеличению спонтанных повреждений и увеличению повреждаемости ДНК 365 нм УФ-излучением, индуцирующим оксидативный стресс [9]. Интересно, что радиорези-стентные потомки облученных фибробластов джунгарского хомячка линии DH-TK характеризуются более компактной структурой хроматина по сравнению с материнскими клетками [10].
Заключение. В результате проведённых исследований показано, что степень компактизации хроматина является одним из ведущих факторов, определяющих клеточную чувствительность к оксидативному стрессу. При этом критическим белком, обеспечивающим корректную сборку нуклеосом в компактные архиструктуры хроматина и тем самым ограничивающим доступ свободных радикалов к ДНК, является линкерный гистон Н1. Увеличение тоничности среды до концентрации, вызывающей диссоциацию линкерного гистона Н1, приводит почти к двойному увеличению выхода повреждений ДНК.
Список литературы Влияние инкубации в гипертонических растворах хлорида натрия на повреждаемость ДНК лимфоцитов периферической крови человека Y-излучением и перекисью водорода
- Folle GA. Nuclear architecture, chromosome domains and genetic damage. Mutat Res 2008; 658 (3): 172-183
- McArt DG, McKerr G, Saetzler K, et al. Comet sensitivity in assessing DNA damage and repair in different cell cycle stages. Mutagenesis2010; 25 (3): 299-303
- Dmitrieva Nl, Burg MB. High NaCI promotes cellular senescence. Cell Cycle 2007; 6 (24): 3108-3113
- Elia MC, Bradley MO. Influence of chromatin structure on the induction of DNA double strand breaks by ionizing radiation. Cancer Res 1992; 52 (6): 1580-1586
- Osipov A, Arkhangelskaya E, Vinokurov A, et al. DNA comet Giemsa staining for conventional bright-field microscopy. Int J Mol Sci 2014; 15 (4): 6086-6095
- Osipov AN, Smetanina NM, Pustovalova MV, et al. The formation of DNA single-strand breaks and alkali-labile sites in human blood lymphocytes exposed to 365-nm UVA radiation. Free Radic Biol Med 2014; 73: 34-40 DOI: 10.1016/j.freeradbiomed.2014.04.027 PubMed: 24816295
- Osipov AN, Klokov DY, Elakov AL, et al. Comparison in vivo Study of Genotoxic Action of High-Versus Very Low Dose-Rate gamma-Irradiation. Nonlinearity Biol Toxicol Med 2004; 2 (3): 223-232
- Roos WP, Binder A, Bohm L. The influence of chromatin structure on initial DNA damage and radiosensitivity in CHO-K1 andxrsl cells at low doses of irradiation 1-10 Gy. Radiat Environ Biophys2002; 41 (3): 199-206
- Сметанина H.M., Пустовалова M.B., Осипов A.H. Влияние инкубации в гипертонических растворах хлорида натрия на повреждаемость ДНК лимфоцитов крови человека длинноволновым УФ-излучением. Радиационная биология. Радиоэкология 2013; 53 (6): 620-624)
- Алипов Е.Д., Тырсина Е.Г., Саримов P.M. и др. Приобретенная радиорезистентность потомков облученных клеток сопровождается перестройками в организации хроматина. Радиационная биология. Радиоэкология 2004; 44 (2): 188-197).


