Влияние источников азота в питательной среде на рост и целлюлазную активность стрептомицетов
Автор: Широких И.Г., Боков Н.А., Назарова Я.И.
Журнал: Известия Коми научного центра УрО РАН @izvestia-komisc
Статья в выпуске: 5 (51), 2021 года.
Бесплатный доступ
Определены биомасса и целлюлазная активность двух перспективных почвенных изолятов стрептомицетов в зависимости от введения в среду органических (пептон, гидролизат казеина) и минеральных (NH4Cl, NaNO3, NH4NO3, (NH4)2SO4, KNO3) источников азота. Для продукции целлюлаз штаммами Streptomyces sp. Мб 4-2 и 1.3 наиболее предпочтительными явились неорганические соли - NH4NO3 и NH4Cl соответственно. Для роста стрептомицетов и накопления биомассы лучшими источниками азота служили пептон и гидролизат казеина. Полученные результаты представляют интерес для разработки новых экологически чистых технологий с использованием стрептомицетов-целлюлолитиков.
Streptomyces, источники азота, деструкция целлюлозы, активность целлюлаз, растительные материалы и отходы
Короткий адрес: https://sciup.org/149139326
IDR: 149139326 | УДК: 579.2 | DOI: 10.19110/1994-5655-2021-5-61-65
Текст научной статьи Влияние источников азота в питательной среде на рост и целлюлазную активность стрептомицетов
В последние годы все больший интерес представляют экологически чистые технологии, внедряемые на предприятиях различных отраслей промышленности. При производстве товаров по экологически чистым технологиям используются материалы, оказывающие минимальное воздействие на окружающую среду. Особую популярность приобретают технологии рециклинга, позволяющие перерабатывать отходы и вторично запускать получаемый продукт в производственный цикл.
В этом контексте особый интерес представляет использование отходов сельского хозяйства. Отходы растениеводства в основном представлены лигноцеллюлозными субстратами (листья, стебли, шелуха, корни, другие неиспользованные части растений). Лигноцеллюлоза - основной структурный компонент растений, состоит из целлюлозы, гемицеллюлозы и лигнина. Наиболее ценной для промышленного производства является целлюлоза.
Известно об использовании целлюлозосодержащих отходов в качестве субстратов для культивирования микроорганизмов, предназначенных для получения клеточных белков, органических кислот, грибов, биологически активных вторичных метаболитов, ферментов, пребиотических олигосахаридов и в качестве источников ферментируемых сахаров при производстве биоэтанола второго поколения [1, 2]. Микробные ферменты активно участвуют в перечисленных процессах, но также могут сами по себе являться целевыми продуктами. Целлюлазы наиболее часто используются в пищевой, целлюлозно-бумажной, текстильной промышленности, производстве стиральных порошков и биоэтанола [2].
Деструкция целлюлозы является комплексным процессом, требующим совместного действия трех групп ферментов:
-
- эндоцеллюлазы (иначе - эндоглюканазы) (ЕС 3.2.1.4), которые случайным образом разрезают внутренние аморфные участки целлюлозной полисахаридной цепочки, образуя олигосахариды различной длины и, следовательно, новые восстанавливающие и невосстанавливающие концы, разрушаемые экзоцеллюлазами;
-
- экзоцеллюлазы (целлобиогидролазы (ЕС 3.2.1.91)), одна часть которых действует на восстанавливающий (со свободной ОН-группой) конец целлюлозы, другая - на невосстанавливающий, отщепляя целлобиозу;
-
- р-глюкозидазы (ЕС 3.2.1.21), гидролизующие растворимые олигосахара и целлобиозу до глюкозы [3-5].
Целлюлазы, используемые сегодня в промышленном производстве, вырабатываются в основном грибами [6]. Но в природе важную роль в деградации и рециркуляции целлюлозы играют почвенные бактерии - стрептомицеты, имеющие сходные с грибами мицелиальную организацию и экологические функции. Стрептомицеты способны использовать широкий спектр источников углерода и азота, продуцировать антибиотики для снижения конкуренции за субстрат, формировать споры в условиях лимитации ресурсов [7, 8]. Существует ряд сообщений о производстве стрептомицетами целлюлаз и ксиланаз [9]. Являясь прокариотами, стрептомицеты легче поддаются генетическим манипуляциям и могут оказаться хорошими кандидатами в производстве целлюлозолитических ферментов. Помимо направленной селекции штаммов-продуцентов для увеличения продукции целлюлолитических ферментов в процессе ферментации растительных отходов зачастую производят оптимизацию состава питательной среды, варьируя в среде концентрацию катионов [9, 10], pH [11, 12] и источники азота [11, 13-15].
Цель работы - выявить оптимальные источники азота для жидкофазного культивирования двух штаммов стрептомицетов-целлюлолитиков.
Объекты и методы исследования
В работе были использованы два природных изолята из почв Кировской области - штаммы Streptomyces sp. Мб 4-2 и 1.3, показавшие ранее высокую целлюлазную активность при деградации соломы [16]. Для культивирования применяли жидкую питательную среду следующего состава (г/л): К2НРО4 - 2, NaCI - 2, MgSO4 7Н2О - 1, MnSO4 -0,05, FeSO4 7H2O - 0,05, CaCI2 2H2O - 2. Устанавливали исходное значение pH 7,2. В качестве единственного источника углерода служила измельченная солома в количестве 1 об.%. Источники азота вносили в среду в зависимости от варианта, в эквимолекулярных по азоту количествах (г/л): NH4CI - 2, NaNO3 - 3,2, NH4NO3- 1,5, (MH4)2SO4 - 2,5, KNO3 -3,77, пептон - 10, гидролизат казеина - 10.
Стрептомицеты выращивали в конических стеклянных колбах объемом 250 мл, содержащих по 50 мл жидкой питательной среды. Инокулятом служили два агаровых блока (диаметром 10 мм), вырезанных керном из 5-суточных газонных культур, выращенных на овсяном агаре при 28 °C. Ферментацию проводили стационарно в течение 15 сут. при 28 °C. Повторность в эксперименте - 3-кратная. Биомассу стрептомицетов измеряли после центрифугирования жидких культур при 7000 об./мин в течение 10 мин и высушивания при 105 °C до постоянного веса. Целлюлазную активность определяли в надосадочной жидкости с реактивом на основе динитросалициловой кислоты (ДНС) спектрофотометрически (540 нм) [17]. Активность фермента выражали в условных единицах (усл. ед./10 мин/г), производя перерасчет на 1 г сухой биомассы бактерий.
Статистическая обработка результатов выполнена методом двухфакторного дисперсионного анализа с использованием программ Microsoft Excel и Statgraphics. Значимыми считали различия при р<0,05.
Результаты и обсуждение
В ходе работы изучили влияние органических и неорганических источников азота на накопление биомассы Streptomyces sp. 1.3 и Мб 4-2 в процессе жидкофазного стационарного роста культур. При культивировании стрептомицетов на средах с органическими источниками азота (гидролизат казеина, пептон) сухая биомасса продуцентов целлюлаз в среднем была выше, чем при культивировании этих же штаммов на средах с минеральными источниками азота (рис. 1). Оба штамма продемонстрировали максимальный уровень накопления биомассы за 15-суточный период на среде с пептоном: Streptomyces sp. Мб 4-2 - 602,6±12,9 мг и Streptomyces sp. 1.3 - 578,3±21,5 мг, что соответственно на 33,5 и 27,0 % больше, чем на минеральной питательной среде с МН4С1. Эти результаты совпадают с данными других работ по стрептомицетам, авторы которых также отмечают, что оптимальными для наращивания биомассы являются органические источники азота - мясной экстракт и пептон [11,15].
Среди сравниваемых минеральных источников азота наибольшую продуктивность обоих штаммов поддерживал KNO3, минимальный уровень продуктивности обеспечивался введением в среду NaNO3. Биомасса стрептомицетов, выращенных в средах с добавлением других солей, различалась по вариантам недостоверно.
Результаты двухфакторного дисперсионного анализа полученных в эксперименте данных показали, что форма доступного азота оказала на продуктивность биомассы в 3,5 раза более значительное влияние (F=65,47; р<0,0001), чем штамм стреп-томицета (F=18,65; р<0,0001). Вклад взаимодейст-
0,7 ж вия этих факторов в варьирование показателя оценивался как несущественный (F= 1,11; р=0,38).
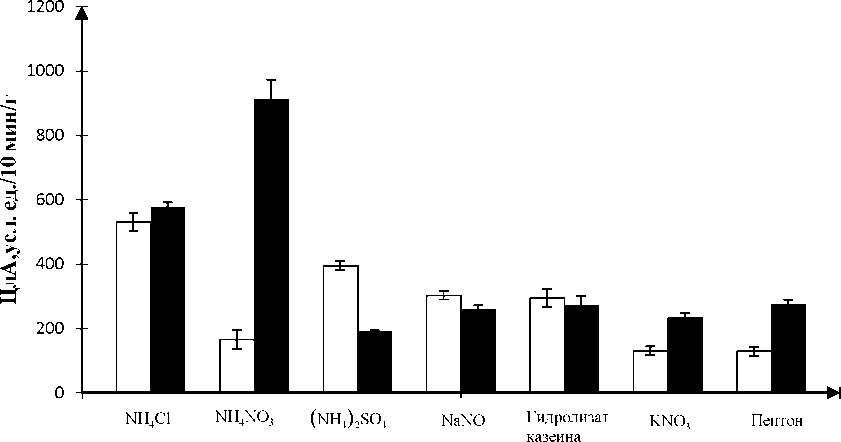
Введение в среду различных источников азота оказало на целлюлазную активность стрептомицетов еще более выраженное влияние, чем на выход биомассы. Но, в отличие от биомассы, максимальной активности фермента содействовало введение в среду минеральных, а не органических источников азота. Ранее в доступной нам литературе об этом не упоминалось. Напротив, при изучении реакции стрептомицетов на различные источники азота лучшие результаты в отношении целлюлазной активности обеспечивались введением в питательные среды органических источников азота, таких как дрожжевой экстракт [13] и пептон [11, 14, 15]. В наших экспериментах максимальную целлюлазную активность на уровне 912,82±60,40 ед./10 мин/г обеспечил штамм Streptomyces sp. Мб 4-2 при росте на среде с МН4МО3 (рис. 2). Это в 3,3-3,4 раза выше, чем при выращивании этого стрептоми-цета на средах, содержащих гидролизат казеина (270,71±31,33 усл. ед./10 мин /г) и пептон (275,2±14, 00 усл. ед./10 мин /г). Максимальная целлюлазная активность штамма Streptomyces sp. 1.3 (531,37±27,25 усл. ед./10 мин /г) отмечена на среде с другим минеральным источником азота - NH4CI. В этих условиях ферментативная активность Streptomyces sp. 1.3 достоверно не отличалась от активности штамма Streptomyces. sp. Мб 4-2 (577,53±14,38 усл. ед./10 мин /г). На средах с другими источниками азота как органическими, так и минеральными целлюлазная активность Streptomyces sp. 1.3 была достоверно ниже, варьируя в пределах от 129,8 (пептон) до 395,0 ((NH4)2SO4) усл. ед./10 мин /г.
Результаты статистической обработки данных по целлюлазной активности двух штаммов, полученные методом двухфакторного дисперсионного анализа, подтвердили, что на варьирование этого показателя практически в равной степени оказыва- lllllll
NH,C1 NH^NO, (NHJSO NaNO, Гидролизат KNOj Пептон казеина
■ Streptomyces sp. Мб 4-2 □ Streptomyces sp. 1.3 Источники азота
Рис. 1. Накопление биомассы двумя культурами стрептомицетов в зависимости от источника азота в жидкой питательной среде.
Fig.l. Accumulation of biomass by two streptomycetes cultures depending on the nitrogen source in a liquid nutrient medium.
Источники азота
■ Streptomyces sp. Мб 4-2 □ Streptomyces sp. 1.3
Рис. 2. Целлюлазная активность двух штаммов стрептомицетов в зависимости от источника азота в жидкой питательной среде.
Fig. 2. Cellulase activity of two strains of streptomycetes depending on the nitrogen source in a liquid nutrient medium.
ют влияние как источник азота (F=225,92; р<0,0001), так и штамм-продуцент (F=205,98; р<0,0001), а также взаимодействие этих факторов (F=225,06; р<0,0001). '
Отсюда следует, что оптимизация состава питательной среды по источнику азота для реализации целлюлолитического потенциала отдельными культурами стрептомицетов должна носить индивидуальный характер. Замена одного компонента среды другим может обеспечить статистически значимое увеличение продукции целлюлазы. В отличие от имевшихся ранее в литературе сведений, максимальные значения целлюлазной активности штаммами Streptomyces sp. Мб 4-2 и 1.3 были достигнуты на средах не с органическими, а с минеральными источниками азота - NH4CI и NH4NO3.
Установлено также значимое влияние источника азота на выход биомассы штаммов-продуцентов целлюлаз. В большей степени, чем неорганические соли, росту исследуемых культур стрептомицетов в условиях жидкофазного культивирования способствовали органические источники - гидролизат казеина и пептон, что совпадает с данными литературы. Штаммоспецифичность в реакции стреп-томицетов-целлюлолитиков на те или иные источники азота по показателю накопления биомассы не прослеживалась.
Вывод
Таким образом, результаты проведенных экспериментов показали, что оптимизация питательной среды по источнику азота позволяет регулировать темпы роста культур стрептомицетов-продуцентов и добиваться максимального выхода целлюлазы. Полученные данные представляют интерес для разработки новых экологически чистых технологических процессов с использованием стреп томицетов в производстве ферментов целлюлазного комплекса и при деструкции целлюлозосодержащих отходов сельского хозяйства.
Список литературы Влияние источников азота в питательной среде на рост и целлюлазную активность стрептомицетов
- Sanchéz С. Lignocellulosic Residues: Biodégradation and Bioconversion by Fungi // Biotechnology Advances. 2008. Vol. 27. P. 185-194. D01:10.1016/j.biotechadv.2008.11.001
- Vermel ho A.B., Supuran C.T., Guisan J.M. Microbial enzyme: applications in industry and in bioremediation. Enzvme Res. 2012. Vol. 2012 P. 1-2. DOI: 10.1155/2012/980681
- Microbial cellulose utilization: fundamentals and biotechnology / L.R. Lynd, P.J. Weimer, W.H. van Zyl, I.SI Pretorius // Microbiol. Mol. Biol. Rev. 2002. Vol. 66. P. 506-577. DOI: 10.1128/MMBR.66.3.506-577.2002
- Lee J. Biological conversion of lignocellulosic biomass to ethanol 11 J. Bio-technol. 1997. Vol. 56. P. 1-24. DOI: 10.1016/s0168-1656 (97) 00073-4
- Wilson D.B. Three microbial strategies for plant cell wall degradation // Ann. N.Y. Acad. Sci. 2008. Vol. 1125. P. 289-297. DOI: 10.1196/annals.1419.026
- Jayasekara S., Ratnayake R. Microbial cellu-lases: An overview and applications. In Cellulose. Elsevier, 2019. P. 1-21. DOI: 10.5772/ intechopen.84 531
- Systems biology and biotechnology of Streptomyces species for the production of secondary metabolites / K.S. Hwang, H.U. Kim, P. Charusanti, B.O. Palsson, S.Y. Lee // Bio-technol Adv. 2014. Vol. 32. № 2. P. 255-268. DOI: 10.1016/j.biotechadv.2013.10.008
- Gopalakrishnan V., Srinivas S.L. Streptomyces. In Beneficial Microbes in Agro-Ecology. Academic Press, 2020. P. 55-71. D01:l0.1016/ B978-0-12-823414-3.00005-8.
- Saini A., Aggarwal N.K., Sharma A. Actino-mycetes: a source of lignocellulolytic enzymes // Enzyme Res. 2015. Vol. 2015. P. 1-15. DOI:l 0.1155/2015/2 79381
- Cellulolytic Streptomyces Sp. Isolated from a Highly Oligotrophic Niche Shows Potential for Hydrolyzing Agricultural Wastes / S. Celaya-l[errera, L.E. Casados-Vôzquez, I. Valdez-Vaz-quez, F. Barona-Gymez, D.K. Bicleshi, J.E. Bar-boza-Corona // BioEnergy Research. 2021. Vol. 14. P. 333-343. D01:10. 1007/sl2155-020-10 174 z
- Surcshkumar C., Munisamy P. Optimization of Process Parameters for Carboxymethyl Cellu-lase Production under Submerged Fermentation by Streptomyces lividians // Journal of Academia and Industrial Research. 2015. Vol. 3. P. 371-379.
- Alam M., Sultana M., Anwar M.N. Isolation, identification and characterization of four cellulolytic actinomycetes and their cellulases // Chittagong University Journal of Biological Sciences. 2013. Vol 6. P. 159-173. D()l:10. 3329/cujbs.v6il-2.17241
- Sinjaroonsak S., Chaiyaso T., H-Kittikun A. Optimization of Cellulase and Xylanase Productions by Streptomyces thermocoprophilus Strain TC13W Using Oil Palm Empty Fruit Bunch and Tuna Condensate as Substrates // Appl Biochem Biotechnol. 2019. Vol. 189. M 1. P. 76-86. DOI: 10.1007/sl2010-019-02986-3.
- Isolation Screening and Optimization of process parameters for enhanced production of cellulase by solid state fermentation / P.R. Yaclav, P.B. Chauhan, M. Gahlout, H. Prajapat // Int. J. Adv. Res. Biol. Sci. 2016. Vol. 3. № 5. P. 21-27.
- Optimization of extracellular endoxylanase, endoglucanase and peroxidase production by Streptomyces sp. F2621 isolated in Turkey / M. Twicer, A. Kuril, M. Isikli, N. Sahin, F.G. Celenk U J Appl Microbiol. 2004 Vol. 97. № 4. P. 783-791. DOI: 10.1111/j. 1365-2672. 2004.02361.x.
- Сравнительная характеристика роста и целлюлазной активности стрептомицетов на различных субстратах / И.Г. Широких, Я.И. Назарова, НА. Боков, Т.Я Ашихмина // Теоретическая и прикладная экология. 2021. № 2. С. 122-127. DOI: 10.25750/1995-4301 2021-2-122-127


