Влияние экспериментально вызванного метаболического синдрома на функциональное состояние мочевого пузыря у крыс
Автор: Кирпатовский В.И., Мудрая И.С., Греков Е.А., Кабанова И.В., Голованов С.А., Дрожжева В.В., Надточий О.Н.
Журнал: Экспериментальная и клиническая урология @ecuro
Рубрика: Экспериментальная урология
Статья в выпуске: 1, 2013 года.
Бесплатный доступ
Эксперименты проводили с использованием 20 зрелых самцов крыс (линия «Август») с массой 280-320 г. У 10 крыс метаболические изменения, характерные для метаболического синдрома (МС), были вызваны использованием высококалорийной диеты (добавление 20% маргарина к стандартной диете и 20% фруктозы в воду в течение 3 месяцев), двусторонняя орхиэктомия (для создания дефицита андрогенов) и стресс (стресс иммобилизации в течение 1 дня в конце периода наблюдения). Еще 10 крыс были контролем. В экспериментальной группе наблюдалось увеличение массы тела, гипергликемия, гиперглюкозурия, гипертриглицеридемия (с увеличением липопротеинов низкой плотности), гиперурикемия и гиперурикурия. Они были типичными для РС. У крыс с РС было показано, что были зафиксированы спонтанные сокращения мочевого пузыря с периодическим увеличением внутрипузырного давления до 7-12 см H 2 O, тогда как в контрольной группе эти сокращения не превышали точки 4 см H 2 O , Также in vitro оценка сокращения фрагментов мочевого пузыря показала, что амплитуда спонтанных сокращений в условиях покоя была выше у группы крыс с РС по сравнению с контрольной группой. Во время электростимуляции спонтанные сокращения в мышечных фрагментах крыс с МС также регистрировались между электрически индуцированными. Это не было случаем в контрольной группе. Автономное регулирование с использованием гармонического анализа вариации биоимпеданса, которое показало доминантность региональной парасимпатической активности у крыс с РС.
Метаболический синдром, гиперактивность мочевого пузыря, вегетативная регуляция
Короткий адрес: https://sciup.org/142188353
IDR: 142188353
Текст научной статьи Влияние экспериментально вызванного метаболического синдрома на функциональное состояние мочевого пузыря у крыс
The experiments were made using 20 mature male rats (line “August”) with a mass of 280-320 g. In 10 rats metabolic changes typical for metabolic syndrome (MS) were induced using high-calorie diet (adding of 20% margarine to standard diet and 20% of fructose to the water during 3 months), bilateral orchiectomy (to create androgen deficiency) and stress (immobilization stress during 1 day in the end of the observation period). Another 10 rats were controls.
In the experimental group increase of the body mass, hyperglycaemia, hyperglucosuria, hypertriglyceridemia (with the increase of low density lipoproteins), hyperuricemia and hyperuricuria were observed. These were typical for MS. In the rats with MS it was shown that spontaneous bladder contractions were enforced, with periodical increases in the intravesical pressure up to 7-12 cm H2O, while in the control group these contractions didn’t get over the point of 4 cm H2O. Also in vitro estimation of bladder fragments’ contraction showed that the amplitude of spontaneous contractions in resting conditions was higher in the group of rats with MS compared to control group. During the electro-stimulation spontaneous contractions in the muscle fragments of the rats with MS were also registered between those electrically induced. This was not a case in the control group. Autonomic regulation using harmonic analysis of bioimpedance variation, which showed the domi-nancy of regional parasympathetic activity in the rats with MS.
В.И. Кирпатовский, И.С. Мудрая, Е.А. Греков, И.В. Кабанова, С.А. Голованов, В.В. Дрожжева, О.Н. Надточий
ФГБУ «НИИ урологии» Минздрава России
од термином «метаболический синдром» (МС) подразумевают комплекс нарушений метаболизма, затрагивающих углеводный и жировой обмен, с развитием ожирения, дислипи демии, инсулинорезистентности вплоть до развития сахарного диабета 2-го типа, атеросклероза, нарушения пуринового обмена. У мужчин этот симптомокомплекс дополняется андрогенным дефицитом, часто приводящим к эректильной дисфункции. Эти изменения повышают риск развития многих заболеваний, в том числе затрагивающих органы мочеполовой системы. Выявлена взаимосвязь МС с развитием мочекаменной болезни, эректильной дисфункции, мужского бесплодия, доброкачественной гиперплазии предстательной железы и дисфункции мочевого пузыря (гиперактивность, недержание мочи) [1].
Данное экспериментальное исследование, проведенное на крысах, посвящено выявлению взаимосвязи экспериментально вызванных метаболических изменений, характерных для МС, с характером нарушений функционального состояния мочевого пузыря и состоянием его вегетативной регуляции.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Опыты проведены на 20 половозрелых крысах-самцах линии «Август» массой 280-320 г (возраст 8-12 мес.). Индуцирование метаболических нарушений, характерных для МС, вызывали комплексом воздействий, включающих в себя формирование андрогенного дефицита путем билатеральной орхэктомии, высококалорийную диету в течение 3 месяцев с избыточным потреблением насыщенных жиров и углеводов (добавление 20% маргарина к стандартному рациону и 20% фруктозы к питьевой воде), а также стрессорное воздействие (иммобилизационный стресс в течение суток в конце периода наблюдения) (10 крыс). Контрольную группу составили 10 интактных крыс, находящихся на стандартной диете вивария, и, не подвергавшихся каким-либо воздействиям.
Через 3 месяца наблюдения проводили биохимическое исследование крови и мочи для характеристики развившихся метаболических изменений. С этой целью крыс помещали в обменные клетки на сутки для сбора мочи и брали пробы крови из хвостовой вены. Биохимические параметры крови и мочи определяли на автоматическом анализаторе «ADVIA-1200».
Оценку функционального состояния мочевого пузыря и его вегетативной регуляции проводили с использованием разработанной совместно с НПФ «Биола» комплекса аппаратуры с анализом спектра малых колебаний импеданса по Фурье, в сочетании с регистрацией внутрипузырного давления при опорожненном и наполненном мочевом пузыре [2], а также путем определения сократительной активности полосок, выкроенных из тела мочевого пузыря в стендовой установке in vitro [3].
В условиях эфирного наркоза выделяли мочевой пузырь, пунктировали его пластиковым катетером, соединенным через 3-ходовой кран с датчиком давления и инфузионным насосом, и подшивали 2 диагностических электрода к верхушке и вблизи шейки мочевого пузыря. Колебания импеданса, связанные с изменением его тонуса, колебаниями кровотока и с вегетативной иннервацией, регистрировали на персональном компьютере и обрабатывали с помощью специально разработанной программы.
Для оценки сократимости детрузора мочевой пузырь удаляли и выкраивали кольцевые фрагменты из области его тела. Фрагменты помещали в камеру экспериментальной установки с постоянно протекающим оксигенированным термостатируемым (370С) питательным раствором Рингера (рН 7,4). Исследования проводили в изометрическом режиме, для чего один конец фрагмента фиксировали к неподвижному стержню, а второй -соединяли с механоэлектрическим преобразователем силы (6МХ2В), для определения усилия растяжения (тонуса) и силы сокращений в условиях электростимуляции прямоугольными импульсами длительностью 300 мс, частотой 6 в минуту, напряжением на 20% выше порогового.
Статистическую обработку цифровых данных проводили с помощью компьютерной программы “Statistica 6.0”, используя непараметрические критерии достоверности разницы результатов для малых выборок.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Через 3 месяца приема высококалорийной диеты в условиях андрогенного дефицита масса крыс возрастала с 301±11 г до 389±32 г (p<0,05). Крысы опытной серии выпивали большее количество воды, в связи с чем суточный диурез у них возрастал в 2 раза.
Биохимические исследования крови и мочи выявили развитие у крыс опытной серии метаболических нарушений, характерных для МС (табл. 1 и 2). Происходило увеличение концентрации глюкозы в крови с увеличением ее суточной экскреции с мочой, что может свидетельствовать о развитии инсулино-резистентности. Хотя уровень общего холестерина крови достоверно не менялся, происходило достоверное изменение соотношения липопротеинов низкой и высокой плотности в сторону преобладания первых, а также достоверное увеличение триглицеридов крови. Достоверно возрастала концентрация мочевой кислоты в крови и ее экскреция с
Таблица 1. Биохимические параметры крови в контрольной и опытной группах крыс
|
Параметры |
Интактные крысы |
Крысы с МС |
|
Мочевина (мМ/л) |
4,8±0,2 |
6,5±0,2** |
|
Креатинин (мкМ/л) |
47±2 |
76±4*** |
|
Мочевая к-та (мМ/л) |
0,059±0,003 |
0,114±0,030* |
|
Общий белок (г/л) |
85,4±0,8 |
81,3±0,7* |
|
Альбумины (г/л) |
34,0±1,4 |
33,5±0,6 |
|
Общий билирубин (мм/л) |
10,7±0,5 |
13,1±0,3* |
|
АСТ (МЕ/л) |
142±9 |
156±9 |
|
АЛТ (МЕ/л) |
82±6 |
65±5 |
|
ЩФ (МЕ/л) |
388±35 |
248±7 |
|
ЛДГ (МЕ/л) |
1445±158 |
1947±215 |
|
Глюкоза (мМ/л) |
7,03±0,17 |
7,85±0,19* |
|
Общий холестерин (мМ/л) |
2,06±0,09 |
1,72±0,12 |
|
ЛПНП (мМ/л) |
0,32±0,02 |
0,31±0,05 |
|
ЛПВП (мМ/л) |
0,49±0,04 |
0,42±0,02 |
|
ЛПНП/ЛПВП |
0,65±0,03 |
0,74±0,02* |
|
Триглицериды (мМ/л) |
0,39±0,03 |
1,08±0,21** |
* - p <0,05; ** - p<0,01; *** - p<0,001
мочой. В крови уменьшалась концентрация белка. Хотя активность исследованных нами ферментов в крови достоверно не менялась, их экскреция с мочой достоверно возрастала, в том числе мембраносвязанных ферментов гамма-глутамил-транспептидазы (ГГТ) и щелочной фосфатазы (ЩФ), что может свидетельствовать о существенном повреждении клеток в почке, а, возможно, и в других органах. О выраженном повреждении почек свидетельствует ухудшение их функциональных параметров – снижение клиренса креатинина, уменьшение реабсорбции натрия в почечных канальцах, а также достоверное увеличение протеинурии. По-видимому, именно с повреждением эпителия почечных канальцев связано увеличение экскреции с мочой основных катионов (натрия, кальция, фосфора). Об ухудшении состояния печени может свидетельствовать тенденция к увеличению концентрации общего билирубина крови.
Полученные данные свидетельствовали о выраженных нарушениях в
Таблица 2. Суточная экскреция с мочой некоторых метаболитов и показатели функции почек крыс в контрольной и опытной группах
|
Параметры |
Интактные крысы |
Крысы с МС |
|
Диурез (мл/сутки) |
14±2 |
29±3** |
|
Мочевина (мМ/сут.) |
9,66±1,18 |
11,36±0,61 |
|
Креатинин (мкМ/сут.) |
0,09±0,01 |
0,156±0,07*** |
|
Na+(мэкв/сут.) |
0,48±0,02 |
0,62±0,01** |
|
Ca2+(мэкв/сут.) |
0,038±0,004 |
0,052±0,006* |
|
P2+(мэкв/сут.) |
0,34±0,05 |
0,74±0,01*** |
|
Мочевая к-та (мМ/сут.) |
0,019±0,003 |
0,034±0,001** |
|
АСТ (МЕ/сут.) |
0,071±0,005 |
1,04±0,48* |
|
АЛТ (МЕ/сут.) |
0,022±0,004 |
0,38±0,13* |
|
ЩФ (МЕ/сут.) |
1,29±0,35 |
3,98±0,20** |
|
ГГТ (МЕ/сут.) |
5,40±1,73 |
9,99±0,14* |
|
ЛДГ (МЕ/сут.) |
0,26±0,01 |
0,88±0,14** |
|
Глюкоза (мМ/сут.) |
0,010±0,001 |
0,017±0,001* |
|
Белок (мг/сут.) |
8,68±0,89 |
17,92±1,33*** |
|
Клиренс креатинина (мл/мин/кг) |
4,58±0,54 |
3,16±0,23* |
|
Реабсорбция натрия (%) |
99,85±0,05 |
99,61±0,03* |
|
Реабсорбция кальция (%) |
99,14±0,11 |
99,36±0,04 |
* - p <0,05; ** - p <0,01; *** - p - <0,001
обмена углеводов, липидов, пуринов и белков у крыс опытной группы, схожих с метаболическими проявлениями МС у людей. Ухудшение показателей, характеризующих функциональное состояние почек и печени, соответствует данным ряда исследований, выявивших гистологические признаки повреждения печени (жировая дистрофия, воспаление, склероз, очаги некроза) и почек (склероз клубочков, очаги некроза, интерстициальный фиброз) у крыс, находящихся на высококалорийной диете с повышенным содержанием углеводов и жиров [4-8].
Оценка функционального состояния мочевого пузыря и его вегетативной регуляции методом импе-дансометрии выявила существенные отклонения всех показателей у крыс с индуцированным МС по сравнению с интактными животными. У крыс опытной серии, как и у интактных крыс, наблюдались спонтанные колебания импеданса, связанные с изменением его тонуса. Подобную ритмическую активность гладкомышечных клеток мочевого пузыря с циклическими колебаниями их электрического потенциала и тонуса выявляли другими электрофизиологическими методами [9-11]. По мнению ряда авторов, спонтанная ритмическая электрическая активность является универсальным механизмом регуляции тонуса гладкомышечных клеток висцеральных органов [12, 13], в том числе и органов мочеполовой системы.
При опорожненном мочевом пузыре спонтанные колебания тонуса не вызывали изменения внутрипузыр-ного давления, которое составляло 1-4 см. вод. ст. При наполнении мочевого пузыря физиологическим раствором до максимальной емкости
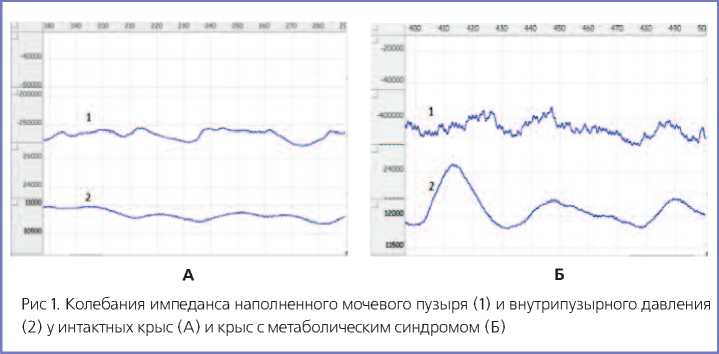
(0,8-1,0 мл) внутрипузырное давление возрастало до 28-39 см. вод. ст. При этом спонтанные колебания импеданса у крыс с индуцированным МС были более высокими по амплитуде и сопровождались совпадающими по фазе выраженными колебаниями внутрипузырного давления, составляющими 7-12 см. вод. ст., тогда как у контрольных крыс колебания внутрипузырного давления не превышали 3-4 см. вод. ст. (рис. 1).
Увеличение спонтанной сократительной активности детрузора было подтверждено в экспериментах по исследованию сократимости полосок, выкроенных из мочевого пузыря, в стендовой установке. При выключенной электростимуляции наблюдалось периодическое сокращение полосок мочевого пузыря крыс с МС, сопоставимое по амплитуде с сокращениями, вызванными электрическими импульсами (рис. 2), тогда как в контрольных опытах спонтанные колебания напряжения полосок были значительно меньшей амплитуды. Более того, в условиях постоянной электростимуляции в опытной серии также наблюдались самостоятельные сокращения между сокращениями, вызванными электрическими импульсами, чего не происходило в контрольной группе. Такие результаты подразумевают наличие спонтанной пейсмейкерной активности в исследуемых фрагментах мочевого пузыря, значительно более выраженной у крыс с МС, которая не подавляется экзогенной стимуляцией.
Миогенный тонус мочевого пузыря обеспечивается мышечными клетками его стенки, а также регуляторными влияниями автономной
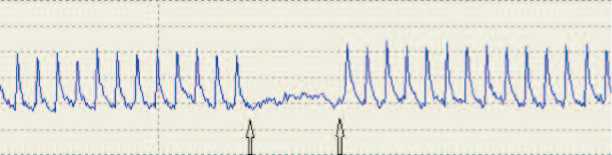
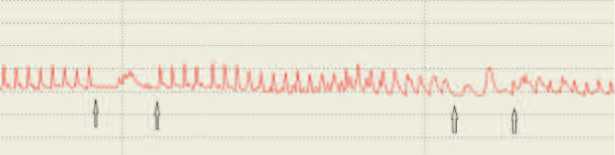
Рис 2. Изометрические сокращения полосок мочевого пузыря интактных крысы (А) и крысы с индуцированным МС (Б). Стрелками указаны моменты включения и выключения электростимуляции
нервной системы. Гармонический анализ спектра микровариаций импеданса мочевого пузыря позволил выявить участие симпатического и парасимпатического отделов вегетативной нервной системы в регуляции тонуса. При МС, как и у нормальных крыс, импедансные спектры содержали низкочастотный пик Майера М1 (0.2 Гц), респираторный пик R1 на частоте дыхания, кардиальный пик С1 на частоте сердцебиения, а также дополнительные пики, представляющие собой гармоники вышеуказанных пиков меньшей амплитуды (рис. 3). В соответствии с современными представлениями принимали, что пики М1 и С1 отражают, соответственно, уровень регионарных симпатических влияний и состояние кровообращения в исследуемом органе [14, 15], в то время как природа респираторных колебаний биоимпеданса, представленных пиком R1, по данным наших иссле-
Рис 3. Частотный спектр колебаний импеданса мочевого пузыря интактной крысы (А) и крысы с МС (Б)
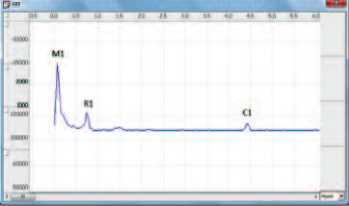
А дований, отражает активность регионарных парасимпатических влияний [16].
Анализ частотного спектра малых колебаний биоимпеданса, связанных с состоянием тонуса сосудов и активностью вегетативной иннервации мочевого пузыря, выявил значительное изменение соотношения активности симпатического и парасимпатического звеньев у крыс с индуцированным МС. При физиологическом наполнении мочевого пузыря у интактных крыс пик М1, характеризующий выраженность симпатических влияний, преобладал над пиком R1, связанным, по нашим данным, с активностью парасимпатического звена регуляции (рис. 3, табл. 3). В связи с ритмическим изменением тонуса мочевого пузыря абсолютные значения пика Майера М1 и респираторного пика R1 сильно варьировали, но их отношение (М1/R1) сохранялось относительно
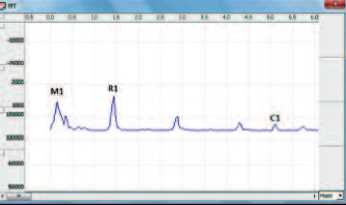
Б стабильным. При наполнении мочевого пузыря до физиологического объема в обеих сериях происходило относительное возрастание отношения M1/R1 (табл. 3), а после частичного его опорожнения наблюдалась обратная тенденция, но при этом сохранялось преобладание активности парасимпатического звена регуляции. Кардиальный пик С1, характеризующий состояние кровоснабжения стенки мочевого пузыря при его наполнении, в обеих сериях достоверно уменьшался, но значительно более выраженные изменения происходили в опытной серии.
Полученные результаты свидетельствуют об усилении ритмических колебаний тонуса мочевого пузыря у крыс с индуцированным МС, которые становятся настолько выраженными, что приводят к периодическим подъемам давления в наполненном мочевом пузыре. Эти колебания возникают за счет некоординированных сокращений разрозненных групп гладкомышечных клеток, индуцированных отдельными субпопуляциями клеток, способных генерировать спонтанные потенциалы действия (пейсмейкерные клетки). В мочевом пузыре этим свойством обладают так называемые «атипичные» гладкомышечные клетки, отличающиеся по морфологии от «типичных» лейомиоцитов, а также интерстициальные клетки, подобные клеткам Кахаля (английская аббревиатура – ICC-LC), также имеющие специфическое строение [17-21]. Оба типа пейсмейкерных клеток иерархически взаимодействуют между собой, а также координируются нервной системой [19, 22]. Генерируемый этими клетками потенциал действия распространяется на окружающие гладкомышечные клетки, вызывая их сокращение.
Усиление спонтанной сократительной активности мочевого пузыря у крыс с МС, выявленное в наших опытах, может быть обусловлено рядом причин, в частности, увеличением активности пейсмейкерных клеток, увеличением их количества, а также повышением возбудимости «типичных» гладкомышечных клеток, что приводит к охвату возбуждением большего количества клеток вокруг пейсмейкерной зоны. в
Таблица 3. Функциональные показатели мочевого пузыря по данным импедансной цистографии in situ и изолированных фрагментов in vitro у интактных крыс и животных с МС
|
Исследуемые параметры |
Интактные крысы |
Крысы с МС |
||
|
Физиологическая емкость м.п. |
Максимальная емкость м.п. |
Физиологическая емкость м.п. |
Максимальная емкость м.п. |
|
|
Опыты in vitro |
||||
|
Среднее детрузорное давление (см. вод. ст.) |
2±1 |
33±2 |
2±1 |
34±2 |
|
Амплитуда колебаний внутрипузырного давления (см. вод. ст.) |
1-4 |
3-4 |
2-5 |
7-12* |
|
Амплитуда колебаний базового импеданса (мОм) |
18-48 |
24-60 |
29-67 |
119-294*** |
|
Кардиальный пик (мОм) |
106.6±9.4 |
69.8±3.1 |
108.7±7.7 |
18.0±1.0*** |
|
Симпато-вагусный баланс м.п. (M1/R1) |
3,03±0,41 |
3,22±0,34 |
0,89±0,24** |
1,98±0,18* |
|
Опыты in vitro |
||||
|
Амплитуда ритмичных сокращений (мН/мм2) |
1,53±0,56 |
1,02±0,17 |
||
|
Амплитуда самопроизвольных сокращений (мН/мм2) |
0,15±0,04 |
0,31±0,05* |
||
* - p <0,05; ** - p<0,01; *** - p<0,001
Усиление пейсмейкерной активности может быть связано с выявленными изменениями в системе вегетативной регуляции сократительной активности мочевого пузыря, а именно с преобладанием парасимпатического компонента над симпатическим звеном регуляции. Выявлено [21, 23], что холинэргическая стимуляция сокращений детрузора карба-холином реализовывалась через активизацию как атипичных гладкомышечных клеток, так и ICC-LC, причем в ICC-LC эффект опосредовался через активацию М3-холинорецепторов. По данным [24], при стимуляции тазового нерва крысы предварительное введение как атропина, так и ингибитора функции ICC-LC (има-таниба мезилата), приводило к снижению сокращений мочевого пузыря дозо-зависимым образом. Им-таниба мезилат в опытах in vitro подавлял амплитуду и частоту сокращений фрагментов мочевого пузыря, индуцированных карбахо- лином (агонистом холинорецепто-ров) [25]. Эти данные в сочетании с данными флуоресцентной микроскопии со специфическими антителами, выявившими тесную взаимосвязь ICC-LC с холинэргическими нервными волокнами [21, 22], свидетельствуют, что ICC-LC играют роль посредника в передаче холинэргиче-ских сигналов на гладкомышечные клетки.
Таким образом, в использованной нами экспериментальной модели МС развивающиеся метаболические сдвиги в организме каким-то образом приводят к активации парасимпатической активности нейрогенной регуляции мочевого пузыря, отвечающей за сокращения детрузора, с соответствующим уменьшением функциональной значимости симпатического звена, опосредующего накопительную функцию этого органа. Относительное преобладание холи-нэргической стимуляции мочевого пузыря сопровождается усилением его спонтанной ритмической сократительной активности, вызывающей значительные колебания внутрипу-зырного давления, возможно, за счет активации или увеличения количества клеток, обладающих пейсмей-керной активностью («атиптичных» гладкомышечных клеток и ICC-LC) с вовлечением в сокращение большего количества лейомиоцитов, а возможно, за счет синхронизации сокращений разрозненных клеточных групп. Клинически такое состояние может проявляться в учащенных позывах на мочеиспускание, императивных позывах, а при слабости сфинктера мочевого пузыря - в эпизодах недержания мочи, что соответствует симптомокомплексу гиперактивности мочевого пузыря.
Выявленная взаимосвязь между изменениями, характерными для МС и дисфункцией мочевого пузыря, может быть полезной в разработке методов лечения расстройств мочеиспускания при данной патологии. □

Список литературы Влияние экспериментально вызванного метаболического синдрома на функциональное состояние мочевого пузыря у крыс
- Gorbachisky I, Akpinar H, Assimos DG. Metabolic syndrome and urological diseases.//Rev. Urol. 2010. Vol. 12, N 4. P. 157-180.
- Мудрая И.С., Ибрагимов А.Р., Кирпатовский В.И., Ревенко С.В., Несторов А.В., Гаврилов И.Ю. Оценка функцмионального состояния мочевого пузыря крыс методом Фурье-импедансной цистометрии.//Экспер. и клинич. урология. 2010. № 3. С. 21-27.
- Кирпатовский В.И., Кудрявцев Ю.В., Мудрая И.С., Белик С.М., Хромов Р.А. Гетерогенность морфологических и функциональных изменений разных отделов мочевого пузыря крыс при инфравезикальной обструкции мочевых путей.//Бюлл. экспер. биол. мед. 2009. Т. 147. № 1. С. 108-112.
- Vazquez-Prieto MA, Gonzalez RE, Renna NP, Galmarini CR, Miatello RM. Aqueous garlic extracts prevent oxidative stress and vascular remodeling in an experimental model of metabolic syndrome.//J Agric Food Chem. 2010. Vol. 58, N 11. P. 630-635.
- Kong X, Zhang DY, Wu H.B, Li FX. Losartan and pioglitazone ameliorate nephroathy in experimental metabolic syndrome rats.//Biol Pharm Bull. 2011. Vol. 34, N 5. P. 693-699.
- Vila L, Rebollo A, Adalsteisson GS, Alegre TM, Merlos M, Roglans N, Laguna JC. Reduction of liver fructokinase expression and improved hepatic inflammation and metabolism in liquid fructose-fed rats after atrovastatin treatment.//Toxicol Appl Pharmacol. 2011. Vol. 251, N 1. P. 32-40.
- Panchal SK, Poudyal H, Iyer A, Nazer R, Alam A, Diwan V, Kauter K, Sernia C, Campbell F, Ward L, Gobe G, Fenning A, Brown L. High-carbohydrate high-fat diet-induced metabolic syndrome and cardiovascular remodeling in rats.//J Cardiovasc Pharmacol. 2011. Vol. 57, N 1. P. 51-64.
- Dhibi L, Brahmi F, Mnari A, Houas Z, Charg I, Bchir L, Gazzah N, Alsaif MA, Hammami M. The intake of high fat diet with different trans-fatty acids levels differentially induces oxidative stress and non-alcoholic fatty liver disease (NAPLD) in rats.//Nutr Metab. 2011. Vol.8, N 1. P. 65.
- Hashitani H, Fukuta H, Takano H, Klemm M, Suzuki H. Origin and propagation of spontaneous excitation in smooth muscle of guinea pig urinary bladder.//J Physiol. 2001. Vol. 530. P. 273-286.
- Gillespie JL. The autonomous bladder: a view of the origin of bladder overactivity and sensory urge.//BJU Int. 2004. Vol. 93. P. 478-483.
- Almasri AM, Ratz PH, Bhatia H, Klausner AP, Speich JE. Rhythmic contraction generates adjustable passive stiffness in rabbit detrusor.//J Appl Physiol. 2010. Vol. 108. P. 544-553.
- Бурсиан А.В. Пейсмейкеры висцеральной системы.//Усп. Физиол. Наук. 2008. Т. 39. № 4. С. 3-13.
- Thornbury KD, Hollywood MA, McHale NG, Sergeant GP. Cajal Beyond the gut: interstitial cells in the urinary system -towards general regulatory mechanisms of smooth muscle contractility.//Acta Gastroenterol Belg. 2011. Vol. 74, N 4. P. 536-542.
- Нестеров А.В., Гаврилов И.Ю., Селектор Л.Я. и др. Фурье-анализ биоимпеданса пальца человека.//Бюлл. экспер. биол. мед. 2010. Т. 150, № 7. С. 31-37.
- Julien C. The enigma of Mayer waves: Facts and models.//Cardiovasc Res. 2006. Vol. 70, N 1. P. 12-21.
- Кирпатовский В.И., Мудрая И.С., Ревенко С.В., Нестеров А.В., Гаврилов И.Ю., Хромов Р.А., Баблумян А.Ю. Оценка интрамурального кровотока и нейрогенной регуляции в интактном и гипертрофированном мочевом пузыре крыс с помощью гармонического анализа биоимпеданса.//Бюлл. экспер. биол. мед. 2012 г. Т. 153, № 4. С. 422-427.
- Кирпатовский В.И., Фролова Е.В., Надточий О.Н. Спонтанная ритмическая активность органов мочевой системы: роль интерстициальных клеток, биологическая значимость, патофизиологические аспекты.//Экспер. и клинич. урология, 2012. № 2. C.70-77
- Shafik A, El-Sibai O, Shafik AA, Shafuk I. Identification of interstitial cells of Cajal in human urinary bladder: Concept of vesical pacemaker.//Urology. 2004. Vol. 64, N 4. P. 809-813.
- Hashitani H. Interaction between interstitial cells and smooth muscles in the lower uri-nary tract and penis.//J Physiol. 2006. Vol. 576, N 3. P. 707-714.
- Hashitani H, Lang RJ. Function of ICC-like cells in the urinary tract and male genital organs.//J Cell Mol Med. 2010. Vol. 14, N 6A. P. 1199-1211.
- McQoskey KD. Interstitial cells of Cajal in the urinary tract.//Handb Exp Pharmacol. 2011. Vol. 202. P. 233-254.
- Davidson RA, McCloskey KD. Morphology and localization of interstitial cells in the guinea pig bladder: structural relationship with smooth muscle and neurons.//J Urol. 2005. Vol. 173. P. 1385-1390.
- Johnston L, Carson C, Lyons AD, Davidson RA, McCloskey KD. Choliergic-induced Ca2+ signaling in interstitial cells of Cajal from the guinea pig bladder.//Amer J Physiol, Renal Physiol. 2008. Vol. 294, N 3. P. F645-F655.
- Min Y, He P, Wang Q, Jin X, Song B, Li L. The effect of c-kit blocker glivac on the contractile response of urinary bladder.//J Surg Res. 2011. Vol. 171, N 2. P. 193-199.
- Vahabi B, McKay NG, Lawson K, Sellers DJ. The role of c-kit positive interstitial cells in mediating phasic contractions of bladder strips from streptozotocin-induced diabetic rats.//BJU Int. 2011. Vol. 107, N 9. P. 1480-1487.


