Влияние экстремальных факторов высокогорья на ультраструктуру лейкоцитов крови крыс
Автор: Бектурганова Асель Орумбековна, Махмудова Жылдыз Акматовна, Аскалиева Нургуль Ракыевна, Ниязалиева Джамиля Карыпбековна, Таалайбекова Мээрим Таалайбековна
Журнал: Бюллетень науки и практики @bulletennauki
Рубрика: Биологические науки
Статья в выпуске: 5 т.9, 2023 года.
Бесплатный доступ
В работе представлены результаты исследования по изучению ультраструктуры клеток белой крови под влиянием факторов высокогорья в сочетании с холодом. Материалы и методы: 70 белых беспородных лабораторных крыс-самцов с массой тела 200-300 г; метод электронно-микроскопического исследования, статистические методы. Результаты исследования. Установлено, что у крыс при адаптации к условиям высокогорья в сочетании с воздействием холода идут резкие изменения ультраструктуры лейкоцитов. У экспериментальных животных на 3-и сутки наблюдения уровень объемной плотности митохондрий повышался почти в 2 раза в нейтрофилах, в 1,5 в эозинофилах и в 1,4 раза в моноцитах и средних лимфоцитах. С увеличением срока пребывания в высокогорье в сочетании с холодовым воздействием объемная плотность митохондрий продолжала возрастать во всех видах клеток белой крови, и на 30-е сутки адаптации оставалась статистически значимо выше и в сравнении с контролем, и в сравнении с показателями группы животных на 3-и сутки адаптации. Объемная плотность рибосом также статистически значимо возрастала на 3-и сутки адаптации к высокогорью в сочетании с холодом в нейтрофилах, эозинофилах и лимфоцитах, и продолжала увеличиваться к 30-м суткам наблюдения. Тенденция к увеличению объемной плотности была отмечена и у вакуолей клеток: на 3-и сутки адаптации было зафиксировано возрастание показателя объемной плотности вакуолей по сравнению с контролем у нейтрофилов. К 30-му дню адаптации объемная плотность вакуолей по сравнению с животными на 3-й день адаптации статистически значимо снижалась, хотя так и не достигала показателей животных контрольной группы. Объемная плотность специфических гранил на 3-и сутки пребывания в горах в нейтрофилах и эозинофилах снизилась почти на 100%.
Ультраструктура клетки, физиологическая адаптация, горы, холод
Короткий адрес: https://sciup.org/14127974
IDR: 14127974 | УДК: 599.323.41 | DOI: 10.33619/2414-2948/90/10
Текст научной статьи Влияние экстремальных факторов высокогорья на ультраструктуру лейкоцитов крови крыс
Бюллетень науки и практики / Bulletin of Science and Practice
Как известно, при изучении проблемы формирования биоадаптаций необходимо базироваться не только на основе различных данных эколого-физиологических аспектов приспособительных реакций, но и учитывать морфологические признаки формирования адаптивных процессов в организме. Реакция организма на действие раздражителей, как правило, сопровождается достаточно выраженными морфологическими и физикохимическими изменениями в тканях, возникающих под воздействием экстремальных факторов внешней среды. Среди множества разнообразных факторов внешней среды одним из наиболее значимых с точки зрения эколого-физиологического воздействия, является холод. Температура воздуха оказывает огромное влияние на жизненно-важные функции организма, такие как обмен веществ, терморегуляция, дыхание, кровообращение и др. [1–4].
Цель исследования — изучение динамики изменений морфологических показателей ультраструктуры клетки белой крови у экспериментальных животных при адаптации к высокогорью в сочетании с воздействием холода.
При проведении экспериментального исследования было использовано 50 белых беспородных лабораторных крыс-самцов с массой тела 200–300 г.
-
1 группа (контроль) — 30 крыс-самцов, которые находились в низкогорье (г. Бишкек) в те же сроки (исходные данные, 3 и 30 сутки).
-
2 группа — крысы, пребывающие в высокогорье 3 суток в сочетании с холодовым воздействием;
-
3 группа — крысы, пребывающие в высокогорье 30 суток в сочетании с холодовым воздействием.
Первый этап эксперимента (контрольная группа) проводился в весеннее время в условиях низкогорья в г. Бишкек. Холодовое воздействие моделировали следующим образом: экспериментальные животные на время эксперимента содержались в помещении при температуре 4–6°С в металлических клетках с небольшим количеством подстилки из опилок. Корм и вода давались им в избытке. Вторая и третья серии эксперимента проводились в условиях пребывания животных на высокогорной базе Туя-Ашу в осеннее время в не термостатированных помещениях вивария при температурах 4–6°С в течение 30 дней. Доступ к корму и воде не ограничивался. Забор крови осуществлялся на 3 и 30 сутки пребывания в низкогорье и высокогорье.
Для электронно-микроскопического исследования использовали свежую кровь, стабилизированную гепарином, которую центрифугировали при 1000 об/мин в течение 10 минут. Выделенная лейкоцитарная пленка обрабатывалась по общепринятой методике. Фиксацию материала производили немедленно, 2,5% глутаральдегидом на буфере Миллонинга, дофиксацию проводили с использованием 1% раствора тетраоксида осмия (все используемые реактивы фирмы Sigma, США). После обезвоживания препараты заливали в эпон (Fluka, Швейцария) по общепринятой методике [5–7].
Срезы, приготовленные на ультратоме, после контрастирования 2% водным раствором уранилацетата натрия или цитратом свинца, приготовленным по Reinolds [8] просматривались с помощью трансмиссионного электронного микроскопа ПЭМ-100 (JEOL, Япония, 2007). Морфометрический анализ ультраструктуры лейкоцитов проводили по Э. Р. Вейбелю [9–11].
Полученные данные обрабатывались при помощи персонального компьютера с использованием табличного редактора Excel 2016 с помощью пакетов прикладных программ Statistica 6.0.
Статистическую значимость (достоверность) различий по количественным переменным определяли путем вычисления t-критерия Стьюдента при параметрическом распределении данных. Изменения считались статистически значимыми (достоверными) при P<0,05 [12–14].
Результаты и обсуждение
Результаты морфологического исследования лейкоцитов в условиях высокогорья в сочетании с холодом отражены в Таблице.
Ранее было показано, что у крыс при адаптации к условиям высокогорья показатели объемной плотности митохондрий к третьему дню адаптации значимо увеличивались в нейтрофилах, моноцитах и эозинофилах [15].
Таблица
МОРФОМЕТРИЧЕСКИЕ ПОКАЗАТЕЛИ УЛЬТРАСТРУКТУРЫ КЛЕТОК КРОВИ КРЫС ПРИ АДАПТАЦИИ К УСЛОВИЯМ ВЫСОКОГОРЬЯ В СОЧЕТАНИИ
С ХОЛОДОМ ПРИ t +4°С (M±m, объемная плотность в %)
|
Показатели |
Контрольная группа 1 г |
Сроки адаптации к высокогорью |
|
|
руппа (3 сутки) |
2 группа (30 сутки) |
||
|
Нейтрофилы |
|||
|
Митохондрии |
0,6±0,01 |
1,2±0,01* |
1,7±0,01**# |
|
Рибосомы |
0,9±0,01 |
1,6±0,01* |
2,6±0,01**# |
|
Вакуоли |
0,4±0,01 |
4,3±0,01* |
1,4±0,01**# |
|
Лизосомы |
7,1±0,01 |
8,9±0,01* |
9,6±0,01**# |
|
Спец. гранулы |
21,3±0,01 |
13,1±0,2* |
21,2±0,4# |
|
Эозинофилы |
|||
|
Митохондрии |
1,1±0,01 |
1,6±0,01* |
1,9±0,01**# |
|
Рибосомы |
1,3±0,01 |
1,3±0,01* |
2,9±0,01**# |
|
Вакуоли |
0,3±0,01 |
1,7±0,01* |
0,8±0,01**# |
|
Спец. гранулы |
21±0,3 |
10,0±0,3* |
21,0±0,4# |
|
Моноциты |
|||
|
Митохондрии |
2,6±0,01 |
3,6±0,3* |
5,2±0,2**# |
|
Рибосомы |
2,3±0,01 |
2,8±0,1* |
4,6±0,4**# |
|
Вакуоли |
0,6±0,01 |
1,3±0,02* |
0,8±0,01**# |
|
Лизосомы |
12,1±1,7 |
14,0±0,2* |
17±0,03**# |
|
Средние лимфоциты |
|||
|
Митохондрии |
1,9±0,01 |
2,8±0,01* |
4,7±0,02**# |
|
Рибосомы |
1,6±0,01 |
1,6±0,04 |
5,2±0,01**# |
|
Вакуоли |
0,4±0,01 |
1,2±0,01* |
0,6±0,01**# |
|
Лизосомы |
0,9±0,02 |
0,7±0,01* |
0,9±0,01# |
|
Примечание: * — |
р < 0,05 при сравнении 1 группы с |
контролем; ** — |
р < 0,05 при сравнении |
2 группы с контролем; # — р < 0,05 при сравнении 2 группы с 1 группой.
Такая же тенденция наблюдалась и у крыс при адаптации к условиям высокогорья с сочетанием холодом: на 3 сутки уровень объемной плотности митохондрий повышался почти в 2 раза в нейтрофилах, в 1,5 в эозинофилах и в 1,4 раза в моноцитах и средних лимфоцитах. С увеличением срока пребывания в высокогорье в сочетании с холодовым воздействием объемная плотность митохондрий продолжала возрастать во всех видах клеток белой крови, и на 30-е сутки адаптации была статистически значимо выше и в сравнении с контролем, и в сравнении с показателями группы животных на 3 сутки адаптации. Эти данные еще раз подчеркивают важнейшую роль митохондрий, как одного из основных регуляторов энергетического обмена в ответе организма на действие стрессовых факторов.
Анализ показателей морфометрии клеток белой крови выявил также статистически значимое увеличение объемной плотности рибосом на 3 сутки адаптации к высокогорью в сочетании с холодом в нейтрофилах, эозинофилах и лимфоцитах (Рисунок 1).
Так, показатели объемной плотности рибосом возросли от 0,9±0,014 до 1,6±0,017 (р < 0,01) в нейтрофилах и от 2,3±0,011 до 2,8±0,1 (р < 0,05) в моноцитах. Причем, на 30 сутки адаптации к высокогорной гипоксии в сочетании с воздействием холода, объемная плотность рибосом продолжал возрастать: в нейтрофилах с 0,9±0,014 до 2,6±0,017 (р < 0,001), в эозинофилах от 1,3±0,014 до 2,9±0,011 (р < 0,01), в моноцитах от 2,3±0,011 до 4,6±0,4 (р < 0,01), в лимфоцитах от 1,6±0,011 до 5,2±0,01 (р < 0,001).
Такая же тенденция к увеличению объемной плотности была отмечена и у вакуолей клеток (Рисунок 2).
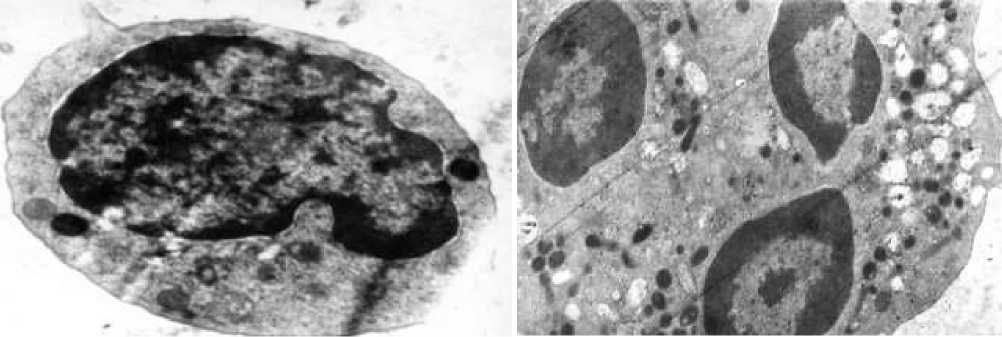
Рисунок 1. Средний лимфоцит крысы на 30 сутки адаптации в сочетании с холодом. В цитоплазме видны митохондрии и большое количество рибосом. Ядро с конденсированным и диффузным хроматином. Ув. ×10000
Рисунок 2. Нейтрофильный лейкоцит крысы на 3 сутки адаптации к условиям высокогорья в сочетании с холодом. В цитоплазме среди первичных и вторичных гранул видны многочисленные электроннопрозрачные вакуоли. Ув. ×20000
В этом случае на 3 сутки адаптации было зафиксировано возрастание показателя объемной плотности вакуолей по сравнению с контролем у нейтрофилов с 0,4±0,013 до 4,6±0,011 при р <0,05, в эозинофилах — с 0,3±0,011 до1,3±0,011 при р <0,05, в моноцитах с 0,6±0,013 до 0,9±0,011 при р <0,05. Повышение объемной плотности вакуолей объясняется тем, что идет процесс увеличения деления клеток и в связи с этим идет увеличение снабжения клеточной мембраны липидами, высвобождение различных соединений из клетки. Это могут быть гормоны или нейромедиаторы, белки и другие макромолекулы. К 30 дню адаптации объемная плотность вакуолей по сравнению с животными на 3 день адаптации статистически значимо снижалась, хотя так и не достигала показателей животных контрольной группы.
Динамика морфометрических показателей лизосом была следующей: в нейтрофилах и моноцитах объемная плотность лизосом к 3 суткам увеличивалась и продолжала возрастать к 30 суткам адаптации. В лимфоцитах этот показатель к 3 дню адаптации уменьшился с 0,9±0,017 до 0,8±0,014 при р <0,05, а к 30 дню адаптации сравнялся с показателями животных контрольной группы.
Особенно выраженные изменения при адаптации к условиям высокогорья в сочетании холодом были выявлены в отношении специфических гранул. Так, на 3 сутки наблюдения объемная плотность специфических гранул нейтрофилов по сравнению с контролем снизилась почти на 100% — с 21,3±0,014 до 13,1±0,2 при р <0,001, а у эозинофилов от 21±0,3 до 10,0±0,3 при р <0,001. Как известно, специфические гранулы содержат белки, которые обладают бактерицидным свойством.
Также в специфических гранулах содержится фермент NADPH-оксидаза. Этот фермент регулирует образование активных форм кислорода, за счет которых и реализуется бактерицидная функция специфических гранул. Снижение объемной плотности специфических гранул свидетельствует о значительном снижении сопротивляемости организма в период аварийной адаптации к гипоксии и холоду. К 30 суткам пребывания в условиях высокогорья в сочетании с холодом показатель объемной плотности специфических гранул в нейтрофилах и эозинофилах практически сравнялся с показателями животных контрольной группы.
Результаты проведенных исследований позволяют заключить, что морфологическим отражением функциональной активности клеток белой крови под воздействием факторов высокогорья в сочетании с холодовым воздействием являются повышение объемной плотности митохондрий, рибосом и вакуолей и снижение объемной плотности специфических гранул.
Список литературы Влияние экстремальных факторов высокогорья на ультраструктуру лейкоцитов крови крыс
- Colguhoun C. M. Introversion - extroversion and the adaptation of the body-temperature rhythm to high work // 5-th International Symposium on high and shift work (Rouen, 12-16 may, 1980). Chronobiologia, vol. VII, July-September 1980. Р. 428.
- Власов Ю. А. Кровообращение и газообмен человека. Новосибирск, 1983. 208 с.
- Агаджанян А. Адаптация человека к условиям Арктического Заполярья. М., 1994. 156 с.
- Казначеев В. П. Клинические аспекты полярной медицины. М.: Медицина, 1986. 208 с.
- Карупу В. Я. Электронная микроскопия. Киев: Вища школа, 1984. 208 с.
- Юрина Н. А. Гистология. М.: Медицина, 1995. 256 с.
- Мавликеев М. О. Краткий курс гистологической техники. Казань, 2020. 107 с.
- Уикли Б. Электронная микроскопия для начинающих. М.: Мир, 1975. 326 с.
- Ташке К. Введение в количественную цито-гистологическую морфологию. Бухарест, 1980. 192 с.
- Wu D. X. Lung lesions in experimental hydrostatic pulmonary edema: an electron microscopic and morphometric study // Exp. Lung Res. 1995. V. 21. №5. P. 711-730.
- Вейбель Э. Р. Морфометрия легких человека. М.: Медицина, 1970. 170 с.
- Реброва О. Ю. Статистический анализ медицинских данных. Применение пакета прикладных программ STATISTICA. М., Медиасфера. 2006. 312 с.
- Боровиков В. П. STATISTICA. Искусство анализа данных на компьютере: Для профессионалов. СПб.: Питер, 2003. С. 146-184.
- Гублер Е. В. Вычислительные методы анализа и распознавания патологических процессов. Л., 1978. 296 с.
- Бектурганова А. О. Морфофункциональное состояние лейкоцитов при кратковременной адаптации животных к климатогеографическим условиям высокогорья // Академический журнал Западной Сибири. 2023. Т. 19. №1. С. 49-52.


