Влияние электрофизиологических механизмов развития фибрилляции предсердий на объем оперативного вмешательства
Автор: Татарский Роман Борисович, Родионов Владимир Александрович, Егай Юрий Владимирович, Борисова Елена Вячеславовна, Баталов Роман Ефимович, Попов Сергей Валентинович, Лебедев Дмитрий Сергеевич
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 1 т.30, 2015 года.
Бесплатный доступ
Цель исследования: оценка эффективности различных подходов оперативного лечения фибрилляции предсердий (ФП) в зависимости от электрофизиологических механизмов. Обследовано 423 пациента с различными формами ФП, медикаментозно резистентных к антиаритмической терапии. Всем пациентам проводилось внутрисер-дечное электрофизиологическое исследование сердца (ВСЭФИ). В зависимости от электрофизиологических форм ФП выбран тип оперативного лечения для каждого пациента. Электрофизиологическое выявление формы Фп позволяет разделить подходы катетерного лечения. В основе катетерного лечения фокусной формы ФП лежит радиочастотная изоляция аритмогенной области. В случае выявления участков замедления (аритмогенных зон) в миокарде левого предсердия, способствующих развитию механизма повторного входа, необходимо проведение дополнительной дефрагментации этого участка.
Фибрилляция предсердий, катетерное лечение, электрофизиологическое исследование
Короткий адрес: https://sciup.org/14920003
IDR: 14920003 | УДК: 616.125.2
Текст научной статьи Влияние электрофизиологических механизмов развития фибрилляции предсердий на объем оперативного вмешательства
В последние десятилетия бурно развивается инвазивная аритмология. Фибрилляция предсердий (ФП) – наиболее распространенная суправентрикулярная аритмия. Клинически обосновано деление на впервые выявленную, пароксизмальную, персистирующую, длительно персистирующую, перманентную формы ФП [1].
В патофизиологическом плане известно несколько электрофизиологических механизмов ФП. Эктопическая или фокальная активность, лежащая в основе как развития, так и поддержания ФП. По данным ряда исследователей [2–4], участки повышенной спонтанной деполяризации найдены в области муфт легочных вен (ЛВ) [5], задней стенки левого предсердия (ЛП), овальной ямки, коронарного синуса, связки Маршала [6, 7], устья верхней полой вены. Множественные волны ре-ентри, локализованные как в левом (ЛП), так и правом предсердии (ПП), функционируют одновременно и играют основную роль в поддержании ФП [8, 9].
Большую роль в ФП играет миокард ЛП, который обладает способностью к развитию ре-ентри, фокусной, автоматической активности и является источником индукции ФП в 95% случаев [10, 11]. Особенность строения муфты заключается в наличии клеток, обладающих пей-смекерной активностью, и клеток проводящей системы, которые были отделены от миокарда в процессе онтогенеза [12]. Группой Haissaguerre еt al. [13] внедрена в практику катетерная изоляция ЛВ у пациентов с пароксизмальной формой ФП. Эта технология позволила с высокой эффективностью элиминировать ФП, что подтвердило большой вклад ЛВ в развитие данного нарушения ритма сердца. Рецидивы пароксизмов в послеоперационном периоде, как раннем, так и позднем, были ассоциированы с восстановлением проведения аблационных линий. Несмотря на высокую эффективность лечения пароксизмальных форм методом радиочастотной изоляции ЛВ, нельзя применить данный подход для сочетанных патофизиологических механизмов развития нарушения ритма. Как правило, этот электрофизиологический феномен встречается у пациентов с длительно существующей ФП.
Это связано прежде всего с ремоделированием миокарда предсердий и формированием аритмогенного субстрата. Катетерное лечение ФП у пациентов должно быть направлено на уменьшение критической массы миокарда и изоляции фокусной активности.
Цель работы: оценить эффективность различных подходов оперативного лечения ФП в зависимости от электрофизиологических механизмов.
Материал и методы
В исследование включено 423 пациента. Пароксизмальной формой ФП страдали 302 пациента (71,4%); 121 пациент с персистирующей формой ФП (28,6%), резистентной к медикаментозному лечению к 2–3 препаратам I–III класса. Всем пациентам планировалось проведение катетерного лечения ФП. В основе деления на группы были результаты проведения ВСЭФИ с использованием стандартного протокола стимуляции предсердий и желудочков. В случае выявлении фокусной активности ЛВ в виде залповой экстрасистолии без развития устойчивого пароксизма ФП пациенты были отнесены к 1-й группе, в случае развития развернутого пароксизма ФП – ко 2-й группе. Пациенты с длительно персистирующей формой ФП были рандомизированы во 2-ю группу. 1-я группа включала 219 пациентов (133 женщины, 86 мужчин), в основе электрофизиологического механизма ФП была подтверждена фокусная активность ЛВ в виде залповой экстрасистолии без развития устойчивого пароксизма ФП. Этиологическими факторами, приводящими к развитию нарушения ритма сердца, в данной группе пациентов были: ишемическая болезнь сердца (ИБС) – у 43 (19,3%), гипертоническая болезнь (ГБ) – у 80 (36,5%), миокардитический кардиосклероз (МКС) – у 41 (18,7%), идиопатическое нарушение ритма сердца (ИНРС) – у 55 (25,1%) пациентов. Этой группе пациентов методом оперативного лечения была выбрана остиальная изоляция ЛВ, а в случае выявления фокусов активности в миокарде предсердий наносились дополнительные воздействия на участки заинтересованного миокарда (рис. 1). При нали-
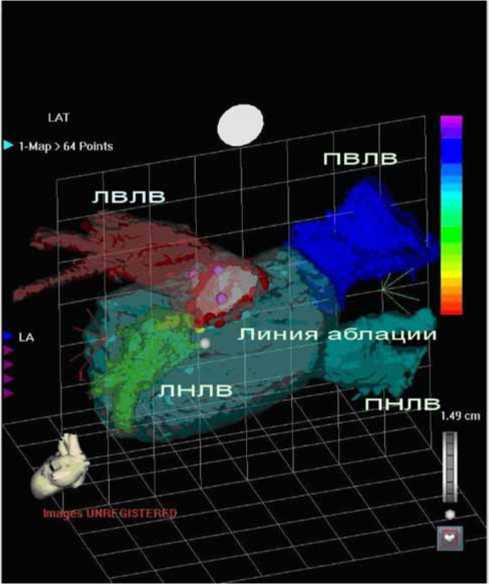
Рис. 1. ЭФИ-реконструкция ЛП, совмещенная с КТ-реконструкцией. Циркулярная изоляция левой верхней ЛВ. Линия аблации представлена красной линией вокруг ЛВЛВ. Примечание: ЛВЛВ – левая верхняя легочная вена, ЛНЛВ – левая нижняя легочная вена, ПВЛВ – правая верхняя легочная вена, ПНЛВ – правая нижняя легочная вена чии у пациентов типичного трепетания предсердий дополнительно проводилась аблация каватрикуспидально-го перешейка.
Во 2-ю группу вошли 204 пациента (129 женщин, 75 мужчин), не выявлено структурного поражения у 32 (15,6%), ИБС – 43 (21,0%), ГБ – 86 (41,1%), МКС – 43 (21,0%). В данной группе в основе поддержания ФП играл роль аритмогенный субстрат, способствующий развитию механизма повторного входа волны возбуждения, а также триггерная активность ЛВ, выступающая в роли индуктора ФП. Пациентам данной группы выполнялся расширенный объем оперативного вмешательства в виде изоляции задней стенки ЛП и линейной изоляции ЛВ (табл. 1).
Критерии исключения: острые воспалительные заболевания, тяжелая сердечная недостаточность ФК III, IV (по классификации NYHA), острый инфаркт миокарда, перенесенный менее 2 мес. назад, тромботические наложения в полостях сердца, стенозирующий атеросклероз коронарных артерий без реваскуляризации, тиреотоксикоз, сахарный диабет, ревматическая болезнь сердца.
Предоперационное обследование включало: общеклинические методы исследования, проведение трансторакальной и чреспищеводной эхокардиографии (ЭхоКГ, ЧПЭхоКГ), суточного мониторирования ЭКГ (СМЭКГ), контрастную спиральную компьютерную томографию (СКТ) с анатомической реконструкцией ЛП, коронаро-ангиографию и ядерно-магнитный резонанс, а также
Таблица 1
Характеристика пациентов
По результатам СКТ средний объем ЛП составил 135±10,3 см3. Перед операцией за 3–4 дня пациентам отменяли варфарин с назначением низкомолекулярного гепарина в профилактической дозе. Для проведения ВСЭФИ использовался бедренный доступ с установкой катетеров в коронарный синус, синоатриальную область правого предсердия. С использованием ЧПЭхоКГ выполнялась транссептальная пункция, и устанавливался один интродъюсер в полость ЛП. Через интродъюсер проводили 20-полюсной катетер Lasso (Biosens–Webster), также транссептально проводился орошаемый аблационный катетер NaviStar ThermoCool (Biosens–Webster) с целью электрофизиологической реконструкции ЛП с использованием навигационной системы нефлюороскопического электрофизиологического картирования. После проведения транссептальной пункции всем пациентам проводилась инфузия гепарина с достижением целевого уровня активированного времени свертывания (250–300 с) с последующим послеоперационным назначением вар-фарина до достижения цифр международного нормализованного отношения 2,5–3,0.
Радиочастотное воздействие выполнялось в области передней стенки ЛП при параметрах 43 °С, 35 Вт и в области задней стенки при параметрах 43 °С, 30 Вт со скоростью орошения 17 мл/мин.
Всем пациентам после операции назначался анти-аритмический препарат III класса (амиодарон) на 6 недель и непрямой пероральный антикоагулянт. Послеоперационный период наблюдения за пациентами составил 8,2±2,3 мес. Эффективность лечения определялась при помощи СМЭКГ, оценки клинических проявлений ФП, плановых визитов в клинику.
Статистическая обработка данных осуществлялась при помощи пакета статистических программ Statistica 10 (StatSoft Inc., version 10.0.228.8, Oklahoma, USA) с использованием непараметрических математических критериев – U-критерия Манна–Уитни, критерия Вилкоксо-на парных сравнений, t-критерия Стьюдента (с уровнем значимости 5%) для парных и непарных величин. Значения р<0,05 принимались статистически значимыми.
Результаты
В 1-й группе выявлено статистически значимое увеличение количества пациентов с неопределенной этиологией заболевания 55 (25,1%) против 32 (15,6%), р=0,02, также отмечена тенденция к более молодому возрасту, в то время как во 2-й группе отмечено повышение количества больных, в нозологии которых преобладала ГБ – 86 (41,1%) к 80 (36,5%); р=0,05.
По данным наблюдения, в 1-й группе у 159 (72,60%) пациентов отсутствовали рецидивы ФП, у 12 (5,4%) больных документированы короткие, гемодинамически незначимые, мало- или асимптомные пароксизмы ФП, поэтому при наличии показаний пациенты продолжили принимать антиаритмический препарат и/или варфарин. Повторное проведение оперативного лечения потребовалось у 48 (21,9%) пациентов с устойчивыми рецидивами ФП. Перед проведением аблации выполнено ВСЭФИ. Выявлено восстановление проведения в области ранее изолированных вен у 31 (64,58%), определен анатомический субстрат с зонами замедленного проведения у 17 (35,4%), что потребовало повторной катетерной изоляции задней стенки ЛП и сегментарной дефрагментации фокусной активности (рис. 2).
Во 2-й группе эффективность катетерного устране-
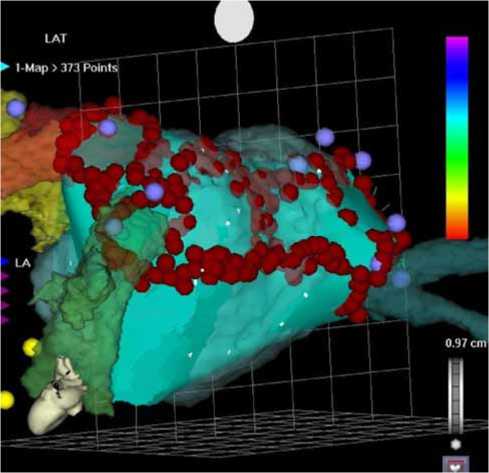
Рис. 2. ЭФИ-реконструкция ЛП, совмещенная с КТ-реконструкцией ЛП. Ход оперативного вмешательства, изоляция верхней левой ЛВ. Линейная изоляция представлена красной линией, выполненной из точек воздействия задней стенки ЛП и устьев ЛВ
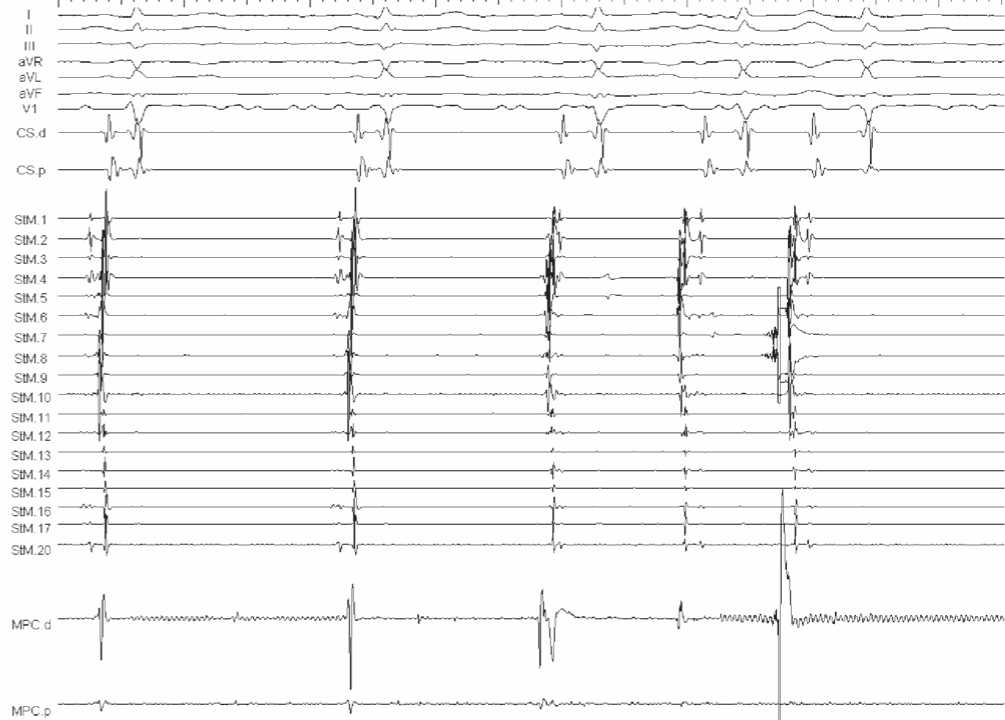
Рис. 3. Фрагмент ВСЭФИ до выполнения РЧА. Восстановление проведения в области ранее изолированного участка ЛП – ЛВ. Показан предсердный захват активностью из ЛВ
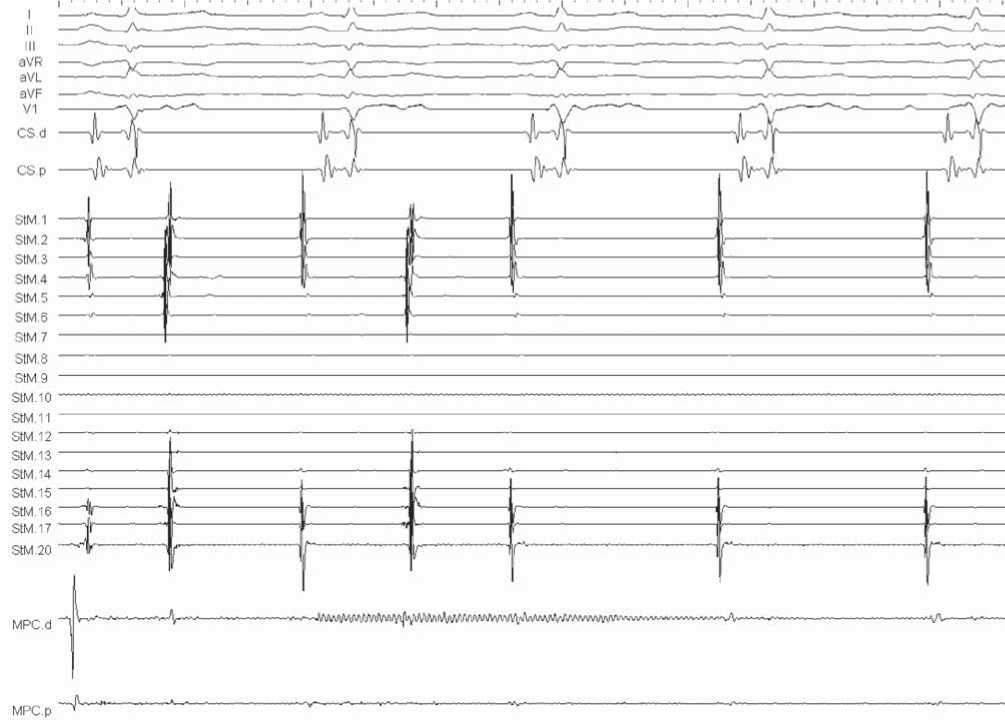
Рис. 4. Фрагмент ВСЭФИ после выполнения РЧА. Повторное изолирование ЛВ. Показано разобщение активности предсердия и ЛВ
ния была достигнута у 158 (77,4%) пациентов, продолжено антиаритмическое лечение в 10 (4,9%) случаях ввиду эффективности принимаемых препаратов [14]. Повторное проведение оперативного лечения потребовалось 35 (17,1%) больным в связи с частыми пароксизмами ФП. Проведена изоляция ЛВ в зонах прорыва проведения, а также дополнительные линии аблации по задней стенке ЛП. Одному пациенту оперативное лечение не проводилось из-за обострения соматической патологии (рис. 3, 4).
Обсуждение
В настоящее время не разработаны “идеальные” подходы к катетерному лечению ФП [14, 15, 16]. Сообщается о достаточно высокой эффективности тех либо иных методик РЧА данного нарушения ритма сердца. Различия в электрофизиологических формах вынуждают исследователей выбирать тип оперативного лечения для каждого пациента, и в последние годы становится ясно, что к катетерному лечению нельзя подходить стандартизован-но. “Фокусная” ФП, как правило, диагностируется пароксизмальной формой, без структурного поражения сердца, и в данном случае целесообразно проведение “щадящей” изоляции ЛВ. Пациентам с длительно персисти- рующей ФП, ассоциированной с предсердным ремоделированием, которое, в свою очередь, взаимосвязано с формированием аритмогенного субстрата, возникает необходимость комбинировать подходы лечения. Поэтому в группе пациентов со сформированным аритмоген-ным субстратом показано проведение изоляции ЛВ, задней стенки ЛП, а при необходимости расширение воздействия с включением зон миокарда, заинтересованных в поддержании ФП. В представленной нами работе получена высокая эффективность лечения нарушения ритма сердца после проведения первичного вмешательства (72,6% пациентов в 1-й группе и 77,4% – во 2-й), что не отличается от результатов в мировой практике [17]. Нельзя не отметить и то, что проведение катетерного лечения ФП приводит не только к устранению данного нарушения ритма сердца, но и к повышению качества жизни у пациентов, подвергшихся данной процедуре [18]. В группах не было выявлено достоверной разницы эффективности лечения (p>0,05), таблица 2. Объем оперативного лечения существенно изменялся, как логично предположить, повышение объема операции приводит к повышению послеоперационного риска осложнений [19, 20]. Конечно, повышение опыта хирурга, применение антикоагулянтов, уменьшение радиочастотной энергии в уязвимых местах миокарда предсердий существенно снижа-
Таблица 2
Эффективность проведенного оперативного лечения
Выводы
Электрофизиологическое выявление формы ФП позволяет разделить подходы катетерного лечения. В основе катетерного лечения фокусной формы ФП лежит радиочастотная изоляция аритмогенной области. В случае выявления участков замедления (аритмогенных зон) в миокарде ЛП, способствующих развитию механизма повторного входа, необходимо проведение дополнительной дефрагментации этого участка. Дифференцированные подходы катетерного лечения, основанные на электрофизиологических особенностях ФП, приводят к высокой эффективности лечения без достоверных различий между группами пациентов, сокращению времени операции, уменьшению соложений, а также играют важную роль в уменьшении объема повреждения.
Список литературы Влияние электрофизиологических механизмов развития фибрилляции предсердий на объем оперативного вмешательства
- Camm A.J., Kirchhof P., Lip G.Y.H. et al. EHRA/EACTS/ESC 2010 Guidelines for the management of fibrillation//Eur. Heart J. -2010. -Vol. 10. -P. 1093.
- Haissaguerre M., Marcus F.I., Fischer B. et al. Radiofrequency catheter ablation in unusual mechanisms of atrial fibrillation: report of three cases//J. Cardiovasc. Electrophysiol. -1994. -Vol. 5. -P. 743-751.
- Jais P., Haissaguerre M., Shah D.C. et al. A focal source of atrial fibrillation treated by discrete radiofrequency ablation//Circulation. -1997. -Vol. 95. -P. 572-576.
- Haissaguerre M., Jais P., Shah D.C. et al. Spontaneous initiation of atrial fibrillation by ectopic beats originating in the pulmonary veins//N. Engl. J. Med. -1998. -Vol. 339. -P. 659-666.
- Scheinman M.M., Morady F. Nonfarmacological approaches to atrial fibrillation//Circulation. -2001. -Vol. 103. -P. 2120-2125.
- Lee S.H., Tai C.T., Hsieh M.H. et al. Predictors of non-pulmonary vein ectopic beats initiating paroxysmal atrial fibrillation: implication for catheter ablation//J. Am. Coll. Cardiol. -2005. -Vol. 46. -P. 1054-1059.
- Shah D., Haissaguerre M., Jais P., Hocini M. Nonpulmonary vein foci: do they exist?//Pacing Clin. Electrophysiol. -2003. -Vol. 26(7 Pt 2). -P. 1631-1635.
- Moe G.K., Rheinboldt W.D., Abildskov J.A. A computer model of atrial fibrillation//Am. Heart J. -1964. -P. 200-220.
- Allessie M.A. et al. Experimental evaluation of moe’s multiple wavelet hypothesis of atrial fibrillation//Cardiac Electrophysiology and Arrhythmias/Zipes D.P., Jalife J. (eds.). -New York: Grune & Stratton, 1985.
- Кantachuvessiri A. et al. Pulmonary veins: Preferred site for catheter ablation of atrial fibrillation//Heart and lung. -2002. -Vol. 3. -P. 271-278.
- Chen S.A., Hsieh M.N., Tai T.C. et al. Initiation of atrial fibrillationby ectopic beats originating from the pulmonary veins//Circulation. -1999. -Vol. 100. -P. 1879-1866.
- Weiss C., Gocht A., Willems S. et al. Impact of the distribution and structure of myocardium in the pulmonary veins for radiofrequency ablation of atrial fibrillation//Pacing Clin. Electrophysiol. -2002. -Vol. 25. -P. 1352-1356.
- Haissaguerre M., Jais P., Shah D.C. et al. Right and left atrial radiofrequency catheter therapy of paroxysmal atrial fibrillation//J. Cardiovasc. Electrophysiol. -1996. -Vol. 7. -P. 1132-1144.
- Антонченко И.В., Татарский Б.А., Родионов В.А. и др. Использование Омега-3 полиненасыщенных жирных кислот при лечении пароксизмальных фибрилляций предсердий//Вестник аритмологии. -2009. -№ 53. -С. 5-11.
- Terasawa T., Balk E.M., Chung M. et al. Systematic review: comparative effectiveness of radiofrequency catheter ablation for atrial fibrillation//Ann. Intern. Med. -2009. -Vol. 151(3). -P. 191-202.
- O’Neill M.D., Jais P., Hocini M. et al. Catheter ablation for atrial fibrillation//Circulation. -2007. -Vol. 116(13). -P. 1515-1523.
- Ouyang F., Bansch D., Ernst S. et al. Complete isolation of left atrium surfrounding the pulmonary veins: new insights from the double-Lasso technique in paroxysmal atrial fibrillation//Circulation. -2004. -Vol. 110(15). -P. 2090-2096.
- Krittayaphong R., Raungrattanaamporn O., Bhuripanyo K. et al. A randomized clinical trial of the efficacy of radiofrequency catheter ablation and amiodarone in the treatment of symptomatic atrial fibrillation//J. Med. Assoc. Thai. -2003. -Vol. 86, suppl 1. -P. S8-16.
- Бшарат Х.А., Баталов Р.Е., Савенкова Г.М. и др. Качество жизни после радиочастотной операции “Maze” у пациентов с фибрилляцией предсердий//Сибирский медицинский журнал (Томск). -2007. -Т. 22(1). -С. 92-96.
- Eick O., Gerritse B., Schumacher B. Popping phenomena in temperature-controlled radiofrequency ablation: when and why do they occur?//Pacing Clin. Electrophysiol. -2000. -Vol. 23(2). -P. 253-258.
- Bunch T., Asirvatham S., Friedman P. et al. Outcomes after cardiac perforation during radiofrequency ablation of the atrium//J. Cardiovasc. Electrophysiol. -2005. -Vol. 16(11). -P. 1172-1179.


