Влияние эндокардиальной процедуры “лабиринт” у пациентов с фибрилляцией предсердий на динамику показателей системы протеолиза внеклеточного матрикса и факторов роста
Автор: Баталов Роман Ефимович, Хлынин Михаил Сергеевич, Усенков Станислав Юрьевич, Гусакова Анна Михайловна, Суслова Татьяна Евгеньевна, Попов Сергей Валентинович
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Клинические исследования
Статья в выпуске: 3 т.30, 2015 года.
Бесплатный доступ
Цель: определить влияние интервенционного вмешательства по поводу фибрилляции предсердий (ФП) на динамику протеолиза внеклеточного матрикса. Материал и методы. В исследование вошли 50 пациентов с персистирующей - 27 (18 мужчин), средний возраст 62,1±9,4 лет и длительно-персистирующей - 23 (14 мужчин), средний возраст 64±11 лет формами ФП, с наличием показаний для проведения интервенционного лечения аритмии. Выполнена радиочастотная антральная изоляция легочных вен, задней стенки левого предсердия (ЛП), левого истмуса сердца с использованием системы CARTO (Biosense Webster, США). Определяли динамику показателей системы протеолиза внеклеточного матрикса и факторов роста в сыворотке крови - матриксных металлопротеиназ (ММП) -1, -3, -9, тканевого фактора роста-β1 (TGF-β1), тканевого ингибитора матриксных металлопротеиназ (ТИМП-1), фактора роста фибробластов (FGF), до процедуры “Лабиринт”, непосредственно после нее, через одни сутки, через 3 и 6 мес. Результаты. Концентрация всех матриксных металлопротеиназ непосредственно после процедуры резко снижалась, что, скорее всего, связано со значительным и объемным термическим поражением ЛП. Через сутки концентрация ММП-1 имела тенденцию к восстановлению, в то время как ММП-3 сохранялась на предыдущем уровне, а ММП-9 резко возрастала до уровня, превышающего таковой до вмешательства. По истечению 3 мес. наблюдения концентрация ММП-1 и -3 практически возвращалась к исходной, а ММП-9 резко снижалась до уровня, имеющегося непосредственно после процедуры. Через полгода наблюдения концентрация ММП-1 имела тенденцию к снижению, и была ниже исходного уровня, уровень ММП-3 также не достиг исходного, в то время как концентрация ММП-9 вернулась к исходной точке. Концентрация тканевого фактора роста-β1 также резко снижалась непосредственно сразу после процедуры, с медленным восстановлением к 6-му мес. наблюдения, чего нельзя сказать о факторе роста фибробластов. Так, сразу после процедуры его концентрация снижалась, что можно объяснить массовой гибелью клеток в миокарде предсердий. Через сутки концентрация увеличивалась и достигала исходных значений. Через 3 и 6 мес. концентрация снижалась. Заключение. Снижение активности металлопротеиназ и факторов роста при отсутствии аритмии после РЧА - результат прекращения структурного ремоделирования и, возможно, его регресса.
Фибрилляция предсердий, радиочастотная аблация, фиброз, внеклеточный матрикс, структурное ремоделирование предсердий
Короткий адрес: https://sciup.org/14920039
IDR: 14920039 | УДК: 616.12-008.313.2
Текст научной статьи Влияние эндокардиальной процедуры “лабиринт” у пациентов с фибрилляцией предсердий на динамику показателей системы протеолиза внеклеточного матрикса и факторов роста
Фундаментальные механизмы, лежащие в основе ФП, являются предметом интенсивных исследований. Важный синергический вклад в субстрат ФП вносит электрическое, сократительное и структурное ремоделирование. В настоящее время считается, что три условия должны быть выполнены для того, чтобы развилась ФП: а) миокард должен предусматривать возможность инициации и поддержания эпизода; другими словами, он должен обеспечить электрофизиологический субстрат, который подходит для инициации и поддержания ФП; б) вегетативная нервная система должна находиться в дисбалансе; в) должен присутствовать триггер или преципитирующее событие, способные инициировать эпизод. Представляется, что кардиальный фиброз (формирование рубцовой ткани в ответ на повреждение) является важным элементом в развитии “ФП содружественного” субстрата [2].
Выявленные структурные изменения являются важной особенностью субстрата ФП, вызывая фиброз, который изменяет состав предсердной ткани и ее функции.
Фиброз является отличительной чертой аритмоген-ного структурного ремоделирования. Фиброз ткани является результатом накопления фрагментов фибриллярного коллагена, которое происходит чаще всего вследствие процесса репаративного замещения дегенеративной миокардиальной паренхимы с сопутствующим реактивным фиброзом, который способствует интерстициальному растяжению. Экспериментальные модели животных показывают региональные различия в фиброзном ремоделировании с большей чувствительностью предсердий, чем желудочков [9]. Предсердный фиброз представляет собой исход патологических конечных точек, таких как старение, сердечная дисфункция, поражение митрального клапана и, возможно, ишемия миокарда.
Предсердный фиброз – многофакторный процесс, возникающий в результате сложных взаимодействий нейрогормональных и клеточных медиаторов [4]. Структурные изменения в предсердиях пациентов с ФП были выявлены на уровне кардиомиоцитов (КМЦ) и внеклеточного матрикса (ВКМ), что наблюдалось и в клинических, и в экспериментальных парадигмах ФП. ВКМ в основном включает в себя коллаген типа I и III, фибронектин, ламинин, энтактин и фибромодулин. Ремоделирование ВКМ представляет собой неадекватный ответ на изменения в кардиальной структуре и функции в процессе прогрес- сирования сердечно-сосудистых заболеваний (ССЗ). Деградация и изменения ВКМ представляют собой процесс жесткой и динамической регуляции с хрупким балансом между матриксными металлопротеиназами (ММП) и тканевым ингибитором матричной металлопротеиназы (ТИМП) [1].
Точные механизмы и сигнальные пути, участвующие в развитии фиброза предсердий, неизвестны, но многие исследования уже показали сложные взаимодействия между нейрогуморальными и клеточными медиаторами. Триггеры для предсердного фиброза включают в себя активацию ренин-ангиотензин-альдостероновой системы (РААС), воспаление и окислительный стресс [19]. Множественные фибропролиферативные сигнальные пути способствуют переходу из профибротических молекул и медиаторов в предсердный фиброз. Ангиотензин II, известная профибротическая молекула, играет центральную роль в выработке коллагена. Трансформирующий фактор роста- β 1 (TGF- β 1), соединительнотканный фактор роста и тромбоцитарный фактор роста также являются важными посредниками в фибропролиферативных процессах. РААС участвует в структурном ремоделировании и развитии фиброза миокарда.
Трансформирующий фактор роста бета-1 (TGF- β 1) секретируется как КМЦ, так и фибробластами и служит основным медиатором регуляторных сигналов ангиотензина II для аутокринного (воздействие на саму клетку, продуцирующую ангиотензин II/TGF- β 1) и паракринного (воздействие на соседние клетки) механизмов регуляции [17]. Ангиотензин II стимулирует синтез TGF- β 1, который является мощным стимулятором активности фибробластов. И, наоборот, TGF- β 1 реципрокным образом усиливает выработку ангиотензина II и дополнительных профиброгенных факторов; таким образом, формируется цикл положительной обратной связи [3]. TGF- β 1 реализует свое действие преимущественно с помощью белка SMAD и белка SMA; этот сигнальный путь запускает активацию фибробластов и отложение коллагена [8].
Гиперэкспрессия постоянно активного TGF-β1 в миокарде приводит к избирательному фиброзу предсердий, гетерогенности проводимости возбуждения по предсердиям и тем самым способствует развитию ФП [16]. Предсердный фиброгенез у больных с ФП сопровождается двухфазным ответом: отмечается раннее увеличение, а затем потеря способности реагировать на TGF-β1. Похоже, что фиброз прогрессирует, несмотря на компенсатор- ные изменения в TGF-β1-сигнальных путях. Высокие концентрации в плазме крови TGF-β1 и ТИМП-1 являются потенциальными неинвазивными предикторами элект-роанатомического ремоделирования ЛП при неклапанной ФП [7].
Другой важный фактор, способствующий ВКМ ремоделированию сердца, – это ТИМП. ММП относятся к семейству цинкзависимых эндопептидаз, которые ответственны за деградацию всех матричных компонентов между клетками [6]. Аномальное увеличение ММП приводит к деградации матричных белков и ВКМ ремоделированию, в то время как ТИМП имеет прямое ингибирование протеолитической активности активной ММП за счет формирования сильной нековалентной связи 1:1 стехиометрических комплексов с ними. Кардиальная ММП экспрессия и активность возрастают в ряде патологических состояний, таких как сердечная недостаточность (СН) и инфаркт миокарда (ИМ). Большое количество клинических исследований и исследований на животных были направлены на определение изменений ММП и ТИМП при ФП [15]. Уровень белка ММП-9 был выше, чем уровень белка ТИМП-1 в моделях собак с ФП по сравнению с контрольной группой. Активность MMП-9 также выборочно и значимо увеличивалась на 50%, а уровень комплексного белка ТИМП-4 был значительно снижен на 50% в образцах у собак после тахисти-мулированной предсердной недостаточности. В другой модели сердца собак ММП ингибирование снижало предсердное ремоделирование и восприимчивость к ФП. Сверхрегуляция MMП-9, ТИМП-1 и ТИМП-3 была зарегистрирована в моделях свиней после быстрой предсердной стимуляции, вызванной ФП, а также изменений в синтезе коллагена и других белках ВКМ, таких как фибриллин или фибронектин. В модели ФП у собак ВКМ-свя-занная транскрипция в предсердии после желудочковой тахииндуцированной застойной сердечной недостаточности (ЗСН) согласовывалась с фиброзной патофизиологией. У пациентов с ФП увеличение экспрессии MMП-1, -3, -7, -9 и TИМП-1, -2, -3, -4 в ткани предсердий, как сообщалось, способствовало предсердному структурному ремоделированию и дилатации предсердий [14]. Предсердное ВКМ ремоделирование проявляется в селективном снижении регуляции ТИМП-2, а также сверхрегуляции ММП-2 и объеме фракции коллагена в предсердии, что было связано с развитием устойчивой ФП у пациентов с кардиомиопатией (КМП) и СН.
Усиление MMП-9 активности наряду с селективным снижением регуляции экспрессии TИМП-1 при ФП способствовало процессу предсердного структурного ремоделирования. Снижение ингиби-
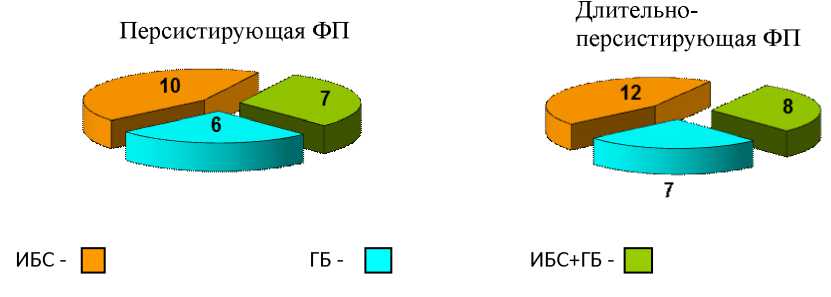
Рис. 1. Клиническая характеристика пациентов
рования активатора плазминогена (ингибитора мощного активатора многих ММП) и экспрессии тканевой металлопротеиназы может способствовать повышению активности металлопротеиназ с увеличением продолжительности ФП у человека. Содержание коллагена, кажется, больше в миокарде предсердий, чем в миокарде желудочков у больных с ФП и СН. Наличие ФП у этих больных может модулировать ММП и TИМП уровни и ВКМ состав в миокарде предсердий [5]. Цель исследования: определить влияние интервенционного вмешательства по поводу ФП на динамику протеолиза внеклеточного матрикса.
Материал и методы
В исследование вошли 50 пациентов с персистирующей – 27 (18 мужчин), средний возраст 62,1±9,4 лет и длительно-персистирующей – 23 (14 мужчин), средний возраст 64±11 лет формами ФП. Клиническая характеристика представлена на рисунке 1.
Критериями включения в исследование были:
-
1) персистирующая или длительно-персистирующая ФП;
-
2) неэффективность как минимум одного антиаритми-ческого препарата для поддержания синусового ритма;
-
3) отсутствие противопоказаний для процедуры “Лабиринт”;
-
4) отсутствие пароксизмов ФП при последующем наблюдении.
Для определения влияния процедуры “Лабиринт” на динамику показателей системы протеолиза внеклеточного матрикса и факторов определялась концентрация в сыворотке крови ММП-1, -3, -9, тканевого фактора рос-та- β 1 (TGF- β 1), тканевого ингибитора матриксных металлопротеиназ (ТИМП-1), фактора роста фибробластов (FGF). Образцы крови забирались до процедуры “Лабиринт”, непосредственно после нее, через одни сутки, через 3 и 6 мес. После взятия крови из вены ее центрифугировали, плазму замораживали и хранили при –70 °С до проведения окончательного анализа.
Всем пациентам проводилось интервенционное лечение ФП. Выполнена радиочастотная антральная изоляция легочных вен, задней стенки ЛП, левого истмуса сердца с использованием системы CARTO (Biosense
Таблица
Динамика концентраций ММП, ТИМП и факторов роста, Me(Q1–Q3)
|
Изучаемые показатели |
I II |
III |
IV |
V |
Kruskal–Wallis test |
||||
|
до |
после |
сутки |
3 мес. |
6 мес. |
PI–II |
р I–III |
р I–IV |
PI–V |
|
|
ММП-1, нг/мл |
4,419 (3,472–5,939) |
2,092 (1,091–4,149) |
3,017 (2,107–4,038) |
3,868 (2,666—5,32) |
3,163 (2,056–6,014) |
0,001 |
0,007 |
0,01 |
0,07 |
|
ММП-3, нг/мл |
9,5115 (8,176–10,027) |
7,628 (4,299–8,778) |
7,750 (4,862–9,198) |
9,168 (5,378–9,768) |
9,739 (6,779–9,972) |
0,001 |
0,01 |
0,7 |
0,9 |
|
ММП-9, нг/мл |
4,438 (2,575–5,388) |
2,421 (1,204–3,875) |
4,669 (4,021–6,869) |
2,944 (1,161–4,423) |
3,342 (2,018–5,041) |
0,01 |
0,02 |
0,001 |
0,6 |
|
ТИМП, нг/мл |
443,8 (418,3–462,0) |
201,97 (155,97–296,4) |
382,1 (316,4–407,3) |
411,6 (396–443,6) |
435,0 (374,2–444,5) |
0,001 |
0,09 |
0,8 |
0,6 |
|
TGF- β 1, нг/мл |
9,714 (6,402–11,978) |
2,3784 (1,512–6,058) |
3,348 (1,853–7,124) |
7,332 (4,59–9,74) |
8,006 (6,641–8,404) |
0,0001 |
0,001 |
0,03 |
0,4 |
|
FGF, пг/мл |
12,651 (8,317–16,26) |
10,052 (5,607–12,275 |
11,746 (7,315–13,284) |
10,469 (7,033–15,827) |
8,008 (7,196–11,325) |
0,01 |
0,4 |
0,95 |
0,72 |
|
ММП-1/TIMP-1/1000 |
0,996 (0,795–1,127) |
1,036 (0,897–1,238) |
0,79 (0,689–0,945) |
0,94 (0,875–1,023) |
0,727 (0,701–0,865) |
0,6 |
0,05 |
0,87 |
0,08 |
|
ММП-3/TIMP-1/1000 |
2,143 (1,652–2,873) |
3,777 (2,974–4,231) |
2,028 (1,789–2,647) |
2,227 (1,712–2,965) |
2,239 (1,624–3,012) |
0,04 |
0,3 |
0,86 |
0,21 |
|
ММП-9/TIMP-1/1000 |
1,0 (0,895–1,234) |
1,199 (0,897–1,956) |
1,222 (1,014–1,567) |
0,715 (0,541–0,951) |
0,768 (0,533–0,984) |
0,06 |
0,1 |
0,05 |
0,05 |
Примечание: p – уровень статистической значимости.
Webster, США). Контроль изолированности вен проводился циркулярным электродом Lasso (Biosense Webster, США). Синусовый ритм в случае необходимости был восстановлен электрической кардиоверсией. После операции в течение 3 мес. все пациенты принимали амиодарон или соталол, варфарин и сопутствующие препараты. В последующем все пациенты были свободны от приема антиаритмиков, но продолжали принимать анитико-агулянты и сопутствующие препараты.
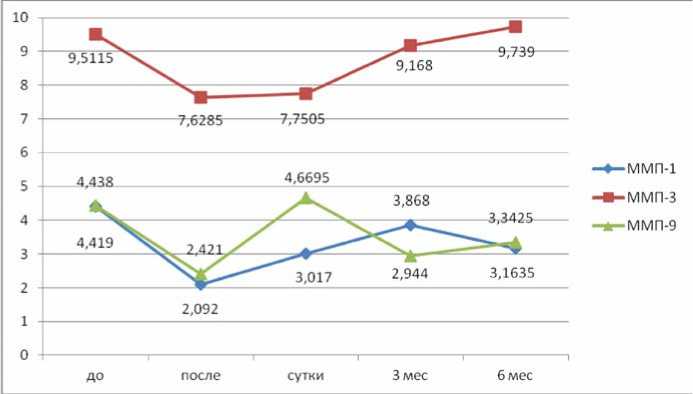
Рис. 2. Динамика концентраций МПП-1, -3, -9 у пациентов после РЧА ФП
Результаты
Все пациенты после прове денного вмешательства и весь срок наблюдения не имели пароксизмов аритмии. Динамика концентрации показателей системы протеолиза представлена в таблице.
Анализируя полученные данные, было выявлено, что концентрация всех ММП непосредственно после процедуры резко снижалась, что, скорее всего, связано со значительным и объемным термическим поражением ЛП. Дальнейшая динамика ММП отличалась. Так, через сутки концентрация ММП-1 имела тенденцию к восстановлению, в то время как ММП-3 сохранялась на предыдущем уровне, а ММП-9 резко возрастала до уровня, превышающего таковой до вмешательства. По истечении 3 мес. наблюдения концентрация ММП-1 и -3 практически возвращалась к исходной, а ММП-9 резко снижалась до уровня, отмечаемого непосредственно после процедуры. Через полгода наблюдения концентрация ММП-1 имела тенденцию к снижению и была ниже исходного уровня, уровень ММП-3 также не достиг исходного, в то время как концентрация ММП-9 вернулась к исходной точке (рис. 2).
Концентрация ТИМП-1 имела более предсказуемый характер, с резким снижением сразу после вмешательства и с медленным восстановлением к 6-му мес. наблюдения (рис. 3).
Более интересным является отношение концентрации ММП к тканевому ингибитору, что, по данным разных авторов, может быть отражением активности ферментов деградации экстрацеллюлярного матрикса. Так, по нашим данным, активность ММП-3 в отношении к тканевому ингибитору резко возрастает сразу после процедуры, что, скорее всего, связано со значительным повреждением тканей и появлением в них большого количества белко-
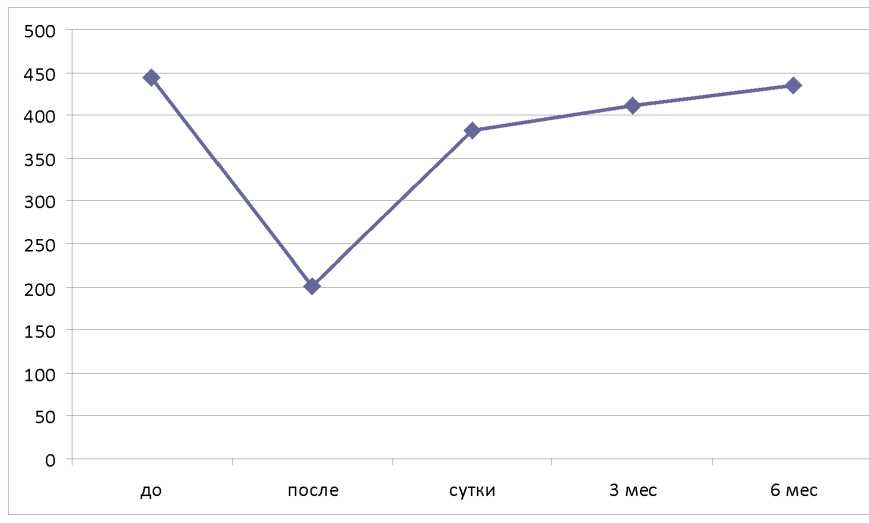
Рис. 3. Динамика концентрации ТИМП-1 у пациентов после РЧА ФП
мо отметить, что через 6 мес. происходит стабилизация процесса в отношении ММП-3, ее концентрация и отношение к ТИМП-1 возвращаются к исходным значениям. Что касается ММП-1 и -9 и отношения к ТИМП-1, то их концентрация в отсутствии эпизодов ФП становится меньше, что, по всей видимости, свидетельствует об изменении фибротических процессов в тканях – их уменьшении, что, возможно, останавливает процесс ремоделирования или даже приводит к его регрессу.
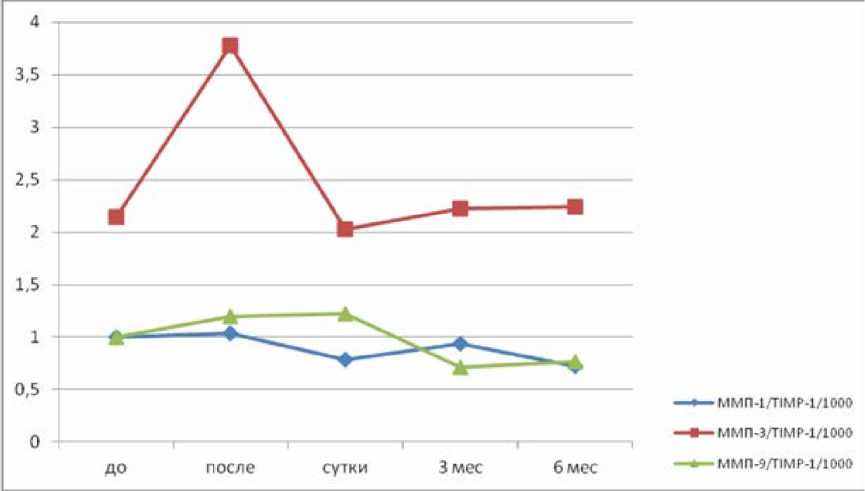
Рис. 4. Отношение концентрации ММП-1, -3, -9 к тканевому ингибитору -1
Динамика концентрации тканевого фактора роста- β 1 также имела резкое снижение непосредственно сразу после процедуры, с медленным восстановлением к 6-му мес. наблюдения, чего нельзя сказать о факторе роста фибробластов (рис. 5). Так, сразу после процедуры его концентрация снижалась, что можно объяснить массовой гибелью клеток в миокарде предсердий. Через сутки концентрация увеличивалась и достигала исходных значений, что свидетельствует о начале процессов восстановления в миокарде предсердий. Через 3 и 6 мес. концентрация снижалась, что можно объяснить только снижением активности фибробластов в отношении синтеза коллагена, уменьшением профиб-ротической составляющей процессов ремоделирования, что напрямую соотносится с активностью ММП и может являться еще одним доказательством замедления или остановки процессов ремоделирования.
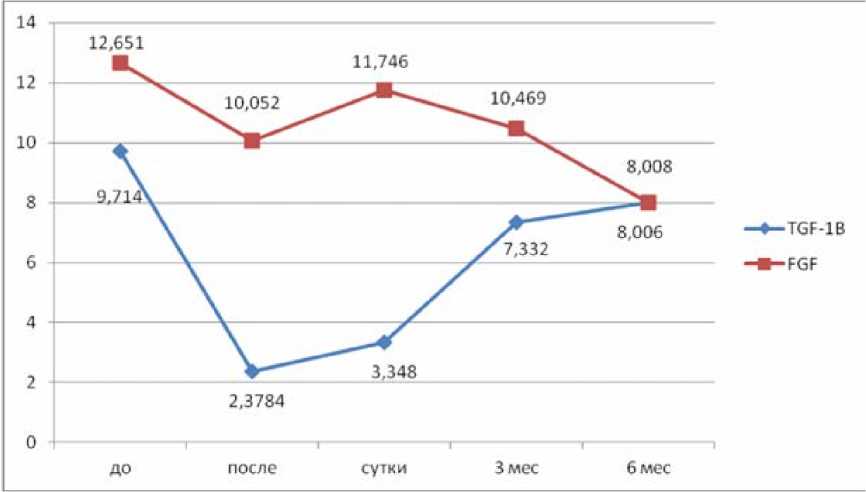
Рис. 5. Динамика тканевого фактора роста- β 1 (TGF- β 1) и фактора роста фибробластов (FGF) у пациентов после РЧА ФП
Заключение
Таким образом, полученные результаты указывают на прямое влияние процедуры “Лабиринт” на концентрацию ММП и факторов роста. Изменение отношения металлопротеиназа/тканевой игибитор является одним из ключевых моментов ремоделирования предсердий, проявляющегося в виде избыточного коллагенооб-разования и, соответственно, приводящего к фиброзу. Снижение активности металлопротеиназ и факторов роста при отсутствии аритмии после РЧА – результат прекращения структурного ремоделирования и, возможно, его регресса. Уменьшение фиброзных изменений – прямой результат исчезновения ФП и, как следствие, электрического ремоделирования, вых фрагментов, остатков коллагена и эластина (рис. 4).
Последующие изменения характеризуют процессы репарации, происходящие в миокарде, восстановление экстрацеллюлярного матрикса. В то же время необходи- что в итоге, возможно, приводит к длительному сохранению синусового ритма. Однако, скорее всего, достигнутое равновесие нестабильно в течение первого полугода наблюдения, учитывая то, что в течение этого времени продолжаются изменения в динамике факторов роста и ММП. Небольшое изменение в электрическом состоянии миокарда предсердий (восстановление проведения из легочных вен с появлением экстрасистолии, появление новых триггеров, тахикардия) могут вновь продолжить процессы электрического ремоделирования и, как следствие, структурного ремоделирования, а это значит, что продолжится избыточный синтез коллагена и замещение КМЦ фиброзной тканью. Поэтому, как показывают полученные данные, в течение первого полугодия после процедуры требуется обращать внимание на возникновение аритмий, проводить их профилактику, что может оказывать прямое влияние на отдаленную эффективность процедуры.
Работа выполнена при финансовой поддержке и на оборудовании Томского регионального центра коллективного пользования, приобретенного при поддержке Минобрнауки России по Соглашению №14.594.21.0001, а также в рамках программы повышения конкурентоспособности Национального исследовательского Томского государственного университета.
Список литературы Влияние эндокардиальной процедуры “лабиринт” у пациентов с фибрилляцией предсердий на динамику показателей системы протеолиза внеклеточного матрикса и факторов роста
- Anyukhovsky E., Sosunov E., Plotnikov A. et al. Cellular electrophysiologic properties of old canine atria provide a substrate for arrhythmogenesis//Cardiovasc. Res. -2002. -Vol. 54. -P. 462-469.
- Bajpai A., Savelieva I., Camm J. Treatment of atrial fibrillation//Br. Med. Bull. -2008. -Vol. 88. -P. 75-94.
- Burstein B., Nattel S. Atrial fibrosis: mechanisms and clinical relevance in atrial fibrillation//J. Am. Coll. Cardiol. -2008. -Vol. 51. -P. 802-809.
- Hanna N., Cardin S., Nattel S. Differences in atrial versus ventricular remodeling in dogs with ventricular tachypacing-induced congestive heart failure//Cardiovasc. Res. -2004. -Vol. 63. -P. 236-244.
- Hinescu M., Gherghiceanu M., Mandache E. Interstitial Cajal-like cells (ICLC) in atrial myocardium: ultrastructural and immunohistochemical characterization//J. Cell. Mol. Med. -2006. -Vol. 10. -P. 243-257.
- Choi E.K., Chang P.C., Lee Y.S. et al. Triggered firing and atrial fibrillation in transgenic mice with selective atrial fibrosis induced by overexpression of TGF-β1//Circ. J. -2012. -Vol. 76 -P. 1354-1362.
- Lee A.A., Dillmann W.H., McCulloch A.D. et al. Angiotensin II stimulates the autocrine production of transforming growth factor-beta 1 in adult rat cardiac fibroblasts//J. Mol. Cell. Cardiol. -1995. -Vol. 27. -P. 2347-2357.
- Purnomo Y., Piccart Y., Coenen T. et al. Oxidative stress and transforming growth factor-β1-induced cardiac fibrosis//Cardiovasc. Hematol. Disord. Drug Targets. -2013. -Vol. 13. -P. 165-172.
- Nattel S., Shiroshita-Takeshita A., Brundel B. Mechanisms of atrial fibrillation: lessons from animal models//Prog. Cardiovasc. Dis. -2005. -Vol. 48. -P. 9-28.
- Ponten A., Folestad E., Pietras K. Platelet4derived growth factor D induces cardiac fibrosis and proliferation of vascular smooth muscle cells in heart-specific transgenic mice//Circ. Res. -2005. -Vol. 97. -P. 1036-1045.
- Ponten A., Li X., Thoren P. et al. Transgenic overexpression of platelet-derived growth factor4C in the mouse heart induces cardiac fibrosis, hypertrophy, and dilated cardiomyopathy//Am. J. Pathol. -2003. -Vol. 163. -P. 673-682.
- Schultz J., Witt S., Glascock B. et al. TGF-beta1 mediates the hypertrophic cardiomyocyte growth induced by angiotensin II//J. Clin. Invest. -2002. -Vol. 109. -P. 787-796.
- Lopez B., Gonzalez A., Ravassa S.J. et al. Circulating Biomarkers of Myocardial Fibrosis: The Need for a Reappraisal//Am. Coll. Cardiol. -2015. -Vol. 65. -P. 2449-2456.
- Rahmutula D., Marcus G.M., Wilson E.E. et al. Molecular basis of selective atrial fibrosis due to overexpression of transforming growth factor-β1//Cardiovasc. Res. -2013. -Vol. 4. -P. 769-779.
- De Jong S., van Veen T.A., de Bakker J.M. et al. Biomarkers of myocardial fibrosis//J. Cardiovasc. Pharmacol. -2011. -Vol. 57. -P. 522-535.


