Влияние эстрадиола на фагоцитарную и окислительную активность моноцитов и нейтрофилов
Автор: Ширшев С.В., Куклина Е.М., Гудина У.С.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Иммунология
Статья в выпуске: 9, 2008 года.
Бесплатный доступ
Исследовано влияние эстрадиола (Е2 ) на фагоцитарную и окислительную активность моноцитов и нейтрофилов в дозах, сопоставимых с концентрацией гормона в I и III триместрах беременности. Показано, что только низкая доза гормона (1нг/мл) угнетает фагоцитарную активность нейтрофилов, тогда как фагоцитарную активность моноцитов подавляют и низкая, и высокая дозы. Е2 также угнетает спонтанную окислительную активность нейтрофилов вне зависимости от дозы и не действует на зимозан-стимулированную. Гормон не влияет на спонтанную хемилюминесценцию и подавляет стимулированную окислительную активность моноцитов в концентрации, соответствующей содержанию гормона в крови в I триместре беременности (1 нг/мл), в течение всего времени стимуляции.
Короткий адрес: https://sciup.org/147204445
IDR: 147204445 | УДК: 612.018:612.017.1:611.018.53
Текст научной статьи Влияние эстрадиола на фагоцитарную и окислительную активность моноцитов и нейтрофилов
Во время беременности в организме женщины происходят важные изменения, направленные на сохранение и развитие плода. Большую роль в этих изменениях играют репродуктивные гормоны, в том числе и эстрадиол (Е 2 ), которые способствуют нормальному протеканию беременности.
Е 2 считается «главным эстрогенным гормоном животного организма». Этот женский половой гормон образуется в яичниках, а также в плаценте. Некоторое количество Е 2 синтезируется интерстициальными клетками семенников (Розен, 1984).
Е 2 стимулирует становление вторичных женских половых признаков. Полагают, что эстрогены оказывают еще и сенсибилизирующее действие в отношении влияния других гормонов на органы размножения. Специфические рецепторы (ERα) для Е 2 обнаружены в цитозоле селезенки, тимоцитах, в стромальных клетках тимуса. По своей структуре, физико-химическим свойствам и авидности эти рецепторы гомологичны гормонсвязывающим рецепторам органов репродукции (Gillette, Gillette, 1994).
Рецепторы к Е 2 также были найдены на нейтрофилах и моноцитах (Wensten et al.,1986). Поскольку эти клетки являются основными эффекторами неспецифических иммунных реакций, а Е 2 в комбинации с другими гормонами помогает настроить иммунную систему для успешного развития зародыша
(Ширшев, 2002), важно знать иммуномодулирующее влияние Е 2 на моноциты и нейтрофилы.
Целью данной работы было исследование модулирующего влияния Е 2 в дозах, соответствующих их уровню в крови в I и III триместрах беременности, на фагоцитарную и окислительную активность моноцитов и нейтрофилов женщин in vitro.
Материалы и методы исследования
В работе использовали фракционированные лейкоциты периферической крови (моноциты и нейтрофилы) небеременных женщин репродуктивного возраста.
В эксперименте использовали Е 2 («Sigma», США) в физиологических концентрациях, соответствующих их уровню в периферической крови I и III триместрах беременности – 1.0 и 10 нг/мл соответственно (Ширшев, 2002). Для стимуляции клеток прменяли зимозан (0.5 мг/мл), опсонизированный пулом сывороток. Для проведения люминолзависи-мой хемилюминесценции использовали люминол («Sigma», США) в концентрации 5 х 10 -4 М.
Мононуклеарные клетки периферической крови (МНК) и нейтрофилы выделяли из гепаринизированной (25 МЕ/мл) венозной крови центрифугированием в двойном градиенте плотности фиколл-верографина («Pharmacia», Швеция; «Спофа», Чехия) с плотностью верхнего и нижнего градиентов 1.077 и 1.112 г/мл соответственно. С верхней интерфазы собирали МНК, с нижней – нейтрофилы. Затем из МНК путем адгезии выделяли моноциты двумя пассажами с чашек Петри («anumbra», Куба). Чистота выделения для моноцитов составляла 78–85% (по оценке моноклональных антител к CD14 (ICN Ph, США)), для нейтрофилов – 95% (гистологическая оценка).
После выделения клетки (5 х 106/мл) инкубировали с гормоном в полной питательной среде на основе среды 199 (НПО «Биомед», Россия) с добавлением 0.01 М Hepes («Serva», Германия), 300 мкг/мл L-глутамина («Serva», Германия), 100 мкг/мл гентамицина («Pharmacia», Швеция), 5% эмбриональной телячьей сыворотки («Serva», Германия) в течение 6 часов при 37°С и 5% СО 2 . После этого определяли их фагоцитарную и окислительную активности. Контрольные культуры клеток инкубировали с растворителем гормона (NaCl 0,9%) при аналогичных условиях. Жизнеспособность клеток оценивали с помощью витального красителя (5% эозин), она составляла 95–97%.
Фагоцитарная активность оценивалась по степени гашения биолюминесценции культуры люминесцентных бактерий генно-инженерного штамма E.coli Lum+ со спонтанным свечением (Патент 2292553 от 27.01.2007).
Готовую суспензию бактерий (180 мкл) в рабочей концентрации 5 х 106 /мл вносили в лунки 96-луночного планшета, инкубировали при 37°С в течение 3–5 мин и снимали фоновый уровень свечения; затем, после внесения клеточной культуры в соотношении 1:10, измерялась степень гашения биолюминесценции в течение 30 мин с интервалом в 10 мин. При этом происходило полное поглощение E. coli Lum+ фагоцитирующими клетками. Измерение производилось на люминоскане «Ascent» (Финляндия). Для анализа результатов рассчитывался индекс фагоцитарной активности клеток ( ИФА ), отражающий процент гашения биолюминесценции по сравнению с его долей в исходном уровне, по формуле
Х 1 – Х 2
ИФА = -------х 100,
Х 1
где Х 1 – интенсивность биолюминесценции контрольной пробы в относительных единицах (RLU);
Х 2 – интенсивность биолюминесценции опытной пробы в относительных единицах (RLU).
Окислительную активность оценивали по интенсивности ЛЗХЛ клеточной культуры (Dahigren, Stendahl, 1984). Для этого в планшет вносили 180 мкл раствора Хенкса без фенолового красного («Биолот», Россия), содержащего люминол (5 х 10 "4 М). После инкубации в течение 3-5 мин при 37 ° С и замера фонового свечения добавляли 20 мкл клеточной суспензии (5 х 106 /мл) и при непрерывном перемешивании измеряли интенсивность спонтанной хемилюминесценции для оценки исходного уровня окислительного метаболизма клеток. Затем в кювету вносили 20 мкл зимозана (0.5 мг/мл), опсонизированного пулом сывороток, и фиксировали интенсивность стимулированной хемилюминесценции в течение 50 мин с интервалом в 10 мин. Измерения производились также на люминоскане «Ascent» (Финляндия) в относительных единицах (RLU).
При статистической обработке результатов вычислялись средняя арифметическая величина и ее стандартная ошибка. Достоверность различий между средними величинами оценивалась с помощью парного t – критерия Стьюдента, достоверными считались данные при р < 0.05.
Результаты исследований и их обсуждение
На первом этапе исследований оценивалась фагоцитарная активность нейтрофилов и моноцитов по степени гашения биолюминесценции.
Установлено, что доза Е 2 , соответствующая его уровню в крови в I триместре беременности, на 10-й мин инкубации достоверно угнетала фагоцитарную активность нейтрофилов, тогда как концентрация в 10 нг/мл не оказывала влияния на протяжении всего времени инкубации (рис. 1).
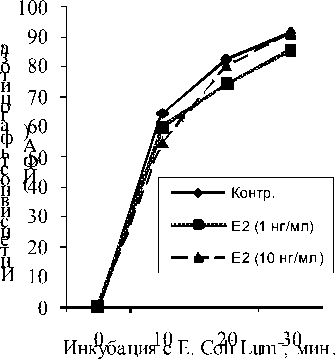
Рис. 1. Изменение индекса фагоцитарной активности нейтрофилов
Примечание: здесь и далее * – р < 0.05 в сопоставлении с контролем
При изучении влияния гормона на фагоцитарную активность моноцитов было установлено, что как угнетение низкой дозой Е 2 , соответствующей её уровню в крови в I триместр беременности, так и ингибирование в концентрации, соответствующей её уровню в III триместр происходило также на 10-й минуте инкубации (рис. 2).
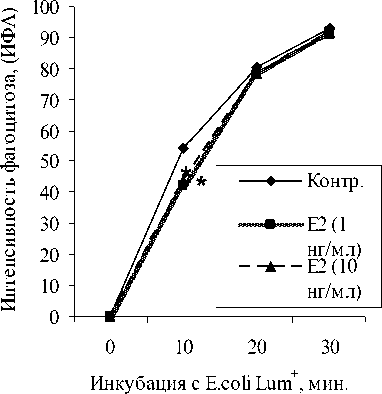
Рис. 2. Изменение индекса фагоцитарной активности моноцитов
Таким образом, на фагоцитарную активность Е 2 оказывал кратковременное угнетающее действие, что, по-видимому, связано с негеномным механизмом реализации гормональных эффектов.
На втором этапе исследования изучалось влияние Е 2 на окислительную активность нейтрофилов и моноцитов с помощью реакции ЛЗХЛ.
Как видно из рис. 3, Е 2 угнетает спонтанную ЛЗХЛ нейтрофилов вне зависимости от исследуемой дозы.
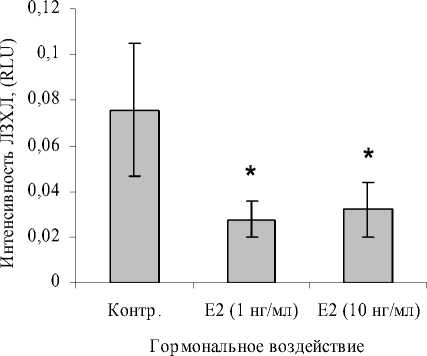
Рис. 3. Влияние Е 2 на спонтанную ЛЗХЛ нейтрофилов
При оценке зимозанстимулированной ЛЗХЛ нейтрофилов статистически достоверного влияния Е2 на окислительную активность клеток выявлено не было (рис. 4).
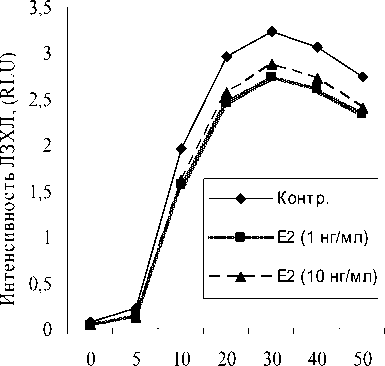
Продолжительность стимуляции, мин.
Рис. 4. Влияние Е 2 на динамику зимозан-стимулированной ЛЗХЛ нейтрофилов
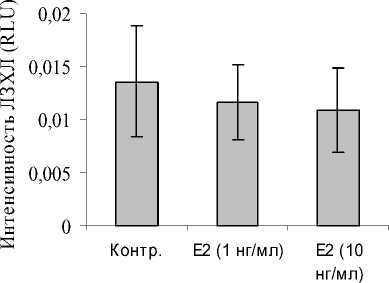
Аналогичные исследования проводились и на моноцитах. При этом выявлено, что Е 2 не оказывал статистически значимого влияния на спонтанную ЛЗХЛ моноцитов (рис. 5).
Гормональное воздействие
Рис. 5. Влияние Е 2 на спонтанную ЛЗХЛ моноцитов
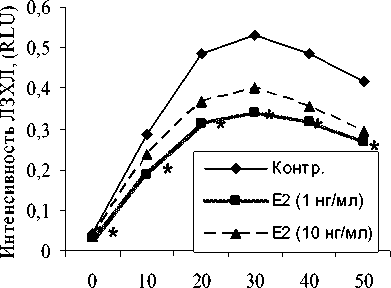
Однако при активации моноцитов опсонизированным зимозаном интенсивность ЛЗХЛ достоверно угнеталась низкой дозой Е 2 , соответствующей ему в крови женщин в I триместр беременности, на всем протяжении эксперимента (рис. 6).
Таким образом, Е 2 в дозе 1.0 нг/мл, соответствующей его уровню в I триместре беременности, угнетает фагоцитарную активность как нейтрофилов, так и моноцитов, а в дозе 10 нг/мл, соответствующей его уровню в III триместре, подавляет фагоцитарную активность только моноцитов.
Спонтанная ЛЗХЛ нейтрофилов угнеталась обеими дозами Е2, которые не оказывали влияния на моноциты, в то время как зимозан-стимулированная ЛЗХЛ моноцитов подавлялась концентрацией Е2, соответствующей его уровню в I триместре, а нейтрофилы были рефрактерны к ингибирующему действию гормона.
Продолжительность стимуляции, мин.
Рис. 6. Влияние на динамику зимозан-стимулированной ЛЗХЛ моноцитов
Таким образом, Е2 эффективно модулирует активность моноцитов и нейтрофилов, оказывая, как правило, угнетающее действие, что, по-видимому, может приводить к снижению функциональной активности фагоцитов в крови женщин во время беременности. В то же время гормон избирательно угнетает спонтанные окислительные процессы нейтрофилов, что ограничивает их участие в ремоделировании тканей при росте плода. Активность моноцитов регулируется прямо противоположно. Е2 угнетает ее при стимуляции, тем самым осуществляется защита плода от аборта, который может быть вы- зван активацией моноцитов при внутриутробной инфекции.
Список литературы Влияние эстрадиола на фагоцитарную и окислительную активность моноцитов и нейтрофилов
- Пат. 2292553 Российская Федерация, МПК 7 G01N33/53. Способ определения фагоцитарной активности нейтрофилов периферической крови человека по степени гашения биолюминесценции./Ширшев С.В., Куклина Е.М., Заморина С.А., Никитина Н.М., Некрасова И.В. -заявитель и патентообладатель Ин-т экологии и генетики микроорганизмов УрО РАН (RU), Ширшев С.В. (RU) -№ 2005118124/15; заявл. 10.06.05; опубл. 27.01.07, Бюл. № 3.
- Розен, В.Б. Основы эндокринологии: учеб. пособие/В.Б. Розен. М.: Высш. шк., 1984. 336 с.
- Ширшев, С.В. Механизмы иммунноэндокринного контроля процессов репродукции: в 2 т./С.В. Ширшев. Екатеринбург: УрО РАН, 2002.
- Dahigren, C. Myeloperoxidase modulates the phagocytic activity of polymorphonuclear neutrophil leukocytes. Studies with cells from a myeloperoxidase deficient patient/C. Dahigren, O. Stendahl//J. Clin. Invest. 1984. Vol. 73. P. 366-373.
- Gillette, S. Changes in thymic oestrogen receptor expression following orchidectomy/S. Gillette, R.W. Gillette//Cell Immunol. 1979. Vol. 42. P. 194-196.
- Wensten, J.J.A.M. Presence of oestrogen receptors in human blood mononuclear cells and thymocytes/J.J.A.M. Wensten, M.A. Blankenstein, F.H.G. Gmeling-Meyling [et al.]//Acta Endocrinol. 1986. Vol. 112. P. 409-414.


