Влияние кишечной микробиоты на устойчивость миокарда к ишемическому-реперфузионному повреждению
Автор: Борщев Ю. Ю., Сонин Д. Л., Минасян С. М., Борщева О. В., Буровенко И. Ю., Галагудза М. М.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Обзоры и лекции
Статья в выпуске: 4 т.38, 2023 года.
Бесплатный доступ
Последние 10-15 лет ознаменованы бурным увеличением объема знаний о роли кишечной микробиоты в регуляции разнообразных физиологических процессов. В частности, отмечены взаимосвязи между нарушениями состава кишечной микрофлоры и увеличением риска развития сердечно-сосудистых заболеваний (ССЗ). Появляются также работы, в которых продемонстрирована возможность уменьшения выраженности ишемического-реперфузионного повреждения (ИРП) миокарда в результате различных воздействий на состав кишечной микробиоты. В настоящем обзоре проанализирована литература последних лет, посвященная влиянию кишечной микробиоты на устойчивость миокарда к ИРП. Показано, что модуляция кишечного микробиома посредством изменения характера питания, введения пробиотиков, антибиотиков, а также трансплантации кишечной микрофлоры приводит к уменьшению размера инфаркта миокарда. В качестве возможных механизмов кардиопротекции, опосредованной изменениями функционального состояния микробиоты, рассматриваются нормализация повышенной проницаемости кишечного эпителиального барьера с уменьшением проявлений системного воспаления, изменения уровня секреции некоторых гормонов, усиление продукции короткоцепочечных жирных кислот и модуляция метаболизма желчных кислот под действием ферментов кишечных бактерий. Концепция повышения устойчивости миокарда к ИРП за счет модуляции состава кишечной микробиоты является совершенно новым научным направлением, требующим детального изучения в эксперименте с возможностью быстрого внедрения полученных результатов в клиническую практику.
Кишечная микробиота, пробиотики, антибиотики, сердце, ишемия, реперфузия, размер инфаркта, кардиопротекция
Короткий адрес: https://sciup.org/149144447
IDR: 149144447 | УДК: 616.127-005.4:616.34-008.87 | DOI: 10.29001/2073-8552-2023-38-4-86-96
Текст обзорной статьи Влияние кишечной микробиоты на устойчивость миокарда к ишемическому-реперфузионному повреждению
В настоящее время ишемическая болезнь сердца (ИБС) наряду со злокачественными новообразованиями лидирует среди причин смерти во всем мире, причем в последние 30 лет, несмотря на совершенствование методов диагностики и лечения ИБС, отмечается значительное увеличение ее распространенности. Так, в 2017 г. в мире насчитывалось 126,5 млн лиц с диагнозом ИБС; при этом ИБС послужила причиной смерти 8,9 млн человек [1]. Несмотря на постепенное улучшение клинических исходов острого коронарного синдрома и, в частности, уменьшение летальности на 6,1–7,4% в год с 2002 по 2015 гг. [2], важнейшей задачей является разработка новых подходов к уменьшению выраженности ишемиче-ского-реперфузионного повреждения (ИРП) миокарда. К сожалению, многочисленные разработанные и апробированные в экспериментальных исследованиях подходы к уменьшению размера инфаркта миокарда оказались неэффективными в клинической практике, что создало ситуацию «трансляционного кризиса» [3].
Последние 10–15 лет были ознаменованы бурным увеличением объема знаний о роли кишечной микробиоты в регуляции разнообразных физиологических процессов [4]. Параллельно происходит накопление научных данных о патогенетическом значении нарушений состава кишечной микробиоты в развитии различных заболеваний, а также о способах терапевтического воздействия на микробиоту с целью профилактики и лечения социально значимых видов патологии. В частности, отмечены взаимосвязи между нарушениями состава кишечной микрофлоры и увеличением риска развития таких сердечно-сосудистых заболеваний (ССЗ), как атеросклероз коронарных и мозговых артерий, артериальная гипертензия (АГ), хроническая сердечная недостаточность [5].
Появляются также работы, в которых продемонстрирована возможность уменьшения выраженности ИРП миокарда в результате различных воздействий на состав кишечной микробиоты [6]. При этом изучение молекуляр- ных механизмов, лежащих в основе подобного кардио-протективного действия модуляции кишечного микробиома, находится на начальном этапе.
Цель настоящего обзора: проанализировать литературу последних лет, посвященную влиянию кишечной микробиоты на устойчивость миокарда к ИРП, и представить авторскую концепцию возможных механизмов про-биотик-опосредованной кардиопротекции.
Кишечная микробиота и сердечно-сосудистые заболевания
С методической точки зрения все исследования, посвященные изучению роли кишечной микробиоты в развитии ССЗ, могут быть разделены на несколько групп. В части исследований проанализированы изменения состава микробиоты, имеющие место при том или ином заболевании, в сравнении со здоровыми испытуемыми. В других работах применяются различные способы коррекции состава кишечной микрофлоры, которые направлены на предотвращение развития заболевания или уменьшение выраженности его проявлений / последствий. Указанные способы включают изменения состава пищи, применение про- и пребиотиков, антибиотиков, а также трансплантацию фекальной микробиоты. Наконец, в немногочисленных исследованиях проанализированы механизмы влияния микробиоты на основные патогенетические факторы ССЗ, доказаны причинно-следственные связи между молекулярными событиями, возникающими при модуляции микробиоты, и исходами ССЗ.
АГ представляет собой важнейший модифицируемый фактор риска развития атеросклероза и занимает начальное положение в континууме ССЗ. В настоящее время в экспериментальных и клинических исследованиях показано, что при АГ происходят значимые изменения состава микробиоты, которые заключаются в уменьшении ее видового разнообразия и в увеличении соотношения фирмикуты / бактероиды [7, 8]. Эти изменения сочетались с уменьшением количества бактерий, продуцирующих такие короткоцепочечные жирные кислоты (КЦЖК), как ацетат, бутират и пропионат [9]. КЦЖК образуются некоторыми представителями кишечной микробиоты из поступающих с пищей полисахаридов и в целом обладают протективными свойствами, а именно нормализуют повышенную проницаемость кишечного эпителиального барьера, уменьшают экспрессию про-воспалительных цитокинов и хемокинов, ослабляют окси-дативный стресс. Введение пропионата сопровождается гипотензивным действием, опосредованным активацией G-белок-связанного рецептора 41, локализованного на эндотелии [10].
Наибольшее количество исследований посвящено изучению связи между состоянием кишечной микробиоты и развитием / прогрессированием атеросклероза [11]. Характерные для пациентов с коронарным атеросклерозом изменения микробиоты включают значительное увеличение фирмикутных бактерий семейства Lactobacillaceae и снижение бактерий семейства Bacteroidaceae [12]. Увеличение представительства бактерий семейства Enterobacteriaceae было ассоциировано с наличием более крупных атеросклеротических бляшек в коронарных артериях и более тяжелым течением ИБС [13].
Одним из важнейших механизмов, связывающих изменения кишечного микробиома с процессом атероге-неза, является увеличение кишечными бактериями продукции триметиламина, который окисляется в печени до триметиламин-N-оксида (ТМАО). Хотя рецепторный механизм действия ТМАО до настоящего времени не описан, обнаружены такие его проатерогенные эффекты, как уменьшение обратного транспорта холестерина, стимуляция образования пенистых клеток, стимуляция сборки NLRP3 инфламмасомы, а также активация тромбоцитов и эндотелиоцитов с усилением адгезии моноцитов к последним [14]. Не менее важное значение в процессе по-тенциации атеросклероза при кишечном дисбиозе может иметь повышение проницаемости эпителиального барьера, бактериальная транслокация и системное воспаление. Примечательно, что другие соединения, образующиеся в результате ферментативной активности кишечных бактерий, в противоположность ТМАО обладают атеро-протективными эффектами, понижая уровень холестерина в крови. Таким действием обладают некоторые КЦЖК и вторичные желчные кислоты (ЖЛК) [15].
Хроническая сердечная недостаточность также характеризуется специфическими изменениями кишечной микробиоты, которые заключаются в уменьшении представительства бутират-продуцирующих бактерий и появлении патогенных бактерий, включая Campylobacter, Salmonella, Shigella, Yersinia , а также грибов рода Candida [16]. Для сердечной недостаточности в наибольшей степени характерно повышение проницаемости кишечного эпителиального барьера, связанное, с одной стороны, с гипоксическим повреждением в результате гипоперфузии кишки и, с другой стороны, с венозным застоем и отеком. Повышение проницаемости эпителия сопровождается транслокацией микроорганизмов и компонентов микробных клеток во внутреннюю среду организма, что ведет к активации иммунной системы и системному воспалению, в частности, к повышению концентрации в крови провос-палительных цитокинов. Цитокины не только обеспечивают усиление катаболических процессов, но и провоцируют анорексию, дисфункцию эндотелия и снижение сократимости миокарда.
Еще один аспект нарушения функции кишечного эпителия – это нарушение всасывания питательных веществ (мальабсорбция), что ведет к кахексии. Дисфункция кишечного эпителия также сопровождается кишечным дисбиозом, проявляющимся проникновением некоторых симбионтов в собственную пластинку слизистой оболочки, нарушением всасывания витаминов и изменением продукции микробных метаболитов. Указанные механизмы составляют основу так называемой «кишечной» гипотезы патогенеза хронической сердечной недостаточности [17].
Более подробная характеристика изменений кишечной микробиоты при ССЗ, а также описание новых мишеней для профилактики и лечения ССЗ на основе воздействия на микробиоту и ее метаболиты даны в нескольких подробных обзорных статьях [18–20].
Кардиопротективные эффекты изменения состава кишечной микробиоты
Значительный интерес представляют исследования, в которых оценивалась взаимосвязь между функцией кишечной микробиоты и устойчивостью миокарда к ИРП. Известно, что у пациентов с коронарным атеросклерозом и острым коронарным синдромом важнейшей детерминантой прогноза является именно размер инфаркта. В основе представлений о классической кардиопротекции лежит возможность ограничения размера инфаркта под действием различных фармакологических и нефармакологических воздействий [21]. Это определение послужило отправной точкой для возникновения гипотезы о том, что управляемое воздействие на кишечную микробиоту и возникающие при этом системные изменения уровня ряда цитокинов, гормонов и метаболитов могут воздействовать на сердце, формируя кардиопротективный фенотип. Результаты поиска литературы, посвященной этому вопросу, представлены в таблице.
Первые данные о влиянии состава кишечной микробиоты на размер экспериментального инфаркта миокарда у крыс были получены в 2012 г. [22]. В этой работе применение ванкомицина и пробиотического штамма L. plantarum 299V сопровождалось значимым снижением концентрации лептина в плазме крови и уменьшением размера инфаркта на 27 и 29% соответственно. Позднее той же группой исследователей были получены данные о влиянии изменения кишечной микробиоты под воздействием ванкомицина и смеси антимикробных препаратов (стрептомицин, неомицин, бацитрацин, полимиксин Б) на устойчивость миокарда к ИРП [24]. При этом также отмечалось уменьшение размера инфаркта на модели ишемии-реперфузии in vivo и на изолированном сердце. Метаболомный анализ плазмы крови животных показал, что модуляция состава микрофлоры с помощью антибиотиков сопровождалась изменением концентрации 284 метаболитов, причем уровень 193 из них снижался. Экзогенное введение некоторых из аминокислот, уровень которых был пониженным, приводило к отмене кардиопро-тективного эффекта в группе, получавшей ванкомицин. Использование пробиотического штамма Lactobacillus rhamnosus GR-1 у крыс с перманентной окклюзией коронарной артерии сопровождалось уменьшением степени выраженности гипертрофии миокарда и улучшением систолической и диастолической функции левого желудочка (ЛЖ).
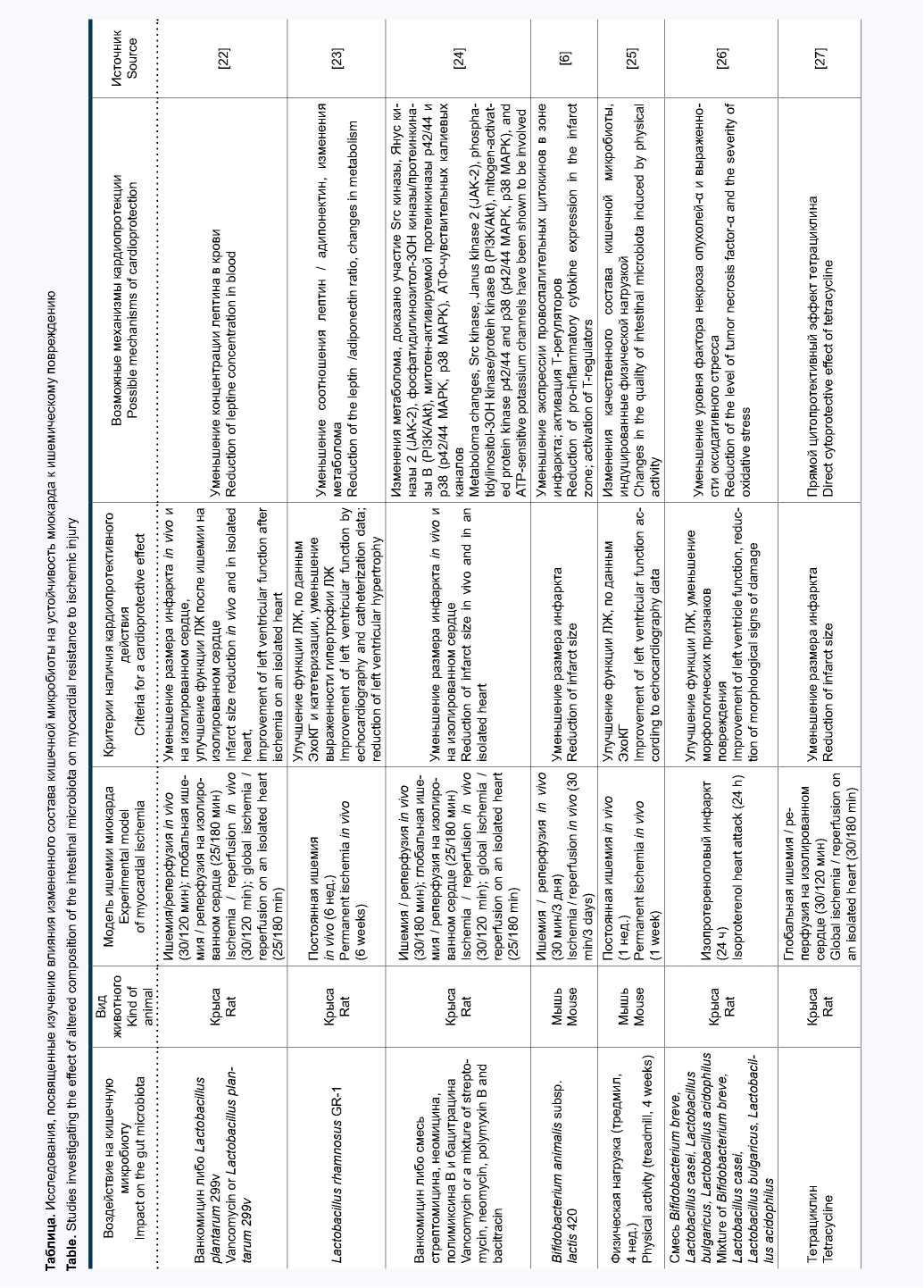
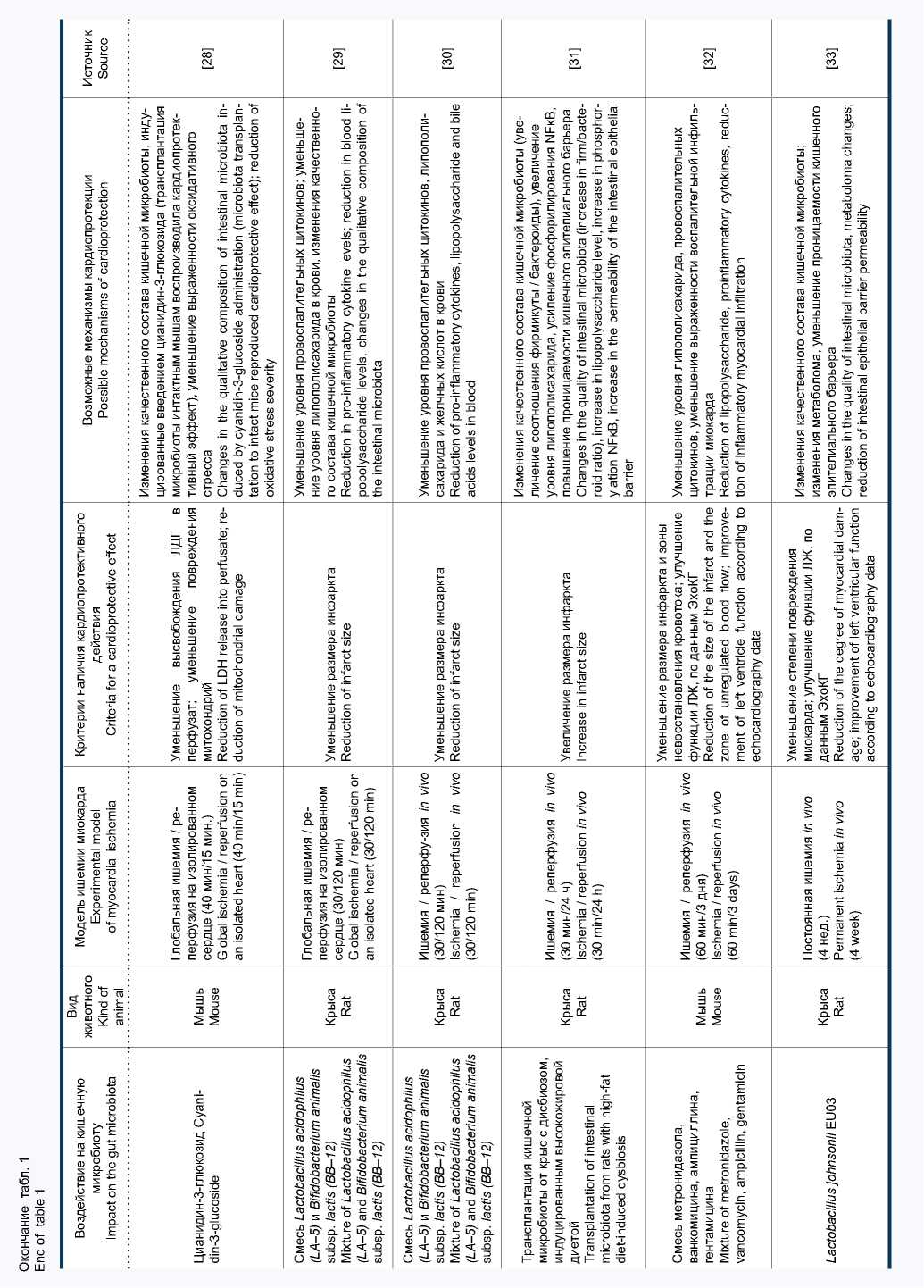
Эти позитивные эффекты пробиотической терапии были ассоциированы с нормализацией повышенного уровня лептина в плазме крови [23]. Применение пробиотического штамма Bifidobacterium animalis subsp. lactis 420 (B420) у мышей с кишечным дисбиозом, вызванным высокожировой диетой, показало существенное уменьшение размера инфаркта, индуцированного 30-минутной окклюзией коронарной артерии с последующей реперфузией [6].
Группой китайских исследователей проведено оригинальное исследование, в котором в качестве стимула для изменения состава кишечного микробиома у мышей применялось не введение антибиотиков / пробиотиков, а нарастающая по интенсивности физическая нагрузка в течение 4 нед. Примечательно, что отмеченные в результате физической нагрузки изменения состава кишечной микробиоты сочетались с повышением ударного объема и систолической функции ЛЖ после моделирования инфаркта миокарда [25]. В одной из работ на модели инфаркта миокарда у крыс было показано, что коронароок-клюзионный инфаркт сам по себе приводит к изменению состава кишечной микробиоты (увеличению представительства бактерий типов Synergistetes и Spirochaetes , а также семейств Lachnospiraceae и Syntrophomonadaceae ) и резкому повышению проницаемости эпителиального барьера тонкой кишки [34].
Кардиопротективный эффект смеси пробиотических штаммов Bifidobacterium breve, Lactobacillus casei, Lactobacillus bulgaricus и Lactobacillus acidophilus при введении в течение 14 дней перед моделированием изо-протеренолового инфаркта миокарда у крыс был обнаружен иранскими учеными [26]. В качестве важнейшего механизма уменьшения повреждения миокарда в этой работе рассматривается снижение уровня фактора некроза опухолей-α и интенсивности оксидативного стресса. В исследованиях нашей группы было впервые показано, что назначение крысам с синдромом системного воспалительного ответа пробиотической терапии путем перорального введения смеси пробиотических штаммов Lactobacillus acidophilus (LA-5) и Bifidobacterium animalis subsp. lactis (BB-12) приводит к уменьшению выраженности возникающих при этом отклонений биохимических и иммунологических параметров, а также сопровождается уменьшением размера инфаркта миокарда [29, 30]. В одном из последних исследований было показано, что введение крысам Lactobacillus johnsonii EU03 перед моделированием постоянной перевязки левой коронарной артерии приводит к уменьшению степени повреждения миокарда и более высоким значением фракции изгнания и фракции укорочения через 4 нед. по сравнению с контролем [33].
Исследования с постоянной окклюзией коронарной артерии более сложно интерпретировать с точки зрения классической кардиопротекции, поскольку в данном случае основной точкой приложения терапевтического воздействия является не ИРП миокарда, а выраженность постинфарктного воспаления, фиброза и ремоделирования. Очевидно, что в некоторых случаях изменения состава кишечной микробиоты могут оказывать негативное влияние на устойчивость миокарда к ИРП и, таким образом, способствовать более выраженному повреждению с увеличением размера инфаркта. Подобный эффект был описан в работе M.A. Gagne и соавт., в которой интактным крысам проводили трансплантацию кишечной микробиоты от крыс с дисбиозом, индуцированным высокожировой диетой и характеризующимся увеличением отношения фирмикуты / бактероиды [31]. В результате у животных-реципиентов было отмечено увеличение размера инфаркта, которое сочеталось с увеличением уровня липополисахарида в плазме крови и повышением проницаемости кишечного барьера.
Таким образом, к настоящему времени в экспериментальных исследованиях на грызунах получены убедительные данные о том, что модуляция кишечного микробиома приводит к уменьшению ИРП миокарда. Для изменения состава и функции микробиоты с целью индукции кардиопротекции применялись различные подходы, включая введение пробиотиков разных групп, антибиотиков и других антимикробных препаратов, трансплантацию кишечной микрофлоры и некоторые непрямые воздействия. В подавляющем большинстве проведенных исследований основным критерием кардиопротективной эффективности являлся размер инфаркта. В некоторых исследованиях применяли также функциональные критерии, например, фракцию выброса ЛЖ, по данным ЭхоКГ.
Механизмы кардиопротекции при изменении состава кишечной микробиоты
Большое значение для последующего переноса результатов исследований по пробиотик-индуцированной кардиопротекции в клиническую практику имеет расшифровка молекулярных механизмов защиты миокарда. В целом, механизмы фармакологической кардиопротекции, равно как и кардиопротекции под действием различных видов кондиционирования миокарда, изучены чрезвычайно подробно [35, 36]. Начиная с конца 90-х гг. XX в., сформировалось представление о трех последовательных этапах реализации кардиопротективного ответа на молекулярном уровне – рецепторном, сигнальном и эффекторном [37].
Исходя из теоретических представлений, можно предположить, что этапы внутриклеточного сигналинга и активации конечного эффектора кардиопротекции являются относительно неспецифичными для различных кардио-протективных воздействий, включая модуляцию микробиоты. Это предположение подтверждается данными о том, что антибиотик-индуцированное ограничение размера инфаркта у крыс не реализовалось при фармакологической блокаде элементов внутриклеточного сигнального каскада кардиопротекции, включая Src киназу, Янус киназу 2, фосфатидилинозитол-3ОН – киназу / протеинкиназу B, митоген-активируемые протеинкиназы р42/44 и р38, а также АТФ-чувствительных калиевых каналов, относящихся к конечным эффекторам [24].
В отличие от сигнального и эффекторного этапов, рецепторный этап реализации кардиопротективного ответа представлен десятками различных типов мембранных рецепторов с соответствующими лигандами. Некоторые из них являются более специфичными для определенных кардиопротективных воздействий. Следует отметить, что рецепторные механизмы кардиопротекции, опосредованной изменениями состава микробиоты, в настоящее время изучены недостаточно.
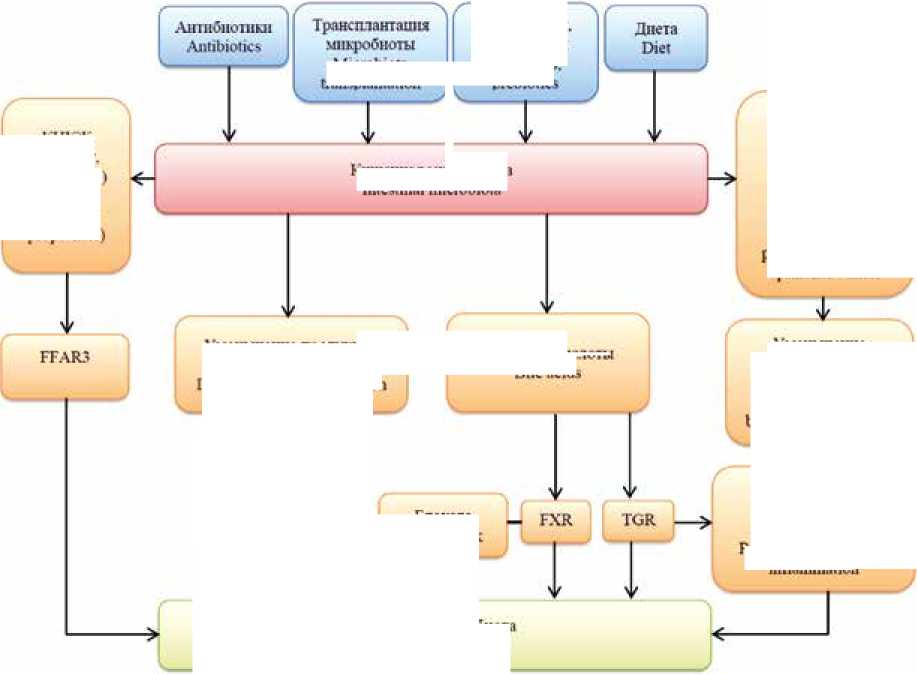
Тем не менее данные литературы позволяют выдвинуть на роль кардиопротективных лигандов некоторые молекулы, уровень которых в крови прямо или опосредованно связан с активностью кишечной микрофлоры. Эти сигнальные молекулы целесообразно разделить на две группы: 1) образующиеся клетками макроорганизма в результате стимуляции со стороны продуктов распада кишечных бактерий; 2) образующиеся ферментативным путем в результате метаболической активности самой микробиоты и поступающие в кровоток из просвета киш- ки. К первой группе относятся молекулярные механизмы, связанные с активацией иммунной системы и последующим изменением продукции цитокинов, факторов роста и некоторых гормонов, а ко второй – продукция ЖЛК и КЦЖК (рис. 1).
Пробиотики, пробиотики Probiotics, orebrotics
КЦКЖ (бутират, пропионат) SCTAs (butyrate, propionate)
Нормали юцня повышенной проницаемости ттпелиального барьера Normalization of increased permeability of the epithelial barrier
Блокада Heart block
Кишечная микроинота Iniestiual microbiota
Уменьшение гтродхгшш лептина Decreased leptin production
Рис. 1. Потенциальные механизмы защиты миокарда от ишемического-реперфузионного повреждения при модификации состава кишечной микробиоты
Примечание: КЦЖК – короткоцепочечные жирные кислоты, FXR – фарнезоидный рецептор X, TGR5 – G-белок-связанный мембранный рецептор желчных кислот 1, FFAR3 – рецептор свободных жирных кислот 3.
Fig. 1. Potential mechanisms of myocardial protection against ischemic-reperfusion injury upon modification of the composition of the intestinal microbiota Note: SCFA – short chain fatty acids, FXR – farnesoid X receptor, TGR5 – G-protein-coupled bile acid membrane receptor 1, FFAR3 – free fatty acid receptor 3.
Microbiota transplantation
Кишечная микробной Intestinal microbiota
Желчные кислоты
Bile acids
-
> меньшенпе бактериальной транслокашш Reduction of bacterial translocation
Уменьшение системного воспаления Redncliori of s>'slenuc inflanimanoD
Активация иммунной системы, цитокины и гормоны
Наряду с другими факторами состав кишечной микробиоты оказывает влияние на проницаемость кишечного эпителиального барьера [38]. Повышение проницаемости эпителиальной выстилки кишечника сопровождается бактериальной транслокацией, т. е. интенсификацией переноса бактерий и патоген-ассоциированных молекулярных паттернов (ПАМП) в собственную пластинку слизистой, где происходит распознавание ПАМП различными типами паттерн-распознающих рецепторов, локализованных как на клетках врожденного иммунитета, так и на эпителиоцитах. Активация клеток приводит к NFκВ-зависимой экспрессии многих генов, участвующих в воспалении, включая адгезионные молекулы, белки острой фазы и провоспалительные цитокины. Применительно к вопросу о кардиопротекции следует подчеркнуть, что значительное повышение концентрации в крови таких провоспали-тельных цитокинов, как фактор некроза опухолей-α, ин-терлейкин-1β и др. сопровождается индукцией апоптоза кардиомиоцитов, угнетением сократительной функции миокарда, усилением хемотаксиса и активацией лейкоцитов в зоне ишемического повреждения [39]. В экспериментальных исследованиях убедительно показаны кар-диопротективные эффекты антицитокиновых препаратов [40, 41].
Таким образом, любые изменения состава кишечной микробиоты, способствующие нормализации проницаемости эпителия и уменьшению проявлений системного и локального воспаления, имеют кардиопротективную направленность. Действительно, в ряде исследований, приведенных в таблице 1, было отмечено уменьшение уровня липополисахарида и провоспалительных цитоки- нов в плазме крови, которое было ассоциировано с ин-фаркт-лимитирующим действием модуляции микробиоты [30, 32]. Не менее важную роль может играть стимуляция противовоспалительных механизмов. Так, в работе C.A. Danilo и соавт. было установлено, что пробиотик-опосре-дованная кардиопротекция у мышей сопровождалась активацией Т-регуляторов, продуцирующих такие цитокины, как трансформирующий фактор роста β, интерлейкин-10 и -35 [6].
В нескольких публикациях было показано, что важным механизмом кардиопротекции при модуляции микробиоты может являться снижение концентрации лептина в плазме крови [22, 23]. Хотя связь между кишечной микробиотой и продукцией лептина изучена недостаточно, эти данные заслуживают внимания, поскольку в последние годы доказано, что хроническая гиперлептинемия приводит к системному воспалению, увеличению размера инфаркта, усилению гипертрофии миокарда и увеличению частоты развития ишемических аритмий [42, 43].
Желчные кислоты
Первичные ЖЛК – холевая и хенодезоксихолевая – синтезируются в гепатоцитах из холестерина и секретируются в составе желчи в просвет кишки, где бактериальная 7α-дегидроксилаза превращает их в дезоксихоле-вую и литохолевую кислоты соответственно [44]. Таким образом, активность кишечной микробиоты является одним из факторов, влияющих на метаболизм ЖЛК и определяющих их уровень в крови, поступающей в печень по воротной вене, а также в системном кровотоке. Поступающие в системный кровоток ЖЛК осуществляют свою сигнальную функцию посредством взаимодействия с двумя группами рецепторов – ядерными рецепторами и мембранными G-белок связанными рецепторами [45]. В контексте кардиопротекции наиболее важными мишенями являются ядерный фарнезоидный рецептор X (FXR) и G-белок-связанный мембранный рецептор желчных кислот 1 (TGR5). Известно, что активация FXR в кардиомиоцитах вызывает открытие митохондриальной поры и сопровождается запуском апоптоза [46]. У мышей, нока-утных по гену FXR, было отмечено улучшение функционального состояния сердца и уменьшение выраженности фиброза миокарда после перевязки коронарной артерии [47]. Позднее было показано, что апоптоз-индуцирующая активность FXR зависит от статуса его посттрансляционной модификации, в частности, степени связывания с малым убиквитин-связанным модификатором 1 (SUMO) [48]. Снижение степени SUMO-илирования FXR приводит к усилению транскрипционной активности последнего, более интенсивному апоптозу и нарастанию выраженности ИРП миокарда.
Если активация FXR преимущественно ассоциирована с негативными кардиоспецифическими последствиями в виде апоптоза кардиомиоцитов и эндотелиальной дисфункции, то стимуляция TGR5, напротив, оказывает защитное действие при ишемии миокарда. Показано, что введение дезоксихолевой кислоты мышам сопровождалось уменьшением размера инфаркта и улучшением функции ЛЖ на модели постоянной перевязки коронарной артерии [49]. Авторы показали, что кардиопротек-тивный эффект дезоксихолевой кислоты был связан с уменьшением экспрессии в миокарде интерлейкина-1β за счет ингибирования NFκB.
Существуют и другие возможные механизмы кардиопротекции при активации TGR5. Так, показано, что стимуляция TGR5 сопровождается усилением секреции глюкагоноподобного пептида-1 энтероэндокринными L-клетками тонкой кишки [50]. Глюкагоноподобный пептид-1 не только обеспечивает нормализацию нарушенной секреции инсулина при сахарном диабете 2-го типа, но и обладает прямым кардиопротективным действием, что было убедительно показано в экспериментальных и клинических исследованиях [51].
Короткоцепочечные жирные кислоты
КЦЖК содержат в своей основной цепочке от 1 до 6 атомов углерода, образуются определенными представителями кишечной микрофлоры из поступающих с пищей неперевариваемых полисахаридов и обладают рядом положительных биологических эффектов. Так, непосредственно в кишке КЦЖК обеспечивают нормализацию повышенной проницаемости эпителиального слоя и служат энергетическим субстратом для эпителиоцитов. Системные эффекты КЦЖК включают подавление воспаления, ослабление оксидативного стресса и снижение артериального давления за счет вазодилатации [52]. Большой интерес вызывает способность КЦЖК к ингибированию гистондеацетилаз, что открывает перспективы эпигеномной регуляции экспрессии генов [53].
С точки зрения кардиопротекции большое значение может иметь рецепторный механизм действия КЦЖК, который реализуется через их взаимодействие с различными классами рецепторов свободных жирных кислот (FFAR) [54]. Показано, что воздействие пропионата на FFAR3 (или GRP41) рецепторы приводит к уменьшению ИРП миокарда у мышей, причем одним из механизмов кардиопротекции является уменьшение продукции ангиотензина II в миокарде [55]. Добавление КЦЖК в рацион мышей, предварительно получавших антибиотики, сопровождалось значимым улучшением выживаемости и усилением миграции в поврежденный миокард миелоидных клеток костного мозга после перманентной перевязки коронарной артерии [56]. Добавление ацетата и пропионата в корм мышам с перегрузкой ЛЖ давлением приводило к улучшению функции сердца, ослаблению фиброза и уменьшению ремоделирования [57]. Следует подчеркнуть, что к настоящему времени продемонстрирована способность КЦЖК уменьшать последствия ИРП не только в миокарде, но также в почке [58], головном мозге [59] и тонкой кишке [60].
Заключение
Таким образом, анализ современной литературы показывает, что концепция повышения устойчивости миокарда к ИРП за счет модуляции состава кишечной микробиоты является совершенно новым научным направлением, требующим детального изучения в эксперименте с возможностью быстрого внедрения полученных результатов в клиническую практику. Результаты рассмотренных в данном обзоре исследований последних 10 лет свидетельствуют о появлении нового тренда, формирующегося на стыке кардиологии, гастроэнтерологии и микробиологии и заключающегося в обосновании стратегии защиты миокарда от ИРП путем контроля состава кишечной микробиоты с помощью антимикробных и пробиотических препаратов.
Список литературы Влияние кишечной микробиоты на устойчивость миокарда к ишемическому-реперфузионному повреждению
- Dai H., Much A.A., Maor E., Asher E., Younis A., Xu Y. et al. Global, regional, and national burden of ischaemic heart disease and its attributable risk factors, 1990-2017: results from the Global Burden of Disease Study 2017. Eur. Heart J. Qual. Care Clin. Outcomes. 2022;8(1):50-60. https://doi.org/10.1093/ehjqcco/qcaa076.
- Camacho X., Nedkoff L., Wright F.L., Nghiem N., Buajitti E., Goldacre R. et al. Relative contribution of trends in myocardial infarction event rates and case fatality to declines in mortality: an international comparative study of 1.95 million events in 80.4 million people in four countries. Lancet. Public Health. 2022;7(3):e229-e239. https://doi.org/10.1016/S24682667(22)00006-8.
- Perrino C., Ferdinandy P., Bøtker H.E., Brundel B.J.J.M., Collins P., Davidson S.M. et al. Improving translational research in sex-specific effects of comorbidities and risk factors in ischaemic heart disease and cardioprotection: position paper and recommendations of the ESC Working Group on Cellular Biology of the Heart. Cardiovasc. Res. 2021;117(2):367-385. https://doi.org/10.1093/cvr/cvaa155.
- Postler T.S., Ghosh S. Understanding the holobiont: how microbial metabolites affect human health and shape the immune system. Cell. Metab. 2017;26(1):110-130. https://doi.org/10.1016/j.cmet.2017.05.008.
- Rahman M.M., Islam F., Or-Rashid M.H., Mamun A.A., Rahaman M.S., Islam M.M. et al. The gut microbiota (microbiome) in cardiovascular disease and its therapeutic regulation. Front. Cell. Infect. Microbiol. 2022;12:903570. https://doi.org/10.3389/fcimb.2022.903570.
- Danilo C.A., Constantopoulos E., McKee L.A., Chen H., Regan J.A., Lipovka Y. et al. Bifidobacterium animalis subsp. Lactis 420 mitigates the pathological impact of myocardial infarction in the mouse. Benef. Microbes. 2017;8(2):257-269. https://doi.org/10.3920/BM2016.0119.
- Yang T., Santisteban M.M., Rodriguez V., Li E., Ahmari N., Carvajal J.M., Zadeh M. et al. Gut dysbiosis is linked to hypertension. Hypertension. 2015;65(6):1331-1340. https://doi.org/10.1161/HYPERTENSIONAHA.115.05315.
- Sun S., Lulla A., Sioda M., Winglee K., Wu M.C., Jacobs D.R.Jr. et al. Gut microbiota composition and blood pressure. Hypertension. 2019;73(5):998-1006. https://doi.org/10.1161/HYPERTENSIONAHA.118.12109.
- Yang Z., Wang Q., Liu Y., Wang L., Ge Z., Li Z. et al. Gut microbiota and hypertension: association, mechanisms and treatment. Clin. Exp. Hypertens. 2023;45(1):2195135. https://doi.org/10.1080/10641963.2023.2195135.
- Pluznick J. A novel SCFA receptor, the microbiota, and blood pressure regulation. Gut Microbes. 2014;5(2):202-207. https://doi.org/10.4161/ gmic.27492.
- Shen X., Li L., Sun Z., Zang G., Zhang L., Shao C. et al. Gut microbiota and atherosclerosis-focusing on the plaque stability. Front. Cardiovasc. Med. 2013;8:668532. https://doi.org/10.3389/fcvm.2021.668532.
- Emoto T., Yamashita T., Sasaki N., Hirota Y., Hayashi T., So A. et al. Analysis of gut microbiota in coronary artery disease patients: a possible link between gut microbiota and coronary artery disease. J. Atheroscler. Thromb. 2016;23(8):908-921. https://doi.org/10.5551/jat.32672.
- Tuomisto S., Huhtala H., Martiskainen M., Goebeler S., Lehtimäki T., Karhunen P.J. Age-dependent association of gut bacteria with coronary atherosclerosis: Tampere Sudden Death Study. PLoS One. 2019;14(8):e0221345. https://doi.org/10.1371/journal.pone.0221345.
- Oktaviono Y.H., Dyah Lamara A., Saputra P.B.T., Arnindita J.N., Pasahari D., Saputra M.E. et al. The roles of trimethylamine-N-oxide in atherosclerosis and its potential therapeutic aspect: A literature review. Biomol. Biomed. 2023;online ahead of print. https://doi.org/10.17305/bb.2023.8893.
- Jia B., Zou Y., Han X., Bae J.W., Jeon C.O. Gut microbiome-mediated mechanisms for reducing cholesterol levels: implications for ameliorating cardiovascular disease. Trends Microbiol. 2023;31(1):76-91. https://doi.org/10.1016/j.tim.2022.08.003.
- Jia Q., Li H., Zhou H., Zhang X., Zhang A., Xie Y. et al. Role and effective therapeutic target of gut microbiota in heart failure. Cardiovasc. Ther. 2019;2019:5164298. https://doi.org/10.1155/2019/5164298.
- Mamic P., Chaikijurajai T., Tang W.H.W. Gut microbiome - a potential mediator of pathogenesis in heart failure and its comorbidities: State-ofthe-art review. J. Mol. Cell. Cardiol. 2021;152:105-117. https://doi.org/10.1016/j.yjmcc.2020.12.001.
- Tang W.H.W., Bäckhed F., Landmesser U., Hazen S.L. Intestinal microbiota in cardiovascular health and disease: JACC State-of-the-Art Review. J. Am. Coll. Cardiol. 2019;73(16):2089-2105. https://doi.org/10.1016/j.jacc.2019.03.024.
- Nesci A., Carnuccio C., Ruggieri V., D’Alessandro A., Di Giorgio A., Santoro L et al. Gut microbiota and cardiovascular disease: evidence on the metabolic and inflammatory background of a complex relationship. Int. J. Mol. Sci. 2023;24(10):9087. https://doi.org/10.3390/ijms24109087.
- Cao H., Zhu Y., Hu G., Zhang Q., Zheng L. Gut microbiome and metabolites, the future direction of diagnosis and treatment of atherosclerosis? Pharmacol. Res. 2023;187:106586. https://doi.org/10.1016/j.phrs.2022.106586.
- Шляхто Е.В., Петрищев Н.Н., Галагудза М.М., Власов Т.Д., Нифонтов Е.М. Кардиопротекция: фундаментальные и клинические аспекты. CПб.: НП-Принт; 2013:399.
- Lam V., Su J., Koprowski S., Hsu A., Tweddell J.S., Rafiee P. et al. Intestinal microbiota determine severity of myocardial infarction in rats. FASEB J. 2012;26(4):1727-1735. https://doi.org/10.1096/fj.11-197921.
- Gan X.T., Ettinger G., Huang C.X., Burton J.P., Haist J.V. et al. Probiotic administration attenuates myocardial hypertrophy and heart failure after myocardial infarction in the rat. Circ. Heart Fail. 2014;7(3):491-499. https://doi.org/10.1161/CIRCHEARTFAILURE.113.000978.
- Lam V., Su J., Hsu A., Gross G.J., Salzman N.H., Baker J.E. Intestinal microbial metabolites are linked to severity of myocardial infarction in rats. PLoS One. 2016;11(8):e0160840. https://doi.org/10.1371/journal.pone.0160840.
- Liu Z., Liu H.Y., Zhou H., Zhan Q., Lai W., Zeng Q. et al. Moderate-intensity exercise affects gut microbiome composition and influences cardiac function in myocardial infarction mice. Front. Microbiol. 2017;8:1687. https://doi.org/10.3389/fmicb.2017.01687.
- Sadeghzadeh J., Vakili A., Sameni H.R., Shadnoush M., Bandegi A.R., Zahedi Khorasani M. The effect of oral consumption of probiotics in prevention of heart injury in a rat myocardial infarction model: a histopathological, hemodynamic and biochemical evaluation. Iran Biomed. J. 2017;21(3):174-181. https://doi.org/10.18869/acadpub.ibj.21.3.174.
- Borshchev Y.Y., Minasian S.M., Burovenko I.Y., Borshchev V.Y., Protsak E.S., Semenova N.Y. et al. Effects of tetracycline on myocardial infarct size in obese rats with chemically-induced colitis. PLoS One. 2019;14(11):e0225185. https://doi.org/10.1371/journal.pone.0225185.
- Trinei M., Carpi A., Menabo’ R., Storto M., Fornari M., Marinelli A. et al. Dietary intake of cyanidin-3-glucoside induces a long-lasting cardioprotection from ischemia/reperfusion injury by altering the microbiota. J. Nutr. Biochem. 2022;101:108921. https://doi.org/10.1016/j.jnutbio.2021.108921.
- Borshchev Y.Y., Burovenko I.Y., Karaseva A.B., Minasian S.M., Protsak E.S., Borshchev V.Y. et al. Probiotic therapy with Lactobacillus acidophilus and Bifidobacterium animalis subsp. lactis results in infarct size limitation in rats with obesity and chemically induced colitis. Microorganisms. 2022;10(11):2293. https://doi.org/10.3390/microorganisms10112293.
- Borshchev Yu.Yu., Sonin D.L., Burovenko I.Yu., Borshchev V.Yu., Cheburkin Yu.V.,Borshcheva O.V. et al. The effect of probiotic strains on myocardial infarction size, biochemical and immunological parameters in rats with systemic inflammatory response syndrome and polymorbidity. J. Evol. Biochem. Physiol. 2022;58(6):2058-2069. https://doi.org/10.1134/S0022093022060321.
- Gagné M.A., Barbeau C., Frégeau G., Gilbert K., Mathieu O., Auger J. et al. Dysbiotic microbiota contributes to the extent of acute myocardial infarction in rats. Sci. Rep. 2022;12(1):16517. https://doi.org/10.1038/s41598022-20826-z.
- Zhao J., Zhang Q., Cheng W., Dai Q., Wei Z., Guo M. et al. Heart-gut microbiota communication determines the severity of cardiac injury after myocardial ischaemia / reperfusion. Cardiovasc. Res. 2023;119(6):1390- 1402. https://doi.org/10.1093/cvr/cvad023.
- Zhong X., Zhao Y., Huang L., Liu J., Wang K., Gao X. et al. Remodeling of the gut microbiome by Lactobacillus johnsonii alleviates the development of acute myocardial infarction. Front. Microbiol. 2023;14:1140498. https://doi.org/10.3389/fmicb.2023.1140498.
- Wu Z.X., Li S.F., Chen H., Song J.X., Gao Y.F., Zhang F. et al. The changes of gut microbiota after acute myocardial infarction in rats. PLoS One. 2017;12(7):e0180717. https://doi.org/10.1371/journal.pone.0180717.
- Цибульников С.Ю., Маслов Л.Н., Цепокина А.В., Хуторная М.В., Кутихин А.Г., Цибульникова М.Р. и др. Проблема конечного эффектора ишемического прекондиционирования сердца. Российский физиологический журнал им. И.М. Сеченова. 2016;102(4):421-435.
- Altamirano F., Wang Z.V., Hill J.A. Cardioprotection in ischaemia-reperfusion injury: novel mechanisms and clinical translation. J. Physiol. 2015;593(17):3773-3788. https://doi.org/10.1113/JP270953.
- Шляхто Е.В., Нифонтов Е.М., Галагудза М.М. Ограничение ишемического и реперфузионного повреждения миокарда с помощью преи посткондиционирования: молекулярные механизмы и мишени для фармакотерапии. Креативная кардиология. 2007;1(2):75-101.
- Lama Tamang R., Juritsch A.F., Ahmad R., Salomon J.D., Dhawan P., Ramer-Tait A.E. et al. The diet-microbiota axis: a key regulator of intestinal permeability in human health and disease. Tissue Barriers. 2023;11(2):2077069. https://doi.org/10.1080/21688370.2022.2077069.
- Hanna A., Frangogiannis N.G. Inflammatory cytokines and chemokines as therapeutic targets in heart failure. Cardiovasc. Drugs Ther. 2020;34(6):849-863. https://doi.org/10.1007/s10557-020-07071-0.
- Belosjorow S., Bolle I., Duschin A., Heusch G., Schulz R. TNF-alpha antibodies are as effective as ischemic preconditioning in reducing infarct size in rabbits. Am. J. Physiol. Heart Circ. Physiol. 2003;284(3):H927- H930. https://doi.org/10.1152/ajpheart.00374.2002.
- Lin J., Li Q., Jin T., Wang J., Gong Y., Lv Q. et al. Cardiomyocyte IL-1R2 protects heart from ischemia/reperfusion injury by attenuating IL-17RA-mediated cardiomyocyte apoptosis. Cell Death Dis. 2022;13(1):90. https://doi.org/10.1038/s41419-022-04533-1.
- Karmazyn M., Gan X.T., Rajapurohitam V. The potential contribution of circulating and locally produced leptin to cardiac hypertrophy and failure. Can. J. Physiol. Pharmacol. 2013;91:883-888. https://doi.org/10.1139/cjpp-20130057.
- Polyakova E.A., Mikhaylov E.N., Galagudza M.M., Shlyakhto E.V. Hyperleptinemia results in systemic inflammation and the exacerbation of ischemia-reperfusion myocardial injury. Heliyon. 2021;7(11):e08491. https://doi.org/10.1016/j.heliyon.2021.e08491.
- Chiang J.Y. Bile acid metabolism and signaling. Compr. Physiol. 2013;3(3):1191-1212. https://doi.org/10.1002/cphy.c120023.
- Fiorucci S., Distrutti E. Bile acid-activated receptors, intestinal microbiota, and the treatment of metabolic disorders. Trends Mol. Med. 2015;21(11):702-714. https://doi.org/10.1016/j.molmed.2015.09.001.
- Pu J., Yuan A., Shan P., Gao E., Wang X., Wang Y. et al. Cardiomyocyte-expressed farnesoid-X-receptor is a novel apoptosis mediator and contributes to myocardial ischaemia/reperfusion injury. Eur. Heart J. 2013;34(24):1834-1845. https://doi.org/10.1093/eurheartj/ehs011.
- Gao J., Liu X., Wang B., Xu H., Xia Q., Lu T. et al. Farnesoid X receptor deletion improves cardiac function, structure and remodeling following myocardial infarction in mice. Mol. Med. Rep. 2017;16(1):673-679. https://doi.org/10.3892/mmr.2017.6643.
- Gao Y., Zhao Y., Yuan A., Xu L., Huang X., Su Y. et al. Effects of farnesoid-X-receptor SUMOylation mutation on myocardial ischemia / reperfusion injury in mice. Exp. Cell. Res. 2018;371(2):301-310. https://doi.org/10.1016/j.yexcr.2018.07.004.
- Wang J., Zhang J., Lin X., Wang Y., Wu X., Yang F. et al. DCA-TGR5 signaling activation alleviates inflammatory response and improves cardiac function in myocardial infarction. J. Mol. Cell. Cardiol. 2021;151:3-14. https://doi.org/10.1016/j.yjmcc.2020.10.014.
- Thomas C., Gioiello A., Noriega L., Strehle A., Oury J., Rizzo G. et al. TGR5-mediated bile acid sensing controls glucose homeostasis. Cell. Metab. 2009;10(3):167-177. https://doi.org/10.1016/j.cmet.2009.08.001.
- Ravassa S., Zudaire A., Díez J. GLP-1 and cardioprotection: from bench to bedside. Cardiovasc. Res. 2012;94(2):316-323. https://doi.org/10.1093/cvr/cvs123.
- Lu Y., Zhang Y., Zhao X., Shang C., Xiang M., Li L., Cui X. Microbiota-derived short-chain fatty acids: Implications for cardiovascular and metabolic disease. Front. Cardiovasc. Med. 2022;9:900381. https://doi.org/10.3389/fcvm.2022.900381.
- Chang P.V., Hao L., Offermanns S., Medzhitov R. The microbial metabolite butyrate regulates intestinal macrophage function via histone deacetylase inhibition. Proc. Natl. Acad. Sci. USA. 2014;111(6):2247- 2252. https://doi.org/10.1073/pnas.1322269111.
- Lymperopoulos A., Suster M.S., Borges J.I. Short-chain fatty acid receptors and cardiovascular function. Int. J. Mol. Sci. 2022;23(6):3303. https://doi.org/10.3390/ijms23063303.
- Deng F., Zhang L.Q., Wu H., Chen Y., Yu W.Q., Han R.H. et al. Propionate alleviates myocardial ischemia-reperfusion injury aggravated by Angiotensin II dependent on caveolin-1/ACE2 axis through GPR41. Int. J. Biol. Sci. 2022;18(2):858-872. https://doi.org/10.7150/ijbs.67724.
- Tang T.W.H., Chen H.C., Chen C.Y., Yen C.Y.T., Lin C.J., PrajnamitraR.P. et al. Loss of gut microbiota alters immune system composition and cripples postinfarction cardiac repair. Circulation. 2019;139(5):647-659. https://doi.org/10.1161/CIRCULATIONAHA.118.035235.
- Lin C.J., Cheng Y.C., Chen H.C., Chao Y.K., Nicholson M.W., Yen E.C.L. et al. Commensal gut microbiota-derived acetate and propionate enhance heart adaptation in response to cardiac pressure overload in mice. Theranostics. 2022;12(17):7319-7334. https://doi.org/10.7150/thno.76002.
- Sun Y., Zhou C., Chen Y., He X., Gao F., Xue D. Quantitative increase in short-chain fatty acids, especially butyrate protects kidney from ischemia/reperfusion injury. J. Investig. Med. 2022;70(1):29-35. https://doi.org/10.1136/jim-2020-001715.
- Chen R., Xu Y., Wu P., Zhou H., Lasanajak Y., Fang Y. et al. Transplantation of fecal microbiota rich in short chain fatty acids and butyric acid treat cerebral ischemic stroke by regulating gut microbiota. Pharmacol. Res. 2019;148:104403. https://doi.org/10.1016/j.phrs.2019.104403.
- Baba A.A., Srinivas M., Shariff A., Nazir T. Role of short chain fatty acids in mesenteric ischemia reperfusion injury in rats. Eur. J. Pediatr. Surg. 2010;20(2):98-101. https://doi.org/10.1055/s-0029-1241836.


