Влияние клеток костного мозга на репаративные процессы при эндопротезировании брюшной стенки (экспериментальное исследование)
Автор: Суковатых Б.С., Назаренко П.М., Пашков В.М., Мутова Т.В., Озеров А.А., Груздов А.Ю.
Журнал: Вестник Национального медико-хирургического центра им. Н.И. Пирогова @vestnik-pirogov-center
Рубрика: Оригинальные статьи
Статья в выпуске: 1 т.20, 2025 года.
Бесплатный доступ
Обоснование: Современным трендом отечественной и мировой герниологии является смещение акцента в сторону эндопротезирования брюшной стенки облегченными протезами, значительно не влияющими на качество жизни пациентов после операции. Однако дефектом легких сеток является недостаточная прочность вследствие слабой реакции соединительной ткани брюшной стенки на их имплантацию. Соединительно-тканная капсула вокруг протеза не всегда может противостоять резкому повышению внутрибрюшного давления пациента, что вызывает в ряде случаев рецидив заболевания. Перспективным решением данной проблемы является использование клеток костного мозга, которые стимулируют процессы регенерации ткани, способствует более короткому сроку формирования прочной соединительной ткани.Цель: экспериментальным путем изучить влияние клеток костного мозга на течение раневого процесса после подкожной имплантации легкого полипропиленового протеза на апоневроз прямых мышц живота.Материалы и методы: Экспериментальное исследование выполнено на 30 кроликах, разделенных на две группы по 15 животных. В обеих группах выполняли подкожную имплантацию легкого полипропиленового протеза на апоневроз прямых мышц живота. Животным в первой группе клетки костного мозга не вводились. Во второй группе после имплантации протеза проводили забор клеток костного мозга из гребня подвздошной кости кролика с помощью иглы для спинномозговой пункции объемом 2,5 мл. Затем вводили клетки костного мозга по 0,5 мл под центр протеза и в область четырех его углов в места, с которых начинается процесс отторжения импланта. На 3-и, 7-е, 14-е, 21-е, 30-е сутки после операции иссекали участок передней брюшной стенки кролика вместе с имплантированным протезом и проводили стандартное гистологическое исследование.Результаты: Воспалительная реакция в первой группе продолжалась 7 суток, во второй - 3 суток. Пик фибробластической реакции наступал в первой на 14-е, во второй - на 7-е сутки. Прочная соединительнотканная капсула в первой группе до 30 суток эксперимента не была сформирована. Во второй группе зрелая капсула образовалась через 21 сутки.Заключение: введение клеток костного мозга в зону имплантации легкого полипропиленового протеза позволяет оптимизировать репаративные процессы в ране.
Эксперимент, брюшная стенка, легкий полипропиленовый протез, клетки костного мозга
Короткий адрес: https://sciup.org/140309979
IDR: 140309979 | DOI: 10.25881/20728255_2025_20_1_60
Текст научной статьи Влияние клеток костного мозга на репаративные процессы при эндопротезировании брюшной стенки (экспериментальное исследование)
В современной герниологии эндопротезы по диаметру их нити принято классифицировать на подвиды, что последовательно разрабатывались друг за другом: тяжелые, стандартные, легкие и суперлегкие. Тяжелые эндопротезы (диаметр нити – 140 мкм) вызывают выраженные склеротические процессы с образованием грубого постоперационного рубца на месте раны, что деформирует брюшную стенку и нарушает ее функции. В связи с этим тяжелые эндопротезы в наше время редко используют в герниопластике [1].
Стандартные эндопротезы (диаметр нити – 120 мкм) применяются широко. Послеоперационные рубцовые изменение тканей брюшной стенки вместе их имплантации менее выражены, чем после имплантации тяжелых сеток. Однако, имплантация стандартного эндопротеза вызыва-

Суковатых Б.С., Назаренко П.М., Пашков В.М. и др.
ВЛИЯНИЕ КЛЕТОК КОСТНОГО МОЗГА НА РЕПАРАТИВНЫЕ ПРОЦЕССЫ ПРИ ЭНДОПРОТЕЗИРОВАНИИ БРЮШНОЙ СТЕНКИ (ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ)
ет атрофию с последующим фиброзом мышц брюшного пресса, что отрицательно влияет на его функции [2].
Поэтому тенденцией является смещение акцента в сторону эндопротезирования брюшной стенки облегченными протезами: легкими (диаметр нити – 90 мкм) и суперлегкими (диаметр нити – 70 мкм). Имплантация этих протезов вызывает минимальные нарушения функции брюшного пресса, что положительно сказывается на качестве жизни больных. Недостатком легких сеток является недостаточная прочность вследствие слабой реакции соединительной ткани брюшной стенки на их имплантацию. Соединительно-тканная капсула вокруг протеза не всегда может противостоять резкому повышению внутрибрюшного давления пациента, что вызывает у 5–10% рецидив заболевания [3].
Актуальной задачей герниологии является создание прочной капсулы вокруг легких сеток после их имплантации в брюшную стенку. Разработан ряд способов, оптимизирующих репаративные процессы при герниопластике: введение в рану аллогенных эмбриональных фибробластов, медикаментозная стимуляция аскорбиновой кислотой, оротатом калия, солкосерилом, аутоплазмой, обогащённой тромбоцитами [4; 5].
Наибольшим репаративным эффектом обладает аутоплазма, обогащенная тромбоцитами, которая содержит факторы роста элементов соединительной ткани [6]. Для создания прочной капсулы необходимо двукратное введение аутоплазмы: одно во время ее имплантации под протез в ткани брюшной стенки, второе – через 3 дня путем чрескожного шприцевого введения [7].
При втором введении трудно ввести плазму без визуального контроля в края и центр протеза (в места, где чаще всего начинается процесс отторжения импланта), а повторный забор крови и повторное введение негативно влияют на психоэмоциональное состояние пациента.
Более перспективным в сравнении с двукратным введением аутоплазмы способом стимуляции репаративных процессов при эндопротезированнии брюшной стенки является введение клеток костного мозга в место имплантации [8].
Известно, что в мононуклеарной фракции костного мозга содержатся стволовые клетки, обладающие как репаративными, так и ангиопротекторными свойствами. Введение клеток костного мозга нашло применение в различных областях медицины. Они используются в кардиологии для замещения кардимиоцитов в постинфарктном миокарде [9]; в неврологии – для генерации новых нейронов в рамках клеточной терапии ишемического инсульта [10]; в панкреатологии – для получения бета-клеток островков Лангерганса поджелудочной железы [11]; в пульмонологии – для лечения идиопатического легочного фиброза [12]; в гепатологии – для клеточной терапии цирроза печени [13]. Подобное широкое использование клеток костного мозга в различных областях медицины дает потенциал их задействования, в том числе, в герниологии и герниопластике, в частности
– при эндопротезировании брюшной стенки легкими протезами.
Цель исследования – экспериментальным путем изучить влияние клеток костного мозга на течение раневого процесса после подкожной имплантации легкого полипропиленового протеза на апоневроз прямых мышц живота.
Материалы и методы исследования
Эксперименты проводились в НИИ «Экспериментальная медицина» ФГБОУ ВО «Курский государственный медицинский университет» Минздрава России. В качестве подопытных животных использовались 30 кроликов породы «Шиншилла» с соблюдением международных требований к выполнению экспериментальных исследований. Сформированы две равнозначных группы, в каждой из которых было по 15 животных.
Как в первой, так и во второй группе выполняли подкожную имплантацию легкого полипропиленового протеза на апоневроз прямых мышц живота. Животным в первой группе клетки костного мозга не вводились. Во второй группе после имплантации протеза проводили забор клеток костного мозга из гребня подвздошной кости кролика с помощью иглы для спинномозговой пункции объемом 2,5 мл. Затем вводили клетки костного мозга по 0,5 мл под центр протеза и в область четырех его углов в места, с которых начинается процесс отторжения импланта.
После выведения животных из эксперимента на 3-и, 7-е, 14-е, 21-е, 30-е сутки после операции иссекали участок передней брюшной стенки кролика вместе с имплантированным протезом для проведения стандартного гистологического исследования. При морфологическом исследовании обращали внимание на динамику клеток воспалительного и фибробластического ряда. Образование и зрелость коллагеновых волокон, формирование соединительнотканной капсулы.
Результаты исследования
В результате проведенного исследования была получена следующая морфологическая картина. На 3-и сутки в обеих группах в тканях передней брюшной стенки визуализируются оптические пустоты из-под нитей протеза и остатки шовного материала. В контрольной группе без введения клеток костного мозга отмечаются незначительные кровоизлияния, очаговые участки некроза и выраженная периваскулярная полиморфноклеточная инфильтрация. В подлежащих тканях наблюдаются признаки интерстециального отека. Место имплантации протеза пропитано нейтрофилами, лимфоцитами и тучными клеток, которые находятся в стадии дегрануляции. Волокна соединительной ткани находятся на начальном процессе формирования, тонкие и незрелые. Клеток фибробластического ряда нет (Рис. 1 А). В основной группе после введения клеток костного мозга воспалительная инфильтрация нейтрофилами менее вы-

ражена, преобладают лимфоциты, появились единичные фибробласты и макрофаги. Вокруг нитей эндопротеза клеточный компонент преобладает над незрелыми соединительнотканными волокнами. Более зрелые волокна расположены преимущественно в нижележащих отделах (Рис. 1 Б).
На 7-е сутки в первой группе воспалительная инфильтрация вокруг протеза сохраняется, но стала менее выраженной. Появились единичные гигантские многоядерные клетки с наличием 2–3 темнобазофильных ядер в непосредственной близости к нитям эндопротеза. Волокнистый компонент начинает преобладать над клеточным. С наружной и внутренней стороны эндопротеза отмечается начало образования грануляционной ткани с большим количеством щелевидных сосудов (Рис. 2 А). Во второй группе нейтрофильная инфильтрация тканей отсутствует, происходит активная миграция клеток фибробластического ряда: фибробластов и макрофагов. Наблюдается процесс активного коллагеногенеза. Однако, пучки коллагеновых волокон располагаются лишь со стороны нижележащих сохраненных тканей (Рис. 2 Б).
На 14-е сутки в первой группе без стимуляции репаративных процессов в области имплантации эндопротеза визуализируются обширные участки грануляционной ткани. При этом в непосредственной близости к нитям отмечается разделение на клеточную часть и следующую за ней волокнистую часть. В поле зрения большое количество фибробластов, макрофагов гигантских многоядерных клеток. Воспалительной инфильтрации нет (Рис. 3 А). Во второй группе после введения клеток костного мозга формируется незрелый соединительнотканный каркас перипротезной капсулы. Вокруг нитей протеза располагаются тонкие соединительнотканные волокна, более упорядоченно и плотно, в сравнении с предыдущим сроком эксперимента. Кнаружи от них определяются более зрелые коллагеновые волокна (Рис. 3 Б).
На 21-е сутки в первой группе вокруг нитей легкого эндопротеза сформировалась незрелая соединительнотканная капсула, которая представлена двумя слоями. Внутренний слой перипротезной капсулы состоит из клеток фибробластического ряда, а наружный из незрелых коллагеновых волокон. Отмечается также увеличение числа гигантских многоядерных клеток с увеличением количества ядер в них, до 6–8 (Рис. 4 А). В группе с введением клеток костного мозга вокруг нитей эндопротезов образовано достаточно зрелая соединительнотканная капсула с четкой анизотропией волокнистого компонента. Появляется зона «напряжения» в виде участка более плотного прилегания коллагеновых волокон друг к другу (Рис. 4 Б).
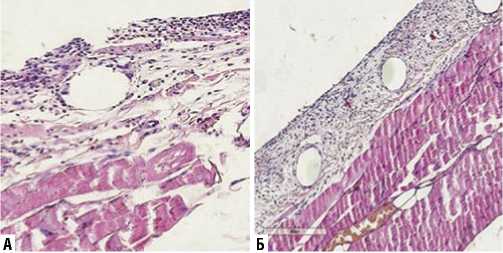
Рис. 1. Микрофотография фрагмента передней брюшной стенки, с имплантацией эндопротеза на 3-и сутки эксперимента. А – без введения клеток костного мозга. Б – с введением клеток костного мозга. Окрашено гематоксилином и эозином. Ув. х 200.
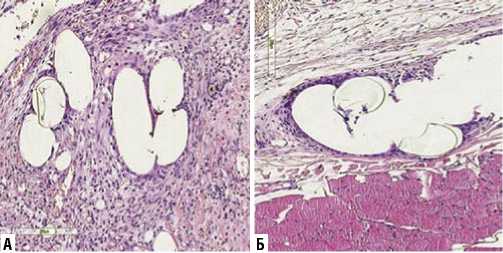
Рис. 3. Микрофотография фрагмента передней брюшной стенки, с имплантацией эндопротеза на 14-е сутки эксперимента. А – без введения клеток костного мозга. Б – с введением клеток костного мозга. Окрашено гематоксилином и эозином. Ув. х 200.
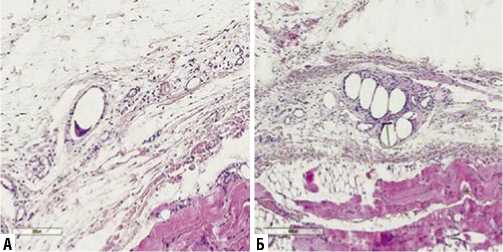
Рис. 2. Микрофотография фрагмента передней брюшной стенки, с имплантацией эндопротеза на 7-е сутки эксперимента. А – без введения клеток костного мозга. Б – с введением клеток костного мозга. Окрашено гематоксилином и эозином. Ув. х 200.
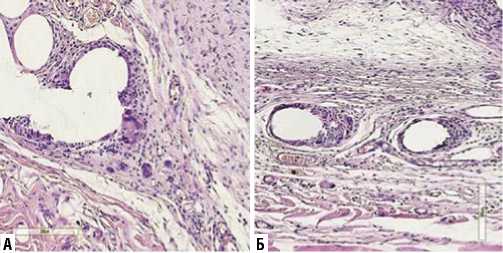
Рис. 4. Микрофотография фрагмента передней брюшной стенки, с имплантацией эндопротеза на 21-е сутки эксперимента. А – без введения клеток костного мозга. Б – с введением клеток костного мозга. Окрашено гематоксилином и эозином. Ув. х 200.

Суковатых Б.С., Назаренко П.М., Пашков В.М. и др.
ВЛИЯНИЕ КЛЕТОК КОСТНОГО МОЗГА НА РЕПАРАТИВНЫЕ ПРОЦЕССЫ ПРИ ЭНДОПРОТЕЗИРОВАНИИ БРЮШНОЙ СТЕНКИ (ЭКСПЕРИМЕНТАЛЬНОЕ ИССЛЕДОВАНИЕ)
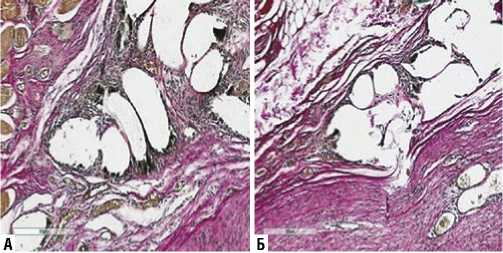
Рис. 5. Микрофотография фрагмента передней брюшной стенки, с имплантацией эндопротеза на 30-е сутки эксперимента. А – без введения клеток костного мозга. Б – с введением клеток костного мозга. Окрашено по Ван Гизон. Ув. х 200.
На 30-е сутки эксперимента в обеих экспериментальных группах происходит образование перипротезной соединительнотканной капсулы. Однако наблюдаются их морфофункциональные отличия. В группе без введения клеток костного мозга отмечается «расслоение» капсулы. Во внутреннем ее слое содержатся незрелые коллагеновые волокна, с преобладанием клеточного компонента. Волокна расположены не плотно, без преимущественной анизотропии. В наружном слое капсулы происходит упорядочивание и структуризация волокон соединительной ткани (Рис. 5 А). Во второй группе соединительнотканная капсула состоит только из зрелых коллагеновых волокон, которые плотно и параллельно прилегают друг к другу (Рис. 5 Б).
Обсуждение
Воспалительная реакция тканей реципиента на имплантацию легкого протеза резко выражена в течение первых 3 суток эксперимента. К 7-м суткам интенсивность ее снижается и полностью нивелируется на 14-е сутки. Введение клеток костного мозга позволяет снизить интенсивность воспаления тканей реципиента на 3-и сутки и полностью прекратить на 7-е сутки. Фибробластическая реакция у животных первой группы начинается на 7-е, достигает своего пика на 14-е и заканчивается на 21-е сутки эксперимента. Во второй группе уже на 3-и сутки отмечено появление в ране клеток соединительной ткани. Пик реакции развивается на 7-е и заканчивается на 14-е сутки эксперимента. Процесс формирования соединительнотканной капсулы в первой группе начинается на 7-е, а к 21-м сутки формируется капсула, состоящая из незрелых коллагеновых волокон. Даже к 30-м суткам достаточно прочная капсула остается не сформированной. Во второй группе у животных уже на 14-е сутки формируется незрелая соединительнотканная капсула, а к 21-м суткам процесс ее формирования заканчивается.
Заключение
Введение клеток костного мозга в зону имплантации легкого полипропиленового протеза позволяет купировать воспалительную реакцию в тканях и достичь пика фибробластического процесса на 7-е сутки, полностью сформировать соединительнотканную капсулу к 2-м суткам эксперимента. Предложенный способ стимуляции репаративных процессов может применяться при эндопротезировании брюшной стенки с использование легких и сверхлегких протезов.


