Влияние компонентов плазмы крови на процесс заживления кожных ран (экспериментальное исследование)
Автор: Горбач Е.Н., Петровская Н.В., Гребнева О.Л.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 2, 2007 года.
Бесплатный доступ
Показаны результаты исследования по определению воздействия компонентов плазмы крови, взятой от собак-доноров, находящихся на этапе дистракции при удлинении конечности по Илизарову, на процесс заживления кожных ран. Эксперимент выполнен на 17 взрослых беспородных собаках, которым создавали полнослойную кожную рану в области лопатки. При помощи гистологических методов исследования выявлено, что применение полученной фракции способствует сокращению сроков заживления и активизации перестройки рубцовой ткани в кожу.
Кожная рана, аллоплазма крови, чрескостный остеосинтез
Короткий адрес: https://sciup.org/142121003
IDR: 142121003
Текст научной статьи Влияние компонентов плазмы крови на процесс заживления кожных ран (экспериментальное исследование)
Заживление полнослойных кожных ран обычно заканчивается формированием эпители-зированного соединительнотканного рубца [1, 3], при этом образовавшийся рубец не перестраивается в кожу в течение длительного срока наблюдения [4, 6]. Достаточно большое количество исследований было посвящено разработке способов стимуляции перестройки рубца в дерму [5, 8, 10, 11, 12]. Однако, несмотря на существование множества различных методов лечения кожных ран, эта проблема остается актуальной. В последнее время большое внимание уделяется влиянию факторов роста на процесс регенерации кожного покрова [2, 7, 9].
Известно, что в период дистракции в сыворотке крови животных и человека обнаруживаются большие концентрации биологически активных веществ различных классов, в том числе факторы роста: трансформирующий фак- тор роста бета-1, -2, -3, инсулиноподобный фактор роста –1, 2, кислый и основной факторы роста фибробластов и многие другие [14-17]. Возможно, что они играют существенную роль в феномене стимуляции остеорепарации у реципиентов посредством введения сыворотки крови от доноров с активным остеогенезом [13]. Мы предположили, что стимулирующий эффект такой сыворотки на заживление кожных ран может быть связан с фракцией с физикохимическими свойствами инсулиноподобных факторов роста - низкомолекулярных белков кислой природы. Целью исследования явилось определение возможности воздействия на процесс заживления кожных ран компонентами плазмы крови, взятой от собак-доноров, находящихся на этапе дистракции при удлинении конечности по Илизарову.
МАТЕРИАЛЫ И МЕТОДЫ
Исследования выполнены на 17 взрослых беспородных собаках, которым в лопаточной области создавали кожный дефект размером 5 мм 30 мм. В I серии (n=5), заживление кожного дефекта происходило естественным образом, во II серии (n=5) животным на поверхность раны накладывали салфетку, смоченную физиологическим раствором, в III серии (n=7) – повязку с раствором фракции из плазмы крови.
Получение препарата для аппликации на рану проводили следующим образом. Из плазмы крови собак, забранной спустя 2-3 недели после начала дистракционного остеосинтеза по Илизарову, по- лучали фракцию, преципитировавшую в диапазоне насыщения сульфата аммония от 33 до 50 %. Полученный материал подвергали гель-проникающей хроматографии на колонке с носителем Toyopearl HW-55 (Toyosoda, Япония). Полипептиды с относительной молекулярной массой 10 кД инкубировали с ДЭАЭ-целлюлозой (Pharmacia, Швеция). После десорбции материала с анионообменника его подвергали диализу против дистиллированной воды и высушивали на устройстве для лиофилизации LyoLab 3000 (USA). Полученные компоненты плазмы крови растворяли в стерильном физиологическом растворе в концентрации 0,2 % и хранили в холодильнике.
Препарат прикладывали к раневой поверхности собак III серии эксперимента дважды в день в течение 15 минут, начиная процедуру на следующий день после операции. Аналогичная манипуляция проводилась с применением стерильного физиологического раствора в опытах II серии.
Материал для исследования получали путем иссечения образовавшегося рубца в пределах здоровых тканей по окончании его эпителиза-ции и через месяц после этого. Манипуляцию проводили в условиях операционной под общим обезболиванием животного. Рану ушивали послойно кетгутовыми и шелковыми нитями. Иссеченную ткань фиксировали в 10 % растворе нейтрального формалина, после этапов обезвоживания и пропитывания – заливали в парафин. Поперечные гистологические срезы окрашивали гематоксилином и эозином, по Ван-Гизону, орсеином по методике Унны-Тенцера.
Полученные препараты исследовали на световом микроскопе фирмы «Opton» (Германия). Измерение площади рубцово-измененной ткани в области кожного дефекта в различные периоды эксперимента осуществляли на оцифрованных изображениях поперечных гистологических срезов при помощи компьютерной программы – анализатора изображений «ВидеоТест - Мастер». Статистическую обработку количественных данных проводили с использованием приложения «Microsoft Exсel» программного продукта «Microsoft Office». Достоверность отличий средних значений оценивали при помощи двухвыборочного t-теста с различными дисперсиями.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В I серии эксперимента заживление кожной раны наступало в среднем через 28,2±3,05 суток, во II серии через 22,6±1,89 суток, в III серии через 18,7±0,71 суток (p 0,01 и p 0,05, при сравнении с показателями I и II серий соответственно).
В этот период эксперимента область дефекта в I и III сериях имела клиновидную форму, а во II серии – форму перевернутой трапеции. В I и II сериях дефект был заполнен незрелой волокнистой соединительной тканью, состоящей из рыхлых формирующихся коллагеновых волокон, между которыми располагались фибробласты разной степени дифференцированности (рис. 1, а). Одни клетки имели вытянутую веретенообразную фор- му и некрупное, базофильно окрашенное ядро, другие – округлую или овальную форму и крупное светлое ядро. Во II серии преобладали волокна, направленные параллельно поверхности кожи.
Среди фибробластов в зоне дефекта встречалось значительное количество клеток на различных стадиях митотического деления (рис. 1, б). Кроме фибробластов, клеточный состав замещающегося дефекта был представлен макрофагами, немногочисленными моноцитами и лейкоцитами, располагающимися в основном в периваскулярных пространствах. Коллагеновые волокна, как правило, не образовывали пучков.
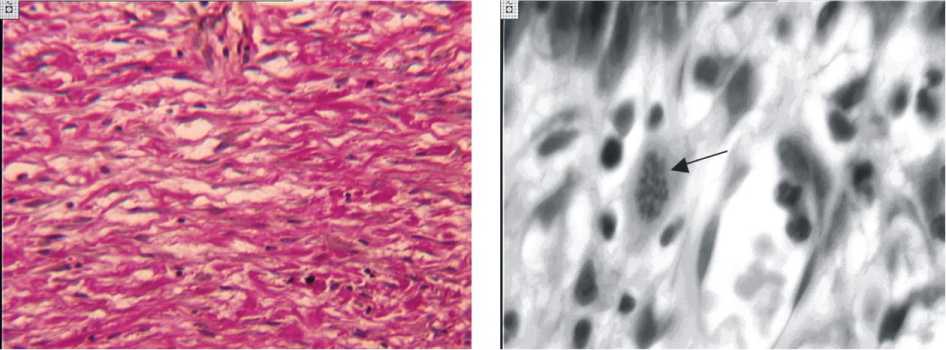
а б
Рис. 1. Гистоструктура формирующейся дермы рубца через 27 суток после операции: а незрелые коллагеновые волокна в зоне рубца. Окраска гематоксилином и эозином. Увеличение 160; б митотическое деление фибробласта (стадия метафазы) наружного участка дермы (стрелка). I серия эксперимента. Окраска гематоксилином и эозином. Увеличение 400
В глубоких слоях формирующейся дермы встречались микрокистозные полости. В зоне дефекта преобладали вертикально расположенные микрососуды с расширенными просветами. Некоторые капилляры были заполнены эритроидной массой. Вокруг большей части сосудов микроцир-куляторного русла и в наружной части дермы обнаруживались круглоклеточные инфильтраты, что свидетельствовало о течении воспалительного процесса. На границе дефекта и краев неповрежденной кожи наблюдались зачатки дериватов (рис. 2).
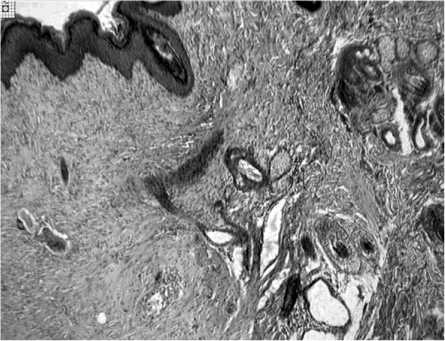
Рис. 2. Новообразованные дериваты кожи и их зачаточные формы на границе рубца и участка неповрежденного кожного покрова. II серия. 22-е сутки эксперимента. Окраска пикрофуксином по Ван-Гизону. Увеличение 25
В III серии эксперимента коллагеновые волокна в области кожного регенерата не имели определенной ориентации, располагались хаотично. Многие волокна объединялись в пучки. Плотность фибробластов в зоне дефекта была увеличена по сравнению с прилежащими участками неповрежденной кожи.
В пограничных с областью рубца тканях количество зачаточных форм дериватов было больше, чем в I и II сериях. В III серии экспериментального исследования в этот период в области дефекта формировались зачатки волосяных фолликулов и сальных желез (рис. 3).
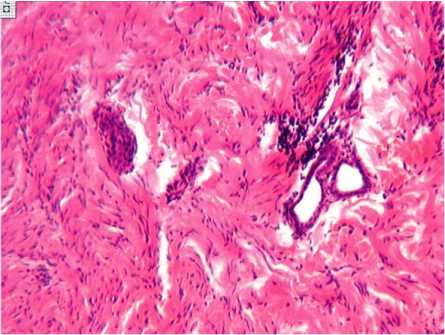
Рис. 3. Развивающиеся формы волосяных фолликулов в зоне перестраивающейся соединительной ткани области дефекта. III серия. 18-е сутки эксперимента. Окраска гематоксилином и эозином. Увеличение 63
Область дефекта во всех случаях была покрыта сформированным эпидермисом. Иногда в пограничных зонах наблюдались акантозы. Роговой слой в этот период имел незначительную толщину. Базальный и шиповатый слои были утолщены за счет увеличения в них клеточных рядов. В базальном слое обнаруживались мито-тически делящиеся эпидермоциты.
Через месяц после заживления в I серии эксперимента поперечный срез рубца имел прямоугольную или клиновидную форму. Внутренняя часть сетчатого слоя дермы была представлена плотной неоформленной волокнистой соединительной тканью. В наружной части сетчатого и в формирующемся сосочковом слоях дермы коллагеновые волокна были расположены параллельно поверхности кожи (рис. 4).
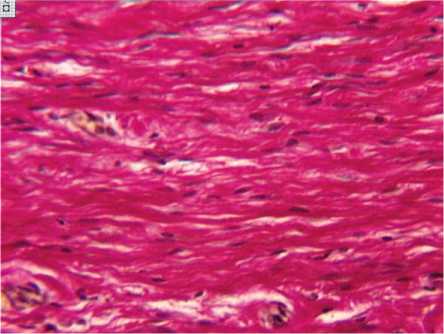
Рис. 4. Коллагеновые волокна в области дефекта через месяц после заживления раны. I серия эксперимента. Окраска гематоксилином и эозином. Увеличение 160
Во II серии поперечный срез рубца имел форму перевернутой трапеции. Дефект заполнялся плотной оформленной волокнистой соединительной тканью. Пучки коллагеновых волокон плотно прилежали друг к другу, между ними располагались фибробласты, незначительное количество макрофагов и лейкоцитов.
В зоне замещающегося кожного дефекта в обеих сериях присутствовало умеренное количество микрососудов. Просветы некоторых из них были расширены и содержали эритроциты. Дериваты в зоне дефекта отсутствовали. Однако развивающиеся их формы обнаруживались на границе области заживающей раны и неповрежденной кожи.
В III серии дефект замещался плотной неоформленной волокнистой соединительной тканью. Коллагеновые волокна в зоне дефекта были достаточно зрелые и образовывали пучки (рис. 5).
Между некоторыми волокнами и их пучками образовывались тканевые промежутки (щели), в которые постепенно проникали сосуды микро-циркуляторного русла. Клеточный состав был представлен в основном фибробластами раз- личной степени дифференцированности. В периваскулярных пространствах наблюдались единичные макрофаги. Эластические волокна в прилежащих к рубцу участках во всех сериях были малочисленны. В зоне дефекта вдоль сосудов наблюдались их незрелые формы.
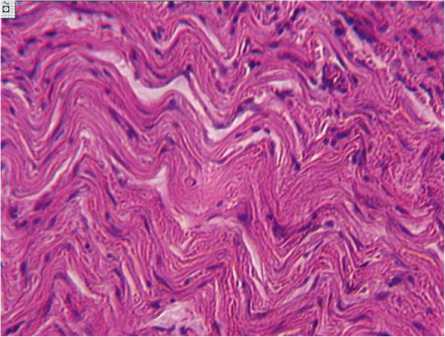
Рис. 5. Пучки коллагеновых волокон извилистой формы в глубоких слоях дермы. III серия эксперимента. 1 месяц после заживления раны. Окраска пикрофуксином по Ван-Гизону. Увеличение 160
В I и II серии область дефекта покрывал утолщенный эпидермис. Рельеф эпидермиса в этих сериях был выражен нечетко. В I серии начинали формироваться гребешки и бороздки. В базальном и шиповидном слоях встречались клетки, находящиеся на различных фазах митотического деления.
В III cерии область дефекта была покрыта сформированным эпидермисом, толщина слоев которого приближалась к норме.
Результаты морфометрического исследования площади, занимаемой рубцово-измененной тканью в период заживления раны показали, что достоверно меньшее ее содержание, по сравнению с I и II сериями, отмечалось в III серии исследования (р 0,05) (табл.). Аналогичные исследуемые величины в I и II сериях достоверных отличий не имели (р 0,05).
Таблица
Площадь рубцово-измененной ткани в области заживающей кожной раны
|
Этапы наблюдения |
Площадь, мм2 (M m) |
||
|
I серия |
II серия |
III серия |
|
|
Заживление |
6 0,23 |
5,75 0,17 |
3,09 0,19 ** |
|
Месяц после |
2,17 0,09 |
3,6 0,14 |
1,74 0,053 * |
|
заживления |
|||
Примечание: подчеркнутый шрифт – различия достоверны, по сравнению с I серией, при р 0,05; * различия достоверны, по сравнению со II серией, при р 0,01; ** различия достоверны, по сравнению со II серией, при р 0,05.
Через месяц после заживления минимальные показатели площади, занимаемой тканью рубцового характера наблюдались в III серии экспери- мента. Они были меньше значений, полученных в I и II сериях, в 1,25 (р 0,05) и 2,1 (р 0,01) раза соответственно. Максимальное содержание рубцово-измененной ткани обнаруживалось во II серии. Ее площадь уменьшалась по сравнению с таковой на момент заживления в 1,59 раза (р 0,05). В I серии через месяц после заживления исследуемые показатели уменьшались в 2,76 раза (р 0,01), в III серии – в 1,77 раза.
В результате проведенных исследований установлено, что во всех сериях период заживления характеризовался эпителизацией поверхности кожной раны и формированием в области дефекта незрелой волокнистой соединительной ткани. Отличительные особенности состояли в cроках заживления раны, наличии в области дефекта кистозных полостей, присутствии (III серия) или отсутствии (I и II серии) зачатков дериватов в области дефекта, степени зрелости волокнистых структур соединительной ткани в области дефекта, выраженностью рельефа эпидермиса.
Наиболее зрелая волокнистая соединительная ткань формировалась в области дефекта через месяц после заживления раны в III серии эксперимента.
По данным морфометрических исследований, применение предложенного биостимулирующего препарата способствовало уменьшению содержания измененной рубцовой ткани в области замещающегося дефекта уже к периоду заживления. Через месяц после эпителизации раны этот эффект еще более усиливался.
Таким образом, полученные результаты показали, что применение компонентов плазмы крови обладает стимулирующим эффектом на процесс регенерации кожных ран, заключающимся в сокращении сроков заживления и постепенном восстановлении органотипического строения дермы. Возможно, что активность выделенной нами фракции плазмы крови обусловлена наличием в ней факторов роста и интерлейкинов, участвующих в обеспечении местных пролиферативных процессов. Не исключено, однако, участие и других механизмов. Так, действующими веществами могут быть полианионы – доноры электронов и активаторов сторожевой полисистемы крови, обеспечивающие гликолитические условия, необходимые для пролиферативных процессов, регуляторные пептиды, продукты и активаторы пероксидации липидов и белков, а также продукты деградации соединительной ткани (дериваты коллагена), вызывающие синтез ее компонентов по механизмам обратной связи. Результаты проведенных исследований доказывают перспективность применения в хирургической практике компонентов плазмы крови, выделенных по разработанной технологии.


