Влияние компонентов сыворотки крови в составе средства для наружного применения на репаративные остео-, керато- и дермогенез в эксперименте
Автор: Гребнева Ольга Леонидовна, Ковинька Михаил Александрович, Силантьева Тамара Алексеевна, Горбач Елена Николаевна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3, 2010 года.
Бесплатный доступ
Изучено действие двух концентраций выделенной из сыворотки крови фракции на репаративную регенерацию кости и кожи при аппликациях в составе средства для наружного применения на мазевой основе «Тизоль» в эксперименте на 30 белых лабораторных мышах. Донорами компонентов сыворотки были животные, которым за трое суток до забора крови осуществляли закрытый перелом костей голени. Реципиентами средства были животные, которым моделировали перелом ребра. Доказано, что применение только мазевой основы, а также фракции плазмы крови в большей концентрации не оказывает статистически значимого влияния на численность клеток линий остео- и хондробластического рядов, тогда как меньшая концентрация компонентов крови вызывает выраженный остеоиндуцирующий эффект. Благоприятное воздействие на керато- и дермогенез отмечали в обеих экспериментальных группах; наиболее выраженным этот эффект был в группе с большей концентрацией компонентов сыворотки крови.
Остеогенез, кератогенез, дермогенез, сыворотка крови, мазевые аппликации, эксперимент
Короткий адрес: https://sciup.org/142121330
IDR: 142121330
Текст научной статьи Влияние компонентов сыворотки крови в составе средства для наружного применения на репаративные остео-, керато- и дермогенез в эксперименте
Проблема сокращения сроков восстановления целостности костей при их нарушениях остается одной из основных в травматологии. Решение ее включает поиск путей влияния на репаративный остеогенез, одним из которых является коррекция регенераторных процессов с помощью фармакологических средств. Ранее проведенные исследования показали эффективность внутритканевого введения полипептидных компонентов сыворотки крови доноров с активным остеогенезом. Лиофилизированные компоненты сыворотки крови с молекулярной массой около 20-30 кД при местном введении в незрелую прослойку дистракционного регенерата ускоряли его минерализацию в экспе- риментальных и клинических условиях [3, 1]. Кроме того, были получены данные о стимулирующем влиянии низкомолекулярных (около 10 кД) компонентов сыворотки крови животных, полученной на этапах лечения травматического повреждения и применяемой в виде инъекций и накожных аппликаций, на репаративный керато- и дермогенез [2].
Целью настоящего исследования явилось изучение действия компонентов сыворотки крови с молекулярной массой около 20-30 кД на репаративную регенерацию кости и кожи при аппликациях в составе средства для наружного применения.
МАТЕРИАЛ И МЕТОДЫ ИССЛЕДОВАНИЯ
Эксперименты проведены в соответствии с этическими нормами работы с лабораторными животными, отраженными в «Европейской конвенции по защите позвоночных животных, ис- пользуемых для экспериментальных и других научных целей» (Страсбург, 1986).
Донорами компонентов крови были 10 белых лабораторных мышей, которым за трое суток до забора крови осуществляли закрытый перелом костей голени. Выделение фракции включало процедуры преципитации компонентов сыворотки крови насыщенным раствором сульфата аммония, гель-проникающей и ионообменной хроматографии на колонках с носителями «СПС-Био Гидрокси» (Москва, АНО «Синтез полимерных материалов») и ДЭАЭ-целлюлозой (Венгрия, Reanal). В результате выделения получали компоненты сыворотки крови, преципитирующие в диапазоне 30-50 % насыщения соли, с молекулярной массой 20-30 кД, адсорбирующиеся на анионообменнике. Лиофилизированные компоненты плазмы наносили накожно в составе мази. В качестве мазевой основы использовали фармакопейный препарат «Тизоль» (аквакомплекс гли-церосольвата титана), разрешенный к медицинскому применению в качестве субстанции и лекарственного препарата. В литературе имеются сведения о противовоспалительном, протекторном, дегидратирующем, противоотечном и местном анальгезирующем действии данного металлокомплексного соединения; кроме того, гелевая структура «Тизоля» обеспечивает высокую проводимость через ткани, что позволяет использовать его для транскутанной транспортировки различных лекарственных веществ [4].
Эксперименты по изучению влияния компонентов крови выполнены на 20 белых лабораторных мышах самцах массой 22-27 г, которые были объединены в четыре экспериментальные группы, по 5 животных в каждой (табл. 1). Животным под наркозом, осуществляемым с помощью препаратов Рометар и Золетил, через продольный разрез кожных покровов осуществляли пересечение специальными ножницами дорсальной части 9-го левого ребра на расстоянии 4-5 мм от линии остистых отростков. Рану ушивали и обрабатывали клеем БФ-6. Контрольную группу 1 составили животные без дополнительных воздействий после операции по моделированию перелома ребра. Животным остальных групп выполняли накожные мазевые аппликации в области оперативного вмешательства один раз в день со 2-х по 9-е сутки после операции.
Через 10 суток эксперимента проводили эвтаназию животных и выделяли материал для морфологических исследований. Материал исследования составили фрагменты грудной клетки, взятые со стороны повреждения. Также в проекции области травмы забирали фрагменты кожного покрова. Образцы фиксировали в 10 % растворе формалина. Костные фрагменты обезжиривали в ацетоне, декальцинировали в трилоне Б, нейтрализовали в 5 % растворе алюмокалиевых квасцов. Промытый материал обезвоживали и заливали в парафин. Гистологические срезы толщиной 5-7 мкм окрашивали гематоксилином и эозином. Светооптическое исследование проводили на микроскопе «Микмед 5» («ЛОМО», Россия). На гистологических препаратах исследовали фрагменты тел реберных костей, включающие зону сращения перелома и прилежащие участки костных отломков. Для выполнения гистомор-фометрического исследования на проекционном экране микроскопа Visopan ("Reichert-Jung", Австрия) размещали тестовую систему в виде решетки с ячеями известной площади. В произвольно выбранных, не перекрывающихся полях зрения производили подсчет количества клеток хондробластической и остеобластической линий дифференцировки, а также остеокластов. Остеоиндуцирующий эффект тестируемых препаратов оценивали по соотношению количества клеток остеобластической и хондробластической линий дифференцировки в составе периостального костного регенерата. Сравнительную оценку состояния кожного покрова проводили с использованием описательной световой микроскопии и полуколичественным методом. В поле зрения микроскопа при общем увеличении х400 подсчитывали число рядов клеток в эпидермисе, оценивали васкуляризацию и клеточность дермы кожного регенерата, при увеличении ×25 наличие в нем дериватов. Выраженность гистоструктурных изменений в сравнении с кожей интактных животных оценивали как сильную (+++), умеренную (++), слабую (+), очень слабую (±), либо как отсутствие признака ( ).
Таблица 1
Распределение животных по группам
|
Группа |
Воздействие |
|
Контроль 1 |
Операция по моделированию перелома ребра |
|
Контроль 2 |
Операция + (суспензия тизоля) |
|
Опыт 1 |
Операция + (суспензия тизоля + 0,6 % фракция плазмы крови) |
|
Опыт 2 |
Операция + (суспензия тизоля + 1,2 % фракция плазмы крови) |
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
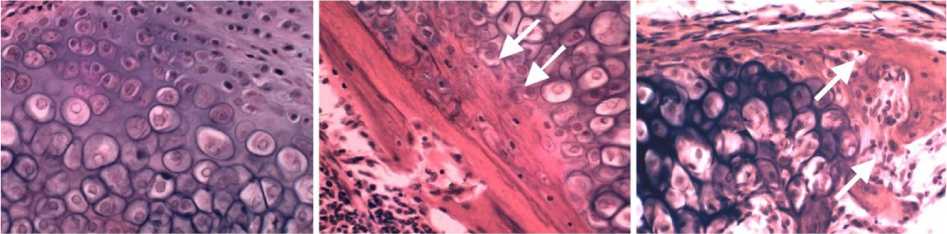
У всех оперированных животных отмечали смещение отломков, соответствующее 0,5-1,0 диаметра реберной кости. В интермедиарной части зоны сращения перелома располагалась рыхлая, реактивно измененная, волокнистая соединительная ткань, бесструктурные массы детрита. На периостальной поверхности ребра формировалась объемная костно-хрящевая мозоль. Прилежащие к компактной пластинке хондроциты были гипертрофированы, в части клеток отмечали дегенеративные изменения. Поверхностно расположенные хондроциты формировали изогенные группы и имели меньший диаметр (рис. 1, а). Новообразованная грубоволокнистая костная ткань наблюдалась в виде тонкого слоя непосредственно на поверхности компактной пластинки кости (рис. 1, б)
и в составе перихондрально образованных костных трабекул (рис. 1, в). Признаков остео- и хондрокластической резорбции не было выявлено.
Данные количественной оценки численности клеток остео- и хондробластической линий дифференцировки, представленные в таблицах 2 и 3, показали, что применение только мазевой основы «Тизоль» (группа «контроль 2»), а также фракции плазмы крови в большей концентрации (группа «опыт 2») не оказывает статистически значимого влияния на численность клеток обеих линий. Кроме того, в группе «опыт 1» отмечено значимое увеличение процентного количества клеток линии остеобластов, что позволяет говорить о выраженном остеоиндуцирующем эффекте в данной группе эксперимента.
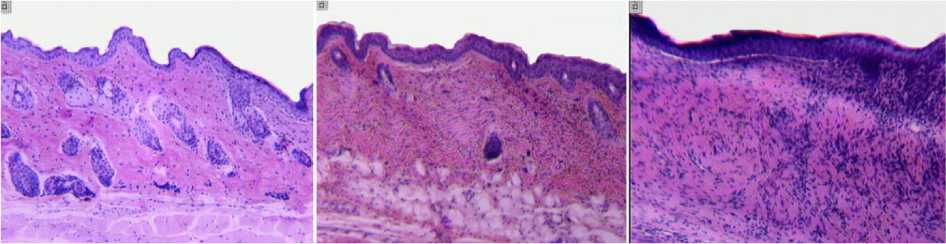
При исследовании кожного покрова в области травмы у животных в группе без применения аппликаций («контроль 1») наблюдали формирование эпителизированного соединительнотканного регенерата с низкой плотностью микрососудов и отсутствием зачатков дериватов. В дермальном слое обнаруживали грубые пучки коллагеновых волокон, ориентированные в основном параллельно поверхности кожи (рис. 2, б). В группе с применением препарата «Тизоль»
(«контроль 2») гистологическая картина была аналогичной (рис. 2, в).
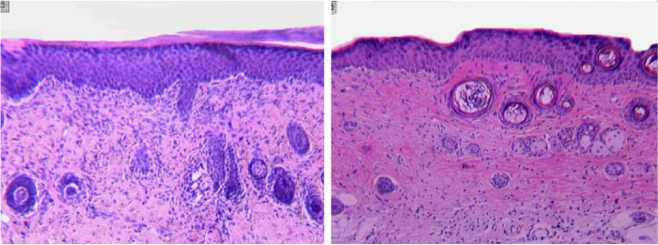
В сравнении с контрольными сериями в кожном регенерате группы «опыт 1» отмечали формирование волосяных фолликулов и зачатков сальных желез (рис. 2, г). Структура кожного покрова области повреждения в cерии «опыт 2» оказалась наиболее приближенной к таковой интактных животных (рис. 2, а). Пучки коллагеновых волокон формировали сетчатое сплетение, наблюдалось значительное количество дериватов кожи. Эпидермис приобретал специфический рельефный рисунок (рис. 2, д).
Клеточный состав в области повреждения кожного покрова у животных контрольных серий был представлен активными фибробластами, периваскулоцитами, лейкоцитами. В опытных сериях преобладали фибробласты. Данные полуколичественного анализа свидетельствуют о том, что к нормальному строению были наиболее приближены регенераты кожного покрова животных опытных серий эксперимента. Наибольшая выраженность стимулирующего эффекта компонентов плазмы крови отмечалась в серии «опыт 2» (таблица 4).
А Б В
Рис. 1. Микрофото периостальной костно-хрящевой мозоли в эксперименте по моделированию перелома реберной кости мыши. Срок эксперимента – 10 суток после операции. А – хондроциты поверхностной и глубокой зон, контроль 2. Б – новообразованная грубоволокнистая костная ткань на периостальной поверхности компактной пластинки (указана стрелками), опыт 2. В – перихондрально образованная грубоволокнистая костная трабекула (указана стрелками), опыт 1. Окраска гематоксилином и эозином. Ок. 10, об. 40
Таблица 2
Количество клеток остеобластической (Ост) и хондробластической (Хондр) линий дифференцировки на единицу площади периоста (0,0025 мм2)
|
Контроль 1 |
Контроль 2 |
Опыт 1 |
Опыт 2 |
|||||||||
|
Ме* |
25* |
75* |
Ме |
25 |
75 |
Ме |
25 |
75 |
Ме |
25 |
75 |
|
|
Ост |
0,733 |
0,533 |
0,983 |
0,633 |
0,617 |
0,683 |
2,600 |
2,217 |
3,050 |
0,317 |
0,300 |
0,417 |
|
Хондр |
7,32 |
6,58 |
7,38 |
6,10 |
5,70 |
7,67 |
5,33 |
5,07 |
5,48 |
6,25 |
6,15 |
7,60 |
*Ме – медиана, 25 и 75 – соотвествующие процентили.
Таблица 3
Уровни достоверности различий между группами по W-критерию Вилкоксона
|
Сравнение групп |
Остеобласты / остеоциты |
Хондробласты/хондроциты |
|
|
Контроль 2 |
Контроль 1 |
0,500 |
0,377 |
|
Опыт 1 |
Контроль 1 |
0,005 |
0,014 |
|
Опыт 2 |
Контроль 1 |
0,105 |
0,417 |
|
Опыт 1 |
Контроль 2 |
0,008 |
0,047 |
|
Опыт 2 |
Контроль 2 |
0,037 |
0,338 |
Таблица 4
Полуколичественная оценка гистоструктурных компонентов кожного покрова в области повреждения ребра
|
Серии эксперимента |
Число рядов клеток в эпидермисе |
Клеточность в дерме |
Наличие дериватов |
Васкуляризация |
|
Контроль 1 |
5-8 |
+++* |
― |
± |
|
Контроль 2 |
7-9 |
+++ |
― |
+ |
|
Опыт 1 |
4-6 |
++ |
± |
+ |
|
Опыт 2 |
3-5 |
+ |
++ |
+ |
|
Норма |
1-2 |
± |
+++ |
++ |
*Степени выраженности признака: (+++) - сильная, (++) - умеренная, (+)- слабая, (±) - очень слабая, (—) - отсутствие признака.
ОБСУЖДЕНИЕ
А
В
Рис. 2. Гистоструктура кожного регенерата, формирующегося в области повреждения через 10 суток эксперимента:
А - кожа интактного животного;
Б - контроль 1;
В - контроль 2;
Г - опыт 1;
Д - опыт 2.
Окраска гематоксилином и эозином. Ок. - 10, об. - 2,5
Б
Г
Д
Более ранние исследования, проведенные в Центре, показали эффективность тестируемых компонентов в отношении репаративного остеогенеза при местных инъекциях в растворе. Настоящее исследование позволило установить, что применение компонентов плазмы крови обладает биологической активностью в составе средства для наружного применения на основе аквакомплекса глицеросольвата титана. Направленность действия и степень выраженности этих эффектов зависит от концентрации компонентов плазмы крови. Нами также установлено, что накожные аппликации выбранной концентрации чистого препарата «Тизоль» не оказывают влияния на заживление перелома реберной кости и восстановление поврежденного кожного покрова экспериментальных животных.
Данные литературы позволяют предположить, что активность выделенной нами фракции плазмы крови обусловлена наличием в ней факторов роста и интерлейкинов, участвующих в обеспечении местных пролиферативных процессов. Общими стимуляторами для регенерации кости и кожи являются множество цитоки- нов: трансформирующие факторы роста (ТФР), тромбоцитарные факторы роста, факторы роста фибробластов и другие цитокины [5, 19, 26, 28].
Так, установлено, что ТФРР играет важную роль при образовании, ремоделировании и репарации кости и кожи [20, 22, 28]. Было обнаружено, что ТФРР способен ингибировать костную резорбцию, индуцируемую другими факторами [23], повышать активность щелочной фосфатазы (КФ 3.1.3.1) [21], являющейся маркером костеобразования. Однако в зависимости от условий культивирования и наличия других регуляторов роста ТФРР может играть роль ингибитора пролиферативных и биосинтетических процессов в тех же клетках, на которые он производил стимулирующий эффект [27, 33]. Так, имеются данные, что в некоторых системах он стимулирует костную резорбцию [39], предположительно действуя на синтез простагландинов [8]. В определенных условиях ТФРР ингибирует активность остеобластов [18], снижает в них активность щелочной фосфатазы в зависимости от дозы и срока инкубации [31]. При исследовании кератогенеза обнаружено, что ТФРР действует на клетки в зависимо- сти от их степени дифференцировки [38].
Возможно, что причиной обнаруженной нами репаративной активности является фактор роста сосудистого эндотелия (VEGF), обнаруженный в плазме крови [9]. Доказано, что ангиогенная активность плазмы крови пациентов, перенесших травму, зависит от наличия в ней VEGF, источником которого является гематома [17,30]. Известно также, что что VEGF играет важную роль в эндохондральном костеобразовании [29, 37, 10 24]. Локальное применение экзогенного VEGF стимулирует процесс костеобразования в области перелома бедренной кости мышей и в дефектах лучевой кости кроликов [35]. Изучение механизмов действия показало, что помимо паракринных эффектов [7, 15, 13], VEGF может действовать непосредственно на остеобласты. Остеобласты синтезируют VEGF при реакции на различные стимулы [11, 16, 32]. Рецепторы VEGF экспрессируются в клетках линии дифференцировки остеобластов [12, 36, 14] и при заживлении пере- ломов у мышей [6]. Выбранные нами сроки и длительность воздействия препарата определяются тем, что, по данным литературы, у грызунов локальные уровни эндогенного VEGF достигают максимума через 5 дней и падают до нормальных уровней спустя 10 дней после перелома [25] или костной травмы [34].
Известно, что действие факторов роста характеризуется пермиссивностью, т.е. зависимостью от присутствия в среде других эффекторов. Возможно, что обнаруженный эффект является следствием оптимального соотношения компонентов плазмы крови. Выяснение этих вопросов является предметом дальнейших исследований.
Таким образом, полученные результаты свидетельствуют о перспективности применения в хирургической практике компонентов плазмы крови в сочетании с препаратом для наружного применения «Тизоль».


