Влияние короткоцепочечных жирных кислот на холинергическую регуляцию сокращений толстой кишки мыши в модели синдрома раздраженного кишечника
Автор: Шайдуллов И.Ф., Хаертдинов Н.Н., Шарафутдинова Д.Н., Порфирьев А.Г., Абдулхаков С.Р., Каримова Р.Г., Ситдикова Г.Ф.
Статья в выпуске: 1 т.249, 2022 года.
Бесплатный доступ
Синдром раздраженного кишечника (СРК) относится к многофакторным заболеваниям, одним из симптомов которого является нарушение двигательной функции кишечника. Целью нашей работы был анализ влияния КЖК на сокращения сегмента проксимального отдела толстой кишки мыши, вызванных активацией рецепторов ацетилхолина, при моделировании СРК. Мыши в модели СРК продемонстрировали висцеральную гиперчувствительность, при этом гистологический анализ ткани толстого кишечника не выявил значительных отличий в двух группах. Анализ КЖК показал значительное увеличение концентраций уксусной, пропионовой и масляной кислот в фекалиях мышей СРК группы. При исследовании холинергической регуляции сократительной активности сегмента толстой кишки было выявлено, что в контроле бутират натрия, пропионат натрия и ацетат натрия приводили к угнетению сократительных ответов, вызванных карбахолином – неспецифическим агонистом М- и Н-холинорецепторов и эпибатидином – специфическим агонистом Н-холинорецепторов, при этом ответ на аппликацию бетанехола – агониста М-холинорецепторов не изменялся. В условиях моделирования СРК ингибиторные эффекты КЖК на сокращения, вызванные карбахолином и эпибатидином, не проявлялись. Полученные данные свидетельствуют о том, что в поствоспалительной модели СРК мыши наряду с увеличением уровня КЖК, изменяются их эффекты на сократительную активность толстого кишечника, что может быть одним из факторов усиления моторики при СРК.
Синдром раздраженного кишечника, висцеральная гиперчувствительность, короткоцепочечные жирные кислоты, М- и Н-холинорецепторы, сокращения толстой кишки
Короткий адрес: https://sciup.org/142234708
IDR: 142234708 | УДК: 591.1:591.2:612.3:616-092 | DOI: 10.31588/2413_4201_1883_1_249_240
Текст научной статьи Влияние короткоцепочечных жирных кислот на холинергическую регуляцию сокращений толстой кишки мыши в модели синдрома раздраженного кишечника
Синдром раздраженного кишечника Однако, роль КЖК в развитии
(СРК) это функциональное расстройство двигательной дисфункции при СРК желудочно-кишечного тракта, которое практически не изучена.
характеризуется хронической Целью нашей работы было абдоминальной болью, дискомфортом, проанализировать висцеральную вздутием живота и нарушениями в работе гиперчувствительность, морфологию кишечника [7]. Механизмы развития СРК стенки толстой кишки и уровень КЖК в до конца не выяснены, а этиологические модели пост-воспалительной СРК у мыши.
факторы включают висцеральную Кроме того, исследовано влияние КЖК на гиперчувствительность, нарушения холинергическую регуляцию сокращений эпителиальной проницаемости и моторики препарата толстой кишки мыши при СРК.
желудочно-кишечного тракта, умеренное Материал и методы исследований.
воспаление, дисбиоз, и, как следствие, Эксперименты проводились на самцах изменения в оси кишечник-мозг [6, 7]. белых лабораторных мышей в соответствие
Перистальтика желудочно-кишечного c Директивой Совета Европейских тракта и секреция слизи, а также сообществ (24 ноября 1986 года;
чувствительность к механическим или 86/609/EEC) и одобрены Локальным химическим сенсорным стимулам могут этическим комитетом КФУ (протокол № 8
быть изменены вследствие нарушений в от 05.05.2015). Модель СРК была энтеральной нервной системе [4, 9, 11]. индуцирована у мышей путем
Данные последних лет указывают на интраректальной инфузии 1 % уксусной значительную роль микробиоты кишечника кислоты в возрасте Р10-Р21, что вызывает и ее метаболитов в развитии СРК [6]. умеренное воспаление и впоследствии
Короткоцепочечные жирные кислоты приводит к висцеральной
(КЖК) образуются кишечными бактериями гиперчувствительности у взрослых в результате ферментации пищевых животных [2]. Гиперчувствительность волокон преимущественно в толстой кишки мышей оценивали в баллах проксимальном отделе толстой кишки, где по шкале интенсивности брюшного их концентрации у человека достигают 70- сгибательного рефлекса (БСР) в ответ на
140 мМ [1]. Помимо обеспечения расширение толстой кишки [16].
кишечного гомеостаза и регуляции водно- Для гистологического анализа электролитного баланса КЖК принимают образцы толстой кишки фиксировали в участие в регуляции моторики [3, 5, 10, 12]. 10 % формалине и обрабатывали с использованием стандартного протокола. Залитые парафином ткани разрезали на срезы толщиной 5 мкм и окрашивали гематоксилином и эозином. Окрашенные препараты оценивались слепым методом двумя независимыми исследователями.
КЖК определяли в образцах кала (1 г) с помощью газожидкостного хроматографического анализа (Agilent, США). В качестве стандартов использовались коммерческие уксусная, пропионовая и масляная кислоты. Анаэробный индекс (Ai) рассчитывали в относительных единицах (о. е.) по формуле: Ai = ΣC3, C4/C2, где C2 – ацетат, C3 – пропионат и C4 – бутират. Общий уровень КЖК представлен как сумма всех концентраций кислот и изокислот в мкг/г.
Сократительная активность сегментов проксимального отдела толстой кишки мыши регистрировалась в изометрических условиях с использованием 4-канальной системы для изолированных органов (Biopac, США). В течение всего эксперимента сегмент толстой кишки омывался аэрированным раствором Кребса. Регистрировали сократительную активность, вызванную аппликацией карбахолина (1 мкМ) – неспецифического агониста М- и Н-холинорецепторов, бетанехола (100 мкМ) – агониста М-холинорецепторов и эпибатидина (10 мкМ) – специфического агониста Н-холинорецепторов. Оценивали максимальную амплитуду сокращения до и после применения КЖК в контрольной группе и группе с моделью СРК.
Статистический анализ проводился методами непараметрического и параметрического анализа с использованием программного обеспечения OriginPro (OriginLab, США). Использовали парный t-критерий Стьюдента или тест ANOVA для множественных сравнений, чтобы определить статистические различия для независимых выборок.
Результат исследований. Нами было обнаружено, что в ответ на растяжение толстой кишки при объемах 0,35 и 0,5 мл показатели БСР в опытной группе были значительно выше, чем в контрольной группе (P<0,05), что указывает на висцеральную гиперчувствительность в модели СРК у мышей (Таблица 1).
Таблица 1 – Показатели брюшного сгибательного рефлекса в ответ на растяжение толстой кишки мышей контрольной и СРК групп
|
Группы |
n |
Объем растяжения, мл |
||||
|
0,1 |
0,25 |
0,35 |
0,5 |
0,65 |
||
|
Контроль |
6 |
0,29±0,11 |
0,86±0,15 |
1,77±0,18 |
2,8±0,12 |
3,64±0,09 |
|
СРК |
6 |
0,5±0,07 |
1,07±0,09 |
2,67±0,08* |
3,86±0,2* |
3,94±0,28 |
*P<0,05 – относительно контрольной группы
Гистологический анализ стенки толстой кишки не выявил различий в морфологии между двумя группами. Существенных структурных повреждений тканей толстой кишки при СРК не наблюдалось. Таким образом, в используемой нами модели поствоспалительной СРК умеренное воспаление в толстой кишке, индуцируемое в ранний постнатальный период, приводит к висцеральной гиперчувствительности у взрослых животных без морфологических изменений стенки толстой кишки [2, 14].
Анализ содержания КЖК и изокислот в фекалиях мышей показал повышение уровней уксусной, пропионовой, масляной и изовалериановой кислоты в образцах от мышей группы с моделью СРК (Рисунок 2). Кроме того, наблюдалось повышение общего уровня изо-кислот с 0,07±0,01 мкг/г в контрольной и до 0,1±0,01 мкг/г в группе мышей с моделью СРК (n=5, P<0,05). Повышение уровней пропионовой и масляной кислот может указывать на активацию условнопатогенной флоры и строгих анаэробов [1]. На это же указывает и снижение значения анаэробного индекса с -0,35±0,05 о.е. в контрольной группе до -0,44±0,05 о.е. при СРК (n=5, P<0,05). Согласно литературным данным у пациентов с СРК также наблюдали высокие концентрации КЖК одновременно представителей
с повышением микрофлоры,
продуцирующих ацетат, пропионат и бутират ( Veillonella и Lactobacillus ) [1, 8, 13].
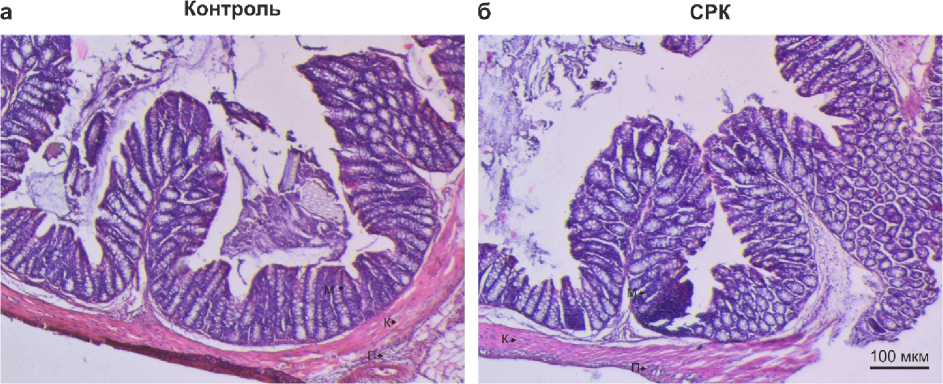
Рисунок 1 – Гистологические образцы стенки толстой кишки у мышей контрольной группы (а) и мышей с моделью СРК (б) в возрасте P45. Срезы окрашены гематоксилином и эозином
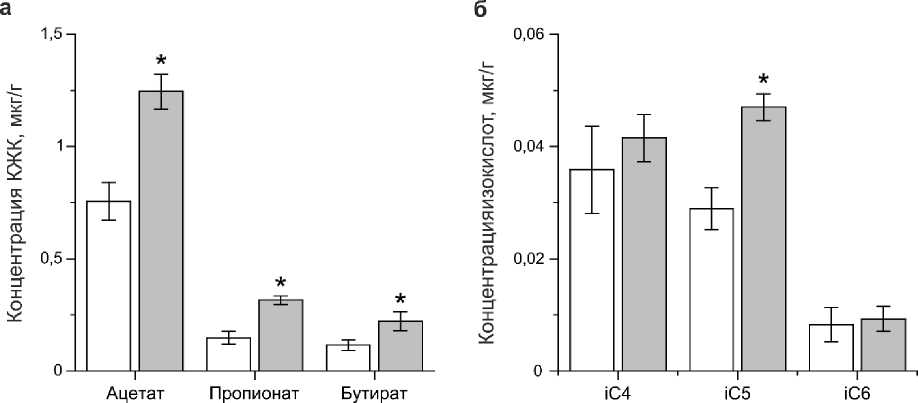
Рисунок 2 – Уровень КЖК в фекалиях мышей контрольной и СРК групп. Концентрации уксусной, пропионовой и бутановой кислот в фекалиях контрольных мышей и мышей с СРК (а). Концентрация изобутановой (iC4), изовалериановой (iC5) и изокапроновой (iC6) кислот в фекалиях контрольной и СРК групп (б). *Р<0,05 – относительной показателей контрольной группы
Далее проанализировано влияние КЖК на холинергические механизмы регуляции сокращения препарата толстой кишки в контроле и при моделировании СРК. Известно, что М-холинорецепторы являются первичной мишенью действия ацетилхолина, активация которых вызывает сокращения гладкомышечных клеток. Кроме того, ацетилхолин активирует Н-холинорецепторы, экспрессирующиеся на энтеральных нервах и усиливающие энтеральную нейротрансмиссию [15]. Добавление агонистов М- и Н-холинорецепторов вызывало резкое увеличение тонуса сегмента кишки: амплитуды сокращений, вызванные карбахолином, бетанехолом и эпибатидином составили 1,85±0,11 г (n=6), 1,95±0,15 г (n=10) и 1,21±0,25 г (n=6), соответственно (Рисунок 3). Инкубация препаратов в ацетате, пропионате или бутирате натрия приводила к значительному снижению амплитуды карбахолин и эпибатидин-вызванных сокращений препарата, что свидетельствует об ингибирующем действии КЖК на Н-холинорецепторы экспрессирующиеся на энтеральных нервных окончаниях (Рисунок 3). При этом бутират натрия обладал наиболее выраженными эффектами на сократительную активность. В условиях СРК эффекты КЖК на карбахолин и эпибатидин вызванные сокращения не проявлялись (Таблица 2).
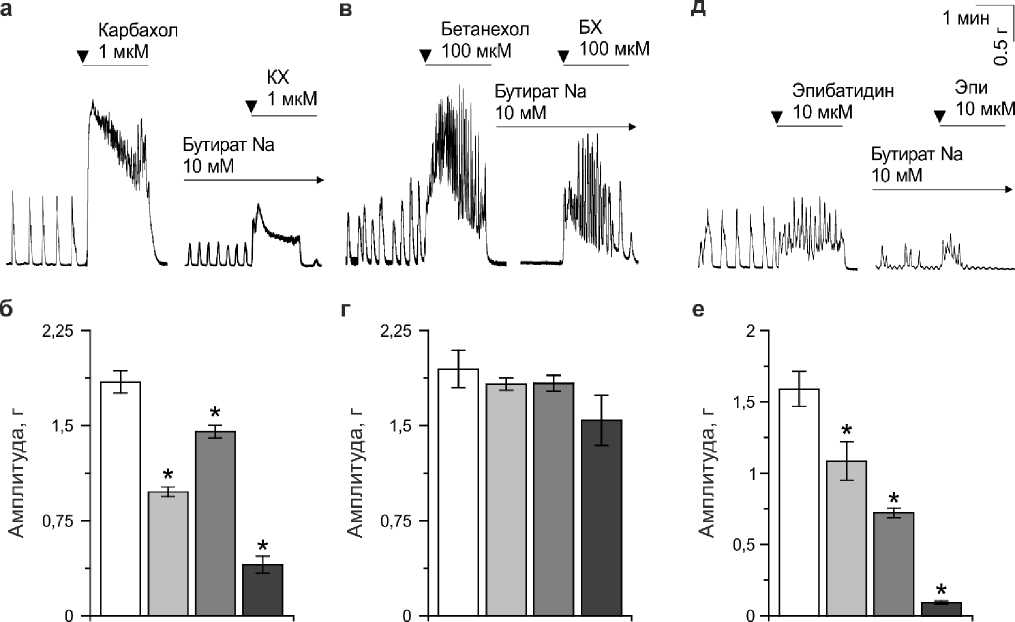
Рисунок 3 – Влияние КЖК на амплитуду вызванных карбахолином, бетанехолом и эпибатидином сокращений сегмента толстой кишки мыши контрольной группы. Оригинальные записи вызванных карбахолином (КХ) (а), бетанехолом (в) и эпибатидином (д) сокращений проксимального отдела толстой кишки мыши до и после инкубации бутановой кислоты (10 мМ). Стрелкой указано время начала аппликации веществ. Амплитуда вызванных карбахолином (б; 1 мкМ), бетанехолом (г) и эпибатидином (е) сокращений толстой кишки до (белый) и после инкубации в ацетате натрия (10 мМ; светло-серый), пропионате натрия (10 мМ; серый) и бутирате натрия (10 мМ; черный). *P<0.05 – относительно исходных значений амплитуды вызванных сокращений
Таблица 2 – Эффекты КЖК на амплитуду вызванных карбахолином, бетанехолом и эпибатидином сокращений препарата толстой кишки мыши в модели СРК.
|
Агонисты холинорецепторов |
|||
|
карбахолин |
бетанехол |
эпибатидин |
|
|
Исходные значения |
1,41±0,06 |
0,93±0,16 |
1,39±0,14 |
|
Ацетат натрия |
1,09±0,05 |
0,92±0,04 |
1,13±0,1 |
|
Пропионат натрия |
1,22±0,07 |
0,86±0,07 |
1,28±0,11 |
|
Бутират натрия |
1,07±0,05 |
0,81±0,1 |
0,99±0,18 |
*P<0,05 – относительно контрольной группы
Заключение. Таким образом, в модели пост-воспалительной СРК у мышей наблюдалась висцеральная гиперчувствительность без морфологических изменений стенки толстой кишки. Анализ содержания КЖК в фекалиях выявил повышение концентраций уксусной, пропионовой, масляной и общего уровня изокислот, что согласуется с литературными данными об изменении уровня КЖК у пациентов с СРК [8, 13]. Анализ влияния КЖК на вызванные активацией М- и Н-холинорецепторов сокращения препарата толстой кишки показал, что КЖК подавляют ответы, вызванные аппликацией карбахолина и эпибатидина, не влияя на ответы, вызванные аппликацией бетанехола. Эти данные указывают на то, что эффекты КЖК опосредуются через Н-холинорецепторы энтеральных нервных окончаний, усиливающих энтеральную нейротрансмиссию [15]. В условиях СРК ингибирующие эффекты КЖК не проявлялись, что, по-видимому, может быть связано с изменением экспрессии или регуляции активности ионных каналов и рецепторов, отвечающих за сократительную активность, что может быть одним из факторов усиления моторики при СРК. Работа поддержана грантом РФФИ №19-315-90084.
Список литературы Влияние короткоцепочечных жирных кислот на холинергическую регуляцию сокращений толстой кишки мыши в модели синдрома раздраженного кишечника
- Бельмер, С. В. Короткоцепочечные жирные кислоты в лечении функциональных заболеваний кишечника у детей: теоретическое обоснование и практическое применение / С. В. Бельмер, М. Д. Ардатская, А. Н. Акопян. – Москва: Прима Принт, 2015. – 48 с.
- Al-Chaer, E. D. A new model of chronic visceral hypersensitivity in adult rats induced by colon irritation during postnatal development / E. D. Al-Chaer, M. Kawasaki, P. J. Pasricha // Gastroenterology – 2000. – Vol. 119 – N. 5 – P. 1276-1285.
- Cherbut, C. Motor effects of shortchain fatty acids and lactate in the gastrointestinal tract / C. Cherbut // Proceedings of the Nutrition Society. – 2003. – Vol. 62 – N. 1 – P. 95–99.
- Chey, W. Y. Colonic motility abnormality in patients with irritable bowel syndrome exhibiting abdominal pain and diarrhea / W. Y. Chey, H. O. Jin, M. H. Lee, S. W. Sun, K. Y. Lee // American Journal of Gastroenterology – 2001. – Vol. 96 – N. 5 – P. 1499-1506.
- Dass, N. B. The relationship between the effects of short-chain fatty acids on intestinal motility in vitro and GPR43 receptor activation / N. B. Dass, A. K. John, A. K. Bassil, C. W. Crumbley [et al.] // Neurogastroenterology and Motility. – 2007. – Vol. 19 – N. 1 – P. 66-74.
- Drossman, D. A. AGA technical review on irritable bowel syndrome / D. A. Drossman, M. Camilleri, E. A. Mayer, W. E. Whitehead // Gastroenterology. – 2002.– Vol. 123 – N. 6 – P. 2108-2131.
- Enck, P. Irritable bowel syndrome / P. Enck, Q. Aziz, G. Barbara, A. D. Farmer [et al.] // Nature Reviews Disease Primers – 2016. – Vol. 2 – P. 1-24.
- Gargari, G. Fecal Clostridialesdistribution and short-chain fatty acids reflect bowel habits in irritable bowel syndrome / G. Gargari, V. Taverniti, C. Gardana, C. Cremon [et al.] // Environmental Microbiology. – 2018. – Vol. 20 – N. 9 – P.3201-3213.
- Gwynne, R. Synaptic Transmission at Functionally Identified Synapses in theEnteric Nervous System: Roles for Both Ionotropic and Metabotropic Receptors/ R. Gwynne, J. Bornstein // Current Neuropharmacology. – 2007. – Vol. 5 – N. 1 – P. 1-17.
- Ono, S. Short-chain fatty acids decrease the frequency of spontaneous contractions of longitudinal muscle via enteric nerves in rat distal colon / S. Ono, S. I. Karaki, A. Kuwahara // Japanese Journal of Physiology. – 2004. – Vol. 54 – N. 5 – P. 483493.
- Peiris, M. Peripheral Kv7 channels regulate visceral sensory function in mouseand human colon / M. Peiris, J. R. F. Hockley, D. E. Reed, E. S. J. Smith, D. C. Bulmer, L. A. Blackshaw // Molecular Pain. – 2017. – Vol. 13 – P. 1-16.
- Shaidullov, I. F. Short chain fatty acids and colon motility in a mouse model of irritable bowel syndrome / I. F. Shaidullov, D. M. Sorokina, F. G. Sitdikov, A. Hermann [et al.] // BMC Gastroenterology. – 2021. – Vol. 21 – N. 1 – P. 1-12.
- Sun, Q. Alterations in fecal shortchain fatty acids in patients with irritable bowel syndrome: A systematic review and meta-analysis / Q. Sun, Q. Jia, L. Song, L. Duan // Medicine (United States) – 2019. – Vol. 98 – N. 7.
- Temiz, T. K. Effect of nitrergic system on colonic motility in a rat model of irritable bowel syndrome / T. K. Temiz, O. Demir, F. Simsek, Y. C. Kaplan [et al.] // Indian Journal of Pharmacology – 2016. – Vol. 48 – N. 4 – P. 424-429.
- Tobin, G. Muscarinic receptor subtypes in the alimentary tract / G. Tobin, D. Giglio, O. Lundgren // Journal of Physiology and Pharmacology. – 2009. – Vol. 60 – N. 1 – P. 3-21.
- Yang, B. Changes of cytokine levels in a mouse model of post-infectious irritable bowel syndrome / B. Yang, X. Zhou, C. Lan // BMC Gastroenterology. – 2015. – Vol. 15 – N. 1 – P. 1-7.


