Влияние криоконсервации на биологические параметры семени у гибридов романовской породы и архара
Автор: Багиров В.А., Иолчиев Б.С., Волкова Н.А., Зиновьева Н.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Криорезистентность сперматозоидов
Статья в выпуске: 2 т.52, 2017 года.
Бесплатный доступ
Криоконсервация генетического материала и искусственное осеменение - важнейшие элементы вспомогательных репродуктивных технологий. Создание криобанков биоматериала, полученного от высокоценных производителей, обеспечивает получение максимально возможного количества потомков. Эта технология позволяет более эффективно использовать генетический материал, сохранять и восстанавливать численность редких и исчезающих видов, а также проводить скрещивание и гибридизацию между изолированными популяциями. Сперматозоиды служат наиболее распространенным биоматериалом, используемым в программах по сохранению и восстановлению генетических ресурсов дикой фауны и домашних животных, что связано с доступностью и легкостью получения спермы. В овцеводстве использование репродуктивной технологии носит локальный характер. Одна из причин этого - низкая эффективность заморожено-оттаян-ного семени, получаемого от баранов-производителей. Замораживание и оттаивание приводят к гибели значительной часть клеток, повреждению их отдельных органелл или сегментов. Свойства спермы гибридных баранов, полученных посредством скрещивания домашних и диких видов Ovis, остаются неизученными. Целью представленного исследования была оценка влияния цикла замораживания и оттаивания на биологические параметры семени баранов-производителей романовской породы и гибридов с архаром ( Ovis ammon ). Материалом для исследований служила сперма гибридных баранов с разной долей кровности по романовской породе и архару: гибрид F1 ( n = 1, 50 % крови архара, получен посредством хирургического осеменения романовской овцы заморожено-оттаянным семенем архара), возвратный кросс BC1 ( n = 5, 25 % крови архара, получен при скрещивании романовских овец с бараном F1), возвратный кросс BC2 ( n = 5, 12,5 % крови архара, получен посредством скрещивания романовских овец с баранами BC1). Сперму романовского барана (ROM) использовали в качестве контроля. Все бараны находились в одинаковых условиях кормления и содержания. Были изучены качественные и количественные показатели свежеполученного и замороженного семени, в частности процентное соотношение подвижных и неподвижных сперматозоидов, их криорезистентность, состояние акросомы и степень конденсации хроматина. При криоконсервации семени, полученного как от гибридных, так и от чистопородных животных, происходило снижение биологической полноценности сперматозоидов. У гибридных животных после криоконсервации подвижность сперматозоидов уменьшалась на 47,0 %, у чистопородных - на 50,0 %. Выявлено повышение криорезистентности у F1 по сравнению с чистопородными животными на 9,0 %, осмотической резистентности - на 20,0 %, дегидрогеназной активности - на 44,5 %. Со снижением доли кровности дикого вида отмечалось нивелирование различий по этим показателям: между группами BC2 и ROM они составляли по криорезистентности 2,2 %, по осмотической резистентности - 4,7 %, по дегидрогеназной активности - 10,0 %, по содержанию интактных акросом - 3,2 %, по аномалии головки сперматозоидов - 1,0 %, по степени фрагментации ДНК - 34,0 %.
Гибриды, архар, криоконсервация, сперматозоиды, замораживание-оттаивание
Короткий адрес: https://sciup.org/142214156
IDR: 142214156 | УДК: 636.32/.38:591.463.1:636.082.12 | DOI: 10.15389/agrobiology.2017.2.268rus
Текст научной статьи Влияние криоконсервации на биологические параметры семени у гибридов романовской породы и архара
Искусственное осеменение — один из основных элементов воспроизводства сельскохозяйственных животных. Эффективное ведение животноводства на современном этапе невозможно без применения этого метода (1-5). Важнейшим звеном вспомогательной репродуктивной технологии считается криоконсервация биологического материала: генеративной плазмы, эмбрионов, половых и соматических клеток (6-8).
Наиболее распространенным генетическим материалом, используемым в программах по сохранению и восстановлению генетических ресурсов дикой фауны и домашних животных, служат сперматозоиды (9). Это связано с доступностью и легкостью получения спермы (5-6 млрд половых клеток на один эякулят). Кроме того, для многих видов животных разра-
∗ Работа выполнена при финансовой поддержке гранта РНФ ¹ 16-14-00039. При проведении исследований было использовано оборудование ЦКП «Биоресурсы и биоинженерия сельскохозяйственных животных» ВИЖ им. академика Л.К. Эрнста.
ботана технология искусственного осеменения с использованием заморо-жено-оттаянного семени.
Криоконсервация спермы позволяет накапливать запас жизнеспособного генеративного материала от высокоценных производителей, более эффективно его использовать, получать максимальное количество потомства, сохранять и восстанавливать численность редких и исчезающих видов, а также проводить скрещивание и гибридизацию между изолированными популяциями. Криоконсервация сперматозоидов состоит из нескольких взаимосвязанных технологических обработок семени, которые приводят к изменениям отдельных структурных единиц сперматозоидов, что часто сопровождается снижением их биологической полноценности (10-14). Показано влияние цикла замораживания-оттаивания на морфологию сперматозоидов (15-19). У всех сельскохозяйственных животных при использовании криоконсервированного семени выход потомства снижается. По мнению ряда исследователей, это связано с уменьшением подвижности сперматозоидов, поскольку для достижения яйцеклетки они должны иметь высокую скорость прямолинейного поступательного движения (20). Низкую вероятность оплодотворения яйцеклетки также имеют сперматозоиды с высокой активностью, но наличием ультраструктурных, биохимических, функциональных повреждений (21, 22).
Применение вспомогательной репродуктивной технологии в овцеводстве носит локальный характер, что связано с невысокой эффективностью криоконсервации семени баранов. Его значительно труднее замораживать, чем сперму других видов млекопитающих. Около 10 % эякулята, полученного от баранов с использованием современных разбавителей и протоколов, криоконсервации не подвергаются (23), в связи с чем требуется оптимизировать технологию криоконсервации сперматозоидов у этого вида животных.
В качестве одного из перспективных способов генетического совершенствования пород овец рассматривается прилитие крови диких видов. Во Всероссийском НИИ животноводства им. Л.К. Эрнста создана модельная популяция, включающая гибридов домашних романовских овец ( Ovis aries ) и архара ( O. ammon ) с разной долей кровности дикого вида. Было показано изменение биологических и продуктивных показателей у особей, несущих кровь диких животных, по сравнению с исходным домашним видом (24, 25). Создан банк семени гибридных животных (26).
В настоящем исследовании мы впервые изучили показатели биологической полноценности семени гибридных баранов с разной долей кров-ности по романовской породе и архару в сравнении с их чистопородными аналогами. Показано влияние криоконсервации на криорезистентность, осмотическую резистентность и дегидрогеназную активность семени. Отмечено повышение этих показателей у гибридных животных, свидетельствующее о более высокой криоустойчивости их семени по сравнению с семенем чистопородных баранов.
Цель представленной работы заключалась в изучении влияния цикла замораживания и оттаивания на биологические параметры сперматозоидов гибридных (с кровью архара) и чистопородных романовских баранов-производителей.
Методика. Материалом для исследований служила сперма гибридных баранов с разной долей кровности по романовской породе и архару: гибрид F1 (n = 1, 50 % крови архара, получен посредством хирургического осеменения романовской овцы заморожено-оттаянным семенем архара), возвратный кросс BC1 (n = 5, 25 % крови архара, получен при скрещива- нии романовских овец с бараном F1), возвратный кросс BC2 (n = 5, 12,5 % крови архара, получен посредством скрещивания романовских овец с баранами BC1). Сперму романовских баранов (ROM) (n = 3) использовали в качестве контроля. Все бараны находились в одинаковых условиях кормления и содержания. Были изучены показатели качества свежеполученно-го разбавленного и замороженно-оттаянного семени.
Сбор семени проводили в искусственную вагину. Разбавление, глубокое замораживание и оттаивание осуществляли в соответствии с собственной методикой криоконсервации семени баранов в гранулах.
Для распознавания и оценки каждого сперматозоида по заданным параметрам использовали программное обеспечение Зоосперм 1.0 (ООО «ВидеоТесТ», г. Санкт-Петербург, Россия). Принцип работы этой программы основан на обработке видеоизображений (27). Целостность акро-сом изучали при дифференциальном окрашивании с применением набора Диахим-Дифф-Квик («АБРИС+», Россия). Индекс фрагментации ДНК в хроматине определяли, выявляя наличие разрывов в ДНК с помощью теста с акридиновым оранжевым (АО-тест) и флуоресцентной микроскопии («Nikon», Япония).
Данные обрабатывали статистически с помощью пакета программ Microsoft Office. В таблицах представлены средние (Х ) и их отклонения ( х ).
Результаты. Анализ подвижности сперматозоидов в свежеполучен-ном и замороженном семени гибридных животных и их чистопородных аналогов не выявил значительных различий по этому показателю. Доля сперматозоидов с прямолинейно-поступательным движением (класс А + В) в обеих экспериментальных группах была практически одинаковой: у гибридных животных — 90,0 % для свежеполученного семени и 43,0 % после криоконсервации, у чистопородных — соответственно 93,0 и 43,0 %. Доля сперматозоидов класса С (с манежным движением) и класса Д (неподвижные) в свежеполученном семени у гибридов не превышала 4,3 и 5,7 %, у чистопородных животных — 3,6 и 3,4 %. В процессе замораживания-оттаивания количество неподвижных сперматозоидов у гибридных баранов увеличивалось до 48,6 %, у их чистопородных аналогов — до 51,2 %.
Показатели осмотической и гипоосмолярной резистентности, а также дегидрогеназной активности сперматозоидов у гибридных и чистопородных животных находились в пределах установленных требований (табл. 1). Вместе с тем они были выше у гибридов. Различия между ROM и F1 составили по показателю криорезистентности 9,0 %, осмотической резистентности — 20,0 %, дегидрогеназной активности — 44,5 %. С увеличением числа генераций различия нивелировались: в третьем поколении гибриды превосходили своих чистопородных аналогов по криорезистентности на 2,2 %, по осмотической резистентности — на 4,7 %, по дегидро-геназной активности — на 10,0 %.
1. Показатели криоустойчивости сперматозоидов, полученных от гибридных и чистопородных романовских баранов ( Х ± х )
|
Группа |
Криорезистентность |
Осмотическая резистентность |
Дегидрогеназная активность, мин |
|
ROM |
0,44±0,02 |
0,21±0,06 |
7,82±0,65 |
|
F 1 |
0,48±0,03 |
0,25±0,08 |
11,31±0,38 |
|
BC 1 |
0,45±0,02 |
0,23±0,06 |
9,09±0,47 |
|
BC 2 |
0,43±0,03 |
0,22±0,01 |
8,61±0,22 |
П р и м еч а ни е. Описание групп см. в разделе «Методика».
Изучение влияния криоконсервации на морфометрические показатели сперматозоидов выявило некоторые различия между экспериментальными группами. Доля сперматозоидов с нарушенной морфологией в свежем эякуляте, полученном от гибридных ба- ранов, составляла 10,7 %, что было на 3,1 % выше аналогичного показателя для чистопородных животных. Наблюдалась разница между группами по частоте встречаемости аномальной морфологии отдельных сегментов сперматозоидов. Более высокий процент нарушений в строении сперматозоидов у чистопородных производителей отмечали в области жгутика, у гибридных баранов — в средней части (рис.).
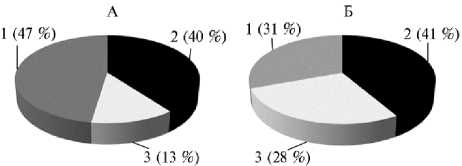
Частота нарушений морфологии в отдельных сегментах сперматозоидов у баранов-производителей романовской породы (А) и гибридов с архаром ( Ovis ammon ) (в среднем по трем группам) (Б) в замороженно-оттаянном семени: 1 — аномалии жгутика, 2 — аномалии головки, 3 — аномалии средней части.
При замораживании и оттаивании число сперматозоидов с нарушенной морфологией повышалось как у гибридных, так и у чистопородных животных. При этом процентное соотноше- ние частоты встречаемости аномального строения в отдельных сегментах сперматозоидов внутри экспериментальных групп практически не изменялось.
Оценка состояния акросом и степени фрагментации хроматина сперматозоидов в свежеполученном и замороженном семени выявила снижение показателей у гибридных животных по сравнению с чистопородными аналогами. Разница между романовскими баранами и экспериментальными группами ВС1 и ВС2 по количеству сперматозоидов с интактными акросомами для свежеполученного семени составила 2,5-3,2 %,
2. Оценка сперматозоидов у гибридных и чистопородных романовских баранов по состоянию акросом и степени фрагментации хроматина до и после криоконсервации ( Х ± х )
|
Группа |
Доля сперматозоидов с интактными акросомами, % |
Степень фрагментации хроматина, % |
|
СПС ЗОС |
СПС ЗОС |
|
ROM |
92,4±5,2 |
90,3±8,7 |
11,6±3,9 |
12,7±1,7 |
|
F 1 |
96,5±6,7 |
88,3±4,7 |
8,6±2,8 |
12,7±3,5 |
|
BC 1 |
89,9±8,3 |
86,4±5,7 |
6,5±2,7 |
9,5±2,4 |
|
BC 2 |
89,2±1,6 |
85,1±4,6 |
8,2±3,8 |
12,3±3,2 |
П р и м еч а ни е. СПС — свежеполученное семя, ЗОС — за- мороженно-оттаянное семя. Описание групп см. в разделе «Методика».
для замороженно-оттаянно-го — 3,9-5,2 %, по степени фрагментации хроматина — соответственно 25,8-43,9 и 021,2 % (табл. 2). При этом мы не выявили корреляции между изменением представленных показателей и долей кровности архара.
В процессе замораживания-оттаивания во всех группах отмечалось снижение доли сперматозоидов с интактными акросомами при повышении индекса фрагментация ДНК. У гибридных животных различия были более выраженными и составили соответственно 4,6-8,4 % и 45,1-47,6 %, у чистопородных — 2,2 и 9,5 %.
Таким образом, после криоконсервации семени, полученного как от гибридных, так и от чистопородных животных отмечалось снижение биологической полноценности сперматозоидов. Семя гибридов было более криоустойчивым по сравнению со спермой романовских баранов: у гибридных животных в процессе криоконсервации подвижность сперматозоидов снизилась на 47,0 %, у чистопородных — на 50,0 %. Показатели криорезистентности сперматозоидов у гибридов также были повышены по сравнению с исходной домашней формой. Со снижением доли кровности архара и приближением по кровности к домашней форме различия по таким биологическим параметрам, как криорезистентность, осмотическая резистентность и дегидрогеназная активность, нивелировались: разница между производителями материнской породы и гибридами BC2 составляла соответственно 2,2, 4,7 и 10,0 %. В эякуляте гибрида F1 содержание сперматозоидов с интактными акросомами было выше на 4,1 %. В свежеполу- ченном эякуляте гибридов степень фрагментации ДНК в хроматине оказалась ниже, чем у исходной романовской породы.
Список литературы Влияние криоконсервации на биологические параметры семени у гибридов романовской породы и архара
- Епишина Т.М. Совершенствование способов повышения воспроизводительных качеств свиней и овец. Докт. дис. М., 2011.
- Lucy M.C. Reproductive loss in high-producing dairy cattle: where will it end? J. Dairy Sci., 2001, 84(6): 1277-1293 ( ) DOI: 10.3168/jds.S0022-0302(01)70158-0
- Washburn S.P., Silvia W.J., Brown C.H., McDaniel B.T., McAllister A.J. Trends in reproductive performance in southeastern Holstein and Jersey DHI herds. J. Dairy Sci., 2002, 85: 244-251 ( ) DOI: 10.3168/jds.S0022-0302(02)74073-3
- Silvia W.J. Changes in reproductive performance of Holstein dairy cows in Kentucky from 1972 to 1996. J. Dairy Sci., 1998, 81: 244.
- Иолчиев Б.С., Багиров В.А., Зиновьева Н.А., Кленовицкий П.М., Таджиева А.В., Сулима Н.Н. Биологическая полноценность спермы и воспроизводство стада. Молочное и мясное скотоводство, 2014, 8: 6-8.
- Багиров В.А., Охлопков И.М, Зиновьева Н.А. Снежный баран Якутии: генетическое разнообразие и пути сохранения генофонда. Дубровицы, 2016.
- Andrabi S.M.H., Maxwell W.M.C. A review on reproductive biotechnologies for conservation of endangered mammalian species. Anim. Reprod. Sci., 2007, 99(3-4): 223-243 ( ) DOI: 10.1016/j.anireprosci.2006.07.002
- Boettcher P.J., Akin O. Current arrangements for national and regional conservation of animal genetic resources. Animal Genetic Resources, 2010, 47: 73-83 ( ) DOI: 10.1017/S2078633610000949
- Pizzi F., Duclos D., Woelders H., Mäki-Tanila A. Role and state of cryopreservation in local cattle breeds. In: Local cattle breeds in Europe. Development of policies and strategies for self-sustaining breeds/S.J. Hiemstra, Y. de Haas, A. MäkiTanila, G. Gandini (eds.). Wageningen Academic Publishers, The Netherlands, 2010: 78-96 (ISBN 978-90-8686-144-6).
- Ерохин А.С., Епишина Т.М., Чернова И.Е. Проблемы криоконсервации семени баранов. В сб.: Современные аспекты селекции, биотехнологии, информатизации в племенном животноводстве. М., 1997: 233-248.
- Курбатов А.Д. Платов Е.М., Корбан Н.В. Криоконсервация спермы сельскохозяйственных животных. Л., 1988.
- Нарижный А.Г., Порфирьев И.А., Савин О.К. Новые антиоксиданты для глубокого замораживания спермы хряков. Свиноферма, 2005, 4: 17-19.
- Amann R., Pickett B. Principles of cryopreservation and a review of stallion spermatozoa. J. Equine Vet. Sci., 1987, 7(3): 145-173 ( ) DOI: 10.1016/S0737-0806(87)80025-4
- Purdy P.H. A review on goat sperm cryopreservation. Small Ruminant Res., 2006, 63: 215-225 ( ) DOI: 10.1016/j.smallrumres.2005.02.015
- Hammadeh M.E., Askari A.S., Georg T., Rosenbaum P., Schmidt W. Effect of freeze-thawing procedure on chromatin stability, morphological and membrane integrity of human spermatozoa in fertile and subfirtile men. International Journal of Andrology, 1999, 22: 155-162 ( ) DOI: 10.1046/j.1365-2605.1999.00162.x
- Buhr M.M., Fiser P., Bailey J.L., Curtis E.F. Cryopreservation in different concentrations of glycerol alters boar sperm and their membranes. Journal of Andrology, 2001, 22: 961-969 ( ) DOI: 10.1002/j.1939-4640.2001.tb03436.x
- Chenoweth P.J. Genetic sperm defects. Theriogenology, 2005, 64: 457-468 ( ) DOI: 10.1016/j.theriogenology.2005.05.005
- Purwantara B., Arifiantini R.I., Riyadhi M. Sperm morphological assessments of Friesian Holstein bull semen collected from three artificial insemination centers in Indonesia. Journal of the Indonesian Tropical Animal Agriculture, 2010, 2: 89-94 ( ) DOI: 10.14710/jitaa.35.2.90-94
- Padrik P., Jaakma U. Sperm morphology in Estonian Holstein dairy bulls, factors affecting it and relation to fertility. Agraarteadus, 2002, 13: 243-256.
- Watson P.F. The causes of reduced fertility with cryopreserved semen. Anim. Reprod. Sci., 2000, 60: 481-492 ( ) DOI: 10.1016/S0378-4320(00)00099-3
- Salamon S., Maxwell W.M.C. Frozen storage of ram semen: II. Causes of low fertility after cervical insemination and methods of improvement. Anim. Reprod. Sci., 1995, 38: 1-36 ( ) DOI: 10.1016/0378-4320(94)01328-J
- Иолчиев Б.С., Таджиев А.В., Багиров В.А., Кленовицкий П.М., Сулима Н.Н. Идиопатические факторы снижения фертильности быков-производителей. Мат. Межд. науч.-практ. конф. «Пути продления продуктивной жизни молочных коров на основе оптимизации разведения, технологий содержания и кормления животных». Дубровицы, 2015: 197-199.
- Blackburn H. Development of national animal genetic resource programs. Reprod. Fertil. Dev., 2004, 16: 27-32 ( ) DOI: 10.10371/RD03075
- Двалишвили В.Г., Виноградов И.С. Эффективность использования корма и продуктивность баранчиков романовской породы разного происхождения. Зоотехния, 2015, 4: 17-19.
- Bogolyubova N.V., Romanov V.N., Devyatkin V.A., Gusev I.V., Bagirov V.A., Zinovieva N.A. Biological parameters for digestive and metabolic processes in interspecies hybrids of domestic sheep (Ovis aries) and argali (Ovis ammon polii). Agricultural Biology, 2016, 51(4): 500-508 ( ) DOI: 10.15389/agrobiology.2016.4.500eng
- Bagirov V., Iolchiev B., Zhilinskij M., Klenovitskij P., Zinovieva N. Establishment of semen bank of wild Ovis species and their hybrids with domestic sheep. Reprod. Domest. Anim., 2016, 51(Suppl. 2): 72-73 ( ) DOI: 10.1111/rda.12801
- Иолчиев Б.С., Багиров В.А., Кленовицкий П.М., Кононов В.П., Насибов Ш.Н., Воеводин В.А. Компьютерная технология для оценки семени животных. Достижения науки и техники АПК, 2011, 9: 54-56.


