Влияние L-NAME и его комбинации с L-аргинином на фонд аминокислот плазмы крови при субтотальной ишемии головного мозга
Автор: Разводовский Ю.Е., Смирнов В.Ю., Дремза И.К., Короткевич Т.В., Максимович Н.Е., Семененя И.Н.
Журнал: Академический журнал Западной Сибири @ajws
Рубрика: Медицина
Статья в выпуске: 6 (83) т.15, 2019 года.
Бесплатный доступ
Цель:характеристика изменений пула свободных аминокислот и их производных в плазме крови крыс при субтотальной ишемии головного мозга (СИГМ) на фоне введения N-нитро-L-аргининметилового эфи-ра (L-NAME) L-аргинина. Материалы и методы:Эксперимент выполнен на 24белых беспородных крысах-самках (по 6 животных в каждой группе) мас-сой 180-220 г. Крысам опытных групп моделировали субтотальную ишемию головногомозга (СИГМ) пу-тём перевязки обеих сонных артерий в течение одного часа. L-NAME (в дозе 5 мг/кг) и его композицию с L-аргинином (в дозе 100 мг/кг) вводили внутривенно непосредственно перед перевязкой общих сонных артерий. Содержание аминокислот и их дериватов в хлорнокислых экстрактах плазмы крови определяли методом обращенно-фазной высокоэффективной жидкостной хроматографии (ВЭЖХ). Результаты:СИГМ вызывает дисбаланс аминокислотного фонда плазмы крови. Введение L-NAME, а также его сов-местное введение с L-аргинином снижает выражен-ность аминокислотного дисбаланса, индуцированного СИГМ. Заключение:Предварительное введение L-NAME, а также комбинации L-NAME и L-аргинина частично корригирует дисбаланс пула аминокислот и родственных соединений плазмы крови при СИГМ.
Короткий адрес: https://sciup.org/140248222
IDR: 140248222
Текст научной статьи Влияние L-NAME и его комбинации с L-аргинином на фонд аминокислот плазмы крови при субтотальной ишемии головного мозга
-
1 Государственное предприятие «Институт биохимии биологически активных соединений НАН Беларуси», г. Гродно, Республика Беларуь.
-
2 УО «Гродненский государственный медицинский университет», г. Гродно, Республика Беларусь.
-
3 Республиканский научно-практический центр психического здоровья, г. Минск, Республика Беларуь
Цель: характеристика изменений пула свободных аминокислот и их производных в плазме крови крыс при субтотальной ишемии головного мозга (СИГМ) на фоне введения N-нитро-L-аргининметилового эфира (L-NAME) L-аргинина. Материалы и методы: Эксперимент выполнен на 24 белых беспородных крысах-самках (по 6 животных в каждой группе) массой 180-220 г. Крысам опытных групп моделировали субтотальную ишемию головного мозга (СИГМ) путём перевязки обеих сонных артерий в течение одного часа. L-NAME (в дозе 5 мг/кг) и его композицию с L-аргинином (в дозе 100 мг/кг) вводили внутривенно непосредственно перед перевязкой общих сонных артерий. Содержание аминокислот и их дериватов в хлорнокислых экстрактах плазмы крови определяли методом обращенно-фазной высокоэффективной жидкостной хроматографии (ВЭЖХ). Результаты: СИГМ вызывает дисбаланс аминокислотного фонда плазмы крови. Введение L-NAME, а также его совместное введение с L-аргинином снижает выраженность аминокислотного дисбаланса, индуцированного СИГМ. Заключение: Предварительное введение L-NAME, а также комбинации L-NAME и L-аргинина частично корригирует дисбаланс пула аминокислот и родственных соединений плазмы крови при СИГМ.
Ишемический инсульт является одной из ведущих причин инвалидности и смертности во многих странах мира [1-3]. Патогенетические механизмы развития ишемического повреждения головного мозга сложны и не до конца изучены [4]. Аминокислоты и их производные играют важную роль в функционировании головного мозга, как в норме, так и при патологии, участвуя в биосинтезе мембранных белков, сигнальных молекул и регуляторных пептидов [4-6]. Поэтому одним из направлений детализации патогенеза ишемического инсульта является изучение изменений аминокислотного фонда в плазме крови и головном мозге.
Оксид азота (NO) является многофункциональным биологическим медиатором, играющим важную роль в поддержании гомеостаза [7]. Генерация NO при ишемии мозга может иметь двоякие последствия, приводя с одной стороны к увеличению мозгового кровотока, повышению антитромбо-генных свойств крови [8, 9], а с другой стороны, к усилению повреждения мозга посредством стимуляции глутамат-чувствительных NMDA-рецепторов мозга и индукции глутаматной нейротоксичности [10, 11].
Использование неселективных ингибиторов NO синтазы, в частности N-нитро и N-метильных аналогов L-аргинина в качестве возможных нейропротекторов при ишемическом повреждении дало неоднозначные результаты. По данным одних авторов, однократное применение ингибитора NO синтазы L-NAME вызывало защитный эффект на модели фокальной ишемии мозга у крыс, проявлявшийся в уменьшении зоны инфаркта [9]. По данным других – использование NG-nitro-L-arginine интраперитонеально за 15 часов до моделирования ишемии головного мозга у крыс оказывало нейропротекторный эффект, что дало основание автору предположить о ключевой роли NO в патогенезе ишемического инсульта [12].
Целью настоящей работы была характеристика изменений пула аминокислот и их метаболитов в плазме крови крыс при ишемии и ведении на ее фоне препарата L-NAME и его комбинации с L-аргинином.
Материалы и методы.
Эксперимент выполнен на 24 белых беспородных крысах-самках (по 6 животных в каждой группе) массой 180-220 г. Крысам опытных групп моделировали субтотальную ишемию головного мозга (СИГМ) путём перевязки обеих сонных артерий в течение одного часа. L-NAME (в дозе 5 мг/кг) и его композицию с L-аргинином (в дозе 100 мг/кг) вводили внутривенно непосредственно перед перевязкой общих сонных артерий. Контрольную группу составили ложнооперированные животные, получавшие эквиобъёмное количество изотонического раствора NaCl. Все оперативные манипуляции проводились в условиях внутривенного тиопентало-вого наркоза (60 мг/кг). После декапитации животных кровь немедленно собирали в гепаринизированные пробирки и центрифугировали 15 мин при 3000 g. К полученной плазме крови добавляли равный объем среды, содержащей 1М хлорную кислоту, ЭДТА (25 мг/л) и дельта-аминовалериановую кислоту (250 мкмоль/л). После центрифугирования (15 мин при 13000 g и +4ºС) полученный супернатант немедленно отбирали в отдельные пробирки.
Спектр определяемых соединений включал протеиногенные аминокислоты, орнитин, цитруллин и ряд родственных соединений (таурин, α-аминобутират и др.). Анализ проводился на хроматографе Agilent 1100 методом обращенно-фазной хроматографии с предколоночной дериватизацией о-фталевым альдегидом и 3-меркаптопропионовой кислотой в Na-боратном буфере [13].
Статистическую обработку данных проводили с помощью программы R. В случае выполнения условий применимости (нормальность выборок и гомогенность дисперсий) применялся параметрический дисперсионный анализ с поправкой Тьюки на множественность сравнений, данные для этих переменных представлены в таблицах как среднее ± стандартная ошибка среднего. В случае невыполнения этих условий применялся непараметрический дисперсионный анализ Краскела-Уоллиса с поправкой Беньямини-Хохберга на множествен- ность сравнений, для этих переменных в таблицах приведены значения медианы и квартилей распределения.
Результаты и их обсуждение.
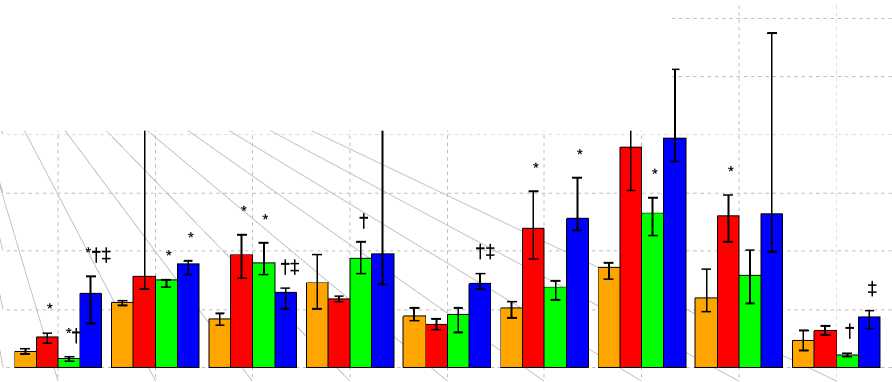
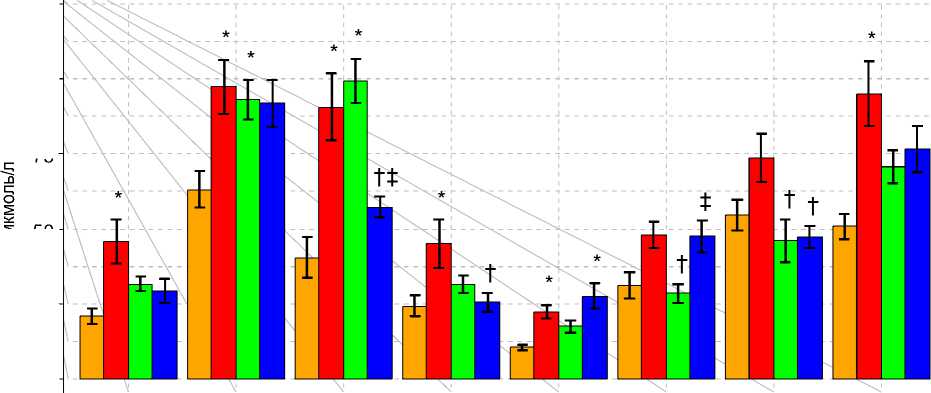
Субтотальная ишемия головного мозга сопровождалась повышением уровней аспартата, аспарагина, глутамина, глицина, аланина, таурина, фенилаланина, гистидина, 3-метилгистидина, треонина, цитруллина, β-аланина, орнитина, а также аминокислот с разветвлённой углеводородной цепью (АРУЦ) в плазме крови (рисунок 1а, б, в).
□ Контроль □ СИГМ □ СИГМ + L-NAME □ СИГМ + L-NAME + L-Arg
*
*
†
Thr bAla x100
Ala
GABA Trp Ile x100 x10 x10
Leu Orn x10 x10
Lys
Рисунок 1а. Концентрация аминокислот и их производных в плазме крови крыс при ишемии и введении на ее фоне L-NAME и его комбинации с L-аргинином, мкмоль/л. Примечание (здесь и в табл.2): * – p<0,05 при сравнении с контролем; † – p<0,05 при сравнении с СИГМ, ‡ – p<0,05 при сравнении с СИГМ+ L-NAME.
□ Контроль ■ СИГМ □ СИГМ + L-NAME □ СИГМ + L-NAME + L-Arg
Asp
Asn
Met
Tyr
Phe
Gly x0.1
Gln x0.1
Val x0.1
Рис. 1б. Концентрация аминокислот и их производных в плазме крови крыс при ишемии и введении на ее фоне L-NAME и его комбинации с L-аргинином, мкмоль/л.
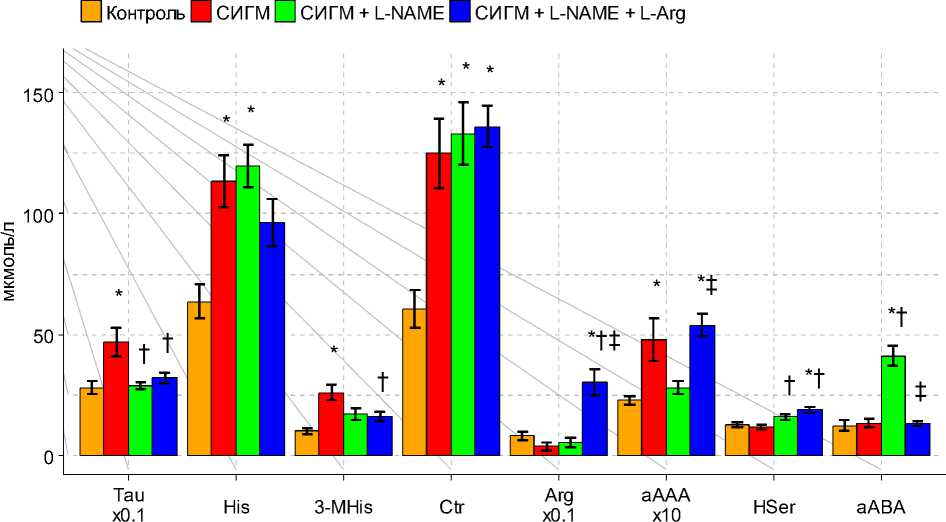
Рис. 1в. Концентрация аминокислот и их производных в плазме крови крыс при ишемии и введении на ее фоне L-NAME и его комбинации с L-аргинином, мкмоль/л.
Контроль СИГМ СИГМ + L-NAME СИГМ + L-NAME + L-Arg
*
*‡
*
*
*
* * * * *† *
†‡ *†*‡ † *†‡ ‡ ††
*
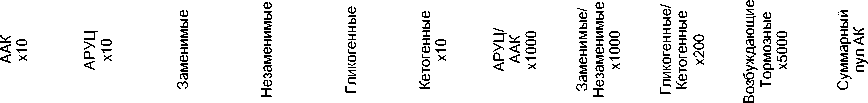
Рис. 2. Интегральные показатели аминокислотного фонда плазмы крови крыс при ишемии и введении на ее фоне L-NAME и его комбинации с L-аргинином, мкмоль/л.
Несмотря на то, что изменения касались в основном гликогенных аминокислот и носили однонаправленный характер (в сторону повышения концентраций), повышения соотношения гликогенных и кетогенных аминокислот не происходило вследствие более, чем двукратного повышения уровня лейцина (рис. 2).
Рост уровней глицина и таурина, играющих роль тормозных нейромедиаторов, не привел к изменению соотношения сумм возбуждающих и тормозных соединений в плазме крови (рис. 2). В тоже время, отмечалось изменение целого рядя интегральных показателей аминокислотного фонда: суммарный пул протеиногенных аминокислот обогащался за счет повышения содержания как заменимых, так и незаменимых его компонентов (при этом их соотношение не менялось), росло соотношение АРУЦ и ароматических аминокислот (ААК) (рис. 2).
Введение L-NAME снижало выраженность аминокислотного дисбаланса, индуцируемого СИГМ. В частности, не наблюдалось повышения уровней аспартата, таурина, валина, изолейцина, орнитина и фенилаланина. В то же время, отмечалось снижение концентрации треонина и повышение – α-аминомасляной кислоты (αABA). Введение L-NAME предотвращало повышение суммарного пула незаменимых компонентов, не влияя на содержание заменимых компонентов. Как следствие этого происходил рост соотношения суммарного пула заменимых и незаменимых аминокислот. Также, L-NAME предотвращал обогащение пула кетогенных аминокислот, хотя сама структура последнего всё ещё отличалась от контрольной (в основном за счет лизина).
Совместное введение L-NAME и L-аргинина предотвращало рост концентраций аспартата, глутамина, гистидина, глицина, таурина, аланина, 3-метилгистидина и фенилаланина в плазме крови. Уровни аспарагина, β -аланина, цитруллина и АРУЦ сохранялись повышенными. Кроме этого, происходил рост концентраций треонина, лизина и аргинина (рисунок 1а, б, в). Следствием этих изменений явилось повышение (по отношению к контролю) содержания кетогенных аминокислот и снижение соотношения заменимых и незаменимых аминокислот. Введение данной композиции не предотвращало обогащение пула протеиногенных аминокислот (в том числе его гликогенных компонентов), а также рост соотношения АРУЦ и ААК (рис. 2).
Как сам L-NAME, так и его совместное введение с L-аргинином вызывало снижение уровня тирозина в плазме крови (по сравнению с группой с СИГМ без введения препаратов), предотвращало повышение уровней таурина и фенилаланина. Ряд аминокислот (α-аминоадипинат (αAAA), Thr, Ile, Orn и, частично, Met и Lys) имели схожий профиль реагирования: рост концентраций при СИГМ, нормализация (или снижение) – при введении L-NAME, и снова рост – при совместном введении L-NAME и L-аргинина.
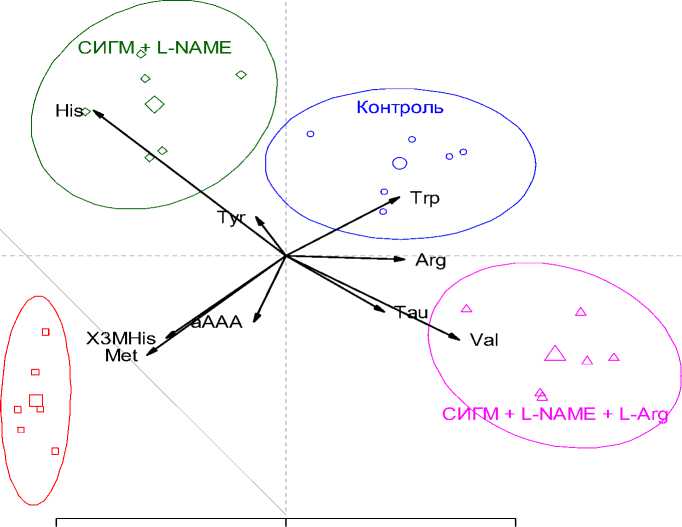
Наиболее значимыми показателями, характеризующими изменения АК фонда плазмы крови при СИГМ и введении L-NAME и L-аргинина, являлись Thr, His, 3-MHis, α -AAA, Tau, Tyr и Arg. Видно, что, несмотря на большую (по сравнению с остальными показателями) вариативность уровня аргинина (F=16,2), дискриминация групп была обусловлена в первую очередь уровнями гистидина и 3-метилгистидина (Fискл>17). Анализ коэффициентов дискриминантных функций (рис. 3) позволяет связать изменение уровня гистидина с введением L-NAME, а уровней таурина, валина и аргинина – с введением композиции L-NAME и L-аргинина. Дискриминация между контролем и группой СИГМ была обусловлена в первую очередь изменениями уровней 3-MHis, Met, α -AAA и Trp.
Оба препарата снижали выраженность АК дисбаланса, о чем можно судить по уменьшению расстояния Махаланобиса между центроидами группы контроля и групп с введением субстанций на плоскости двух главных компонент (рисунок 3). Однако, на основании полученных данных нельзя утверждать о более выраженном нормализующем эффекте в отношении АК пула плазмы крови при введении какого-то одного препарата.
СИГМ
-5 0 5
Корень 1 (52.9%)
Рис. 3. Расположение канонических значений на плоскости 2-х главных компонент.
Заключение. Таким образом, СИГМ вызывает дисбаланс в фонде аминокислот плазмы крови. Введение L-NAME, также как и его совместное введение с L-аргинином снижает выраженность аминокислотного дисбаланса, индуцированного СИГМ. Корригирующие эффекты L-NAME и его комбинации с L-аргинином в отношении фонда аминокислот плазмы крови при СИГМ имеют специфические особенности.
THE EFFECT OF L-NAME AND ITS COMBINATION WITH L-ARGININE ON THE SPECTRUM OF FREE AMINO ACIDS IN BLOOD PLASMA UNDER SUBTOTAL CEREBRAL ISCHEMIA
-
Y.E. Razvodovsky1, V.Y. Smirnov2,
-
I .K. Dremza2, T.V. Korotkevich3,
N.Ye. Maksimovich2, I.N. Semenenya1
-
1Institute biochemistry of biologically active substances Academy of science of Belarus, Grodno, Belarus.
-
2Grodno State Medical University Republic of Belarus.
-
3 Republicans scientific-practical centre of psychic health, Minsk, Republic of Belarus.
The aim of this study was to estimate the changes in the pool of free amino acids and their derivatives in plasma of rats undergoing subtotal cerebral ischemia (SCI) and treated with L-arginine and L-NAME. Materials and methods: Experiment was held on 24 rats: 12 animals were undergoing bilateral filament occlusion of arteries carotid, 6 of them L-NAME (5 mg/kg) was administrated, 6 of them L-arginine and L-NAME (100 mg/kg) was administrated. The analyses of free amino acids levels in the blood plasma extracts were carried out by reversed-phase HPLC. Results: Subtotal cerebral ischemia induced imbalance in the pool of amino acids of plasma. Concentrations of several amino acids were elevated after subtotal cerebral ischemia, including aspartate, glycin, taurine, alanine and phenylalanine. Administration of L-NAME, as well as combination of L-arginine and L-NAME partially prevented the imbalance of the amino acids pool, caused by SCI. Conclusions: Preventive injection of L-arginine and L-NAME alleviate the imbalance in the pool of free amino acids of blood plasma caused by SCI.
Список литературы Влияние L-NAME и его комбинации с L-аргинином на фонд аминокислот плазмы крови при субтотальной ишемии головного мозга
- Kim A.S., Johnston S.C. Global variation in the relative burden of stroke and ischemic heart disease // Circulation. 2011. V.124. P. 314-323.
- Razvodovsky Y.E. Alcohol attributable fraction of stroke mortality in Russia. // Journal of the Neurological Science. 2013. V. 33, № 1. P. 231.
- Razvodovsky Y.E. The differential effects of beverage type on stroke mortality. Razvodovsky // Clinical Experimental Cardiology. 2015. № 2. С. 1- 6.
- Кулеш С.Д. Патогенез ишемического инсульта: Биохимические механизмы и роль нейроактивных аминокислот // Медицинские Новости. 1998. № 1. С. 21-24.
- Разводовский Ю.Е., Смирнов В.Ю., Троян Э.И., Максимович Н.Е. Межполушарная асимметрия церебрального аминокислотного пула при субтотальной ишемии головного мозга крыс // Анналы клинической и экспериментальной неврологии. 2019. V.13, № 2. P. 41-46.
- Razvodovsky Y.E., Troyan E.I., Doroshenko E.M., et al. Levels of free amino acids and their derivatives in the brain cortex of rats during unilateral ischemia. International Journal of Neuroscience and Behavior Studies. 2017. V. 1, № 1. P. 18-21.
- Moncada S., Palmer R., Higgs E. Nitric oxide: physiology, pathophysiology and pharmacology // Pharmacological Review. 1991. № 43. P. 109-142.
- Максимович Н.Е. Роль оксида азота в патогенезе ишемических и реперфузионных повреждений мозга. Гродно, ГрГМУ, 2004. 180с.
- Salter M., Duffy C., Garthwaite J., Strijbos P.J. Substantial regional and hemispheric differences in brain nitric oxide synthase (NOS) inhibition following intracerebroventricular administration of N-nitro-L-arginine (L-NA) and its methyl ester (L-NAME) // Neuropharmacology. 1995. № 34. P. 639-649.
- Kozniewska E. Roberts T.P., Tsuura M. N sup G-Nitro-L-Arginine delays the development of brain injury during focal ischemia in rats. // Stroke. 1995. V. 26, № 2. P. 282-288.
- Maksimovich N.Ye. Tolerance of hypoxic hypoxia in rats with cerebral ischemia treated by NO-synthase modulators // Hypoxia medical. 2004. V.1-2. P. 20-23.
- Trifiletti R.R. Neuroprotective effects of NG-nitro-L-arginine in focal stroke in the 7-day old rat // European Journal of Pharmacology. 1992. V.21. P. 197-198.
- Смирнов В.Ю., Разводовский Ю.Е., Дорошенко Е.М., Островский Ю.Е. Влияние композиции аминокислот с разветвленной углеводородной цепью, триптофана и таурина на обмен аминокислот в экспериментальных моделях алкоголизма // Украинский биохимический журнал. 2003. Т. 75, № 4. С. 101-107.


