Влияние масляной основы раствора ретинола пальмитата на морфологию эритроцитов
Автор: Ломановская Т.А., Боронихина Т.В., Пьявченко Г.А., Яцковский А.Н.
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.29, 2021 года.
Бесплатный доступ
Для объективной экспериментальной и клинической оценки действия ретинола и его эфиров на эритроциты требуется дополнительное выяснение их возможной реакции на вспомогательные вещества, присутствующие в масляных растворах этих соединений. Цель исследования - морфоденситометрический анализ эритроцитов крови животных, получавших масляную основу раствора ретинола пальмитата. Исследование выполнено на 12 крысах самцах Wistar весом 120 грамм, которым в течение 10 дней вводили через рот по 0,2 мл/ сутки масляной основы, содержащей рапсовое масло и антиоксиданты - бутилгидрокситолуол и бутилгидроксианизол. Контрольной группой были 12 интактных крыс. Используя аппаратно-программный комплекс DiaMorph Cito (ЗАО «ДиаМорф», Россия), в окрашенных раствором Лейшмана мазках крови измеряли морфоденситометрические параметры эритроцитов (дискоцитов), позволяющие количественно оценить их морфофункциональное состояние у животных контрольной и экспериментальной групп. Установлено, что у крыс, потреблявших масляную основу, возникали изменения оптических и некоторых геометрических параметров эритроцитов. Наблюдалось увеличение интегральной оптической плотности цитоплазмы, а также кривизны нисходящего участка тора и длины профиля дискоцитов. Поскольку зрелые эритроциты лишены аппарата биосинтеза, увеличение интегральной оптической плотности их цитоплазмы в условиях потребления масляной основы следует рассматривать как появление в крови эритроцитов с большим, чем у интактных животных, количеством гемоглобина. Подобную реакцию эритрона можно предположительно рассматривать как результат воздействия компонентов масляной основы на процесс синтеза гемоглобина в эритробластах красного костного мозга. В результате изменения геометрии эритроцитов увеличились площадь их поверхности и ее соотношение с объемом клеток. На основании полученных результатов можно заключить, что потребление масляной основы, используемой для приготовления раствора ретинола пальмитата, вызывает незначительную по объему деформацию эритроцитов. Возникающие при этом изменения оптических и геометрических параметров эритроцитов предположительно способствуют повышению их газотранспортной и газообменной функций.
Ретинола пальмитат, масляная основа, эритроциты, морфоденситометрия
Короткий адрес: https://sciup.org/143178427
IDR: 143178427 | DOI: 10.20340/mv-mn.2021.29(3).610
Текст научной статьи Влияние масляной основы раствора ретинола пальмитата на морфологию эритроцитов
Ломановская Т.А., Боронихина Т.В., Пьявченко Г.А., Яцковский А.Н. Влияние масляной основы раствора ретинола пальмитата на морфологию эритроцитов. Морфологические ведомости. 2021;29(3):610. (3).610
Lomanovskaya TA, Boronikhina TV, P’yavchenko GA, Yatskovsky AN. The effect of the oil base of retinol palmitate solution on red blood cells morphology. Morfologicheskie Vedomosti – Morphological Newsletter. 2021;29(3):610. (3):610
Article received 22 August 2020 Article accepted 23 November 2021
Введение. При исследовании ксенобиотиков в качестве биологической цитотоксичности мембранотропных модели часто используют эритроциты [1], обладающие способностью к обратимой деформации, которая при внешних воздействиях может меняться в зависимости от состояния их цитоскелета и(или) вязкоупругих свойств мембраны [2-6]. Одним из последствий подобных сдвигов является изменение размера, формы и других их характеристик [7-8], что может быть выявлено с помощью морфоденситометрических методов анализа. Лекарственные препараты ретинола и его эфиров, предназначенные для приема внутрь, выпускаются в виде масляных растворов. Одним из таких препаратов является раствор ретинола пальмитата (производитель - АО «Ретиноиды»), в котором в качестве основы используется рапсовое масло с добавлением бутилгидрокситолуола и бутилгидроксианизола - антиоксидантов, препятствующих окислению действующей субстанции [9]. Масло рапса богато жирными кислотами [1011], при чрезмерном потреблении которых их состав и соотношение в мембранах эритроцитов изменяются [12-14]. Антиоксиданты также могут воздействовать на содержание жирных кислот в фосфолипидах эритроцитарных мембран [15]. Так как от жирнокислотного состава мембраны зависят ее реологические характеристики и как следствие -деформируемость клеток [8, 16-17], логично предположить, что компоненты масляной основы раствора ретинола пальмитата могут в совокупности влиять на морфофункциональное состояние эритроцитов. Сведения об этом в литературе отсутствуют. Уточнение характера реакции эритроцитов на вспомогательные вещества, присутствующие в растворах ретинола и его эфиров, необходимо для более объективной оценки воздействия препаратов этой группы на клетки крови, как в эксперименте, так и в клинике.
Цель исследования : с помощью метода морфоденситометрии оценить морфологию эритроцитов и показатели их мембран у животных, потребляющих масляную основу раствора ретинола пальмитата.
Материалы и методы исследования . Эксперимент проведен на 24 крысах самцах линии Wistar с исходной массой тела около
120 грамм, полученных из филиала «Столбовая» «Научного центра биомедицинских технологий» Федерального медки-биологического агентства России. Содержание и манипуляции с животными осуществлялись согласно Правилам надлежащей лабораторной практики (Приказ Минздрава РФ № 199н от 01.04.2016) и в соответствии с решением локального этического комитета (протокол № 02-20 от 05.02.2020). В течение всего срока содержания животные имели свободный доступ к стандартному гранулированному корму и воде. После недельной адаптации к условиям вивария животных рандомизировали на две группы по 12 особей в каждой. Контрольную группу составили интактные крысы. Крысам экспериментальной группы в течение 10 дней вводили через рот по 0,2 мл/сутки масляной основы, содержащей низкоэруковое рапсовое масло и равные количества (по 0,1 г на 100 мл масла) бутилгидрокситолуола и бутилгидроксианизола (препарат предоставлен АО «Ретиноиды»). Ежедневно, перед очередным введением препарата, путем прокалывания вены хвоста стерильным скарификатором получали каплю крови и готовили мазки, которые после высушивания фиксировали 15 мин в 96% этаноле. Мазки крови животных обеих групп окрашивали одновременно раствором Лейшмана по схеме: концентрированный раствор красителя - 2 минуты, концентрированный раствор красителя и дистиллированная вода 1:2 - 10 минут, дистиллированная вода - 5 минут. С помощью аппаратнопрограммного комплекса DiaMorph Cito (ЗАО «ДиаМорф», Россия) на оцифрованных изображениях мазков крови измеряли морфоденситометрические параметры эритроцитов (дискоцитов). Перечень параметров, позволяющих количественно оценить реакцию эритроцитов на воздействие, приведен в таблице 1. В каждом мазке крови при увеличении в 900 раз (иммерсия) измеряли параметры не менее чем 30 эритроцитов, находящихся в соседних полях зрения центрального участка мазка. Объем выборки (число животных, число клеток) был рассчитан при планировании эксперимента по результатам анализа индивидуальной и групповой дисперсии параметров эритроцитов у 10 интактных крыс с учетом 5% допустимой погрешности. При статистическом анализе результатов гипотезы о нормальном распределении признаков (тест Колмогорова-Смирнова для одной выборки) и о равенстве дисперсий
(тест Левена) были отклонены. Для оценки значимости различий средних арифметических двух выборок использовали непараметрический критерий Манна-Уитни. Доверительная вероятность различий оценивалась на уровне p≤0,05.
Таблица 1
Перечень измеренных морфоденситометрических параметров дискоцитов и их обозначения
|
Параметр |
Название |
|
Area |
площадь проекции на плоскость |
|
IOD |
интегральная оптическая плотность |
|
Cur1 |
кривизна восходящей части тора* |
|
Cur2 |
кривизна нисходящей части тора |
|
Cur3 |
кривизна пэллора** |
|
L_er |
длина профиля |
|
Surface |
площадь поверхности |
|
Volume |
объем |
|
Surface/Volume |
отношение площади поверхности к объему |
Примечание: тор* – периферический выпуклый участок дискоцита, пэллор** – центральный вогнутый участок дискоцита.
Результаты исследования и обсуждение. У крыс, потреблявших масляную основу (далее - МО), выявлены изменения оптических и геометрических параметров эритроцитов, которые возникали в определенной последовательности (рис. 1). Наиболее рано, с 6 дня после начала введения МО значимо возрастала IOD цитоплазмы эритроцитов. IOD является косвенным показателем содержания гемоглобина в эритроците [18]. Поскольку зрелые эритроциты лишены аппарата биосинтеза, увеличение IOD их цитоплазмы в условиях потребления МО следует трактовать не иначе, как появление в крови эритроцитов с бóльшим, чем у интактных животных, количеством гемоглобина. Подобную реакцию эритрона можно предположительно рассматривать как результат воздействия компонентов МО на процесс синтеза гемоглобина в эритробластах, что вероятно обусловлено присутствием в рапсовом масле токоферола [10], участвующего в регуляции эритропоэза путем контроля биосинтеза гема [19]. В интервале 8-11 дней эксперимента в сравниваемых группах были зафиксированы различия не всех, а лишь некоторых геометрических параметров эритроцитов. Так, показатели Area, Cur1 и Cur3 существенно не отличались от аналогичных показателей в контроле на протяжении всего срока наблюдения. Из параметров, описывающих профиль дискоцитов, заметно возрастали Cur2 и коррелирующая с ней L_er. В результате изменения профиля эритроцитов их показатель площади увеличивался. При этом, поскольку объем эритроцитов оставался практически неизменным, соотношение Surface/Volume в итоге возросло к 11 дню наблюдения. В основе флюктуаций геометрических характеристик эритроцитов, возникающих на фоне перорального введения МО, скорее всего, лежат изменения липидного профиля их плазмолеммы. Показано, что при употреблении растительных масел, богатых ненасыщенными жирными кислотами, содержание последних в плазме крови и в эритроцитарной мембране возрастает [13, 20-21], а ее микровязкость и текучесть меняются [16]. Это отражается не только на морфологии, но и на возможности эритроцитов обеспечивать газообмен, который зависит от величины таких геометрических параметров клеток как площадь и объем и их соотношения [7-8]. Помимо жирных кислот определенный вклад в изменение морфологии и функционального состояния эритроцитов при потреблении МО могут вносить также присутствующие в ее составе бутилгидрокситолуол и бутилгидроксианизол.
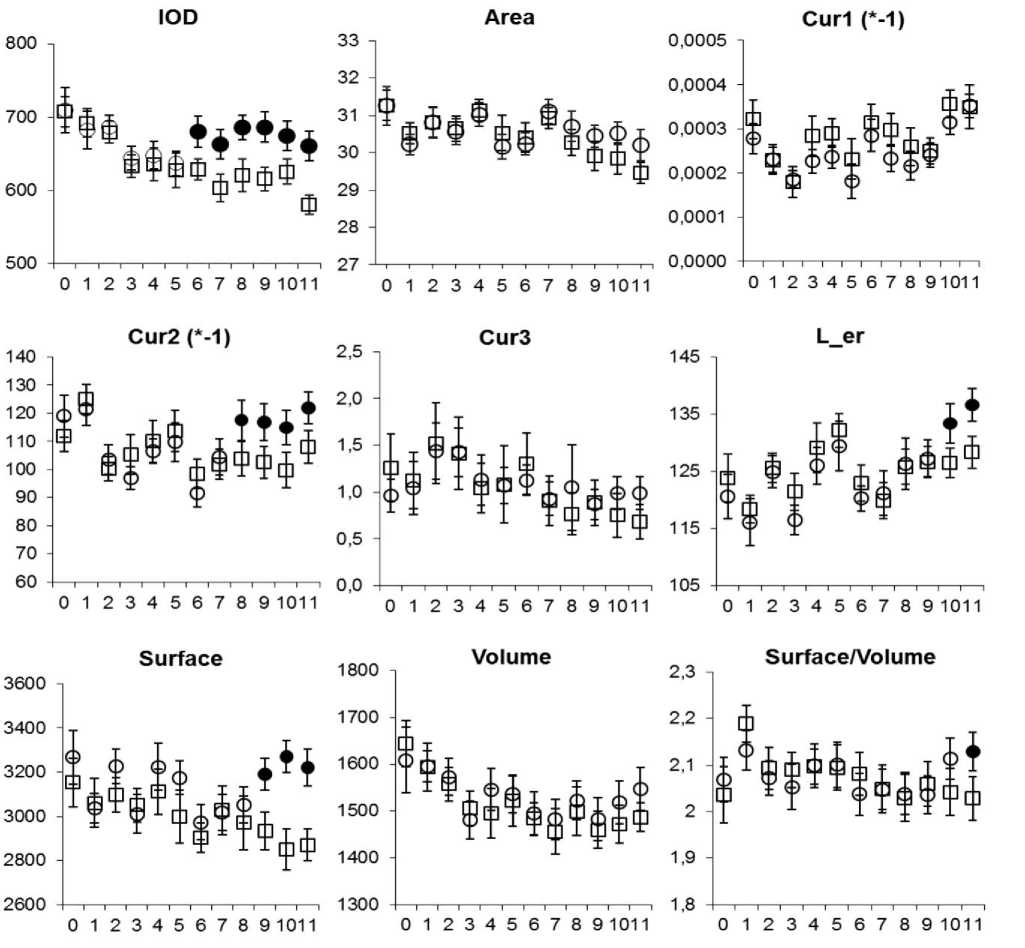
Рис. 1. Средние значения и доверительные интервалы морфоденситометрических параметров дискоцитов у интактных крыс (прямоугольники) и у крыс, получавших ежедневно по 0,2 мл масляной основы раствора ретинола пальмитата (круги).
Обозначения: маркеры с заливкой указывают на значимые различия между группами. Ось абсцисс – дни наблюдения: день 0 – начало введения масляной основы, день 10 – последнее введение препарата. Ось ординат – единицы измерения: показатель площади «Area» в мкм2, остальные параметры в условных единицах (наименования всех параметров приведены в таблице 1 выше).
В течение жизненного цикла эритроцита в нем постоянно образуются свободные радикалы и продукты перекисного окисления липидов, накопление которых при снижении активности внутриклеточной системы антиоксидантной защиты вызывает критические изменения цитоскелета и биомеханических свойств мембраны клетки [22]. Бутилгидрокситолуол и бутилгидроксианизол ингибируют окисление липидов, снижают образование активных форм кислорода, стимулируют активность антиоксидантных ферментов, что в целом улучшает реологические свойства и проницаемость эритроцитарной мембраны [15, 23-24]. Обобщая приведенные выше факты, можно полагать, что, в отличие от эффектов ретинола пальмитата [25], потребление МО не оказывает выраженного токсического действия на эритроциты. Напротив, ограниченные по объему изменения формы эритроцитов скорее способствуют повышению их газотранспортной и газообменной функций. На это указывают возникающие в данных условиях увеличение IOD цитоплазмы (содержания в ней гемоглобина), а также увеличение площади и ее соотношения с объемом эритроцитов. Последнее вероятно обусловлено меняющимися реологическими характеристиками эритроцитарной мембраны.
Заключение. Таким образом, потребление масляной основы, используемой для приготовления раствора ретинола пальмитата, вызывает незначительную деформацию эритроцитов предположительно за счет изменения вязкоупругих свойств их мембраны. Возникающие при этом изменения геометрических и оптических параметров эритроцитов в совокупности свидетельствуют о позитивном воздействии масляной основы на их функциональную активность, повышении газотранспортной и газообменной функций.
Список литературы Влияние масляной основы раствора ретинола пальмитата на морфологию эритроцитов
- Farag MR, Alagawany M, Erythrocytes as a biological model for screening of xenobiotics toxicity. Chemico-Biological Interactions. 2017;279:73-83. https://doi.org/10.1016/j.cbi.2017.11.007.
- Parrow NL, Violet PC, Tu H, Nichols J, Pittman CA, Fitzhugh C, Fleming RE, Mohandas N, Tisdale JF, Levine M. Measuring Deformability and Red Cell Heterogeneity in Blood by Ektacytometry. J Vis Exp. 2018;(131):e56910. https://doi.org/10.3791/56910.
- Asaro RJ, Zhu Q. Vital erythrocyte phenomena: what can theory, modeling, and simulation offer? Biomech Model Mechanobiol. 2020;19(5):1361-1388. https://doi.org/10.1007/s10237-020-01302-x.
- Lamzin IM, Khayrullin RM. The quality assessment of stored red blood cells probed using atomic force microscopy. Anatomy Research International. 2014; Article ID 869683. https://doi.org/10.1155/2014/869683
- Stolbovskaya OV, Khayrullin RM, Kulikova TK, Snezhkina AV, Sadritdinova A.F. Issledovanie vyazko-elasticheskikh svoystv tsitoplazmaticheskoy membrany limfotsitov krovi cheloveka metodom atomno-silovoy mikroskopii. Fundamental'nye issledovaniya. 2013;(4-5):1149-1152. In Russian.
- Lamzin IM, Khayrullin RM. Issledovanie izmeneniy biofizicheskikh svoystv eritrotsitov pri khranenii v eritrotsitsoderzhashchikh sredakh s pomoshch'yu atomno-silovoy mikroskopii. Saratovskiy nauchno-meditsinskiy zhurnal. 2014;10(1):44-48. In Russian.
- Park H, Lee S, Ji M, Kim K, Son Y, Jang S, Park Y. Measuring cell surface area and deformability of individual human red blood cells over blood storage using quantitative phase imaging. Scientific Reports. 2016;6(1):34257. https://doi.org/10.1038/srep34257.
- Renoux C, Faivre M, Bessaa A, Da Costa L, Joly Ph, Gauthier A, Connes Ph. Impact of surface-area-to-volume ratio, internal viscosity and membrane viscoelasticity on red blood cell deformability measured in isotonic condition. Scientific Reports. 2019;9:6771. https://doi.org/10.1038/s41598-019-43200-y.
- Instrukciya po ispol'zovaniyu lekarstvennogo preparata dlya medicinskogo primeneniya Retinola pal'mitat. «Retinoidy» Al'manah. 2014;33:7-10. URL: https://retinoids.ru/pub/edition/almanacs almanac-33.
- Matthaus B, Özcan MM, Al Juhaimi F. Some rape/canola seed oils: fatty acid composition and tocopherols. Zeitschrift Für Naturforschung C. 2016;71(3-4):73-77. https://doi.org/10.1515/znc-2016-0003.
- Garcia-Aloy M, Hulshof PJM, Estruel-Amades S, Osté MCJ, Lankinen M, Geleijnse JM, Andres-Lacueva C. Biomarkers of food intake for nuts and vegetable oils: an extensive literature search. Genes & Nutrition. 2019;14:7. https://doi.org/10.1186/s12263-019-0628-8.
- Lee SM, Chung SH, Park Y, Park MK, Son YK, Kim SE, An WS. Effect of Omega-3 Fatty Acid on the Fatty Acid Content of the Erythrocyte Membrane and Proteinuria in Patients with Diabetic Nephropathy. International Journal of Endocrinology. 2015;208121:8. https://doi.org/10.1155/2015/208121.
- Hals PA, Wang X, Piscitelli F, Di Marzo V, Xiao YF. The time course of erythrocyte membrane fatty acid concentrations during and after treatment of non-human primates with increasing doses of an omega-3 rich phospholipid preparation derived from krill-oil. Lipids Health Dis. 2017;16(1):16. https://doi.org/10.1186/s12944-017-0414-9.
- Nagashree RS, Manjunath NK, Indu M, Ramesh M, Venugopal V, Sreedhar P, Pavithra N, Nagendra HR. Effect of a Diet Enriched with Fresh Coconut Saturated Fats on Plasma Lipids and Erythrocyte Fatty Acid Composition in Normal Adults. J Am Coll Nutr. 2017;36(5):330-334. https://doi.org/10.1080/07315724.2017.1280713.
- Li H, Zhou X, Gao P, Li Q, Li H, Huang R, Wu M. Inhibition of lipid oxidation in foods and feeds and hydroxyl radical-treated fish erythrocytes: A comparative study of Ginkgo biloba leaves extracts and synthetic antioxidants. Anim Nutr. 2016;2(3):234-241. https://doi.org/10.1016/j.aninu.2016.04.007.
- Weijers RNM. Membrane flexibility, free fatty acids, and the onset of vascular and neurological lesions in type 2 diabetes. Journal of Diabetes&Metabolic Disorders. 2015;15:1-13. https://doi.org/10.1186/s40200-016-0235-9.
- Kim OY, Lee SM, An WS. Impact of Blood or Erythrocyte Membrane Fatty Acids for Disease Risk Prediction: Focusing on Cardiovascular Disease and Chronic Kidney Disease. Nutrients. 2018;10(10):1454. https://doi.org/10.3390/nu10101454.
- Mohandas N, Gallagher PG. Red cell membrane: past, present, and future. Blood. 2008;112(10):3939-3948. https://doi.org/10.1182/blood-2008-07-161166.
- Van Doormaal JJ, Ideda IG, Muskiet FAJ, Martini IA, Doorenbos H. Effects of short-term high dose intake of evening primrose oil on plasma and cellular fatty acid compositions, α-tocopherol levels, and erythropoiesis in normal and Type 1 (insulin-dependent) diabetic men. Diabetologia. 1988;31(8):576-584. https://doi.org/10.1007/bf00264763.
- Stoeckel K, Bachmann L, Dobeleit G, Fuhrmann H. Response of plasma fatty acid profiles to changes in dietary n-3 fatty acids and its correlation with erythrocyte fatty acid profiles in dogs. Journal of Animal Physiology and Animal Nutrition. 2012;97(6):1142-1151. https://doi.org/10.1111/jpn.12023.
- Chen C, Wang P, Zhang Z, Ye Y, Zhuo S, Zhou Q, Zhang B. Effects of plant oils with different fatty acid composition on cardiovascular risk factors in moderately hypercholesteremic Chinese adults: a randomized, double-blinded, parallel-designed trial. Food&Function. 2020:35. https://doi.org/10.1039/d0fo00875c.
- Sinha A, Chu TT, Dao M, Chandramohanadas R. Single-cell evaluation of red blood cell bio-mechanical and nano-structural alterations upon chemically induced oxidative stress. Sci Rep. 2015;7(5):9768. https://doi.org/10.1038/srep09768.
- Yehye WA, Rahman NA, Ariffin A, Abd Hamid SB, Alhadi AA, Kadir FA, Yaeghoobi M. Understanding the chemistry behind the antioxidant activities of butylated hydroxytoluene (BHT): a review. Eur J Med Chem. 2015;28(101):295-312. https://doi.org/10.1016/j.ejmech.2015.06.026.
- Sánchez-Gallego JI, López-Revuelta A, Hernández-Hernández A, Sardina JL, López-Ruano G, Sánchez-Yagüe J, Llanillo M. Comparative antioxidant capacities of quercetin and butylated hydroxyanisole in cholesterol-modified erythrocytes damaged by tert-butylhydroperoxide. Food Chem Toxicol. 2011;49(9):2212-21. https://doi.org/10.1016/j.fct.2011.06.014.
- Lomanovskaya TA, Boronihina TV, Yackovskij AN. Izmeneniya morfologii eritrocitov pri peredozirovke retinola pal'mitata. Operativnaya hirurgiya i klinicheskaya anatomiya. 2020;4(1):46-51. https://doi.org/10.17116/operhirurg2020401146.


