Влияние медиаторов воспаления на моноциты периферической крови в норме и при эндотоксикозе
Автор: Лопухова Евгения Николаевна, Трофимов Владимир Александрович, Власов Алексей Петрович
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 3 т.22, 2014 года.
Бесплатный доступ
При эндотоксикозе процесс апоптотической гибели моноцитов периферической крови усиливается. Однако при этом также возрастает и число клеток, гибнущих некрозом. Определение соотношения жизнеспособных клеток, числа клеток, гибнущих апоптозом и некрозом, может являться прогностическим критерием оценки тяжести эндотоксикоза, перспектив благоприятного исхода и успешного лечения заболевания. Перекись водорода, гистамин и серотонин влияют на запуск программы апоптоза моноцитов крови доноров и больных с эндотоксикозом, однако с различной проапоптотической активностью.
Моноциты, эндотоксикоз, медиаторы воспаления, апоптоз
Короткий адрес: https://sciup.org/143177001
IDR: 143177001
Текст научной статьи Влияние медиаторов воспаления на моноциты периферической крови в норме и при эндотоксикозе
Введение. Эндотоксикоз как системное воспаление приводит к формированию и развитию глубоких метаболических перестроек, определяющих широту патофизиологических расстройств в организме, сопровождающихся глубокими количественными и качественными изменениями метаболизма [1, 2]. В связи с этим к основным критериям оценки эндотоксикоза, степени его тяжести относится анализ биохимических показателей организма [2]. В то же время, немаловажно знать состояние клеток, их способность адекватно реагировать на внешнюю стимуляцию. При этом одним из информативных показателей статуса клеток может служить их морфологическая оценка.
Для реализации данной цели цитологического исследования наиболее подходящим объектом являются моноциты периферической крови. Эти клетки являются высокореактивными и обеспечивают реализацию важных реакции клеточного иммунитета и надзора за эффективностью протекания физиологических процессов в различных тканях и органах [3-5]. Поэтому при различных заболеваниях любые, даже, казалось бы, малозначимые изменения функциональной активности моноцитов и макрофагов могут иметь определенное значение в развитии патофизиологических реакций.
При эндотоксикозе моноциты испытывают мощнейший стресс вследствие воздействия на их рецепторный аппарат и клеточные мембраны в целом широкого спектра химических веществ, включая медиаторы воспаления и эндотоксины. В этих условиях способность моноцитов реализовывать заложенный в них потенциал является основой для успешного разрешения и ограничения воспалительного процесса, независимо от стадии его развития.
Важнейшей причиной ослабления функциональной активности моноцитов в сосудистом русле может выступать запуск процессов апоптоза или некроза, обусловленный воздействием на клетки потенциальных индукторов гибели, включая реактивные формы активного кислорода, окисленные липиды, другие медиаторы воспаления [6].
При различных заболеваниях запуск программы апоптоза клеток может носить как компенсаторно-приспособительный характер, так и способствовать развитию и хронизации патологического процесса [7-10]. В тоже время усиление некротических процессов обязательно приводит к деструктивным клеточным, тканевым и органным изменениям в организме.
Поэтому анализ жизнеспособности моноцитов, их склонности к апоптозу или некрозу позволит определить уровень адаптационных, компенсаторно-приспособительных возможностей организма при эндотоксикозе и путей его коррекции.
Цель исследования - изучить проапопто-тическую и пронекротическую активности моноцитов периферической крови при эндотоксикозе различной степени выраженности, а также при действии медиаторов воспаления (перекиси водорода, серотонина, гистамина) в опытах in vitro .
Материал и методы исследования. Работа проводилась на фракции мононуклеаров, выделенной из периферической крови доноров (норма) и больных с острым аппендицитом, осложненным перитонитом, у которых зарегистрированы явления эндогенной интоксикации различной степени тяжести (больные с эндотоксикозом). Параметрами формирования выборок и оценки эндотоксикоза являлись общепринятые лабораторно-клинические и биохимические показатели, такие как содержание молекул средней массы (МСМ), общая и эффективная концентрация альбумина (ОКА и ЭКА), резерв связывания альбумина (РСА), индекс токсичности (ИТ), индекс гипоксии (ИГ), относительное содержание молочной и пировиноградной кислот [11].
Клетки получали из цельной крови на градиенте плотности с помощью Ficoll-Paque™ (ρ=1,077), Sigma, США. Рабочая концентрация суспензии составляла 106 кл/мл. Жизнеспособность клеток определяли в тесте с трипановым синим. Пробы инкубировали в СО2-инкубаторе при температуре 37ºС в течение 2 часов. Клетки, погибающие апоптозом или некрозом, выявляли методом флуоресцентной микроскопии (микроскоп «Motic BA400»), с помощью Hoechst 33258 (Sigma, США), акридинового оранжевого, красителя Гимза (Merk), наборов ApoDetect Annexin V-FITC Kit, CellEvent Caspase-3/7 green detection reagent (Invitrogen, США).
В опытах in vitro применяли перекись водорода в концентрациях 1 мМ и 5 мМ(Sigma, США), серотонин (0,1 мМ и 1 мМ) (Sigma, США), гистамин (0,2 мМ и 2 мМ) (Sigma, США). Полученные данные статистически обрабатывали методом вариационной статистики с использованием t-критерия Стьюдента. Достоверность различия определяли в каждой серии по отношению к исходному значению р .
Результаты исследования и их обсу- ждение. В работе проводились исследования с моноцитами, выделенными из периферической крови двух групп: доноров и больных с эндотоксикозом. Критерием отнесения к группе доноров (норма) являлись значения показателей равные: МСМ(λ=280 нм) – 250±19,08(×10-3) усл. ед., МСМ(λ=254 нм) – 296,4±22,17(×10-3) усл. ед., ОКА – 50,04±2,17 г/л, ЭКА – 45,09±2,46 г/л, РСА – 0,88±0,04 усл. ед., ИТ – 0,13±0,01 усл.ед, содержание молочной кислоты – 0,25±0,022 ммоль/г белка, пировиноградной кислоты – 0, 035±0,003 ммоль/г белка, ИГ – 7,11±0,05. В группе больных с эндотоксикозом данные показатели значительно отличались от их значений в группе доноров, в частности, величина МСМ была превышена примерно в 1,8 раза, значения ОКА, ЭКА, РСА снижены в 1,08, 1,6 и 1,4 раза соответственно, содержание молочной и пировиноградной кислот возрастали в 1,7 и 1,5 раза соответственно, ИТ превышен в 4,8 раза, ИГ – 1,16 раза.
Моноциты, выделенные из периферической крови, не имели выраженных признаков апоптоза или некроза, жизнеспособность клеток была достаточно высока и достигала 96-97%. При эндотоксикозе количество гибнущих клеток по сравнению с нормой возрастает с 3,5 % до 6,8 %.
В апототически измененных клетках больных с эндотоксикозом меняется интенсивность свечения (Hoechst 33258, пропидиум иодид), смещаются максимумы флуоресценции (акридиновый оранжевый) ядерных красителей, чётко диагностируется изменение формы ядра, наличие фрагментов (апоптотических телец). Возрастает свечение аннексина, меченного ФИТЦ (Annexin V-FITC), взаимодействующего с полярными головками молекул фосфатидилсеринов, транс-лоцированных на внешний монослой клеточной мембраны моноцитов в ходе реализации программы апоптоза (рис.1). С помощью набора CellEvent Caspase-3/7 green detection reagent можно судить об активации каспаз 3 и 7, при которой проявляется свечение красителя, связанного с субстратом, расщепляемым активированными каспазами (рис. 2).
Таким образом, программа апоптоза в моноцитах при эндотоксикозе активируется, однако при этом возрастает и число клеток, гибнущих некрозом. Очевидно, что определение соотношения жизнеспособных и гибнущих клеток, числа клеток, гибнущих апоптозом и некрозом, может являться прогностическим критерием оценки перспектив благоприятного исхода и успешного лечения заболевания.
После двухчасовой инкубации клеток с различными индукторами наблюдалось изменение соотношения апоптотических и некротических состояний.
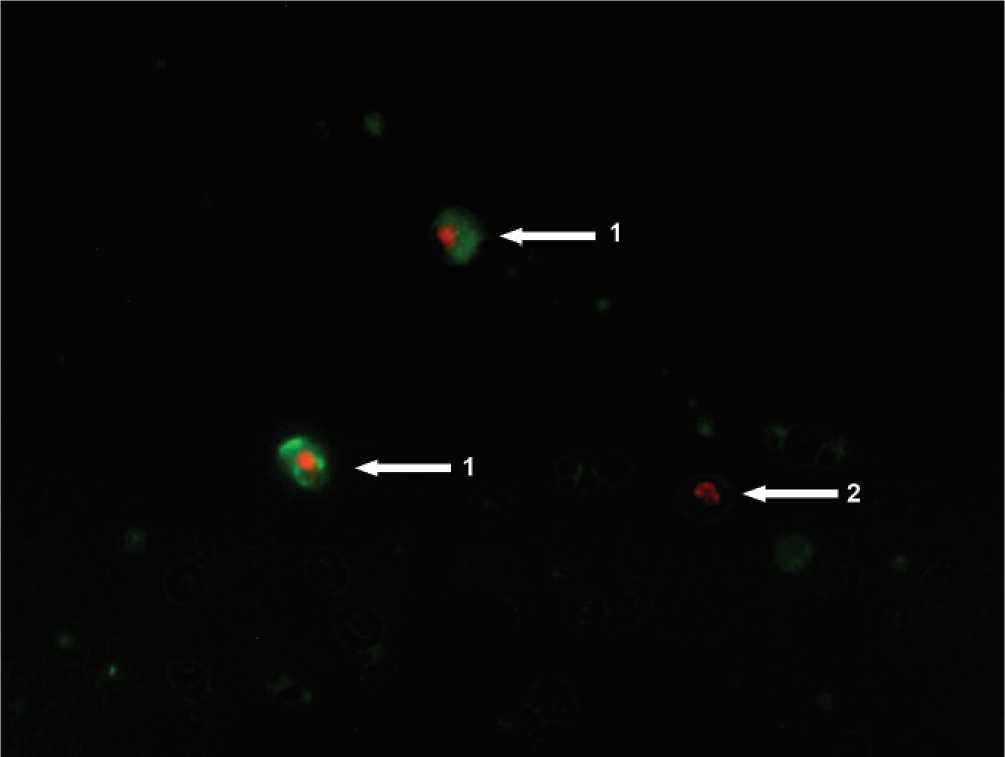
Рис. 1. Моноциты окрашенные Annexin V-FITC. 1) апоптотически гибнущие клетки, 2) клетки, гибнущие некрозом. Ув. 400.
Перекись водорода в диапазоне концентраций 1-10 мМ обладает высокой проапоптоти-ческой активностью по отношению к моноцитам доноров и больных с эндотоксикозом. Признаки апоптоза моноцитов проявлялись уже через 1 час после добавления перекиси водорода. Наибольшего значения проапоптотический эффект после двухчасовой инкубации без усиления некротического эффекта достигал при использовании вещества в концентрации 1мМ. При этом доля апоптотических клеток в норме и группе больных с эндотоксикозом отличалась незначительно и составляла 37,1 и 38,1 % соответственно (рис. 3). Однако при распределении данных относительно тяжести эндотоксикоза жизнеспособность моноцитов значительно снижалась у больных с эндотоксикозом средней тяжести (табл. 1).
С увеличением концентрации перекиси до 5мМ в популяции анализируемых моноцитов усиливались и некротические процессы.
При этом наиболее выраженное проапоп-тотическое действие 5 мМ перекись водорода оказывала на моноциты, выделенные из крови доноров (Рис. 3). В клетках, выделенных из крови больных с эндотоксикозом, увеличивался проне-кротический эффект, причем рост был пропорционален увеличению тяжести эндотоксикоза. Тем не менее, количество живых клеток, выделенных из крови больных с эндотоксикозом, было на 11,96 % выше, чем из крови здоровых доноров (рис. 3).
Подобный эффект наблюдался при действии 1мМ серотонина – доля живых клеток доноров снижалась на 11,53 % относительно клеток группы больных с эндотоксикозом (рис. 3). Увеличение концентрации серотонина с 0,1мМ до 1мМ приводило к резкому уменьшению жизнеспособности моноцитов, выделенных из клеток доноров, – на 23 %, при этом снижение жизнеспособности клеток в группе больных с эндотоксикозом составило лишь 2,6 %. В то же время такое разительное снижение жизнеспособности клеток доноров сопровождалось увеличением проапоптотического эффекта – доля апоптотических клеток возросла с 26,5 % при действии 0,1 мМ серотонина до 40,3 % при действии 1 мМ. Увеличение концентрации серотонина в суспензии клеток, выделенных из
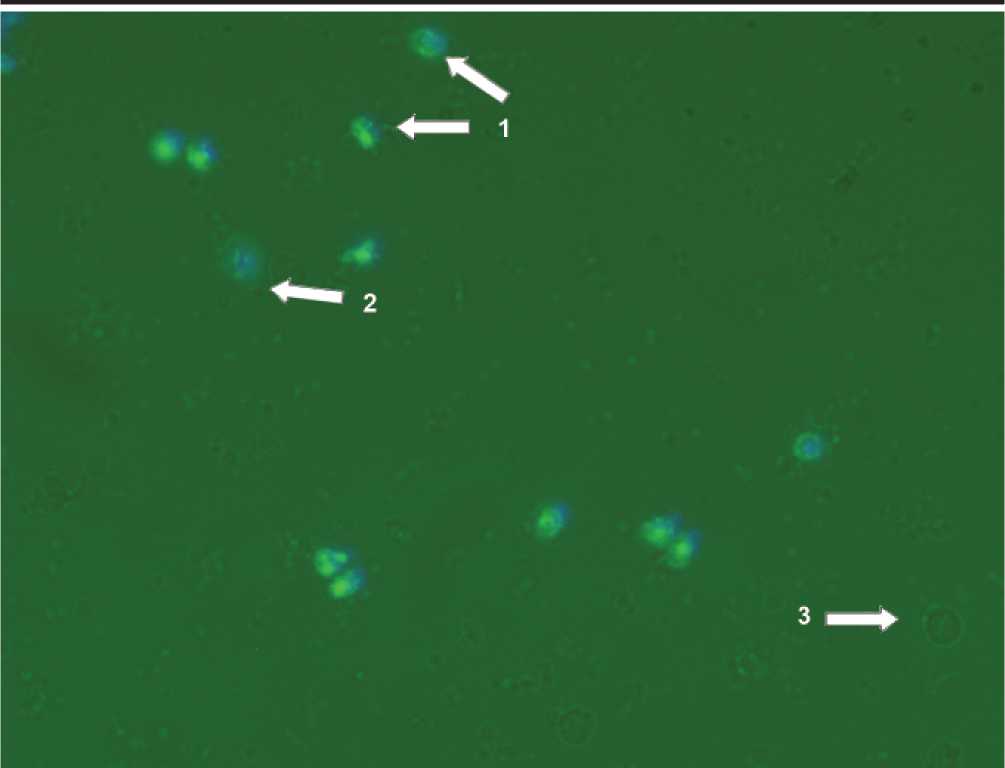
Рис. 2. Моноциты окрашенные CellEvent Caspase-3/7 green detection reagent. 1) апоптотически гибнущие клетки, 2) клетки, гибнущие некрозом, 3) живые клетки. Ув. 400.
крови больных с эндотоксикозом, не вызывало подобного проапоптотического эффекта, в целом доля апоптотических клеток даже снизилась с 30,8 % до 29,5 %, пронекротический же эффект усиливался на 31,6%.
В то время как действие перекиси водорода и серотонина в увеличивающихся концентрациях приводило к общему снижению жизнеспособности, воздействие гистамина производило противоположный эффект. Гистамин в концентрации 0,2 мМ вызывал снижение жизнеспособности, как клеток доноров, так и моноцитов выделенных из крови больных с эдотоксикозом, до 57,5 % и 56,7 %, тогда как в концентрации 2мМ гистамин производил меньший эффект – жизнеспособность моноцитов составляла 64,5 % и 62,1 %, соответственно (рис.3). При этом увеличение концентрации гистамина вызывало усиление пронекротического эффекта в клетках обоих групп.
Рассматривая особенности действия медиаторов на клетки и ткани в динамике воспалительного процесса в организме, отметим, что фазововременной характер воспаления в конечном итоге определяется последовательной активацией клеток под влиянием соответствующих медиаторов. При этом в ходе развития воспалительного процесса активные формы кислорода, серотонин и гистамин образуются клетками, участвующими в воспалении, на разных стадиях процесса и оказывают модифицирующее действие на его течение [12].
Перекись водорода концентрационно-зависимо влияла на жизнеспособность моноцитов доноров и больных с эндотоксикозом. Однако с ростом тяжести эндотоксикоза способность 1 мМ перекиси водорода вызывать гибель клеток нивелировалась, что, по-видимому, связано с потерей чувствительности клеток к действующему фактору и высоким процентом изначально гибнущих клеток. В то же время серотонин влиял на жизнеспособность моноцитов доноров, но не стимулировал гибель моноцитов больных с эндотоксикозом различной тяжести.
Наиболее показательным в плане сохранения жизнеспособности клеток был эффект гистамина, который стимулировал гибель моноцитов доноров
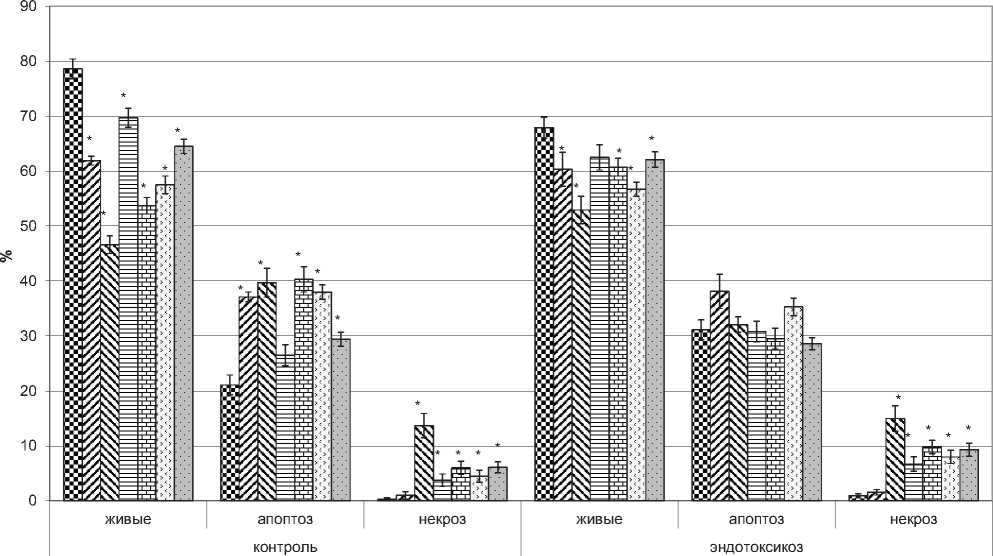
контроль 1мМ Н2О2 5мМ Н2О2 0,1мМ серотонина 1мМ серотонина 0,2мМ гистамина 2мМ гистамина
Рис. 3 Соотношение живых клеток и клеток, гибнущих апоптозом и некрозом, выделенных из крови доноров (норма) и больных с эндотоксикозом (эндотоксикоз).
Примечание: * – достоверность отличия по отношению к контролю при p < 0,05.
и больных с эндотоксикозом при использовании в концентрации 0,2 мМ, однако при увеличении концентрации гистамина до 2 мМ проявлялся протекторный эффект – число гибнущих клеток, в том числе и у больных с эндотоксикозом уменьшалось.
Другим важнейшим критерием патофизиологической оценки клеток при воспалении является определение состояния клеток, гибнущих путем апоптоза или некроза. Отметим, что наибольшая пронекротическая способность выявлена у перекиси водорода (5 мМ), у серотонина (1 мМ) и гистамина (2 мМ) в высоких концентрациях по отношению к моноцитам больных с эндотоксикозом.
Таким образом, отдельные медиаторы воспаления могут по-разному влиять на реализацию апоптотической программы моноцитов, течение воспалительного процесса и формирование эндотоксикоза. Сбои в исполнении воспалительной программы вследствие низкой эффективности медиаторных воздействий при недостаточном, чрезмерном или непоследовательном образовании отдельных медиаторов воспаления, их химической модификации могут иметь решающее значение в усилении эндотоксикоза.
Очевидно, что «уход» клеток в апоптоз является одной из важнейших причин изменения баланса медиаторных влияний и развития кле- точных дисфункций. В связи с этим анализ жизнеспособности моноцитов крови может использоваться как диагностический критерий прогноза воспалительного процесса, сопровождаемого эндотоксикозом. Сделанный вывод о запуске того или иного вида суицидной программы, позволяет судить о степени ослабления иммунного надзора, осуществляемого моноцитами и макрофагами.
Выводы.
-
1. В патогенезе эндотоксикоза важная роль отводится усилению процессов апоптотической гибели моноцитов периферической крови. Усиление некротической гибели моноцитов является критерием неблагоприятного течения эндотоксикоза.
-
2. Медиаторы воспаления: перекись водорода, гистамин и серотонин влияют на запуск программы апоптоза моноцитов крови доноров и больных с эндотоксикозом, однако с различной проапоптотической и пронекротической активностью максимальной у перекиси водорода. При этом гистамин оказывает протекторное действие на гибель моноцитов периферической крови при эндотоксикозе.
-
3. Определение цитологического статуса клеток, их склонности к тому или иному пути гибели может быть использовано в диагностике
Таблица.
Жизнеспособность моноцитов, выделенных из крови здоровых доноров и больных с эндотоксикозом, при действии различных медиаторов воспаления (%) (M±m)
|
Медиатор |
группы |
|||
|
норма |
больные с эндотоксикозом |
|||
|
легкой степени |
средней степени |
тяжелой степени |
||
|
контроль |
78,6±1,8 |
71,2±1,7* |
68,3±4,3* |
64,2±1,7* |
|
1мМ Н2О2 |
61,9±0,8 |
67,1±1,1* |
48,6±1,*2 |
65,3±1* |
|
5мМ Н2О2 |
46,6±1,6 |
58,9±2,5* |
53,8±1,8* |
46,1±3,7 |
|
0,1мМ серотонина |
69,7±1,7 |
68,5±2,5 |
63,3±2,2* |
55,7±2,4* |
|
1мМ серотонина |
53,7±1,5 |
64,7±1,7* |
62,1±1,4* |
56,2±1,1 |
|
0,2мМ гистамина |
57,5±1,6 |
58,5±1,7 |
57,7±2,6 |
54±1,7 |
|
2мМ гистамина |
64,5±1,3 |
64±1,7 |
62±2,3 |
60,3±2,6 |
Примечание: * – достоверность отличия по отношению к норме при p < 0,05.
выраженности эндотоксикоза в дополнение к биохимическим критериям оценки.
Список литературы Влияние медиаторов воспаления на моноциты периферической крови в норме и при эндотоксикозе
- Бородин Е.А. Биохимия эндотокситоза. Механизмы развития и оценка степени тяжести при воспалительных заболеваниях легких/Е. А. Бородин, Е. В. Егоршина, В. П. Самсонов -Благовещенск.: АГМА. -2003. -129 с.
- Келина Н. Ю. Биохимические проявления эндотоксикоза: методические аспекты изучения и оценки, прогностическая значимость (аналитический обзор)/Н. Ю. Келина, Н. В. Безручко, Г. К. Рубцов//Медико-биологические науки -2012. -№6. -С. 143-147.
- Sheel M. The diverse roles of monocytes in inflammation caused by protozoan parasitic diseases/M. Sheel and Ch. R. Engwerda//Trends in Parasitology -2012. -Vol. 28, No. 10. -P. 408-416.
- Haveman J. W. The central role of monocytes in the pathogenesis of sepsis: consequences for immunomonitoring and treatment/J.W. Haveman, A.C. Muller Kobold, J.W. Cohen Tervaert et al.//The Netherlands Journal of Medicine -1999. -Vol.55. -P. 132-141.
- Koussoulas V. Monocytes in systematic inflammatory response syndrome: Differences between sepsis and acute pancreatitis/V. Koussoulas, M. Tzivras, V. Karagianni et al.//World J Gastroenterol -2006. -Vol. 12, No. 41. -P. 6711-6714.
- Shih C. M. Nickel ions from a corroded cardiovascular stent induce monocytic cell apoptosis: Proposed impact on vascular remodeling and mechanism/C.M. Shih, C.Y. Huang, L.R. Liao, et al.//J. Formos Med. Assoc. -2014. -published Online: May 16
- Цыпленкова В. Г. Апоптоз/В.Г. Цыпленкова, Н.Н. Бескровнова//Арх. патол. -1996. -Т.58, № 5. -С. 71-74.
- Elmore S. Apoptosis: A review of programmed cell death/S. Elmore. Toxicology and Pathology, 2007. Vol. 35, № 4, P. 495-516.
- Лушников Е. Ф. Гибель клетки (апоптоз)/Е. Ф. Лушников, А.Ю. Абросимов-М.: Медицина, 2001. 190 с.
- Пальцев М. А. Молекулярная медицина и прогресс фундаментальных наук/М. А. Пальцев//Вестник РАН. -2002. -Т. 72, № 1. -С. 13-21.
- Карпищенко А. И. Медицинские лабораторные технологии и диагностика: в 2 т. Т.2/А. И. Карпищенко и др. -СПб: Интермедика. -1999. -656 с.
- Пальцев М. А. Межклеточные взаимодействия -2-е изд., перераб. и доп./М. А. Пальцев, А. А. Иванов, С. Е. Северин -М.: Медицина, 2003. -288 с.
- Borodin E. А. Biokhimiya ehndotoksitoza. Mekhanizmy razvitiya i otsenka stepeni tyazhesti pri vospalitel'nykh zabolevaniyakh legkikh/E. А. Borodin, E. V. Egorshina, V. P. Samsonov -Blagoveshhensk.: АGMА. -2003. -129 s.
- Kelina N. Yu. Biokhimicheskie proyavleniya ehndotoksikoza: metodicheskie aspekty izucheniya i otsenki, prognosticheskaya znachimost' (analiticheskijobzor)/N. Yu. Kelina, N. V. Bezruchko, G. K. Rubtsov//Mediko-biologicheskie nauki -2012. -№6. -S. 143-147.
- Sheel M. The diverse roles of monocytes in inflammation caused by protozoan parasitic diseases/M. Sheel and Ch. R. Engwerda//Trends in Parasitology -2012. -Vol. 28, No. 10. -P. 408-416.
- Haveman J.W. The central role of monocytes in the pathogenesis of sepsis: consequences for immunomonitoring and treatment/J.W. Haveman, A.C. Muller Kobold, J.W. Cohen Tervaert et al.//The Netherlands Journal of Medicine -1999. -Vol.55. -P. 132-141.
- Koussoulas V. Monocytes in systematic inflammatory response syndrome: Differences between sepsis and acute pancreatitis/V. Koussoulas, M. Tzivras, V. Karagianni et al.//World J Gastroenterol -2006. -Vol. 12, No. 41. -P. 6711-6714.
- Shih C.M. Nickel ions from a corroded cardiovascular stent induce monocytic cell apoptosis: Proposed impact on vascular remodeling and mechanism/C.M. Shih, C.Y. Huang, L.R. Liao, et al.//J. Formos Med. Assoc. -2014. -published Online: May 16
- Tsyplenkova V.G. Аpoptoz/V.G. Tsyplenkova, N.N. Beskrovnova//Агkh. patol. -1996. -T.58, № 5. -S. 71-74.
- Elmore S. Apoptosis: A review of programmed cell death/S. Elmore. Toxicology and Pathology, 2007. Vol. 35, № 4, P. 495-516.
- Lushnikov E. F. Gibel' kletki (apoptoz)/E. F.Lushnikov, А.YU. Аbrosimov-M.: Meditsina, 2001. 190 s.
- Pal'tsev M. А. Molekulyarnaya meditsina i progress fundamental'nykh nauk/M. А. Pal'tsev//Vestnik RАN. -2002. -T. 72, № 1. -S. 13-21.
- Karpishhenko А. I. Meditsinskie laboratornye tekhnologiii diagnostika: v2t. T. 2/А. I. Karpishhenko i dr. -SPb: Intermedika. -1999. -656 s.
- Pal'tsev M. А. Mezhkletochnye vzaimodejstviya -2-e izd., pererab. i dop./M. А. Pal'tsev, А. А. Ivanov, S. E. Severin -M.: Meditsina, 2003. -288s.


