Влияние мексидола на предсердный и мозговой натрийуретические пептиды миоцитов правого предсердия крыс в постреперфузионном периоде
Автор: Бугрова Марина Леонидовна
Журнал: Морфологические ведомости @morpholetter
Рубрика: Оригинальные исследования
Статья в выпуске: 1 т.24, 2016 года.
Бесплатный доступ
Методами иммуноцитохимии, трансмиссионной электронной микроскопии, световой микроскопии исследовали влияние мексидола на процессы накопления и выделения предсердного и мозгового натрийуретических пептидов кардио-миоцитов крыс в постреперфузионном периоде. Выявлена разная реакция пептидов на введение препарата: увеличение продукции предсердного натрийуретического пептида через 60 мин и отсутствие эффекта через 60 суток постреперфузи-онного периода. На мозговой натрийуретический пептид мексидол оказывал пролонгированное действие через 60 суток и практически не влиял через 60 мин восстановительного периода.
Предсердный натрийуретический пептид, мозговой натрийуретический пептид, постреперфузионный период, мексидол
Короткий адрес: https://sciup.org/143177090
IDR: 143177090
Текст научной статьи Влияние мексидола на предсердный и мозговой натрийуретические пептиды миоцитов правого предсердия крыс в постреперфузионном периоде
Введение. Семейство натрийуретических пептидов является важным звеном в сложной системе поддержания водно-солевого баланса в организме [1]. Среди сердечных гормонов наибольший интерес исследователей вызывают предсердный (ПНП) и мозговой (МНП) натрийуретический пептиды [2, 3]. Основные действия этих веществ - снижение артериального давления за счет натрийуретического, диуретического эффектов и ингибирование ренин–ангиотензин-альдо-стероновой системы [1, 4]. Несмотря на сходство ПНП и МНП в литературе имеются противоречивые данные об их физиологической эффективности и прогностической значимости [1, 5]. Для объективности выводов необходимо анализировать параллельно оба пептида [6]. Синтетические аналоги гормонов используют в клинике [1, 7]. В связи, с чем актуальной является проблема взаимодействия ПНП и МНП с препаратами, применяемыми в кардиологии, одним из которых является антигипоксант метаболического типа действия 3-гидрокси-6-метил-2-этилпиридина сукцинат – мексидол. Ранее нами были проведены исследования влияния мексидола на МНП в постреперфузионном периоде (ПРП) и частично на ПНП [8, 9, 10]. Для прояснения и детального анализа спорных моментов было проведено комплексное морфологическое исследование влияния препарата на продукцию натрийуретических пептидов на ранних и отдаленных сроках ПРП в эксперименте.
Цель исследования – в сравнительном аспекте изучить влияние мексидола на аккумуляцию и выделение предсердного и мозгового натрийуретических пептидов (ПНП и МНП) предсердных миоцитов крыс в постреперфузионном периоде (ПРП).
Материал и методы исследования. Эксперименты выполнены на 25 белых аутбредных Wistar крысах - самцах, массой 220-250г в соответствии с правилами, установленными Европейской конвенцией по защите позвоночных животных, используемых для экспериментальных и других научных целей (принятой в Страсбурге 18.03.1986г. и подтвержденной в 15.06.2006г.). Применяли модель клинической смерти по В.Г. Корпачеву [11]. Анализировались следующие группы животных: 1) интактные (n=5);
-
2) контрольные животные через 60 мин ПРП (n=5);
-
3) крысы через 60 мин ПРП с введением мексидола (n=5);
-
4) контрольные животные через 60 сут ПРП (n=5);
-
5) крысы через 60 сут ПРП с введением мек-сидола (n=5).
В 3-й и 5-й группах мексидол вводили после восстановления кровотока внутрибрюшинно в течение первого часа в три приема, в дозе 25 мг/кг. Электронно-микроскопический анализ образцов правого предсердия всех групп животных выполнялся по стандартной методике [12]. Локализацию ПНП и МНП выявляли на уль-тратонких срезах с помощью поликлональных антител: Rabbit anti-Atrial Natriuretic Factor (1-28) (rat), Rabbit anti-Brain Natriuretic Peptide-32 (Rat) Serum, Peninsula Laboratories. Inc., Bachem, США и вторых антител Protein-A/Gold (15 nm), ф. EM Grade, Electron Microscopy Sciences, США [8, 10]. Для каждого пептида реакции осуществляли отдельно. Срезы контрастировали уранилацетатом, цитратом свинца и просматривали в электронном микроскопе Morgagni 268D (ф. FEI, США). Проводили подсчет гранул с иммунореактивным материалом в полях зрения (38х38 мкм). Выделяли два типа гранул: осмиофильные с четкой мембраной, осуществляющие хранение пептидов (А-тип) и менее электронноплотные с размытой мембраной, выделяющие пептиды (В-тип) [13]. Для исследования на светооптическом уровне образцы левого желудочка брали у интактных крыс, через 60 суток
ПРП и через 60 суток ПРП с введением мексидола (1-й, 4-й и 5-й групп). Образцы фиксировали в 10% растворе нейтрального формалина и заливали в парафин [14]. Приготовленные на микротоме SM 2000R (Leica, Австрия) срезы 5 – 7 мкм, окрашивали гематоксилином и эозином, по Ван Гизону; изучали с помощью светового микроскопа Eclips 80i (Nikon, Япония) и программы NIS-Elements BR 4.00.02. При увеличении х40 определяли площадь поперечного сечения кардиомиоцитов, процентное соотношение миоцитов, коллагеновых волокон и внеклеточного матрикса в полях зрения 2560х1920 мкм. Статистическую обработку данных проводили в программе Statistica 10.0 с помощью критерия Манна-Уитни (р<0,05).
Результаты исследования и их обсуждение. Через 60 мин ПРП полученные результаты выявили существенные различия воздействия мексидола на накопление и выведение натрийуретических пептидов. В опытной 3-й группе по количеству гранул было отмечено положительное влияние препарата на образование и выброс ПНП: сравнение с контрольной серией (2-й группой), в которой было зафиксировано повышенное количество пептида относительно интактной 1-й серии, показало повышение числа гранул А – типа на 38, В – типа на 42% и общего числа гранул на 37% (табл., рис. 1). В то же время мексидол незначительно снижал продукцию МНП: соотношение гранул
Таблица.
Количество гранул А – и В – типов, содержащих ПНП и МНП, предсердных миоцитов крыс в постреперфузионном периоде (M±m)
|
Группы животных |
Гранулы, содержащие ПНП, тип |
Гранулы, содержащие МНП, тип |
||
|
А |
В |
А |
В |
|
|
Интактные |
65,75±2,76 |
38,90±2,88 |
16,00±0,77 |
7,53±0,38 |
|
60 мин ПРП |
85,64±2,94 |
56,48±2,41 |
37,47±2,57 |
23,37±1,59 |
|
P1=0,004301 |
P1=0,001499 |
P1=0,000190 |
P1=0,000002 |
|
|
118,28±4,43 |
80,4±3,68 |
30,80±1,86 |
18,60±1,08 |
|
|
60 мин ПРП с мексидолом |
P1=0,000002 |
P1=0,000001 |
P1=0,000001 |
P1=0,000000 |
|
P2=0,000285 |
P2=0,000907 |
P2=0,320190 |
P2=0,124392 |
|
|
105,17±3,99 |
54,70±3,78 |
50,60±2,55 |
26,96±1,41 |
|
|
60 сут ПРП |
P1=0,000010 |
P1=0,007210 |
P1=0,000000 |
P1=0,000000 |
|
P2=0,012420 |
P2=0,833668 |
P2=0,011709 |
P2=0,304423 |
|
|
112,61±4,33 |
60,87±3,05 |
67,26±2,96 |
40,78±1,78 |
|
|
P1=0,000030 |
P1=0,005210 |
P1=0,000000 |
P1=0,000000 |
|
|
60 сут ПРП с мексидолом |
P2=0,002034 |
P2=0,833668 |
P2=0,000000 |
P2=0,000002 |
|
P3=0,307015 |
P3=0,297047 |
P3=0,011100 |
P3=0,000001 |
|
|
P4=0,635027 |
P4=0,025824 |
P4=0,000000 |
P4=0,000000 |
|
Примечание:
Р1 – достоверность различий относительно интактных животных;
Р2 - достоверность различий относительно 60 мин ПРП;
Р3 - достоверность различий относительно 60 сут ПРП;
Р4 - достоверность различий относительно 60 мин ПРП с мексидолом по тесту Манна-Уитни.
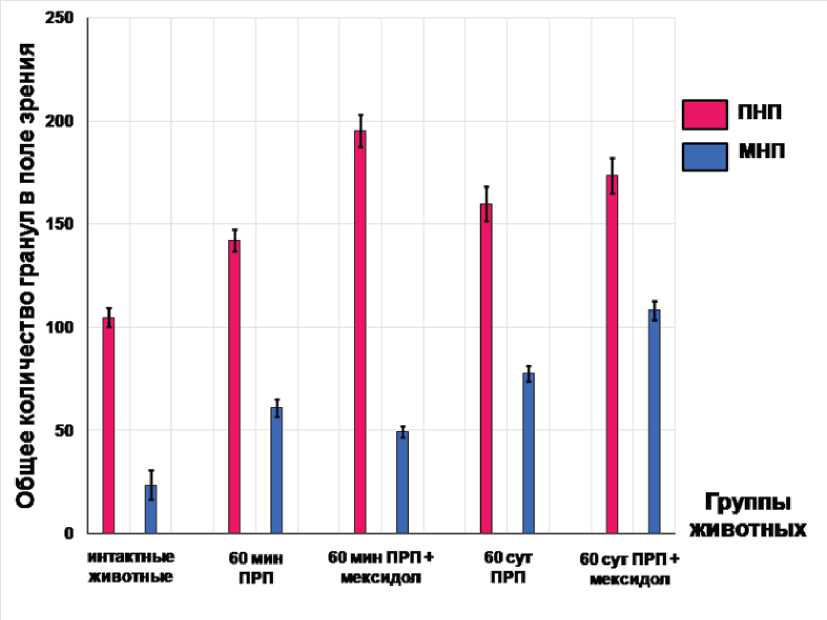
Рис. 1. Общее количество гранул с предсердным (ПНП) и мозговым (МНП) натрийуретическими пептидами у интактных и экспериментальных животных (по тесту Манна - Уитни).
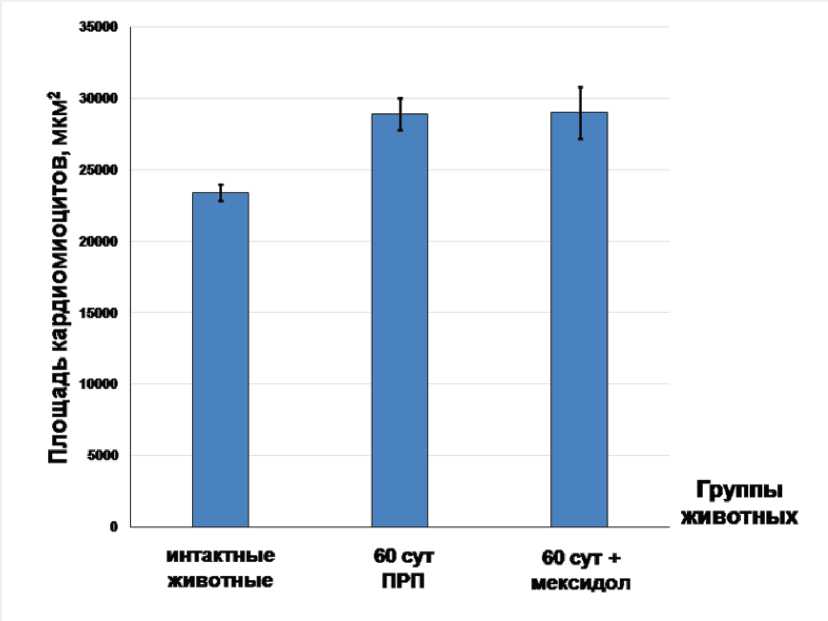
Рис. 2. Площадь поперечного сечения кардиомиоцитов левого желудочка у интактных и экспериментальных животных через 60 суток постреперфузионного периода (по тесту Манна - Уитни).
Соотношение компонентов соединительной ткани и кардиомиоцитов в левом желудочке крыс через 60 сут ПРП
(' Коллагеновые волокна и Внеклеточный матрикс и Кардиомиоциты
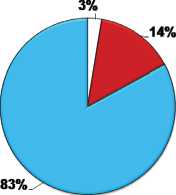
Соотношение компонентов соединительной ткани и кардиомиоцитов в левом желудочке крыс через 60 сут ПРП с применением мексидола
. Коллагеновые волокна и Внеклеточный матрикс и Кардиомиоциты 2% 2%
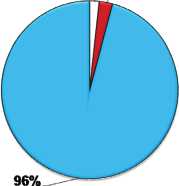
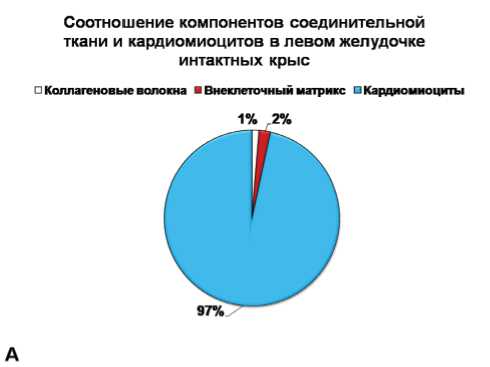
Рис. 3. Соотношение тканевых компонентов в миокарде левого желудочка крыс: интактных (А), через 60 суток постреперфузионного периода (Б) и 60 суток постреперфузионного периода с введением мексидола (В).
было выше уровня интактной 1-й группы, однако общее количество гранул достоверно отличалось от контрольной 2-й группы, и было меньше на 18% (см. таблицу, рис. 1). Ранее обсуждалось цитопро-текторное свойство препарата, обусловленное антиоксидантной активностью 3-оксипиридинов и антигипоксическим свойством янтарной кислоты [15, 16]. Было показано сохранение ультраструктуры кардиомиоцитов [10]. Вазопротекторное свойство мексидола приводило к улучшению микроциркуляции, отсутствию агрегации эритроцитов [8]. По данным исследователей, препарат нивелировал скачок артериального давления, возникающий во время реанимационных мероприятий [17]. Есть мнение, ПНП вырабатывается больше в норме, МНП - при сердечно - сосудистой патологии [18]. Небольшое снижение продукции МНП на фоне увеличения ПНП могло быть хорошим признаком, отражающим положительное влияние мексидола на состояние миокарда. Увеличение накопления/выведения пептидов в контрольной 2-й группе животных было обусловлено действием факторов ишемии/реперфузии: HIF-1α (hypoxia inducible factor - 1α) и ET-1 (эндотелин 1) [1, 19, 20]. Предполагается, после стимуляции накопления и выброса ПНП и МНП введение мексидола дополнительно усиливало синтетические реакции в кардиомиоцитах. Смещение процессов в сторону увеличения продукции ПНП и уменьшения МНП происходило вследствие ограниченности клеточных резервов для образования дублирующих друг друга веществ.
Через 60 сут эксперимента также была выявлена разная реакция пептидов в ответ на введение мексидола в раннем ПРП. Было показано отсутствие эффекта препарата на продукцию ПНП: содержание гормона было увеличено относительно интактных животных, но не отличалось от контрольной 4-й группы, и, по сравнению с 3-й группой (60 мин ПРП с введением мескидола), происходило снижение выделения пептида из кардиомиоцитов: гранул В – типа и общее количество уменьшилось на 25 и на 12%, соответственно (табл., рис. 1). На МНП мексидол воздействовал, как сильный стимулятор, о чем свидетельствовало значительное увеличение количества гранул с пептидом по сравнению со всеми группами: по отношению к 4-й контрольной группе (60 сут ПРП) гранул А – типа было выше на 33, В – типа на 51% и их общего количества на 39% (табл., рис. 1).
Исследование миокарда левого желудочка на светооптическом уровне выявило гипертрофию кардиомиоцитов как в 4-й, так и в 5-й группе животных (через 60 сут ПРП с мексидолом и без препарата): достоверное увеличение площади поперечного сечения миоцитов на 23% относительно 1-й группы интактных животных (рис. 2). Повышенное содержание сердечных гормонов относительно показателей интактных животных могло быть связано с выявленной гипертрофией кардиомиоцитов у животных, как с применением препарата, так и без его введения: натрийуретические пептиды используются в качестве маркеров гипертрофии миокарда [1, 21]. В то же время в группе с введением мексидола было обнаружено уменьшение доли компонентов соединительной ткани в сердце практически до значений интактных животных (рис. 3а, б, в), что могло быть связано с антифиброзными свойствами ПНП и МНП: ингибированием пролиферации фибробластов и их синтетической активности [4, 22]. Более выраженная реакция МНП на введение мексидола объяснялась несколькими факторами. С одной стороны, препарат, введенный в раннем ПРП, оказывал пролонгированный эффект, который объяснялся медленным ответом пептида на различные воздействия [1, 23]. С другой стороны, некоторые исследователи считают МНП более продуктивным гормоном, чем ПНП в плане действия на органы-мишени: наличие гипертрофии являлось стимулирующим для усиления образования и выведения пептида, обладающего антигипертрофическим свойством [4, 24]. Однако, есть мнение, что большое количество гранул с МНП является не положительным, а отрицательным фактором, так как длительная экспозиция пептида может усугублять ремоделирование миокарда в эксперименте [25]. Наконец, увеличение содержания МНП на фоне снижения выделения ПНП могло свидетельствовать о переходе системы натрийуретических гормонов на новый уровень функционирования. По-видимому, существует некий баланс между пептидами: при достижении определенного уровня происходит смещение продукции в сторону увеличения одного из них и уменьшения другого.
Полученные данные свидетельствуют о значительных отличиях в механизмах запуска образования и выброса сердечных гормонов в ответ на действие фармакологических веществ.
Таким образом, была выявлена разная реакция пептидов в ответ на введение мексидола в дозе 25 мг/кг. В раннем ПРП препарат усиливал продукцию ПНП и незначительно снижал МНП, относительно контрольных животных. В отдаленном ПРП, напротив, практически не отражался на накоплении/выделении ПНП и значительно стимулировал МНП. Проведенное исследование вносит вклад в понимание взаимодействия натрийуретических пептидов с лекарственными средствами в условиях сердечно - сосудистой патологии.
Список литературы Влияние мексидола на предсердный и мозговой натрийуретические пептиды миоцитов правого предсердия крыс в постреперфузионном периоде
- Ogawa T., de Bold A. The heart as an endocrine organ // Endocrine Connections. - 2014. - Vol. 3. -P.31- 44.
- Tokudome T., Kishimoto I., Shindo T., Kawakami H., Koyama T., Otani K., Nishimura H., Miyazato M., Kohno M., Nakao K., Kangawa K. Importance of Endogenous Atrial and Brain Natriuretic Peptides in Murine Embryonic Vascular and Organ Development //Endocrinology. - 2016. - Vol. 157(1). - P. 358-367.
- Kuhn M. Cardiac actions of atrial natriuretic Peptide: new visions of an old friend // Circ Res. -2015. - Vol. 116(8). - P. 1278-80.
- Иванова С.В., Нестерова Е.А. Семейство натрийуретических пептидов: возможности применения в поликлинической практике // Медицинский совет. - 2014. - № 2. - С. 77-81.
- Максимов В.Ф., Коростышевская И.М., Курганов С.А., Маркель А.Л., Руденко Н.С., Якобсон Г.С. Изменения миоэндокринных клеток правого предсердия у крыс при гипертензии и после снижения артериального давления//Цитология. - 2014. - т. 56, № 10. - С. 725 -734.
- Sato M., Mikamo A., Kurazumi H., Suzuki R., Murakami M., Kobayashi T., Yoshimura K., Hamano K. Ratio of preoperative atrial natriuretic peptide to brain natriuretic peptide predicts the outcome of the maze procedure in mitral valve disease // J. Cardiothorac Surg. - 2013. - Vol. 8. - P. 32.
- DOI: 10.1186/1749-8090-8-32
- Matsue Y., Kagiyama N., Yoshida K., Kume T., Okura H., Suzuki M., Matsumura A., Yoshida K., Hashimoto Y. Carperitide is associated with increased in-hospital mortality in acute heart failure: a propensity score-matched analysis // J. Card Fail. - 2015. - Vol. 21. - P. 859-864.
- Бугрова М.Л., Абросимов Д.А., Яковлева Е.И. Влияние Мексидола на мозговой натрийуретический пептид кардиомиоцитов в постреперфузионном периоде в эксперименте // Современные технологии в медицине. - 2015. - т. 7, № 3. - С. 40-46.
- Бугрова М.Л., Харьковская Е.Е., Яковлева Е.И. Влияние Мексидола на предсердный натрийуретический пептид в изолированном по Лангендорфу сердце крысы // Современные технологии в медицине. - 2014. - т. 6, № 2. - С. 25 - 31.
- Бугрова М.Л., Яковлева Е.И., Ермолин И.Л. Образование и выброс предсердного натрийуретического пептида в кардиомиоцитах под воздействием мексидола в раннем постреперфузионном периоде в эксперименте // Морфологические ведомости. - 2014. - № 2. - С. 19 - 25.
- Корпачев В.Г., Лысенков С.П., Телль Л.З. Моделирование клинической смерти и постреанимационной болезни у крыс // Патологическая физиология и экспериментальная терапия. - 1982. - № 3. - С. 78-80.
- Бисерова Н.М. Методы визуализации биологических ультраструктур. Подготовка биологических объектов для изучения с помощью электронных и флуоресцентных конфокальных лазерных микроскопов. Практическое руководство для биологов. - Москва: Товарищество научных изданий КМК. - 2013. - 104 с., 24 вкл.
- Mifune H., Suzuki S., Noda Y. et al. Fine structure of atrial natriuretic peptide (ANP) - granules in the atrial cardiocytes in the pig, cattle and horse//J Vet Med Sci. - 1991. - Vol. 53. - P. 561 - 568.
- Коржевский Д.Э., Гиляров А.В. Основы гистологической техники. - СПб: СпецЛит. - 2010. - 95с.
- Замотаева М.Н., Чаиркин И.Н., Инчина В.И., Дроздов И.А. Экспериментальное обоснование применения мексидола и 3-оксипиридина фумарата при хроническом повреждении миокарда // Бюллетень экспериментальной биологии и медицины. - 2013. - № 2. - С. 176 - 178.
- Андреева Н.Н. Экспериментальные и клинические аспекты применения мексидола при гипоксии (обзор) // Медицинский альманах. - 2009. - № 4. - С. 193-197.
- Проданец Н.Н. Действие мексидола на структурно-функциональные перестройки стенки магистральных сосудов в постреперфузионном периоде//Автореф. дис..канд. биол. наук. - Н. Новгород, 2007. - 25с.
- Voulteenaho O., Ala-Kopsala M., Ruskoaho H. BNP as marker in heart disease // Adv. Clin. Chem. - 2005. - Vol. 40. - P. 1-36.
- Weidemann A., Klanke B., Wagner M., Volk T., Willam C., Wiesener M., Eckardt K., Warnecke C. Hypoxia, via stabilization of hypoxia-inducible factor HIF-1α is a direct and sufficient stimulus for brain-type natriuretic peptide induction // BJ. Immediate Publication. - 2007. - Vol. 409. - P. 233-242.
- Arjamaa O., Nikinmaa M. Hypoxia regulates the natriuretic peptide system //Int J Physiol Pathophysiol Pharmacol. - 2011. - Vol. 3(3). - P. 191-201.
- Ogawa N., Komura H., Kuwasako K., Kitamura K., Kato J. Plasma levels of natriuretic peptides and development of chronic kidney disease // BMC Nephrol. - 2015. - Vol. 16(1). - P. 171. 10.1186/ s12882-015-0163-9.
- DOI: 10.1186/s12882-015-0163-9
- Watson C., Phelan D., Xu M., Collier P., Neary R., Smolenski A., Ledwidge M., McDonald K., Baugh J. Mechanical stretch up-regulates the B-type natriuretic peptide system in human cardiac fibroblasts: a possible defense against transforming growth factor-β mediated fibrosis//Fibrogenesis and tissue repair. - 2012. - Vol. 5. - P. 1 - 10.
- Steiner J., Guglin M. BNP or NTproBNP? A clinician's perspective//Int. J. Cardiol. - 2008. - Vol. 129. - P. 5-14.
- Cavallero, S. González G., Seropian I., Cerrudo C., Matorra F., Morales C., Hertig C., Puyó A., Fernandez B., Gelpi R. Ventricular function and natriuretic peptides in sequentially combined models of hypertension //Am. J. Physiol. Heart. Circ. Physiol. - 2010. - Vol. 298. - P. H1290- H1299.
- Thireau J., Karam S., Fauconnier J., Roberge S., Cassan C., Cazorla O., Aimond F., Lacampagne A., Babuty D., Richard S. Functional evidence for an active role of B-type natriuretic peptide in cardiac remodelling and pro-arrhythmogenicity // Cardiovasc. Res. - 2012. - Vol. 95. - P. 59-68.


