Влияние метаболических нарушений на течение остеоартроза
Автор: Артменко Наталья Алексеевна, Тер-ананьянц Е.А., Машталова О.Г.
Журнал: Клиническая практика @clinpractice
Рубрика: Оригинальные исследования
Статья в выпуске: 1 (5), 2011 года.
Бесплатный доступ
Целью данного исследования явилось изучение влияния ожирения на течение остеоартроза (ОА) у женщин. Материал и методы. Обследованы 83 пациентки с диагнозом ОА, которые были разделены на 2 группы. 1я группа(51 больная) с индексом массы тела (ИМТ) ≥ 30 кг/м 2; 2я группа (32 пациентки) с ИМТ2. Объективизация симптомов достигалась использованием визуальной аналоговой шкалы (ВАШ) и альгофункциональный индекса WOMAC. Кроме того, определяли сывороточный уровень Среактивного белка (СРБ) и интерлейкина6 (ИЛ6). Результаты. Выявлено существование прямой умеренной связи между ИМТ и выраженностью болевого синдрома по ВАШ (r = 356, p = 0,027). При избыточной массе тела (2я группа) установлена очень тесная связь между изменением индекса боли по ВАШ и затруднениями в выполнении повседневной деятельности (В WOMAC) (r = 0,971, р = 0,28). В обеих группах пациенток с ОА вне зависимости от ИМТ отмечено высокое содержание СРБ и ИЛ6. У женщин с дегенеративнодеструктивным заболеванием суставов получена очень тесная связь между содержанием ИЛ6 и выраженностью боли по ВАШ (r = 0,99; р = 0,23). У больных ОА 2й группы выявлена сильная связь между показателями СРБ и ИЛ6 (r = 0,84, р = 0,002) и значительная связь между этими же показателями в группе женщин с ИМТ2 (r = 0,67, р = 0,006). Заключение. Течение ОА у женщин с избыточной массой тела сопровождается более выраженным болевым синдромом, повышением уровней биомаркеров системного воспаления, значительными функциональными нарушениями и частым развитием синовитов коленных суставов.
Остеоартроз, ожирение, биомаркеры, болевой синдром
Короткий адрес: https://sciup.org/14338364
IDR: 14338364
Текст научной статьи Влияние метаболических нарушений на течение остеоартроза
Остеоартроз (ОА) представляет собой «группу заболеваний различной этиологии со сходными биологическими, морфологическими и клиническими исходами, при которых в патологический процесс вовлекаются все структуры сустава, приводя к дегенерации хряща» [1]. В основе прогрессирования дегенеративно-деструктивного заболевания суставов лежит генетическая предрасположенность, биомеханические и метаболические изменения, взаимодействующие друг с другом и только частично связанные с возрастными изменениями [2].
Увеличение распространенности ОА с возрастом предполагает наличие у многих пациентов сопутствующих заболеваний [3]. По результатам международных исследований, у больных ОА чаще всего встречаются сердечнососудистые заболевания: ишемическая болезнь сердца (ИБС), артериальная гипертензия (АГ) и метаболические нарушения (ожирение, сахарный диабет и др.) [4]. Развитие кардиоваскулярной патологии у пациентов с ожирением приводит к значительному повышению риска сосудистых катастроф и ухудшению жизненного прогноза у больных этой группы. Однако влияние коморбидного фона на течение ОА остается недостаточно изученным.
Высказываются противоречивые мнения о причинно-следственных связях между ожирением и прогрессированием дегенеративнодеструктивного заболевания суставов [5]. Общепринятая точка зрения об избыточной массе тела как механическом факторе повреждения суставов не отражает всего многообразия взаимосвязанных нарушений, развивающихся у больных ОА с ожирением.
В связи с этим целью настоящего исследования явилась оценка альгофункциональных изменений у пациенток с ОА при избыточной массе тела, а также определение значения ожирения для жизненного прогноза больных этой группы.
Материал и методы
Исследуемая группа включала 83 пациентки с достоверным диагнозом ОА, установленным по клинико-рентгенологическим данным на основании критериев Американской коллегии ревматологов (1999 г.) [6]. Средний возраст больных составил 58,4 ± 12,5 лет (от 45 до 70 лет), продолжительность заболевания – 9,8 4,7 года (от 1 до 24 лет).
Для объективизации оценки поражения опорно-двигательной системы у пациенток с
ОА использовали определение боли по визуальной аналоговой шкале (ВАШ) и альгофунк-циональный индекс WOMAC (Western Ontario and McMaster Universities). Ожирение диагностировали на основании определения индекса массы тела (ИМТ); объема талии (ОТ); объема бедер (ОБ) и их соотношения [7].
Твердофазным иммуноферментным методом определяли концентрацию С-реактивного белка (С-РБ) и интерлейкина-6 (ИЛ-6) (набор коммерческих тест-систем BIOMERICA, INC., Nordic Bioscience Diagnostics A/S).
Для оценки состояния периартикулярных тканей, визуализации хряща и поверхности костных структур выполнили ультразвуковое исследование суставов (Phillips HD-11) [8].
При проведении статистического анализа результатов использовали стандартный пакет статистических программ Microsoft Excell и Statistica 6 (Stat Soft, США), а также методы описательной статистики, корреляционно-регрессионный метод множественной регрессии. Количественные данные представлены в виде средних значений (М) ± стандартное отклонение (m). Для сравнения средних (М) между группами использовали параметрический критерий Стьюдента при нормальном распределении признаков и непараметрические критерий Манна-Уитни-Вилкоксона при отклонении ряда от нормального. Статистическую гипотезу принимали как альтернативную при p < 0,05. Коэффициент корреляции проверяли на достоверность связи.
Результаты исследования и их обсуждение
Для выявления клинико-лабораторных особенностей течения ОА у женщин с ожирением были сформированы две группы, сопоставимые по возрасту, давности и рентгенологической стадии заболевания. В первую – с ИМТ ≥ 30 кг/м2 – вошла 51 (67,64%) пациентка, вторую группу составили 32 (32,36%) человека с ИМТ < 30 кг/м2.
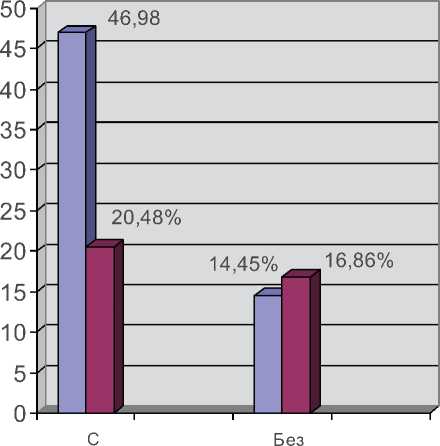
Наличие локального воспаления у больных ОА является ключевым звеном в развитии дегенеративных процессов в суставах, инициированных механическим повреждением хряща [9]. В связи с этим несомненный интерес представляет анализ зависимости выявления периартикулярного воспаления от ИМТ у больных с ОА (рис. 1).
Локальное воспаление в коленных суставах выявлено у 53 (63,85%) больных ОА, причем большинство из них страдали ожирением. У пациенток с дегенеративно-деструктивным за-
□ ИМТ более 30 кг/м2 ■ ИМТ менее 30 кг/м2
Рис. 1. Выявление синовитов коленных суставов у больных ОА (%) в зависимости от ИМТ.
болеванием суставов при избыточной массе тела синовиты диагностировались значительно чаще, чем у женщин с ИМТ <30 кг/м2 (рис. 1). В группе больных с ОА без явлений периарти-кулярного воспаления коленных суставов зависимости от ИМТ не отмечено.
Синовит при дегенеративно-деструктивном заболевании суставов, вероятно, вторичен, но существенно влияет на выраженность болевого синдрома и степень функциональных ограничений у этих пациентов [10]. Для объективизации оценки болевого синдрома и поражения опорно-двигательной системы у пациентов с ОА в зависимости от ИМТ были использованы ВАШ и альгофункциональный индекс WOMAC (табл. 1).
У всех пациенток с ОА отмечен болевой синдром, соответствующий значению индекса боли по ВАШ свыше 40 мм. «Выраженный» болевой синдром (40-60 мм) чаще встречался у женщин с ИМТ менее 30 кг/м2. «Резко выраженная» боль (свыше 60 мм) чаще всего выявлялась у женщин с ожирением.
Таблица 1
Изменения альгофункциональных индексов у женщин с ОА в зависимости от ИМТ
|
Альгофункциональные индексы |
ИМТ ≥ 30 кг/м 2 n=51 |
ИМТ <30 кг/м 2 n=32 |
p |
|
Оценка боли по ВАШ: умеренная |
- |
- |
|
|
«выраженная» |
52,13±7,82 19 (37,25%) |
49,06±9,11 21 (65,62%) |
p>0,05 |
|
«резко выраженная» |
74,51±8,63 32 (62,74%) |
69,38±8,29 11 (34,37%) |
p>0,05 |
|
Индекс Womac: Боль (А) |
163,4±23,5 |
112,1±17,9 |
р<0,05 |
|
Ограничения подвижности (Б) |
103,5±10,8 |
83,4±9,6 |
р>0,05 |
|
Затруднения в выполнении повседневной деятельности (В) |
1272,4±67,8 |
1074,0±50,7 |
p<0,05 |
|
Суммарный |
1539,3±102,1 |
1269,5±78,2 |
р<0,05 |
При проведении парциального корреляционного анализа у больных ОА отмечено существование прямой умеренной достоверной связи между ИМТ и выраженностью болевого синдрома по ВАШ (r=356, p=0,027).
Одним из наиболее информативных клинических показателей функционального состояния суставов у больных ОА признан индекс
WOMAC [11]. Оценка полученных данных выявила, что значение суммарного индекса WOMAC и его составляющих (Боль – А, ограничения подвижности – Б, затруднения в выполнении повседневной деятельности – В) были выше у пациенток с ОА при избыточной массе тела. Только различие одного из показателей индекса WOMAC – ограничения под- вижности (Б) – в группах больных с ИМТ < 30 кг/м2 и у женщин с ожирением было статистически недостоверным.
При проведении парциального корреляционного анализа у пациенток с ОА при избыточной массе тела выявлена очень тесная связь между изменением индекса боли по ВАШ и затруднениями в выполнении повседневной деятельности (В – WOMAC) (r=0,971, р=0,28).
В настоящее время для объяснения связи между ожирением и развитием ОА предложено несколько теорий. Считается, что при избыточной массе тела происходит перегрузка сустава повышенным весом, т.е. механическое повреждение хряща [12]. В другой теории подчеркивается роль ожирения как патофизиологического состояния, сопровождающегося развитием «цепной реакции» воспалительных изменений [13].
Взгляды на значение системных иммуно- воспалительных изменений при метаболических нарушениях и, в частности, у больных с ожирением и ОА неоднозначны [14, 15]. В связи с этим интересным представляется анализ изменения содержания С-РБ и ИЛ-6 у женщин с дегенеративно-деструктивным заболеванием суставов в зависимости от ИМТ. Результаты исследования представлены в табл. 2.
В обеих группах пациенток с ОА вне зависимости от ИМТ отмечено достоверно более высокое содержание С-РБ и ИЛ-6 по сравнению с концентрацией анализируемых показателей в контрольной группе. Только у 17 (20,48%) обследованных женщин уровень С-РБ был меньше, чем в контроле, причем большинство из них имели ИМТ менее 30 кг/м2. У больных с ОА при ожирении содержание обоих маркеров воспаления было достоверно выше, чем у пациенток с ИМТ < 30 кг/м2.
Таблица 2
р 2 – достоверность различий показателей у больных между группами больных ОА с различным ИМТ.
Изменение содержания СРБ и ИЛ-6 у женщин с ОА в зависимости от ИМТ
При проведении парциального корреляционного анализа у женщин с дегенеративнодеструктивным заболеванием суставов получена очень тесная связь между содержанием ИЛ-6 и выраженностью боли по ВАШ (r=0,99; р=0,23). У больных ОА с избыточной массой тела выявлена тесная (сильная) связь (r=0,84, р = 0,002) между показателями С-РБ и ИЛ-6 и заметная (значительная) связь (r=0,67, р=0,006) между этими же показателями в группе женщин с ИМТ < 30 кг/м2.
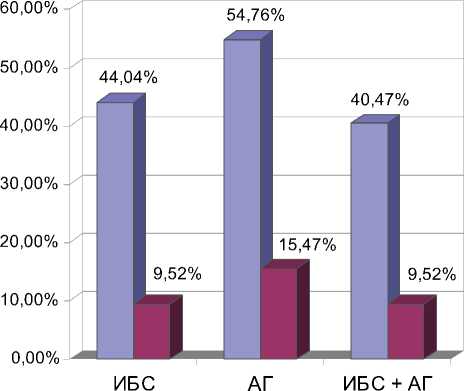
Избыточный вес не только является одним из факторов риска ОА, но и сопровождается развитием инсулиновой резистентности, дислипидемии, способствующих прогрессированию атеросклероза и развитию кардиоваскулярной патологии [16]. В связи с этим несомненный интерес представляет анализ встречаемости сердечно-сосудистых заболеваний у женщин с ОА в зависимости от ИМТ (рис. 2).
□ ИМТ более 30кг/м2 ■ ИМТ менее 30 кг/м2
Рис. 2. Встречаемость сердечно-сосудистых заболеваний у больных ОА (%) в зависимости от ИМТ.
Сердечно-сосудистые заболевания у пациенток с ОА при избыточной массе тела встречались значительно чаще, чем у женщин при ИМТ < 30 кг/м2. Наиболее распространенной кардиоваскулярной проблемой была артериальная гипертензия, несколько реже диагностировались различные формы ИБС, что совпадает с результатами других исследований [17, 18]. Заслуживает внимания частое сочетание артериальной гипертензии и ИБС у женщин с ожирением (37 человек – 40,47%). Кроме того, именно в группе пациенток с избыточной массой тела были отмечены серьезные сердечно-сосудистые осложнения – у 4 (4,26%) из них в анамнезе было острое нарушение мозгового кровообращения, у 5 (6,02%) – инфаркт миокарда. Полученные данные свидетельствуют о высоком риске развития сосудистых катастроф у больных с ОА при ожирении.
Ожирение отмечено у большинства обследованных женщин с ОА и, следовательно, избыточная масса тела может быть признана одним из ведущих факторов риска развития дегенеративно-деструктивного заболевания суставов. Анализ полученных данных у пациенток с дегенеративно-деструктивным заболеванием суставов при избыточной массе тела выявил выраженный болевой синдром, частые явления периартику-лярного воспаления коленных суставов, наиболее значительные изменения альгофункцио-нального индекса WOMAC. Результаты исследования свидетельствуют о более тяжелом течении ОА у женщин с избыточной массой тела по сравнению с выраженностью клинических проявлений дегенеративно-деструктивного заболевания суставов у пациенток с ИМТ< 30 кг/м2.
Согласно современным представлениям, воспаление суставов не только определяет тяжесть клинических проявлений при ОА, но и связано с прогрессированием заболевания. Дисбаланс и гиперпродукция медиаторов воспаления или цитокинов вызывают изменение функциональной активности хондроцитов, приводят к преобладанию катаболических процессов над анаболическими и таким образом способствуют прогрессированию ОА [19].
Увеличение уровня провоспалительных цитокинов, в том числе ИЛ-6, вызывает развитие деструктивных изменений в хрящевом матриксе [20]. Кроме того, содержание ИЛ-6 в крови коррелирует с ИМТ и увеличивается пропорционально нарастанию массы жировой ткани, что позволяет считать его индуктором инсули-норезистентности [21].
Другая биологическая роль ИЛ-6 заключает- ся в активации иммунной защиты со стимуляцией синтеза С-РБ гепатоцитами. Согласно современным представлениям, концентрация С-РБ отражает вялотекущее воспаление [22]. У больных ОА отмечена зависимость содержания С-РБ от выраженности эрозивного процесса в суставах [23]. Кроме того, повышение уровня этого острофазового белка ассоциируется с риском развития сосудистых осложнений [24].
Результаты исследования совпадают с полученными ранее данными о влиянии воспаления на прогрессирование дегенеративно-деструктивных изменений в суставах при ОА [25]. В исследуемой группе больных ОА отмечено достоверное по сравнению с контролем повышение содержания С-РБ и ИЛ-6, свидетельствующее о развитии хронического воспалительного процесса при дегенеративно-деструктивном заболевании суставов. Уровень анализируемых маркеров воспаления у женщин с ОА при ожирении был достоверно выше, чем у пациенток с ИМТ < 30 кг/м2, что отражает более значительные иммуновоспалительные изменения у больных с избыточной массой тела. Наличие тесной корреляционной связи между С-РБ и ИЛ-6 позволяет говорить о патогенетическом взаимодействии этих маркеров воспаления.
Женщины с ОА при ИМТ ≥ 30 кг/м2 часто страдали сердечно-сосудистыми заболеваниями – АГ, ИБС. Учитывая выявленную ранее зависимость возрастания кардиоваскулярного риска при повышении уровня маркеров воспаления (С-РБ) [26], очевидна высокая вероятность развития сосудистых катастроф у женщин с избыточной массой тела.
Таким образом, течение ОА у женщин с избыточной массой тела сопровождалось выраженным болевым синдромом, значительными функциональными нарушениями и частым развитием синовитов коленных суставов. У большинства пациенток с дегенеративно-деструктивным заболеванием суставов при ожирении отмечено повышение содержания С-РБ и ИЛ-6, свидетельствующее о формировании у них хронического воспаления. Полученные клинико-лабораторные данные свидетельствуют о более тяжелом течении ОА у пациенток с избыточной массой тела по сравнению с развитием дегенеративно-деструктивного заболевания суставов у женщин с ИМТ < 30 кг/м2. Особенностью течения ОА у пациенток с ожирением можно считать частое выявление кардиоваскулярной патологии с высоким риском развития сердечно-сосудистых катастроф.
Список литературы Влияние метаболических нарушений на течение остеоартроза
- Fan Z., Bau B., Yang H. et al. Freshly isolated osteoarthritic chondrocytes are catabolically more active than normal chondrocytes, but less responsive to catabolic stimulation with interleukin1beta//Arthritis Rheum. 2005. Vol. 52 (1). P. 136-143.
- Yoo S.A., Park B.H., Yoon H.J. et al. Calcineurin modulates the catabolic and anabolic activity of chondrocytes and participates in the progression of experimental osteoarthritis//Arthritis Rheum. 2007. Vol. 56 (7). Р. 2299-2311.
- Dandona P., Aljada A.,Chaudhury A. et al. Metabolic Syndrome: a comprehensive perspective based on interactions between obesity, diabetes, and inflammation//Circulation. 2005. Vol. 111 (11). Р. 1448-1454.
- Grundy S.M. Inflammation, hypertension, and metabolic syndrome//JAMA. 2003. Vol. 290 (22). P. 3000-3002.
- Wellen K.E., Hotamisligil G.S. Inflamation, stress, and diabetes//J. Clin. Invest. 2005. Vol. 115 (5). P. 1111-1119.
- Altman RD. Measurement of structure (disease) modification in osteoarthritis//Osteoarthritis Cartilage. 2004. Vol. 12. Suppl. A. Р. S69-S76.
- Bloomgarden А. Inflammation and insulin resistance//Diabetes Care. 2003. Vol. 26 (5). Р. 1619-1623.
- Зубарев А.В. Диагностический ультразвук. Костномышечная система. М.: ООО "Фирма Стром"., 2002 136 с.
- McWilliams D.E., Reehana G., Carolyn B. et al. Cartilage oligomezic matrix protein and aggrecan in synovial fluid from patients with osteoarthritis: markers of local or systemic characteristics?//Rheumatology. 2004. Vol. 43. Suppl. 2. P. 68.
- Hunter D.J., Niu J., Zhang Y. et al. Knee height, knee pain, and knee osteoarthritis: the Beijing Osteoarthritis Study//Arthritis Rheum. 2005. Vol. 52 (5). P. 1418-1423.
- Cicuttini F.M., Teichtahl A.J., Wluka A.E. et al. The relationship between body composition and knee cartilage volume in healthy, middleaged subjects.//Arthritis Rheumatism. 2005. Vol. 52 (2). P. 461-467.
- Putz D.M., Goldner W.S., Bar R.S. et al. Adiponectin and Creactive protein in obesity, type 2 diabetes, and monodrug therapy//Metabolism. 2004. Vol. 53 (11). Р. 1454-1461.
- Kumar N., Marshall N.J., Neely D. et al. CRP levels are raised in patients with longstanding osteoarthritis when compared with normal controls//Rheumatology. 2004. Vol. 43. Suppl. 2. P. 69.
- Belo J.N., Berger M.Y., Reijman M. et al. Prognostic factors of progression of osteoarhtritis of the knee -a systemic factors and disease stage//Ann. Rheam. Dis. Ann. Eur. Congr. of Rheumatology EULAR 2005. Abstracts. Vol.64. Suppl. 111. P. 479.
- Agarwal S., Deschner J., Long P. et al. Role of NFkb transcription factors in antiinflammatory and proinflammatory actions of mechanical signals//Arthritis Rheum. 2004. Vol. 50 (11). P. 3541-3548.
- Aronson D., Bartha P., Zinder O. et al. Obesity is the major determinant of elevated Creactive protein in subjects with the metabolic syndrome//Int. J. Obes. Relat. Metab. Disord. 2004. Vol. 28 (5). P. 674-679.
- Saxne T., Lindell M., MDnsson B et al. Inflammation is a feature of the disease process in early knee joint osteoarthritis//Rheumatology (Oxford). 2003. Vol. 42 (7). P. 903-904.
- Ridker P.M., Wilson P.W., Grundy S.M. Should Creactive protein be added to metabolic syndrome and to assessment of global cardiovascular risk?//Circulation. 2004. Vol. 109 (23). Р. 2818-2825.
- Sharma L. Local factors in osteoarthritis.//Curr. Opin. Rheumatol. 2001. Vol. 13 (5). P. Р. 441-446.
- Алексеева Л.И., Зайцева Е.М. Субхондральная кость при остеоартрозе: новые возможности терапии//РМЖ. 2004. Т. 12, № 20 С. 1133-1136.
- Bastard J.P., Maachi M., Van Nhieu J.T. et al, Adipose tissue IL6 content correlates with resistance to insulin activation of glucose uptake both in vivo and in vitro//J. Clin. Endocrinol. Metab. 2002. Vol. 87 (5). P. 2084-2089.
- Behre C.J., Fagerberg B., HultJn L.M., Hulthe J. The reciprocal association of adipocytokines with insulin resistance and Creactive protein in clinically healthy men//Metabolism. 2005. Vol. 54 (4). Р. 439-444.
- Andersson M.L., Saxne T., Petersson I.F. Creactive protein as a marker of developing knee joint osteoarthritis -A 12 year followup//Arthritis Rheum. 2007. Vol. 56 (9). P. 1461-1478.
- Yeh E.T. CRP as a mediator of disease//Circulation. 2004. Vol. 109 (21 Suppl. 1): II-114.
- Brandt KD., Lohmander S., Doherty M. Pathogenesis of osteoarthritis. Introduction: The concept of osteoarthritis as failure of the diarthrodial joint/In K.D. Brandt, M. Doherty, S. Lohmander (eds.), Osteoarthritis, Second Edition. Oxford: Oxford University Press 2003: Р. 69-71.
- Anan F., Takahashi N., Nakagawa M. et al. Highsensivity Creactive protein is associated with insulin resistance and cardiovascular autonomic dysfunction in type 2 diabetic patients//Metabolism. 2005. Vol. 54 (4). Р. 552-558.


