Влияние метода обработки кости на ее прочность
Автор: Антипов Александр Павлович, Гордина Екатерина Михайловна, Марков Михаил Александрович, Божкова Светлана Анатольевна
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 6 т.28, 2022 года.
Бесплатный доступ
Введение. Для восполнения дефектов костной ткани, образующихся во время хирургических вмешательств, оптимальным вариантом является использование костных трансплантатов. Такой биоматериал высоко адаптивен, структурно динамичен, метаболически активен и характеризуется высокой прочностью. Стандартная подготовка графтов для последующей имплантации включает в себя очистку с последующей глубокой заморозкой и стерилизацией. Однако используемые методы обработки костного материала и реагенты могут изменять биомеханические свойства кости. Цель. Изучить влияние этапа разработанной химической очистки и последующей лиофилизации на механическую прочность костных графтов в сравнении с нативной свежезамороженной костью. Материалы и методы. В исследовании использовали срезы метаэпифиза единого уровня одной большеберцовой кости одной особи крупного рогатого скота, для исключения влияния вариабельности плотности нативной кости, полученной от разных доноров. Кость распиливали ручной пилой на блоки. В зависимости от метода обработки формировали 3 группы образцов - свежезамороженная нативная кость, очищенная методом комбинирующего химического и физического воздействия на кость и очищенная тем же способом кость, с последующей лиофилизацией. Измерение механических свойств проводили в режиме одноосного сжатия на разрывной машине 1958У-10-1. Статистический анализ полученных данных выполняли с использованием критерия Колмогорова-Смирнова (K-S) и поправкой Лильефорса (Lilliefors), наличие статистической значимости различий оценивали методом однофакторного дисперсионного анализа (One-Way ANOVA). Результаты. Площадь поперечного сечения блоков, изготовленных ручным способом, была сопоставима. Вне зависимости от способа обработки костной ткани не регистрировали снижение прочности ниже исходной. Наибольшие прочностные характеристики продемонстрировали очищенные костные блоки до лиофилизации. После лиофилизации прочность образцов снижалась, однако, несмотря на это данный показатель оставался выше, чем для свежезамороженной нативной кости. Кроме того, между группами образцов не регистрировали статистически значимых различий в параметрах максимального прилагаемого усилия и площади сечения. В то время как значения модуля упругости и относительной деформации между группами имели статистически значимые отличия (р function show_abstract() { $('#abstract1').hide(); $('#abstract2').show(); $('#abstract_expand').hide(); }
Биомеханическая прочность, костный банк, аллографты, трансплантат, метод обработки
Короткий адрес: https://sciup.org/142236817
IDR: 142236817 | УДК: 616.71-089.844:611-018.4:620.17 | DOI: 10.18019/1028-4427-2022-28-6-783-787
Текст научной статьи Влияние метода обработки кости на ее прочность
Ежегодно по всему миру выполняют 2,2 миллиона реконструктивных операций с использованием костных аллотрансплантатов с оценочной рыночной стоимостью 2,4 миллиарда долларов (на 2016 год) [1-3]. Согласно новому отчету Polaris Market Research, к 2028 году объем мирового рынка костных трансплантатов и заменителей достигнет 4,3 млрд. долларов США. На 2020 год сегмент аллотрансплантатов доминировал на рынке, и с 2021 по 2028 год, согласно прогнозам, доля выручки превысит 4,8 % [4]. Для реконструкции костных дефектов оптимальным вариантом является аутологичная трансплантация с прогнозируемым
результатом [5, 6]. Однако такая технология требует максимально высокой квалификации оперирующего хирурга и операционной бригады, длительного времени анестезиологического пособия, что приводит к увеличению стоимости лечения пациента [7]. При наличии организованного костного банка с необходимым количеством материала одним из вариантов решения является использование аллокости.
Аллотрансплантаты используют для восстановления костной ткани, в том числе для обеспечения достаточной стабильности при остеосинтезе переломов [8] или при операциях тотального и ревизионного эндопротезирования [9], количество которых растет из года в год [10]. В зависимости от размера и конфигурации дефекта используют различные типы аллографтов – измельченные (крошка, кубики) и структурные костные аллотрансплантаты [11]. Краткосрочные и долгосрочные клинические и радиологические исследования показали перспективные результаты использования аллотрансплантатов при ревизиях вертлужной впадины и бедренной кости [12. 13]. Костный трансплантат высоко адаптивен, структурно динамичен, метаболически активен и превосходит все другие биоматериалы с точки зрения прочности [14]. Кость непрерывно модифицируется, что ведет к формированию, поддержанию или деградации костной массы за счет сложного процесса клеточной регуляции, а также координации остеобластов и остеокластов (резорбция костного матрикса) [15]. Также преимуществом аллотрансплантатов является их меньшая стоимость в сравнении с биокерамикой и индивидуальными конструкциями.
Механическая целостность и характеристики используемой кости при различных условиях нагрузки напрямую зависят от ее механических свойств, в том числе прочности, на которую может влиять выбор метода обработки костного материала, включающий условия хранения, очистки и стерилизации [16-18]. Несмотря на то, что имеются сообщения об улучшении прочностных характеристик костной ткани после дели-пидизации и удалении форменных элементов [19, 20], последующая стерилизация гамма-излучением демонстрирует негативное влияние на прочностные характеристики материала. Lansdown et al. в своем обзоре, включающем 18 исследований по оценке влияния облучения на прочность остеопластического материала на основе аллокости, описали негативные биомеханические эффекты умеренных доз облучения и подчеркнули неоднозначные результаты относительно эффектов облучения в малых дозах (< 2 мрад.) [21]. Один из вариантов стерилизации, химический, включающий обработку перуксусной кислотой и сверхкритическим CO2 также оказывает негативное влияние на прочность трансплантатов [22]. Bui et al. изучали влияние обработки сверхкритическим CO2 и гамма-облучением (2-2,8 мрад.) на биомеханические свойства аллотрансплантатов мениска и установили, что оба метода вызывают повышение жесткости и снижение упругости по сравнению с нативными образцами [23].
Цель исследования – изучить влияние разработанной технологии очистки и последующей лиофилизации на механическую прочность свежезамороженной губчатой кости.
МАТЕРИАЛЫ И МЕТОДЫ
Для исключения влияния вариабельности плотности нативной кости, полученной от разных доноров, на результаты в исследовании использовали один срез метаэпифиза большеберцовой кости особи крупного рогатого скота. На первом этапе губчатую кость отделяли от компактной и размечали сеткой для получения наибольшего количества образцов с единого спила (рис. 1). Образцы отбирались равномерно – из центральных и периферических отделов среза губчатой кости для каждой из групп. Далее по разметке кость распиливали ручной пилой на бруски размером 7 ± 1,5 × 7 ± 1,27 × 10 мм.

Рис. 1. Срез метаэпифиза большеберцовой кости крупного рогатого скота с удаленным кортикальным слоем, свежезамороженный (цветом выделены зоны, из которых брали образцы для исследования)
Сформированы 3 группы образцов:
-
1 – свежезамороженная кость (n = 8), испытание проводили после оттаивания трансплантатов при комнатной температуре 20 ± 2 градуса в течение 3 часов в герметичном контейнере;
-
2 – кость (n = 13), очищенная химическим методом (согласно экспериментальной технологии, разрабатываемой в НМИЦ ТО им. Р.Р. Вредена). Методика включала последовательную обработку с использованием химических (растворы спиртов и эфиров) и физических методов воздействия (встряхивание, перемешивание, гидродинамическая струя).
-
3 – кость (n = 11), обработанная аналогичным группе 2 способом дополнительно лиофилизированная в течение 40 часов в сублимационной установке HETO PowerDry PL3000 (Дания).
Материал, используемый во 2 и 3 группах, был заготовлен по оригинальной разработанной нами методике (патент RU 2722266 C1).
Для контроля качества костной ткани после очистки использовались электронные микрофотографии, полученные с помощью сканирующего электронного микроскопа Carl Zeiss Supra-55 (Германия).
Измерение механических свойств образцов костей проводили в течение 3-х часов от их изготовления при комнатной температуре в режиме одноосного сжатия на разрывной машине 1958У-10-1 (Россия) со скоростью испытания 1 мм/мин. Костные блоки устанавливали вертикально между зажимными плоскостями установки механических испытаний. По результатам определяли модуль упругости Е, проч- ность на сжатие σр, предельную деформацию до разрушения εр.
Статистический анализ полученных данных проводили, используя пакет программного обеспечения Statistica. Данные представляли в виде средней величины ± ошибка среднего (M ± m). Оценку нормальности распределения значений выполняли с использованием критерия Колмогорова-Смирнова (K-S) и поправкой Лильефорса (Lilliefors), наличие статистической значимости различий оценивали методом однофакторного дисперсионного анализа (One-Way ANOVA). Статистически значимыми принимали значения p менее 0,05.
РЕЗУЛЬТАТЫ
Площадь поперечного сечения блоков, изготовленных ручным способом, была сопоставима и составила в среднем 51,45 ± 1,2 мм2. На рисунке 2 представлены результаты сканирующей микроскопии после очистки и лиофилизации костной ткани. Видно отсутствие форменных клеточных элементов и небольшое количество микротрещин в минерально-коллагеновом матриксе (рис. 2)
Вне зависимости от способа обработки кости не регистрировали снижение прочности ниже нативной кости (табл. 1).
Несмотря на отсутствие статистически значимых различий, установлено, что химическая очистка об- разцов увеличила предел прочности костных блоков в 2,3 раза. Последующая лиофилизация снизила данный показатель, но он по-прежнему превышал предел прочности в группе 1 в 1,8 раза.
Между группами не регистрировали статистически значимых различий в параметрах максимального прилагаемого усилия и площади сечения. В то время как значения модуля упругости и относительной деформации между группами имели статистически значимые отличия (р < 0,05). В группах 2 и 3 эти показатели были значимо выше, чем в первой (р < 0,05) (рис. 3, 4).
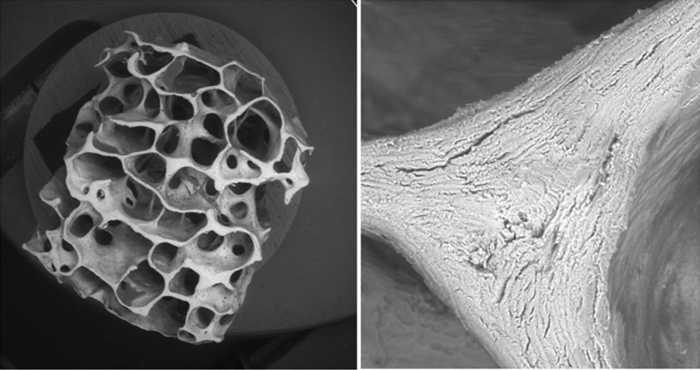
Рис. 2. Микрофото костной ткани после очистки и лиофилизации (сканирующая электронная микроскопия)
Таблица 1
Результаты измерений и замеров прочностных характеристик в группах образцов
|
Показатель |
Группа 1 |
Группа 2 |
Группа 3 |
p |
|
Ширина, мм |
7,7 ± 0,6 |
7,6 ± 0,4 |
7,4 ± 0,4 |
0,927 |
|
Толщина, мм |
7,1 ± 0,4 |
6,9 ± 0,3 |
7,0 ± 0,4 |
0,914 |
|
Площадь поперечного сечения, мм2 |
52,9 ± 2,0 |
50,8 ± 1,3 |
50,7 ± 2,5 |
0,723 |
|
Максимальное усилие, Н |
452,2 ± 83,1 |
1022,3 ± 181,8 |
848,8 ± 246,3 |
0,164 |
|
Предел прочности, МПа |
8,8 ± 1,9 |
20,3 ± 3,6 |
16,0 ± 4,2 |
0,116 |
|
Модуль упругости, МПа |
139,5 ± 34 |
345,5 ± 28 |
193,6 ± 41,4 |
0,009 |
|
Относительная деформация при разрушении, % |
35,4 ± 6,3 |
10,7 ± 2,7 |
32,2 ± 7,7 |
0,007 |
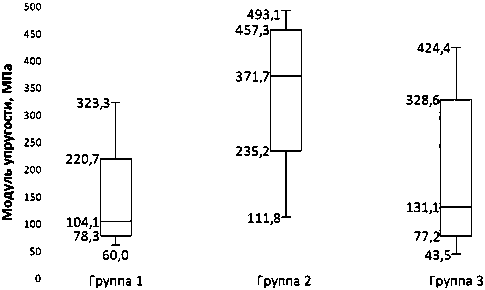
Рис. 3. Значения модуля упругости для каждой из групп
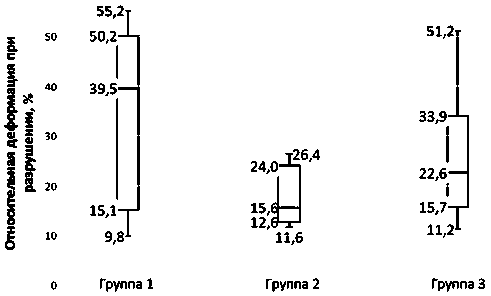
Рис. 4. Значения показателя относительной деформации при разрушении для каждой из групп
ОБСУЖДЕНИЕ
Скрининг доноров костных аллографтов и исследование полученного материала на наличие инфекций остается «золотым стандартом» в подготовке костной ткани для последующей трансплантации. Несмотря на все предпринятые меры, периодически регистрируют случаи инфицирования реципиентов. Повышение безопасности костного материала возможно при совершенствовании методов их очистки, обработки и хранения. Снижение риска заражения при трансплантации достигается путем обработки аллографтов методами, не оказывающими негативного влияния на свойства аллотрансплантата и обеспечивающими полное очищение костного материала [24].
Сублимационная сушка – лиофилизация - позволяет сохранить трансплантаты в неизмененном виде до 5 лет. Метод представляет собой глубокую заморозку костной ткани с последующим нагревом материала в условиях низкого давления до остаточной влажности менее 5 % [25]. Однако влияние данного способа обработки на прочность кости оценивается неоднозначно. Работами Matter et al. и Kang et al. доказано отсутствие влияния криоконсервации перед сушкой и многократного повторного замораживания на прочность кости [26, 27]. При этом ряд авторов сообщал о снижении прочности кости при лиофилизации [28, 29]. Однако R.R. Pelker установил, что данный метод не влияет на свойства костной ткани [29]. В другом исследовании было показано, что губчатая кость при сушке деградирует в значительно меньшей степени, в сравнении с кортикальной [30].
В нашем исследовании образцы с дополнительной лиофилизацией характеризовались меньшей прочностью в сравнении с образцами после химической очистки, но при этом превосходили по тестируемым показателям свежезамороженные костные блоки. Полученный результат, скорее всего, обусловлен повреждением коллагеновых волокон и появлением микротрещин кости в результате сушки (рис. 4, 5) [31]. P. Garnero et al. в своей работе показали влияние коллагеновых связей на прочность кости независимо от содержания минералов, объем которых может снижаться в процессе химической очистки и последующей сублимации [32].
Известно, что на прочность костной ткани влияют используемые в процессе обработки химические реагенты и метод последующей стерилизации. Для очистки костного материала часто применяют перекись водорода. Установлено, что данный реагент способен изменять структуру белков, воздействуя на пептидные цепи, а в кислой среде повышает пористость твердых тканей без негативного влияния на волокна коллагена. В свою очередь, H.K. Chаng с соавторами продемонстрировали значительное снижение прочности дентина в эксперименте с 30 % раствором перекиси водорода [33]. В разрабатываемом способе очистки трансплантатов удалось путем комбинации физических и химических методов избежать применения агрессивных реагентов, которые способны привести к снижению прочности полученных графтов.
Увеличение прочности трансплантатов на промежуточных этапах можно объяснить формируемой на одном из этапов очищения кости щелочной средой, которая создает условия для гидролиза коллагена [34-36]. Так увеличивается процентное содержание минералов и в результате происходит увеличение прочностных характеристик кости. Однако при этом регистрировали снижение показателя относительной деформации. Кость в процессе химического метода обработки становилась прочнее, но хрупче, в сравнении со свежезамороженными образцами, однако последующая лиофилизация привела к восстановлению данного показателя. Полученные результаты продемонстрировали сохранение и увеличение прочности трансплантатов после обработки и лиофилизации, при этом регистрировали снижение пластичности трансплантатов.
ЗАКЛЮЧЕНИЕ
В постоянно развивающейся ортопедической хирургии доступность безопасных аллотрансплантатов является приоритетным в лечении многих патологий и травм опорно-двигательного аппарата. Проведенное исследование показало, что разрабатываемый экспериментальный метод химической очистки с последующей лиофилизацией костных блоков не ведет к снижению прочностных свойств костной ткани. Таким образом, получаемый остеозамещающий материал является перспективным для дальнейших исследований и потенциально может быть использован в качестве структурного и опорного трансплантата. Представляется актуальным дальнейшее изучение влияния различных методов стерилизации (физических или химических) на прочность получаемого костнопластического материала.
Список литературы Влияние метода обработки кости на ее прочность
- Bohner M., Galea L.G., Dobelin N. Calcium phosphate bone graft substitutes: Failures and hopes // J. Eur. Ceram. Soc. 2012. Vol. 32, No 11. P. 2663-2671. DOI: 10.1016/j.jeurceramsoc.2012.02.028.
- National Hospital Discharge Survey: 2007 summary / M.J. Hall, C.J. DeFrances, S.N. Williams, A. Golosinskiy, A. Schwartzman // Natl. Health Stat. Report. 2010. No 29. P. 1-20, 24.
- Giannoudis P.V., Dinopoulos H., Tsiridis E. Bone substitutes: an update // Injury. 2005. Vol. 36, No Suppl. 3. P. S20-S27. DOI: 10.1016/j. injury.2005.07.029.
- Bone Grafts and Substitutes Market Size, Share & Trends Analysis Report by Material Type (Natural, Synthetic); by Application Type (Spinal Fusion, Craniomaxillofacial, Long Bone); by Region - Segment Forecast, 2021 - 2028. 2020, 120 p.
- McGovern J.A., Griffin M., Hutmacher D.W. Animal models for bone tissue engineering and modelling disease // Dis. Model Mech. 2018. Vol. 11, No 4. dmm033084. DOI: 10.1242/dmm.033084.
- Patel R., Trampuz A. Infections transmitted through musculoskeletal-tissue allografts // N. Engl. J. Med. 2004. Vol. 350, No 25. P. 2544-2546. DOI: 10.1056/NEJMp048090.
- Periosteum mimetic coating on structural bone allografts via electrospray deposition enhances repair and reconstruction of segmental defects / Z. Zhuang, J.V. John, H. Liao, J. Luo, P. Rubery, A. Mesfin, S.K. Boda, J. Xie, X. Zhang // ACS Biomater. Sci. Eng. 2020. Vol. 6, No 11. P. 62416252. DOI: 10.1021/acsbiomaterials.0c00421.
- Оптимизация свойств аллогенной кости при хирургическом лечении переломов плато большеберцовой кости (предварительные данные клинического исследования) / А. Ваза, А. Файн, С. Гнетецкий [и др.] // V Международный конгресс ассоциации ревмоортопедов : [материалы]. М., 2021.
- A novel, multi-level approach to assess allograft incorporation in revision total hip arthroplasty / T. Rolvien, C. Friesecke, S. Butscheidt, T. Gehrke, M. Hahn, K. Püschel // Sci. Rep. 2020. Vol. 10, No 1. 15226. DOI: 10.1038/s41598-020-72257-3.
- Эпидемиология эндопротезирования тазобедренного и коленного суставов и перипротезной инфекции в Российской Федерации / А.П. Середа, А.А. Кочиш, А.А. Черный, А.П. Антипов, А.Г. Алиев, Е.В. Вебер, Т.Н. Воронцова, С.А. Божкова, И.И. Шубняков, Р.М. Тихилов // Травматология и ортопедия России. 2021. Т. 27, № 3. С. 84-93.
- Management of acetabular bone loss in revision total hip arthroplasty / G.K. Deirmengian, B. Zmistowski, J.T. O'Neil, W.J. Hozack // J. Bone Joint Surg. Am. 2011. Vol. 93, No 19. P. 1842-1852. DOI: 10.2106/JBJS.J.01197.
- Acetabular reconstruction using fresh frozen bone allograft / A. Dua, K Kiran, R Malhotra, S. Bhan // Hip Int. 2010. Vol. 20, No 2. P. 143-149. DOI: 10.1177/112070001002000203.
- Ullmark G., Obrant K.J. Histology of impacted bone-graft incorporation // J. Arthroplasty. 2002. Vol. 17, No 2. P. 150-157. DOI: 10.1054/ arth.2002.29393.
- Segmental bone defects: from cellular and molecular pathways to the development of novel biological treatments / S.G. Pneumaticos, G.K. Triantafyllopoulos, E.K. Basdra, A.G. Papavassiliou // J. Cell Mol. Med. 2010. Vol. 14, No 11. P. 2561-2569. DOI: 10.1111/j.1582-4934.2010.01062.x.
- Biological basis of bone strength: anatomy, physiology and measurement / N.H. Hart, R.U. Newton, J. Tan, T. Rantalainen, P. Chivers, A. Siafarikas, S. Nimphius // J. Musculoskelet. Neuronal Interact. 2020. Vol. 20, No 3. P. 347-371.
- Gamma radiation sterilization reduces the high-cycle fatigue life of allograft bone / A. Islam, K. Chapin, E. Moore, J. Ford, C. Rimnac, O. Akkus // Clin. Orthop. Relat. Res. 2016. Vol. 474, No 3. P. 827-835. DOI: 10.1007/s11999-015-4589-y.
- Биомодель костной ткани и ксеногенного костного трансплантата: механические свойства / A.M. Цициашвили, А.М. Панин, С.Д. Арутюнов, В.А. Какуша, М.Г. Ковалев, Д.А. Саващук // Российский стоматологический журнал. 2019. Т. 23, № 6. С. 254-262.
- Structural mechanical properties of radiation-sterilized human bone-tendon-bone grafts preserved by different methods / G. Gut, J. Marowska, A. Jastrzebska, E. Olender, A. Kaminski // Cell Tissue Bank. 2016. Vol. 17, No 2. P. 277-287. DOI: 10.1007/s10561-015-9538-1.
- The mechanical stability of allografts after a cleaning process: comparison of two preparation modes / D. Putzer, D.C. Huber, A. Wurm, W. Schmoelz, M. Nogler // J. Arthroplasty. 2014. Vol. 29, No 8. P. 1642-1646. DOI: 10.1016/j.arth.2014.03.028.
- Influence of water and fat content on compressive stiffness properties of impacted morsellized bone: an experimental ex vivo study on bone pellets / L. Fosse, H. R0nningen, P. Benum, R.B. Sandven // Acta Orthop. 2006. Vol. 77, No 1. P. 15-22. DOI: 10.1080/17453670610045641.
- What factors influence the biomechanical properties of allograft tissue for ACL reconstruction? A systematic review / D.A. Lansdown, A.J. Riff, M. Meadows, A.B. Yanke, B.R. Bach Jr. // Clin. Orthop. Relat. Res. 2017. Vol. 475, No 10. P. 2412-2426. DOI: 10.1007/s11999-017-5330-9.
- Autograft or allograft for reconstruction of anterior cruciate ligament: a health economics perspective / H. Mistry, A. Metcalfe, J. Colquitt, E. Loveman, N.A. Smith, P. Royle, N. Waugh // Knee Surg. Sports Traumatol. Arthrosc. 2019. Vol. 27, No 6. P. 1782-1790. DOI: 10.1007/s00167-019-05436-z.
- Meniscal allograft sterilisation: effect on biomechanical and histological properties / D. Bui, V. Lovric, R. Oliver, N. Bertollo, D. Broe, W.R. Walsh // Cell Tissue Bank. 2015. Vol. 16, No 3. P. 467-475. DOI: 10.1007/s10561-014-9492-3.
- Clostridium infections associated with musculoskeletal-tissue allografts / M.A. Kainer, J.V. Linden, D.N. Whaley, H.T. Holmes, W.R. Jarvis, D.B. Jernigan, L.K. Archibald // N. Engl. J. Med. 2004. Vol. 350, No 25. P. 2564-2571. DOI: 10.1056/NEJMoa023222.
- Eastlund T. Infectious disease transmission through cell, tissue, and organ transplantation: reducing the risk through donor selection // Cell Transplant. 1995. Vol. 4, No 5. P. 455-477. DOI: 10.1177/096368979500400507.
- Kang Q., An Y.H., Friedman R.J. Effects of multiple freezing-thawing cycles on ultimate indentation load and stiffness of bovine cancellous bone // Am. J/Vet. Res. 1997. Vol. 58, No 10. P. 1171-1173.
- Biomechanical examinations of cancellous bone concerning the influence of duration and temperature of cryopreservation / H.P. Matter, T.V. Garrel, U. Bilderbeek, W. Mittelmeier // J. Biomed. Mater. Res. 2001. Vol. 55, No 1. P. 40-44. DOI: 10.1002/1097-4636(200104)55:1<40::aid-jbm60-3.0.co;2-6.
- Currey J.D. The effect of porosity and mineral content on the Young's modulus of elasticity of compact bone // J. Biomech. 1988. Vol. 21, No 2. P. 131-139. DOI: 10.1016/0021-9290(88)90006-1.
- Radiation-induced alterations of fracture healing biomechanics / R.R. Pelker, G.E. Friedlaender, M.M. Panjabi, D. Kapp, A. Doganis // J. Orthop. Res. 1984. Vol. 2, No 1. P. 90-96. DOI: 10.1002/jor.1100020114.
- Martin R.B. Is all cortical bone remodeling initiated by microdamage? // Bone. 2002. Vol. 30, No 1. P. 8-13. DOI: 10.1016/s8756-3282(01)00620-2.
- Божкова С.А., Новокшонова А.А., Конев В.А. Современные возможности локальной антибиотикотерапии перипротезной инфекции и остеомиелита // Травматология и ортопедия. 2015. № 3 (77). С. 92-107.
- Viguet-Carrin S., Garnero P., Delmas P.D. The role of collagen in bone strength // Osteoporos. Int. 2006. Vol 17, No 3. P. 319-336. DOI: 10.1007/ s00198-005-2035-9.
- Chng H.K., Palamara J.E., Messer H.H. Effect of hydrogen peroxide and sodium perborate on biomechanical properties of human dentin // J. Endod. 2002. Vol. 28, No 2. P. 62-67. DOI: 10.1097/00004770-200202000-00003.
- Remodeling of ACL allografts is inhibited by peracetic acid sterilization / S.U. Scheffler, J. Gonnermann, J. Kamp, D. Przybilla, A. Pruss // Clin. Orthop. Relat. Res. 2008. Vol. 466, No 8. P. 1810-1818. DOI: 10.1007/s11999-008-0288-2.
- Effects of carbodiimide crosslinking conditions on the physical properties of laminated intestinal submucosa / K. Billiar, J. Murray, D. Laude, G. Abraham, N. Bachrach // J. Biomed. Mater. Res. 2001. Vol. 56, No 1. P. 101-108. DOI: 10.1002/1097-4636(200107)56:1<101::aid-jbm1074-3.0.co;2-6.
- Thermal stability of calf skin collagen type I in salt solutions / R. Komsa-Penkova, R. Koynova, G. Kostov, B.G. Tenchov // Biochim. Biophys. Acta. 1996. Vol. 1297, No 2. P. 171-181. DOI: 10.1016/s0167-4838(96)00092-1.


