Влияние моноклонального блокатора IL-6 на течение асептического некроза головки бедренной кости в эксперименте (пилотное исследование)
Автор: Шабалдин Н.А., Синицкая А.В., Игишева Л.Н., Богданов Л.А., Шабалдин А.В.
Журнал: Гений ортопедии @geniy-ortopedii
Рубрика: Оригинальные статьи
Статья в выпуске: 3 т.30, 2024 года.
Бесплатный доступ
Введение. Патогенетическое обоснование лечения асептического некроза головки бедренной кости в настоящее время отсутствует. Одним из наиболее перспективных направлений возможной таргетной терапии является применение генно-инженерных препаратов, в том числе моноклональных блокаторов провоспалительных цитокинов, направленных на ингибирование воспаления и опосредованное этим снижение активности остеодеструкции.Цель работы - оценить предварительные результаты применения моноклонального блокатора IL-6 при течении асептического некроза головки бедренной кости в эксперименте.Материалы и методы. Хирургическая индукция асептического некроза головки бедренной кости выполнена 18 самцам крыс линии Вистар. Животные разделены на две группы по 9 особей: первая группа не получала лечения, вторая получала терапию моноклональным блокатором рецептора IL-6, начиная со второй недели эксперимента, по одной инъекции один раз в две недели. Все животные выведены из эксперимента на 4, 6 и 8 неделях после индукции асептического некроза, по три крысы из каждой группы. Суммарная РНК выделена из головки бедренной кости со стороны асептического некроза и условно-здоровой стороны в качестве контроля. Проведено исследование экспрессии генов регуляторных белков остеогенеза методом кПЦР. Для изучения особенностей остеодеструктивных процессов всем животным проведено гистологическое исследование препаратов головок бедренных костей.Результаты. Гистологические препараты головок бедренных костей животных второй группы характеризовались менее выраженными остеодеструктивными, хондродеструктивными процессами по сравнению с животными, не получавшими терапию. мРНК-профиль крыс второй группы отобразил усиление экспрессии генов, кодирующих белки, участвующих в остеорепарации на всех этапах эксперимента. При этом активность генов, кодирующих белки провоспалительных цитокинов, регуляторных молекул остеокластогенеза, была снижена относительно первой группы.Обсуждение. Полученные данные свидетельствуют о важной роли воспаления в регуляции остеодеструкции. Ингибирование биологического действия IL-6 способствовало угнетению экспрессии генов остеокластогенеза, усилению активности генов метаболизма костной ткани и обусловливало снижение интенсивности остеодеструкции и активацию остеорепарации.Заключение. Предварительные результаты применения моноклонального блокатора провоспалительного цитокина IL-6 свидетельствуют об ингибировании остеодеструктивных, усилении остеорепаративных процессов за счет коррекции экспрессии генов костного метаболизма при развитии асептического некроза головки бедренной кости у крыс в модельном эксперименте.
Асептический некроз, генно-инженерные препараты, остеодеструкция, моноклональный блокатор il-6, остеобластогенез, остеокластогенез, остеоиндукция, противовоспалительная терапия
Короткий адрес: https://sciup.org/142241862
IDR: 142241862 | УДК: [616.718.41-002.4-08:602.68]-092.9 | DOI: 10.18019/1028-4427-2024-30-3-406-416
Текст научной статьи Влияние моноклонального блокатора IL-6 на течение асептического некроза головки бедренной кости в эксперименте (пилотное исследование)
Асептический некроз головки бедренной кости представляет собой развивающийся по стадиям патологический процесс, при котором остеорезорбция на ранних стадиях сменяется активацией остеорепарации на более поздних [1, 2, 3]. Результатом костной деструкции может явиться развитие деформирующего коксартроза, грубой дисконгруэнтности в тазобедренном суставе с необходимостью выполнения эндопротезирования. Патогенез аваскулярного некроза головки бедренной кости до конца не известен, однако в последнее время отмечается тенденция к росту заинтересованности в изучении нарушений регуляции костного гомеостаза на молекулярно-клеточном уровне [4, 5]. При этом наиболее часто применимым вариантом консервативной терапии при асептическом некрозе головки бедренной кости является физиотерапия, направленная на улучшение кровоснабжения проксимального отдела бедра, усиление оссификации, а также соблюдение ортопедического режима [6]. Данное лечение не может рассматриваться в качестве таргетного и в ряде случаев не обладает значимой эффективностью. Для разработки новых патогенетически обоснованных стратегий лечения нарушений остеогенеза необходимо детальное понимание патофизиологических механизмов изменений метаболизма костной ткани и возможных путей влияния на них.
Баланс ремоделирования костной ткани поддерживается за счет функционирования большого количества внутриклеточных, межклеточных сигнальных путей, процессов фосфорилирования, синтеза регуляторных молекул [7, 8]. Основным сигнальным путем, направленным на дифференцировку и активацию зрелых остеокластов, является система рецептора активатора ядерного фактора каппа β , его лиганда и остеопротегерина (RANK-RANKL-OPG) [9, 10]. Взаимодействие мембранного рецептора активатора ядерного фактора каппа β (RANK) с его лигандом (RANKL) приводит к транслокации ядерного фактора каппа β (NFk β ) в клеточное ядро и активации внутриклеточных путей, в результате чего индуцируется дифференцировка прогениторных клеток в зрелый остеокласт с последующей активацией. Некоторые научно-исследовательские работы указывают на одну из ведущих ролей усиления остеокластогенеза в развитие костнодеструктивных процессов при аваскуляр-ном некрозе [11, 12].
Ряд сигнальных молекул, в том числе провоспалительные цитокины, могут иметь значение в регулировании синтеза RANKL. Доказано биологическое действие провоспалительных цитокинов, таких как IL-6, IL-1 β , TNF α , направленное на увеличение экспрессии RANKL, активацию остеокластогенеза и, как следствие, усиление остеолизиса [13, 14, 15]. Кроме того, обнаружена роль провоспалительных цитокинов в апоптозе и аутофагии остеобластов посредствам сигнального пути митоген-активируе-мой протеинкиназы (MAPK) / ядерного фактора- κ B (NF- κ B) [16]. Регуляция активности остеокластов и, следовательно, воздействие на костный гомеостаз возможны посредством коррекции активности проостеокластогенных медиаторов. Так, ряд исследовательских работ обнаруживает увеличенную концентрацию провоспалительных цитокинов в синовиальной жидкости на ранних стадиях асептического некроза головки бедренной кости и рассматривают данные регуляторные молекулы в качестве возможной терапевтической цели лечения данного заболевания [17, 18].
В регулировании активности остеобластогенеза задействовано большое количество сигнальных путей: канонический и не канонический wnt (wingless) / b катенин, JAK (Janus Kinase) / STAT (Signal Transducer and Activator of Transcription), MAPK (протеинкиназа, активируемая митогенами) [19, 20, 21]. Наряду с антирезорбтивной терапией возможно применение анаболитической терапии, целью которой является усиление остеоиндукции при развитии асептического некроза головки бедренной кости. Ранее выполненное исследование экспрессии генов, кодирующих белки провос-палительных цитокинов, молекул, участвующих в остеокластогенезе, остеобластогенезе, белков костного матрикса у крыс после хирургической индукции асептического некроза головки бедренной кости, отобразило более раннее по времени угнетение остеогенного звена костного гомеостаза, чем усиление остеорезорбтивного [22].
Учитывая ключевое значение тканевой гипоксии на фоне гипоперфузии в развитии асептического некроза головки бедренной кости, ряд исследований связывает патогенез остеодеструктивных процессов со сверхэкспрессией индуцированного гипоксией фактора 1 α (HIF-1 α ). Так, в результате модельного эксперимента на поросятах удалось обнаружить повышенную концентрацию белка HIF-1 α в головке бедренной кости при манифестации аваскулярного некроза [23]. Известно, что белок HIF-1 α играет важную роль в процессах ремоделирования и поддержания костного гомеостаза [24, 25, 26]. При этом ряд исследовательских работ обнаружил индуктивное воздействие как сверхэкспрессии гена, так и самого протеина HIF-1 α на концентрацию RANKL и, как следствие, активацию дифференцировки остеокластов из прогениторных клеток [27, 28]. Соответственно антирезорбтивная терапия, направленная на снижение интенсивности остеокластогенеза, возможна посредством коррекции активности HIF-1 α как одного из триггерных факторов развития аваскулярного некроза.
Таким образом, с целью разработки таргетной терапии, направленной на нормализацию межклеточных взаимодействий, изучаются механизмы регуляции, обусловливающие высокую активность остеокластов. Эффективная коррекция различных звеньев патогенеза остеодеструкции позволит значительно улучшить качество жизни больных с асептическим некрозом.
Цель работы — оценить предварительные результаты применения моноклонального блокатора IL-6 при течении асептического некроза головки бедренной кости в эксперименте.
МАТЕРИАЛЫ И МЕТОДЫ
Проведен модельный эксперимент на 18 самцах крыс линии Вистар, массой (250 ± 25) г, в возрасте трех месяцев. Всем животным для индукции асептического некроза головки бедренной кости выполнены хирургические манипуляции в виде наложения плотной лигатуры из рассасывающегося шовного материала викрил вокруг шейки бедренной кости, для создания зоны гипоперфузии, а также введения в полость сустава 1,5 мл 2 % раствора реополиглюкина для увеличения внутрисуставного давления. Модель индукции асептического некроза головки бедренной кости защищена патентом Российской Федерации [29].
Затем животные разделены на две равные группы. Животные первой группы не получали лечения (группа сравнения). Животные второй группы получали инъекцию препаратом сарилумаб (кевзара), моноклональным блокатором рецептора IL-6, начиная со второй недели эксперимента, по одной инъекции один раз в две недели, из расчета 15 мг на кг тела (основная группа). Животные содержались в клетках по три особи со свободным доступом к корму и воде. Всех животных выводили из эксперимента путем декапитации на 4, 6 и 8 неделе после индукции асептического некроза, по три крысы из каждой группы. Эксперимент выполнен согласно «Конвенции по защите позвоночных животных, используемых для экспериментальных и других научных целей», принятой Советом Европы (Strasbourg, Франция, 1986), и Директивой Совета 86/609/ ЕЕС от 24.11.1986 «По согласованию законов, правил и административных распоряжений стран участниц в отношении защиты животных, используемых в экспериментальных и научных целях» на базе Кемеровского ГМУ и НИИ КПССЗ (Кемерово).
После выведения животных из эксперимента выполняли экстирпацию бедренных костей, как со стороны манифестации асептического некроза, так и с условно-здоровой в качестве сравнения. Проксимальный эпифиз отделяли от бедренной кости и разделяли на две равные части. Часть головки бедренной кости использовали для гистологического исследования. Препарат подготавливали стандартным бескислотным методом с использованием солей ЭДТА и окрашивали гематоксилином и эозином. Для оценки морфометрических параметров использовалась программное обеспечение ImageJ, позволяющее определить окрашенные костные балки в качестве пиксельного значения, что дало возможность провести количественную оценку морфометрических показателей.
Часть головки бедренной кости, как пораженной асептическим некрозом, так и здоровой, использовали для выделения суммарной РНК набором RNeasy MicroKit (QIAGEN, Германия) согласно протоколу производителя. Качество и количество выделенной РНК определяли на спектрофотометре Qubit 4 (Invitrogen, США) путем оценки индекса RIQ (RNA Integrity and Quality) с использованием набора реагентов Qubit RNA IQ Assay Kit (Invitrogen, США).
Уровень экспрессии генов определяли методом количественной полимеразной реакции с обратной транскрипцией, используя набор High-Capacity cDNA Reverse Transcription Kit (4368814, Thermo Fisher Scientific, Waltham, MA, USA). Праймеры синтезированы на приборе ABI 3900 high-throughput DNA synthesiser (Thermo Fisher Scientific, Waltham, MA, USA) компанией Евроген (Москва, Россия). Результаты кПЦР нормировали с помощью трех референсных генов actb, tbp, b2m в соответствии с имеющимися рекомендациями. Экспрессию изучаемых генов рассчитывали по методу 2-ΔΔСt. Исследовали экспрессию генов il4, il6, il1b, tnfa, tgfb, sp7, runx2, opn/spp1, bmp2, bglap, rankl, alpl, hif1a .
Статистическую обработку полученных результатов проводили в пакетах программ Statistica for WINDOWS фирмы StatSoftInc (США), версия 10.0 по правилам вариационной статистики. В исследовании использованы крысы линии Вистар, содержащиеся в одинаковых оптимальных условиях, поэтому W-теста Шапиро – Уилка показал нормальное распределение. Количественные данные представляли в виде средней и стандартной ошибки (М ± m). Сравнение значений уровней метрических показателей в несвязанных выборках проводили с помощью критерия Стьюдента. Вероятность ошибки первого рода принята за 5 %, а второго уровня — за 20 %, соответственно уровень статистической значимости выявлялся при p < 0,05, что соответствует стандартным требованиям. В эксперименте использовали чистую линию лабораторных крыс Вистар, что обусловливало генетическую однородность изучаемых групп. Так, исследование даже малой выборки позволило выполнить статистическую обработку полученных результатов.
РЕЗУЛЬТАТЫ
Гистологическое исследование
Двигательная активность крыс, получавших инъекции моноклонального блокатора IL-6, восстановилась быстрее, чем в группе сравнения. Так, все крысы основной группы через 4 нед. после индукции асептического некроза были способны вставать на задние лапы, в то время как в группе сравнения лишь часть животных могла выполнить упор на тазовые конечности на 6 нед. после начала эксперимента (рис. 1).
Гистологическая картина препаратов головок бедренных костей в обеих группах подтверждала развитие хондродеструктивных и остеодеструк-
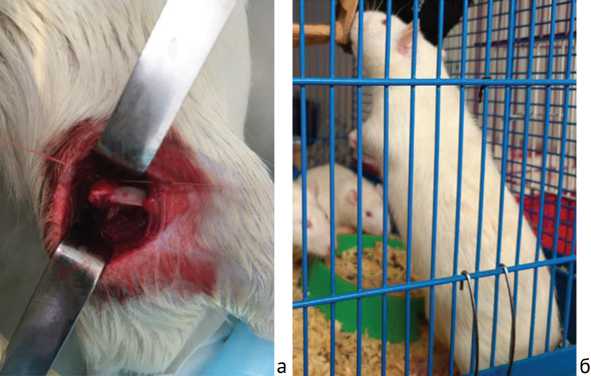
Рис. 1. Фото эксперимента: а — хирургическая индукция асептического некроза головки бедренной кости; б — осевая нагрузка на задние лапы у крыс основной группы
тивных процессов. При исследовании визуализированы пустые костные лакуны, часть костной ткани замещена плотной фиброзной тканью. В зонах остеорезорбции определены активные остеокласты как гигантские многоядерные клетки. Количество остеобластов, которые определены как мононуклеарные клетки, увеличивалось в первую очередь в зонах остеосклероза. Тем не менее, характер течения аваскулярного некроза отличался. Прогрессирующая остеорезорбция от четвертой к шестой неделе отмечена у животных первой группы, при этом признаки остеорепарации визуализированы лишь на восьмой неделе эксперимента. В то время как в группе животных, получавших препарат моноклонального блокатора IL-6, обособленные остеолитические процессы зафиксированы лишь на четвертой неделе, на шестой и восьмой неделях на фоне течения остеодеструкции визуализированы активные остеобласты, участки реваскуляризации, восстановления кости.
Через четыре недели после хирургической индукции асептического некроза у крыс, не получавших лечение, визуализировано изменение нормальной архитектоники костных балок губчатого вещества на волнообразное расположение, плотность трабекул снижена. Промежуточный слой гиалинового хряща характеризовался разрежённостью, большая часть хондроцитов находилась в наружном слое. Хондроциты теряли элипсовидную форму, выявлены признаки разрушения их ядра. В то время как у животных второй группы препараты головок бедренных костей в большей степени сохраняли нормальную архитектонику, потеря костных трабекул была ниже, чем у крыс первой группы. Расположение хондроцитов в гиалиновом хряще было более равномерное (рис. 2).
В препаратах головок бедренных костей животных первой группы через шесть недель после начала эксперимента наблюдали признаки прогрессирующей остеорезорбции, диагностировали дальнейшую потерю плотности костных балок по сравнению с препаратами через четыре недели развития асептического некроза. Количество активных остеокластов, лакун костной резорбции увеличи-
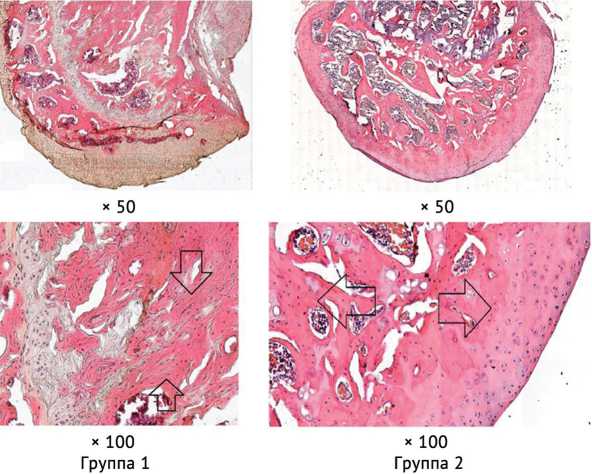
Рис. 2. Гистологическая картина через 4 нед. после манифестации асептического некроза (окраска гематоксилином и эозином). Группа 1. Стрелками указано волнообразное положение костных трабекул. Группа 2. Стрелками указано равномерное расположение хондроцитов, нормальная архитектоника губчатого вещества
валось от четвертой к шестой неделе эксперимента. Часть гиалинового хряща замещалась фиброзной тканью. У животных второй группы в препаратах головок бедренных костей, наряду с признаками остеодеструкции в виде потери части костных трабекул, их волнообразном расположении, определяли активные остеобласты в зонах костного склероза. При этом потеря плотности костных балок у животных, получавших моноклональный блокатор IL-6, была ниже, чем у крыс первой группы (рис. 3).
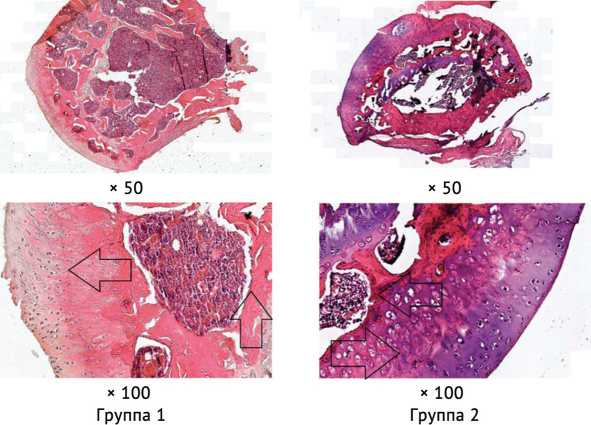
Через 8 недель в головках бедренных костей крыс, не получавших лечения, отмечались первые признаки остеогенной направленности. Визуализировалось истончение суставного хряща, потеря части хондроцитов, костных трабекул. В то же время на фоне замещения губчатого вещества плотной фиброзной тканью определялись активные остеобласты. У крыс второй группы гиалиновый хрящ характеризовался большей сохранностью плотности хондроцитов как в наружном, так и в промежуточном слоях. Костные трабекулы имели большую плотность, определялись зоны минерализации с большим скоплением активных остеобластов, участки реваскуляризации кости. Количество остеоцитов увеличивалось по сравнению с препаратами через 6 недель после индукции асептического некроза (рис. 4).
Использование программы ImageJ позволило выполнить количественную оценку изменений плотности костных трабекул. Так, у крыс, не получавших лечение, течение асептического некроза сопровождалось прогрессирующей потерей костной плотности с четвертой по шестую неделю. При этом на восьмой неделе эксперимента отмечен незначительный рост плотности костных балок. Тенденция к снижению плотности
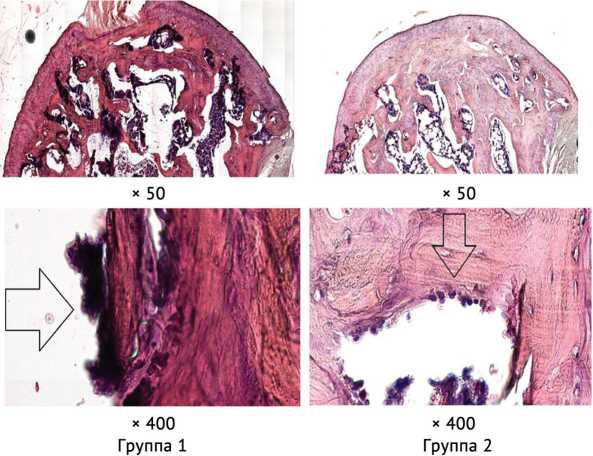
Рис. 3. Гистологическая картина через 6 нед. после манифестации асептического некроза (окраска гематоксилином и эозином). Группа 1. Стрелками указаны активные остеокласты. Группа 2. Стрелками указаны активные остеобласты
x 100
Группа 1
х 100
Группа 2
Рис. 4. Гистологическая картина через 8 нед. после манифестации асептического некроза (окраска гематоксилином и эозином). Группа 1. Стрелками указаны неравномерное распределение хондроцитов в гиалиновом хряще, активные остеобласты. Группа 2. Стрелками указаны равномерное, плотное распределение хондроцитов в гиалиновом хряще, участок минерализации кости
костных трабекул от четвертой к шестой неделе и восстановлению на восьмой неделе эксперимента зафиксирована и в основной группе. Однако объем костных балок у животных, получавших противовоспалительную терапию моноклональным блокатором IL-6, был значительно больше, чем у крыс без лечения на шестой и восьмой неделях после индукции асептического некроза (табл. 1).
Гистологические показатели объема костных балок (%)
Таблица 1
|
Недели эксперимента |
Группа сравнения |
Основная группа |
p -level |
|
4 |
31,45 ± 1,03 |
33,67 ± 1,43 |
> 0,05 |
|
6 |
23,03 ± 1,23 |
30,78 ± 1,32 |
0,02* |
|
8 |
24,43 ± 1,29 |
31,66 ± 1,36 |
0,03* |
Примечание : * — значимое различие.
Изменение мРНК-профиля
Особенности функционирования сигнальных путей ремоделирования костной ткани, их регуляция на молекулярно-клеточном уровне определяли активность остеорезорбтивных и остеорепаративных процессов. Через один месяц после хирургической индукции асептического некроза наибольшие отличия получены в динамике изменения генов, кодирующих белки, связанных с остеоиндукцией. Так, у животных второй группы на фоне снижения экспрессии гена провоспалительного цитокина интерлейкина 6 (il6) значимо усиливалась экспрессия гена остеокальцина (bglap), кодируемый белок которого секретируется остеобластами и участвует в регуляции ремоделирования кости, гена щелочной фосфатазы (alpl), определяющего интенсив- ность минерализации кости, гена трансформирующего фактора роста b (tgfb), кодируемый белок которого усиливает реваскуляризацию, участвует в процессах остеорепарации. Кроме того, у крыс, получавших терапию моноклональным блокатором IL-6, значимо снижалась экспрессия гена гипоксически индуцированного фактора 1α (hif1α). У животных первой группы значимо усиливалась экспрессия гена секретируемого фосфопротеина 1 (spp1). Белок, кодируемый этим геном, способствует адгезии остеокластов к костному матриксу, обладает высокой специфичностью к гидроксиапатиту и мембранным белкам остеокластов (табл. 2).
Через шесть недель после индукции асептического некроза головки бедренной кости у крыс, не получавших лечения (группа сравнения), наблюдалась сверхэкспрессия генов провоспалительных цитокинов il6 , tnf α , а также гена лиганда рецептора активатора ядерного фактора κβ ( rankl ). Представленный ген кодирует один из основных белков сигнального пути RANK–RANKL–OPG, направленного на дифференцировку и активацию остеокластов. В то же время у животных, получавших терапию моноклональным блокатором IL6, была значительно подавлена экспрессия гена il6 , tnf α . Интенсивность экспрессии гена rankl не отличалась от условно-здоровой конечности. Также у крыс основной группы фиксировалась повышенная экспрессия генов, направленных на усиление остеобластогенеза, таких как ген костного морфогенетического бела ( bmp2 ), ген транскрипционного фактора ( sp7 ), участвующий в дифференцировке остеобластов, оставалась повышенной экспрессия генов tgfb . Однако стоит отметить усиленную экспрессию гена spp1 , которая может свидетельствовать об активности остеокластов (табл. 3).
Через два месяца после развития аваскулярного некроза головки бедренной кости у крыс первой группы сохраняется сверхэкспрессия генов il6 , tnf α . Интенсивность экспрессии гена rankl несколько снизилась по сравнению с предыдущим исследованием, однако была более высокой, чем в условно-здоровой конечности. Усиливался синтез мРНК гена spp1 . Тем не менее, изменение мРНК-профиля в головках бедренных костей у животных, не получавших лечение, также свидетельствует об усилении остеогенеза. Увеличивалась экспрессия генов alpl . У крыс второй группы сохранялось увеличение экспрессии генов, кодирующих белки, биологическое действие которых направлено на усиление остеорепарации. Оставался повышенным синтез мРНК генов runx2 , sp7 . Однако на этом фоне интенсивность экспрессии гена rankl была повышенной по сравнению с условно-здоровой конечностью (табл. 4).
Таблица 2
|
мРНК-профиль через 4 недели |
|||
|
Ген |
Группа сравнения |
Основная группа |
p -level |
|
bmp2 |
1,097 ± 0,219 |
0,831 ± 0,137 |
> 0,05 |
|
alpl |
0,484 ± 0,095 |
2,445 ± 0,738 |
0,02* |
|
hif1a |
1,031 ± 0,563 |
0,342 ± 0,059 |
0,04* |
|
rankl |
1,216 ± 0,609 |
1,157 ± 0,583 |
> 0,05 |
|
runx2 |
0,934 ± 0,319 |
0,891 ± 0,204 |
> 0,05 |
|
sp7 |
1,051 ± 0,421 |
1,774 ± 0,538 |
> 0,05 |
|
bglap |
0,684 ± 0,137 |
3,637 ± 0,926 |
0,01* |
|
spp1 |
7,691 ± 1,823 |
0,624 ± 0,137 |
< 0,001* |
|
tgfb |
0,964 ± 0,371 |
3,092 ± 0,957 |
0,01* |
|
tnfa |
1,142 ± 0,296 |
0,806 ± 0,172 |
> 0,05 |
|
il6 |
1,125 ± 0,325 |
0,79 ± 0,148 |
0,04* |
Примечание : * — значимое различие.
Таблица 3
|
мРНК-профиль через 6 недель |
|||
|
Ген |
Группа сравнения |
Основная группа |
p -level |
|
bmp2 |
1,613 ± 0,419 |
2,462 ± 0,816 |
0,03* |
|
alpl |
2,394 ± 0,751 |
2,936 ± 0,973 |
> 0,05 |
|
hif1a |
0,768 ± 0,143 |
1,287 ± 0,419 |
> 0,05 |
|
rankl |
11,076 ± 3,054 |
1,019 ± 0,326 |
0,001* |
|
runx2 |
3,831 ± 0,904 |
0,501 ± 0,118 |
0,01* |
|
sp7 |
1,998 ± 0,673 |
3,095 ± 1,008 |
0,04* |
|
bglap |
0,702 ± 0,179 |
1,043 ± 0,307 |
> 0,05 |
|
spp1 |
0,447 ± 0,103 |
2,297 ± 0,713 |
0,01* |
|
tgfb |
0,943 ± 0,319 |
2,331 ± 0,784 |
0,02* |
|
tnfa |
14,471 ± 4,107 |
1,918 ± 0,607 |
< 0,001* |
|
il6 |
3,844 ± 0,916 |
0,054 ± 0,014 |
< 0,001* |
|
Примечание : * — значимое различие. Таблица 4 мРНК-профиль через 8 недель |
|||
|
Ген |
Группа сравнения |
Основная группа |
p -level |
|
bmp2 |
2,602 ± 0,803 |
2,373 ± 0,805 |
> 0,05 |
|
alpl |
2,087 ± 0,657 |
1,457 ± 0,432 |
0,03* |
|
hif1a |
0,549 ± 0,153 |
0,989 ± 0,328 |
> 0,05 |
|
rankl |
1,804 ± 0,604 |
1,884 ± 0,579 |
> 0,05 |
|
runx2 |
1,276 ± 0,428 |
2,145 ± 0,692 |
0,02* |
|
sp7 |
1,491 ± 0,501 |
2,087 ± 0,713 |
0,04* |
|
bglap |
1,695 ± 0,539 |
1,868 ± 0,617 |
> 0,05 |
|
spp1 |
3,127 ± 1,012 |
0,962 ± 0,329 |
0,01* |
|
tgfb |
1,013 ± 0,326 |
1,464 ± 0,507 |
> 0,05 |
|
tnfa |
13,262 ± 4,084 |
1,316 ± 0,436 |
< 0,001* |
|
il6 |
15,927 ± 5,247 |
1,458 ± 0,519 |
< 0,001* |
|
Примечание : * — значимое различие. |
|||
ОБСУЖДЕНИЕ
Изменение мРНК-профиля при развитии асептического некроза головки бедренной кости характеризуется крайней гетерогенностью, в то же время некоторые закономерности синтеза генов, кодирующих регуляторные протеины остеогенеза, могут определять течение остеодеструктивных, остеорепа-ративных процессов.
Развитие аваскулярного некроза у животных, не получавших терапии, по данным гистологического исследования сопровождалось прогениторным течением остеорезорбтивных, хондродеструктивных процессов вплоть до 8 недели после создания зоны гипоперфузии головки бедренной кости. Только через восемь недель после начала эксперимента в гистологических препаратах определены первые признаки остеорепарации.
При этом в изменении мРНК-профиля проксимального эпифиза бедра прослеживается тенденция к сверхэкспрессии генов провоспалительных цитокинов, генов остеокластогенеза от четвертой к восьмой неделе. Так, усиление экспрессии генов il6 , tnf α , rankl наблюдалось как на шестой, так и на восьмой неделе течения асептического некроза. Представленные гены кодируют белки провоспалительных цитокинов и ключевой молекулы сигнального пути остеокластогенеза. J. Song et al. в выполненном исследовании протеома у больных с асептическим некрозом головки бедренной кости отмечают увеличение концентрации провоспалительных цитокинов и придают большое значение усилению неспецифического воспаления в процессах нарушения регуляции костного гомеостаза [30]. Биологическое действие провоспалительных цитокинов направлено на индукцию сигнального пути RANK–RANKL–OPG, усиление дифференцировки и активации зрелых остеокластов. Существует ряд исследовательских работ, подтверждающих сверхэкспрессию представленных медиаторов воспаления на ранних стадиях развития асептического некроза головки бедренной кости [31, 32]. Так, логично рассматривать взаимосвязь между увеличением уровня мРНК в головке бедренной кости как генов провоспалительных цитокинов il6 , tnf α , так и гена rankl , и гистологической картиной прогрессирующего разрушения костной, хрящевой тканей. Полученные данные свидетельствуют о важной роли воспаления в регуляции остеодеструкции.
Кроме того, на четвертой и восьмой неделях после хирургической индукции асептического некроза наблюдали сверхэкспрессию гена spp1 . Исследования концентрации секретируемого фосфопротеина 1 ( spp1 ) в остеобластах на фоне развития асептического некроза головки бедренной кости отобразили значительное повышение концентрации данного белка по сравнению с условно-здоровой конечностью [33]. Известно, что кодируемый белок гена spp1 способствует прикреплению остеокластов к костному матриксу [34]. Кроме того, увеличение экспрессии гена spp1 может способствовать активации остеокластогенеза через сигнальный путь PI3K/AKT [35]. Так, увеличение экспрессии представленного гена на фоне гистологической картины прогрессирующей остеодеструкции от четвертой к восьмой неделе эксперимента также может рассматриваться как один из факторов, способствующих усилению процессов резорбции.
В то же время на восьмой неделе эксперимента при исследовании гистологических препаратов животных первой группы определяли большое количество активных остеобластов. При этом экспрессия генов, кодирующих белки, участвующих в минерализации кости, остеобластогенезе ( bmp2 , alpl , bglap ), усиливалась. Таким образом, процессы регенерации, деструкции костной ткани во многом обусловлены изменениями в мРНК-профиле головки бедренной кости.
Изменения при исследовании гистологических препаратов головки бедренной кости у крыс, получавших моноклональный блокатор IL-6, характеризовались менее интенсивным течением остеодеструкции по сравнению с животными первой группы. Плотность расположения костных трабекул, архитектоника губчатого вещества, изменения в гиалиновом хряще имели менее выраженный характер и более соответствовали условно-здоровой конечности. При этом уже с шестой недели после хирургической индукции асептического некроза в препаратах визуализировали признаки остеорепарации.
Динамика изменения мРНК-профиля генов, кодирующих регуляторные протеины остеогенеза, имела свои особенности. Экспрессия гена провоспалительного цитокина il6 ожидаемо была снижена на четвертой и шестой неделях эксперимента. Максимальное ингибирование активности гена il6 получено на шестой неделе, при этом на восьмой неделе наблюдали незначительное усиление экспрессии. Активность гена tnf α менялась в зависимости от времени после манифестации асептического некроза. Так, экспрессия гена tnf α на четвертой неделе эксперимента была несколько снижена, в то время как на шестой и восьмой неделях повышена по сравнению с условно-здоровой конечностью. При этом стоит отметить, что активность генов провоспалительных цитокинов il6 , tnf α на всех этапах эксперимента у крыс второй группы была значимо ниже, чем у первой группы. Представленные данные указывают на ингибирование неспецифического воспаления на фоне терапии моноклональным блокатором IL-6.
Со снижением интенсивности биологического действия провоспалительного цитокина IL-6 можно связать изменения в экспрессии генов, кодирующих белки, регулирующих остеокластогенез и активность процессов остеолизиса. Наиболее яркая картина ингибирования остеокластогенеза наблюдалась на 6 неделе эксперимента. Так, у животных, не получавших специфического лечения, отмечалась сверхэкспрессия гена rankl , когда у крыс, получавших моноклональный блокатор IL-6, экспрессия представленного гена не отличалась от условно-здоровой конечности. Однако в то же время у крыс второй группы зафиксировано повышение экспрессии гена spp1 , что может указывать на процессы остеолизиса и, возможно, опосредованные пути активации зрелых остеокластов.
Первые четыре недели после индукции аваскулярного некроза у животных второй группы сопровождались усилением экспрессии генов, связанных с остеоиндукцией, реваскуляризации, таких как sp7 , bglap , alpl , tgf β . Преобладание экспрессии генов, кодирующих белки остеобластогенеза, внеклеточного костного матрикса, минерализации кости, сохранялось с четвертой по восьмую неделю эксперимента, при этом характер мРНК-профиля несколько менялся в зависимости от времени, прошедшего с момента манифестации асептического некроза головки бедренной кости. Существует ряд исследовательских работ, обнаруживающих эффективность применения антирезорбтивной, противовоспалительной терапии в модельных экспериментах асептического некроза головки бедренной кости на животных [31, 32, 36]. Эффективность лечения оценивалась с помощью данных микрокомпьютерной томографии, гистологических, иммуногистохимических исследований, которые отобразили усиление процессов репарации костной ткани, снижение остеорезорбции по сравнению с условно-здоровой конечностью. Однако исследования молекулярно-клеточных механизмов регуляции остеогенеза на фоне применения моноклональных блокаторов провоспалительных цитокинов весьма малочисленны.
Интенсивность экспрессии гена транскрипционного фактора sp7 была повышена в течение всего эксперимента у крыс второй группы. Протеин, кодируемый представленным геном, является членом семейства транскрипционных факторов цинкового фактора, которые играют фундаментальную роль в процессах дифференцировки остеобластов из прогениторных клеток, хондрогенезе, а также поддержке баланса в дифференцировке мезенхимальных клеток по остеогенному, хондрогенному пути [37]. Повышение экспрессии гена sp7 на четвертой, шестой и восьмой неделях после индукции аваскулярного некроза на фоне приема моноклонального блокатора IL-6 может свидетельствовать об усилении хондрогенеза, остеогенеза. Кроме того, у крыс второй группы была повышена экспрессия гена щелочной фосфатазы alpl с четвертой по восьмую неделю эксперимента. Представленные данные подтверждают усиление метаболизма костной ткани на фоне подавления биологического действия провоспалительного цитокина IL-6.
Таким образом, предварительные результаты применения моноклонального блокатора провоспалитель-ного цитокина IL-6 свидетельствуют о более благоприятном течении асептического некроза головки бедренной кости у крыс. Большая сохранность плотности костных трабекул, структуры гиалинового хряща, губчатой кости получены у животных, получавших специфическую противовоспалительную терапию. Динамика изменений мРНК-профиля у крыс исследуемой группы свидетельствует об ингибировании экспрессии генов остеокластогенеза, остеолизиса ( rankl , spp1 ) на фоне снижения активности генов провос-палительных цитокинов il6 , tnf α . В то же время экспрессия генов, кодирующих регуляторные белки остеобластогенеза, минерализации костной ткани, была повышена на всех этапах эксперимента. Однако стоит отметить, что полученные результаты актуальны в случае раннего применения специфической противовоспалительной терапии генно-инженерными препаратами, до стадии фрагментации головки бедренной кости. Кроме того, некоторые регуляторные белки синтезируются на посттрансляционном уровне. Дальнейшее исследование с увеличением объема выборки позволит сделать более достоверные выводы об эффективности противовоспалительной терапии в коррекции костного гомеостаза. Также при изучении способов таргетной терапии, патогенеза аваскулярного некроза требуется оценка концентрации регуляторных протеинов, участвующих в остеогенезе, процессах ремоделирования костной ткани.
ЗАКЛЮЧЕНИЕ
Предварительные результаты применения моноклонального блокатора провоспалительного цитокина IL-6 свидетельствуют об ингибировании остеодеструктивных, усилении остеорепаративных процессов за счет коррекции экспрессии генов костного метаболизма при развитии асептического некроза головки бедренной кости у крыс в модельном эксперименте.
Список литературы Влияние моноклонального блокатора IL-6 на течение асептического некроза головки бедренной кости в эксперименте (пилотное исследование)
- Кужеливский ИИ. Болезнь Пертеса: современное состояние проблемы и пути её решения. Сибирский медицинский журнал (Иркутск). 2015;135(4):117-121.
- Hines JT, Jo WL, Cui О, et al. Osteonecrosis of the Femoral Head: an Updated Review of ARCO on Pathogenesis, Staging and Treatment. J Korean Med Sci. 2021;36(24):e177. doi: 10.3346/jkms.2021.36.e177
- Mukisi-Mukaza M, Gomez-Brouchet A, Donkerwolcke M, et al. Histopathology of aseptic necrosis of the femoral head in sickle cell disease. Int Orthop. 2011;35(8):1145-1150. doi: 10.1007/s00264-010-1121-6
- Adapala NS, Kim HK. Comprehensive Genome-Wide Transcriptomic Analysis of Immature Articular Cartilage following Ischemic Osteonecrosis of the Femoral Head in Piglets. PLoS One. 2016;11(4):e0153174. doi: 10.1371/ journal.pone.0153174
- Naik AA, Narayanan A, Khanchandani P, et al. Systems analysis of avascular necrosis of femoral head using integrative data analysis and literature mining delineates pathways associated with disease. Sci Rep. 2020;10(1):18099. doi: 10.1038/s41598-020-75197-0
- Одарченко Д.И., Дзюба Г.Г., Ерофеев С.А., Кузнецов Н.К. Проблемы диагностики и лечения асептического некроза головки бедренной кости в современной травматологии и ортопедии (обзор литературы). Гений ортопедии. 2021;27(2):270-276. doi: 10.18019/1028-4427-2021-27-2-270-276
- Tang CY, Wu M, Zhao D, et al. Runx1 is a central regulator of osteogenesis for bone homeostasis by orchestrating BMP and WNT signaling pathways. PLoS Genet. 2021;17(1):e1009233. doi: 10.1371/journal.pgen.1009233
- Li О, Wang Z. Involvement of FAK/P38 Signaling Pathways in Mediating the Enhanced Osteogenesis Induced by Nano-Graphene Oxide Modification on Titanium Implant Surface. Int J Nanomedicine. 2020;15:4659-4676. doi: 10.2147/IJN. S245608
- Udagawa N, Koide M, Nakamura M, et al. Osteoclast differentiation by RANKL and OPG signaling pathways. J Bone Miner Metab. 2021;39(1):19-26. doi: 10.1007/s00774-020-01162-6
- Герштейн ЕС, Тимофеев ЮС, Зуев АА, Кушлинский НЕ. Лиганд-рецепторная система RANK/RANKL/OPG и ее роль при первичных новообразованиях костей (анализ литературы и собственные результаты). Успехи молекулярной онкологии. 2015;2(3):51-59. doi: 10.17650/2313-805X-2015-2-3-51-59
- Samara S, Dailiana Z, Chassanidis C, et al. Expression profile of osteoprotegerin, RANK and RANKL genes in the femoral head of patients with avascular necrosis. Exp Mol Pathol. 2014;96(1):9-14. doi: 10.1016/j.yexmp.2013.10.014
- Chen B, Du Z, Dong X, et al. Association of Variant Interactions in RANK, RANKL, OPG, TRAF6, and NFATC1 Genes with the Development of Osteonecrosis of the Femoral Head. DNA Cell Biol. 2019;38(7):734-746. doi: 10.1089/dna.2019.4710
- Amarasekara DS, Yun H, Kim S, et al. Regulation of Osteoclast Differentiation by Cytokine Networks. Immune Netw. 2018;18(1):e8. doi: 10.4110/in.2018.18.e8
- Zupan J, Jeras M, Marc J. Osteoimmunology and the influence of pro-inflammatory cytokines on osteoclasts. Biochem Med (Zagreb). 2013;23(1):43-63. doi: 10.11613/bm.2013.007
- Moon SJ, Ahn IE, Jung H, et al. Temporal differential effects of proinflammatory cytokines on osteoclastogenesis. Int J Mol Med. 2013;31(4):769-777. doi: 10.3892/ijmm.2013.1269
- Zheng LW, Wang WC, Mao XZ, et al. TNF-a regulates the early development of avascular necrosis of the femoral head by mediating osteoblast autophagy and apoptosis via the p38 MAPK/NF-kB signaling pathway. Cell Biol Int. 2020;44(9):1881-1889. doi: 10.1002/cbin.11394
- Kamiya N, Kim HK. Elevation of Proinflammatory Cytokine HMGB1 in the Synovial Fluid of Patients With Legg-Calve-Perthes Disease and Correlation With IL-6. JBMR Plus. 2020;5(2):e10429. doi: 10.1002/jbm4.10429
- Adapala NS, Yamaguchi R, Phipps M, et al. Necrotic Bone Stimulates Proinflammatory Responses in Macrophages through the Activation of Toll-Like Receptor 4. Am J Pathol. 2016;186(11):2987-2999. doi: 10.1016/j.ajpath.2016.06.024
- Ren R, Guo J, Chen Y, et al. The role of Ca2+ /Calcineurin/NFAT signalling pathway in osteoblastogenesis. Cell Prolif. 2021;54(11):e13122. doi: 10.1111/cpr.13122
- Amarasekara DS, Kim S, Rho J. Regulation of Osteoblast Differentiation by Cytokine Networks. Int J Mol Sci. 2021;22(6):2851. doi: 10.3390/ijms22062851
- Eda H, Shimada H, Beidler DR, Monahan JB. Proinflammatory cytokines, IL-1ß and TNF-a, induce expression of interleukin-34 mRNA via JNK- and p44/42 MAPK-NF-kB pathway but not p38 pathway in osteoblasts. Rheumatol Int. 2011;31(11):1525-1530. doi: 10.1007/s00296-010-1688-7
- Shabaldin Na, Sinitskaya AV, Shabaldin AV, Mukhamadiyarov RA. Expression Dynamics of Bone Homeostasis Genes in the Development of Aseptic Femoral Head Necrosis in Rats. JEvolBiochem Phys. 2023;59(1):180-191. doi: 10.1134/ S0022093023010155
- Yamaguchi R, Kamiya N, Adapala NS, et al. HIF-1-Dependent IL-6 Activation in Articular Chondrocytes Initiating Synovitis in Femoral Head Ischemic Osteonecrosis. J Bone Joint Surg Am. 2016;98(13):1122-1131. doi: 10.2106/JBJS.15.01209
- Yellowley CE, Genetos DC. Hypoxia Signaling in the Skeleton: Implications for Bone Health. Curr Osteoporos Rep. 2019;17(1):26-35. doi: 10.1007/s11914-019-00500-6
- Stegen S, van Gastel N, Eelen G, et al. HIF-1a Promotes Glutamine-Mediated Redox Homeostasis and Glycogen-Dependent Bioenergetics to Support Postimplantation Bone Cell Survival. Cell Metab. 2016;23(2):265-279. doi: 10.1016/j.cmet.2016.01.002
- Ding H, Gao YS, Hu C, et al. HIF-1a transgenic bone marrow cells can promote tissue repair in cases of corticosteroid-induced osteonecrosis of the femoral head in rabbits. PLoS One. 2013;8(5):e63628. doi: 10.1371/journal.pone.0063628
- Zhu J, Tang Y, Wu О, et al. HIF-1a facilitates osteocyte-mediated osteoclastogenesis by activating JAK2/STAT3 pathway in vitro. J Cell Physiol. 2019;234(11):21182-21192. doi: 10.1002/jcp.28721
- Hirai K, Furusho H, Hirota K, Sasaki H. Activation of hypoxia-inducible factor 1 attenuates periapical inflammation and bone loss. Int J Oral Sci. 2018;10(2):12. doi: 10.1038/s41368-018-0015-0
- Шабалдин Н.А., Шабалдин А.В., Шабалдина Е.В. и др. Способ моделирования асептического некроза головки бедренной кости у лабораторных крыс. Патент РФ на изобретение № 2773606. Бюл. № 16. Доступно по: https:// www.fips.ru/registers-doc-view/fips_servlet. Ссылка активна на 16.01.2024.
- Song J, Wu J, Poulet B, et al. Proteomics analysis of hip articular cartilage identifies differentially expressed proteins associated with osteonecrosis of the femoral head. Osteoarthritis Cartilage. 2021;29(7):1081-1092. doi: 10.1016/j. joca.2021.04.005
- Kuroyanagi G, Adapala NS, Yamaguchi R, et al. Interleukin-6 deletion stimulates revascularization and new bone formation following ischemic osteonecrosis in a murine model. Bone. 2018;116:221-231. doi: 10.1016/j.bone.2018.08.011
- Ren Y, Deng Z, Gokani V, et al. Anti-Interleukin-6 Therapy Decreases Hip Synovitis and Bone Resorption and Increases Bone Formation Following Ischemic Osteonecrosis of the Femoral Head. J Bone Miner Res. 2021;36(2):357-368. doi: 10.1002/jbmr.4191
- Maestro-Paramio L, García-Rey E, Bensiamar F, Saldaña L. Osteoblast function in patients with idiopathic osteonecrosis of the femoral head: implications for a possible novel therapy. Bone Joint Res. 2021;10(9):619-628. doi: 10.1302/2046-3758.109.BJR-2021-0016.R1
- Foster BL, Ao M, Salmon CR, et al. Osteopontin regulates dentin and alveolar bone development and mineralization. Bone. 2018;107:196-207. doi: 10.1016/j.bone.2017.12.004
- Cai X, Zheng Y, Ren F, et al. Secretory phosphoprotein 1 secreted by fibroblast-like synoviocytes promotes osteoclasts formation via PI3K/AKT signaling in collagen-induced arthritis. BiomedPharmacother. 2022;155:113687. doi: 10.1016/j. biopha.2022.113687
- Kim HK, Aruwajoye O, Du J, Kamiya N. Local administration of bone morphogenetic protein-2 and bisphosphonate during non-weight-bearing treatment of ischemic osteonecrosis of the femoral head: an experimental investigation in immature pigs. J Bone Joint Surg Am. 2014;96(18):1515-1524. doi: 10.2106/JBJS.M.01361
- Fiscaletti M, Biggin A, Bennetts B, et al. Novel variant in Sp7/Osx associated with recessive osteogenesis imperfecta with bone fragility and hearing impairment. Bone. 2018;110:66-75. doi: 10.1016/j.bone.2018.01.031


