Влияние на бактериальный гидролитический комплекс гумусо-аккумулятивного горизонта техноурбанозема пассажа через кишечник дождевого червя Aporrectodea caliginosa
Автор: Фролов О.А., Якушев А.В.
Журнал: Бюллетень Почвенного института им. В.В. Докучаева @byulleten-esoil
Статья в выпуске: 94, 2018 года.
Бесплатный доступ
Изучены экофизиологические особенности транзитного (прошедшее через кишечную полость) бактериального гидролитического комплекса Aporrectodea caliginosa : проведено сравнение в почве и копролитах биоразнообразия, преобладающих экологических стратегии и физиологических состояний среди его членов. Исследование проводили комплексным структурно-функциональным методом, основанном на кинетическом анализе сукцессии инициированных гидролитических бактериальных сообществ, возникающих после инокуляции набора селективных жидких питательных сред суспензией исследуемых образцов. В инициированные сообщества помимо гидролитических микроорганизмов входят негидролитические бактерии-спутники (олиготрофы и копиотрофы). Рост инициированных бактериальных сообществ на восьми средах с биополимерами (хитине, целлюлозе, пектине, крахмале, ксилане, декстране 500, твине 20, казеине) измеряли по оптической плотности. Описывали его двумя кинетическими параметрами, применяемыми для описания чистых культур микроорганизмов: максимальная удельная скорость роста и начальное физиологическое состояние...
Зоомикробные взаимодействия, кинетика роста, физиологическое состояние микроорганизмов, экологические стратегии микроорганизмов
Короткий адрес: https://sciup.org/143165447
IDR: 143165447 | УДК: 631.46 | DOI: 10.19047/0136-1694-2018-94-57-73
Текст научной статьи Влияние на бактериальный гидролитический комплекс гумусо-аккумулятивного горизонта техноурбанозема пассажа через кишечник дождевого червя Aporrectodea caliginosa
Почвенные животные и микроорганизмы влияют на плодородие почвы (Звягинцев и др. 2005). Это влияние часто реализуется через зоомикробные взаимодействия (Byzov at al., 1993; Bi at al., 2018). В частности, почвенные животные в ассоциации с микроорганизмами в почве проводят трансформацию (минерализацию и гумификацию) органических остатков, в том числе и биополимеров (Chang at al., 2016), мобилизацию–иммобилизацию элементов питания (Бызов, 2005). От содержания и качества гумуса значительно зависит плодородие (Hargitai,1993). Животные-сапрофаги измельчают, перемещают, перемешивают подстилку и переваривают ее совместно с кишечными микроорганизмами. В дальнейшем их экскременты трансформируются (“стареют”) под воздействием микробиологических, физических и химических процессов. В результате образуются гумусовые горизонты (Bal, 1970). Одним из востребованных и перспективных подходов к изучению вклада микробного комплекса в преобразования органических остатков в почве является оценка экофизиологических особенностей его членов: физиологического разнообразия, преобладающих физиологических состояний и экологических стратегий (Благодатская, 2004; Благодатская, 2008; Córdova, 2018). Подход основан на анализе кинетических характеристик микроорганизмов. Определение кинетики роста и построение моделей, описывающих его, востребовано в прикладных научных исследованиях, в медицинской и пищевой промышленности, оценке экологического состояния окружающей среды (Panikov, 2016; Stanbury at al., 2017; Atungulu at al., 2016; Dev at al., 2016). Проводятся исследования влияния на скорость роста микроорганизмов плотности биомассы (AlSayed at al., 2017; Krichen et al., 2018), кислотности среды (Akkermans, Van Impe, 2018) и др. Экологические стратегии, преобладающие среди кишечных микроорганизмов, и их физиологическое состояние позволяют понять механизмы трансформации органического вещества в пищеварительной системе животных и зоомикробных взаимодействий.
Дождевые черви – одни из наиболее значимых для плодородия почвенных животных (Huang, Xia, 2018; Peigné at al., 2018; Sanchez-Hernandez at al., 2018; Sanchez-Hernandez, 2018) . Им посвящено множество работ по физиологии (Laverack, 1963; Satchell, 1983) , экологии (Юрков и др., 2008; Тихонов и др., 2011; Кутовая, 2012; Храмченкова и др., 2012) и применению в сельском хозяйстве (вермикомпостирование) (Бызов, Якушев, 2008) .
Цель исследования – изучение транзитного (полостного) бактериального комплекса кишечника Aporrectodea caliginosa : сравнение в почве и копролитах разнообразия бактериального комплекса, преобладающих среди его членов экологических стратегии и физиологических состояний.
ОБЪЕКТЫ И МЕТОДЫ
В г. Москве на территории Ботанического сада МГУ им. М.В. Ломоносова на Воробьевых горах собрано 20 особей (15 ювенильных и 5 половозрелых) эврибионтных эндогейных дождевых червей Aporrectodea caliginosa , определенных по специализированной литературе (Всеволодова-Перель, 1997) . Черви содержались неделю в условиях лабораторного микрокосма при постоянной весовой влажности почвы 45% и температуре 25°C в образце (0.8 кг) гумусово-аккумулятивного горизонта техноурбанозема (Розанова и др., 2016) , в котором они обитали в природе. Для получения экскрементов червей отмывали от почвы, помещали в чашку Петри и выдерживали сутки при температуре +10°. Количество бактерий на поверхности червей несопоставимо меньше, чем в копролитах, и их влиянием можно пренебречь. После этого копролиты собирали и анализировали одновременно с образцами почвы (корма).
Экофизиологическую характеристику бактериальных комплексов проводили комплексным структурно-функциональным Таблица 1. Набор полимеров, использованных в селективных средах
Метод не исследует микроорганизмы на классических для почвенной микробиологии уровнях изучения: операционных таксономических единицах, целых сообществах или биохимических процессах, проводимых микробным комплексом. Он изучает не исследованные ранее, временно возникающие в микролокусе из пула ассоциации (смешанные культуры), которые непосредственно осуществляют большинство процессов в природе. В комплексном методе эти консорции микроорганизмов воссоздаются посредством создания инициированных сообществ в лабораторных микрокосмах после внесения суспензии исследуемого природного сообщества в набор селективных жидких питательных сред. При этом анализируются возникающие кинетические параметры сукцессионных изменений. Поскольку процесс происходит в более контролируемых условиях, чем в классических почвенных инициированных сообществах, то его можно представить как рост и отмирание смешанной периодической культуры, описываемой классическими кинетическими параметрами: микробным экономическим коэффициентом, максимальной удельной скоростью роста, метаболическим коэффициентом и т.д. В данной работе исследовали инициированные бактериальные сообщества, содержащие аэробные и факультативно-анаэробные культивируемые микроорганизмы, использующие как трудно-, так и легкодоступные полимеры (филумы Cytophaga-Flavibacterium-Bacteroides, Firmicutes, Proteobacteria, Actinobacteria). В эти ассоциации входят не только гидролитические бактерии, но и их спутники, представленные как копиотро-фами, так и олиготрофами. Поведение инициированных гидролитических сообществ в лаг-фазе и фазе экспоненциального роста описывали уравнением комплексной модели периодической культуры (Якушев, 2015), которая для этих стадий роста идентична модели Н.С. Паникова (1991, 1996):
x(t) = X o (l - P0 + р 0 е ^ т1), где х ( t ) – экспериментально установленная по оптической плотности концентрация клеток (кл./мл) в момент времени t (ч) в селективных жидких питательных средах; x 0 – экспериментально установленная концентрация клеток бактерий в момент инокуляции питательных сред почвенной суспензией (КОЕ/мл); μ m – максимальная удельная скорость ассоциации на среде с полимером (ч-1); ρ 0 – начальное физиологическое состояние растущей смешанной культуры, характеризующее физиологическое состояние бактерий еще в почве – на момент инокуляции ими питательной среды. Чем ρ 0 выше, тем активность бактерий выше.
Биоразнообразие бактерий в инициированных гидролитических сообществах, сформировавшихся на жидких средах с полимерами, определяли по индексам Бергера–Паркера и Шеннона, рассчитанным по данным встречаемости морфотипов бактерий на чашках Петри на среде “Rich” (разбавленной глюкозо-пептоннодрожжевой среде). В результате получено по 7 индексов для инициированных сообществ из почвы и копролитов. Использование слабоселективной среды позволяет более полно учесть биоразнообразие инициированных гидролитических сообществ, чем высев на агаризованные варианты селективных сред, так как помимо гидролитических бактерий в данные сообщества входят копио-трофные и олиготрофные негидролитические бактерии, не способные вырасти на среде с полимерами.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
Распределения частот встречаемости значений индексов Шеннона и Бергера–Паркера инициированных гидролитических бактериальных сообществ (табл. 2) имеет ненормальный характер (рис. 1). Поэтому информативно применить непараметрический статистический анализ. Медианный и непараметрический дисперсионный анализы не выявили достоверных различий в биоразнообразии инициированных сообществ на средах с биополимерами, возникших из природных сообществ почвы и экскрементов.
Таблица 2. Морфотипы выделенных бактериальных сообществ
|
Среда |
Корм |
копролиты |
||
|
морфотип № |
доля |
морфотип № |
доля |
|
|
Крахмал |
03 |
0.72 |
2 |
0.66 |
|
04 |
0.26 |
4 |
0.30 |
|
|
08 |
0.02 |
8 |
0.02 |
|
|
КМЦ |
13 |
1 |
2 |
0.75 |
|
9 |
0.25 |
|||
|
Пектин |
05 |
1 |
2 |
0.90 |
|
100 |
0.08 |
|||
|
120 |
00.013 |
|||
|
Ксилан |
06 |
0.66 |
2 |
0.68 |
|
11 |
0.3 |
4 |
0.06 |
|
|
6 |
0.03 |
|||
|
8 |
0.20 |
|||
|
Казеин |
01 |
0.61 |
1 |
0.34 |
|
0 |
0.38 |
2 |
0.13 |
|
|
3 |
0.52 |
|||
|
Твин 20 |
02 |
0.10 |
2 |
0.10 |
|
08 |
0.21 |
3 |
0.45 |
|
|
09 |
0.68 |
4 |
0.02 |
|
|
8 |
0.37 |
|||
|
9 |
00.027 |
|||
|
Декстран-500 |
02 |
0.86 |
2 |
00.091 |
|
0 |
0.03 |
4 |
0.47 |
|
|
07 |
0.38 |
6 |
0.11 |
|
|
08 |
0.05 |
8 |
0.08 |
|
|
100 |
0.24 |
|||
A
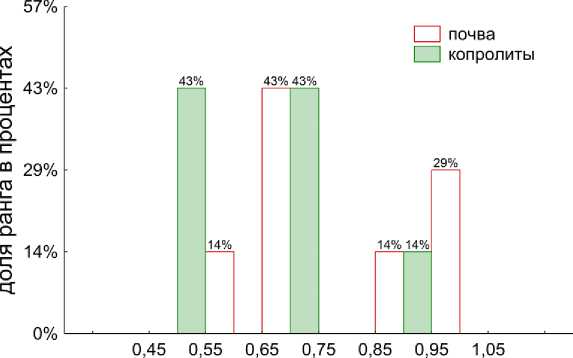
Индекс Бергера-Паркера
В
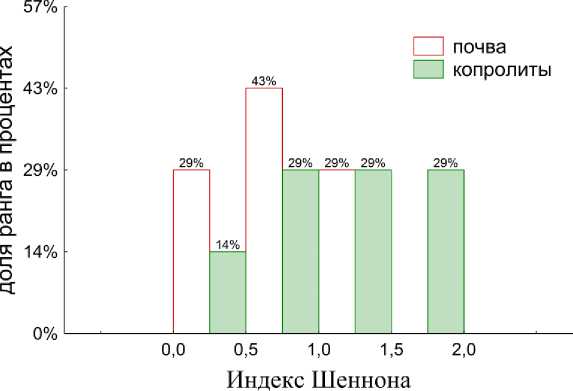
Рис. 1. Ранговое распределение частот встречаемости индексов биоразнообразия инициированных гидролитических сообществ (А – индекс Бергера–Паркера, B – индекс Шеннона).
Поэтому был проведен непосредственный анализ ранговых распределений выявивший тенденцию к смещению в ходе пассажа доли встречающихся значений индекса Шеннона в сторону больших значений и меньших значений по индексу Бергера–Паркера. Увеличение биоразнообразия инициированных сообществ указывает на увеличение биоразнообразия бактериального комплекса копролитов: видовой состав становится более выровненным и разнообразным, а следовательно и более устойчивым. Возможно, слабые величины эффектов связаны с тем, что почва уже была сильно переработана червями. Семь дней для этого вполне достаточно. И по сути, анализировались старые копролиты, смешанные с почвой, и свежие копролиты, собранные в чашке Петри.
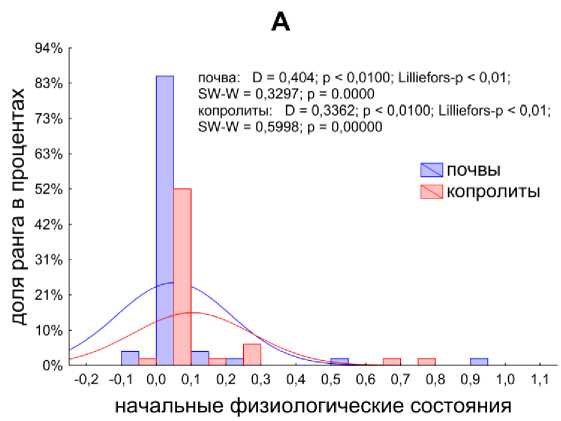
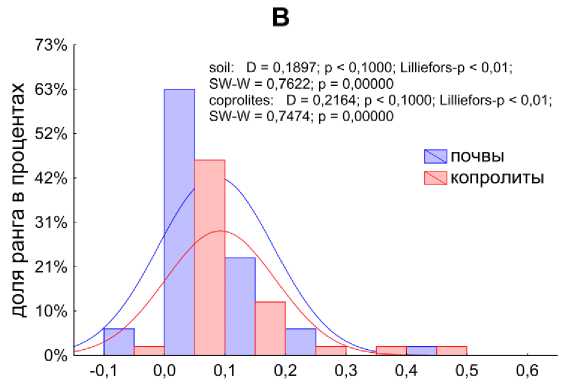
Максимальная удельная скорость роста (μ m ) и начальное физиологическое состояние гидролитических ассоциаций (ρ 0 ) распределены не нормально (рис. 2). Поскольку данные не подчиняются закону нормального распределения, то для сравнения использовались медианный и непараметрический дисперсионный анализы.
Непараметрический однофакторный дисперсионный анализ на основании критерия Краскела—Уоллиса (H (1, N = 80) = 13.9, p = 0.0002) и медианный тест по критерию согласия Пирсона (χ2 = 13.3, df = 1, p = 0.0003) установили увеличение медианных значений ρ 0 для инициированных сообществ в ходе пассажа почвы через кишечник дождевого червя (рис. 3).
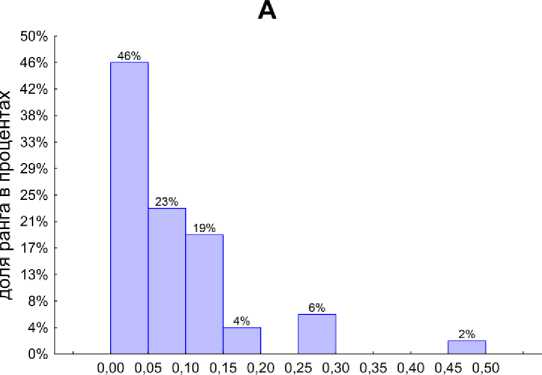
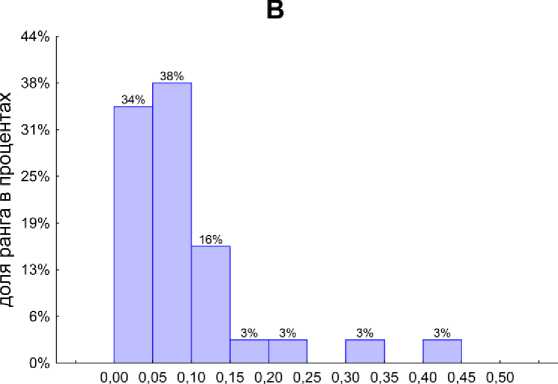
Эти анализы не выявили достоверных различий медианных значений μ m . Поэтому был проведен анализ ранговых распределений (рис. 4). При пассаже почвы через кишечник увеличивается доля быстрорастущих бактерий в бактериальном сообществе ко-пролитов (увеличивается доля класса со значениями μ m от 0.05 до 0.1 с 23 до 38% и уменьшается доля класса 0–0.05 с 46 до 34%).
максимальная удельная скорость роста
Рис. 2. Проверка на нормальность ранговых распределений (А – начальных физиологических состояний (безразмерная величина), B – максимальной удельной скорости роста (1/ч)) инициированных гидролитических сообществ.
Начальные физиологические состояния
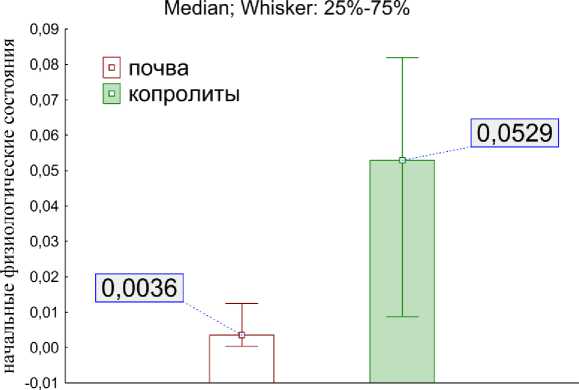
Рис. 3. Начальные физиологические состояния (медиана и квартили) инициированных гидролитических сообществ, сформировавшихся на жидких средах с полимерами.
ЗАКЛЮЧЕНИЕ
При пассаже через кишечник дождевого червя транзитный почвенный бактериальный гидролитический комплекс становится более устойчивым, более выровненным и разнообразным. Происходит его активизация – начальное физиологическое состояние инициированных гидролитических сообществ выше. Среди его членов увеличивается доля быстрорастущих бактерий r -стратегов: на жидких средах с полимерами доля быстрорастущих инициированных гидролитических ассоциации повышается.
максимальная удельная скорость роста (почва)
максимальная удельная скорость роста (копролиты)
Рис. 4 Ранговые распределения частоты встречаемости максимальных удельных скоростей роста инициированных гидролитических бактериальных сообществ, сформировавшихся на средах с полимерами (A – почва, B – копролиты).
Список литературы Влияние на бактериальный гидролитический комплекс гумусо-аккумулятивного горизонта техноурбанозема пассажа через кишечник дождевого червя Aporrectodea caliginosa
- Благодатская Е.В., Ермолаев А.М., Мякшина Т.Н. Экологические стратегии микробных сообществ почв под растениями луговых экосистем//Изв. РАН. Сер. биологическая. 2004. №. 6. С. 740-748.
- Благодатский С.А., Богомолова И.Н., Благодатская Е.В. Микробная биомасса и кинетика роста микроорганизмов в черноземах при различном сельскохозяйственном использовании//Микробиология. 2008. Т. 77. № 1. С. 113-120.
- Бызов Б.А. Зоомикробные взаимодействия в почве. М.: ГЕОС, 2005. 213 с.
- Бызов Б.А., Якушев А.В., Микробиологическая характеристика вермикомпостирования методом мультисубстратного тестирования//Почвоведение. 2008. № 11. С. 1381-1387 DOI: 10.1134/S1064229308110112
- Всеволодова-Перель Т.С. Дождевые черви фауны России. Кадастр и определитель. М.: Наука, 1997. 102 с.
- Звягинцев Д.Г., Бабьева И.П., Зенова Г.М. Биология почв. М.: Изд-во Моск. ун-та, 2005. 445 с.
- Кутовая О.В. Характеристика гумусовых веществ агродерново-подзолистой почвы и копролитов дождевых червей//Бюл. Почв. ин-та им. В.В. Докучаева. 2012. Вып. 69. С. 46-59.
- Розанова М.С., Прокофьева Т.В., Лысак Л.В., Рахлеева А.А. Органическое вещество почв ботанического сада МГУ им. М.В. Ломоносова на Ленинских горах//Почвоведение. 2016. № 9. С. 1079-1092 DOI: 10.7868/S0032180X16090124
- Паников Н. С. Синтетическая хемостатная модель как средство описания сложного динамического поведения микроорганизмов//Микробиология. 1991. Т. 60. № 3. С. 431-441.
- Тихонов В.В., Бызов Б.А., Завгородняя Ю.А., Демин В.В. Дождевые черви преобразователи структуры и биологической активности гуминовых кислот//Изв. РАН. Сер. биологическая. 2011. № 1. С. 24-32 DOI: 10.1134/S1062359010061032
- Храмченкова О., Веремеев В., Бачура Ю. Водоросли почв и копролитов дождевых червей в луговых экосистемах//Наука и инновации. 2012. Т. 2. № 108.
- Юрков А.М., Чернов И.Ю., Тиунов А.В Влияние дождевых червей lumbricus terrestris на структуру дрожжевого сообщества лесной подстилки//Микробиология. 2008. Т. 77. № 1. С. 121-125 DOI: 10.1134/S0026261708010153
- Якушев А.В. Комплексный структурно-функциональный метод характеристики микробных популяций//Почвоведение. 2015. № 4. С. 429-446 DOI: 10.7868/S0032180X15040115
- Akkermans S., Van Impe J.F. Mechanistic modelling of the inhibitory effect of pH on microbial growth//Food Microbiol. 2018. Т. 72. P. 214-219 DOI: 10.1016/j.fm.2017.12.007
- AlSayed A., Fergala A., Eldyasti A. Influence of biomass density and food to microorganisms ratio on the mixed culture type I methanotrophs enriched from activated sludge//J. Environ. Sci. 2017 DOI: 10.1016/j.jes.2017.11.017
- Atungulu G.G., Thote S., Wilson S. Storage of hybrid rough rice-Consideration of microbial growth kinetics and prediction models//J. Stored Products Res. 2016. Т. 69. С. 235-244 DOI: 10.1016/j.jspr.2016.09.003
- Bal L. Morphological investigation in two moder-humus profiles and the role of the soil fauna in their genesis//Geoderma. 1970. Т. 4. № 1. С. 5-36 DOI: 10.1016/0016-7061(70)90030-3
- Bi Y.M., Tian G.L., Wang C., Zhang Y., Wang D.N., Zhang F.F., Sun Z.J. Differential effects of two earthworm species on Fusarium wilt of strawberry//Appl. Soil Ecology. 2018. V. 126. P. 174-181 DOI: 10.1016/j.apsoil.2018.02.024
- Byzov B.A., Thanh V.N., Babjeva I.P. Interrelationships between yeasts and soil diplopods//Soil Biol. Biochem. 1993. Т. 25. № 8. С. 1119-1126 DOI: 10.1016/0038-0717(93)90160-D
- Chang C.H., Szlavecz K., Buyer J.S. Species-specific effects of earthworms on microbial communities and the fate of litter-derived carbon//Soil Biol. Biochem. 2016. V. 100. P. 129-139 DOI: 10.1016/j.soilbio.2016.06.004
- Córdova O. et al. Influence of growth kinetics of microalgal cultures on biogas production//Renewable Energy. 2018. Т. 122. С. 455-459 DOI: 10.1016/j.renene.2018.01.125
- Dev S., Roy S., Bhattacharya J. Understanding the performance of sulfate reducing bacteria based packed bed reactor by growth kinetics study and microbial profiling//J. Environ. Management. 2016. Т. 177. С. 101-110 DOI: 10.1016/j.jenvman.2016.03.049
- Hargitai L. The role of organic matter content and humus quality in the maintenance of soil fertility and in environmental protection//Landscape and Urban Planning. 1993. Т. 27. № 2-4. С. 161-167 DOI: 10.1016/0169-2046(93)90044-E
- Huang G., Chen S., Dai C., Sun L., Sun W., Tang Y., Xiong F., He R., Ma H., Effects of ultrasound on microbial growth and enzyme activity//Ultrasonics Sonochemistry. 2017. Т. 37. С. 144-149 DOI: 10.1016/j.ultsonch.2016.12.018
- Huang K., Xia H. Role of earthworms' mucus in vermicomposting system: Biodegradation tests based on humification and microbial activity//Sci. Total Environ. 2018. V. 610. 703-708 DOI: 10.1016/j.scitotenv.2017.08.104
- Krichen E., Harmand J., Torrijos M., Godon J.J., Bernet N., Rapaport A. High biomass density promotes density-dependent microbial growth rate//Biochem. Engin. J. 2018. Т. 130. С. 66-75 DOI: 10.1016/j.bej.2017.11.017
- Laverack M.S. The Physiology of Earthworms. N.Y.: Macmillan, 1963. 230 p.
- Laverack N.S. Mechanistic mathematical models of microbial growth in bioreactors and in natural soils: explanation of complex phenomena//Mathematics and Computers in Simulation. 1996. Т. 42. № 2-3. С. 179-186 DOI: 10.1016/0378-4754(95)00127-1
- Panikov N.S. Kinetics of Microbial Processes, Reference Module in Earth Systems and Environmental Sciences. Elsevier, 2016. P. 1-19 DOI: 10.1016/B978-0-12-409548-9.09733-5
- Peigne J., Vian J.F., Payet V., Saby N.P. Soil fertility after 10 years of conservation tillage in organic farming//Soil and Tillage Res. 2018. V. 175. 194-204 DOI: 10.1016/j.still.2017.09.008
- Sanchez-Hernandez J. C. Biochar activation with exoenzymes induced by earthworms: A novel functional strategy for soil quality promotion//J. Hazardous Materials, 2018. V. 350. 136-143 DOI: 10.1016/j.jhazmat.2018.02.019
- Sanchez-Hernandez J.C., del Pino J.N., Capowiez,Y., Mazzia C., Rault M. Soil enzyme dynamics in chlorpyrifos-treated soils under the influence of earthworms//Sci. Total Environ. 2018. V. 612. P. 1407-1416 DOI: 10.1016/j.scitotenv.2017.09.043
- Satchell J.E. Earthworm microbiology//Earworm ecology from Darwin to vermiculture. London, N.Y, 1983. P. 315-364 DOI: 10.1007/978-94-009-5965-1
- Stanbury P.F., Whitaker A., Hall S.J. Principles of Fermentation Technology. Elsevier, 2017 P. 21-74 DOI: 10.1016/B978-0-08-099953-1.00002-8


