Влияние наночастиц диоксида кремния на морфологию внутренних органов у крыс при пероральном введении
Автор: Зайцева Н.В., Землянова М.А., Звездин В.Н., Довбыш А.А., Гмошинский И.В., Хотимченко С.А.
Журнал: Анализ риска здоровью @journal-fcrisk
Рубрика: Экспериментальные модели и инструментальные исследования для оценки риска в гигиене и эпидемиологии
Статья в выпуске: 4 (16), 2016 года.
Бесплатный доступ
Объектом исследования являлся аморфный диоксид кремния (SiO2), который широко используется в качестве пищевой добавки (Е551), вспомогательного компонента в фармацевтических препаратах, в парфюмерно-косметической продукции и т.п. В спецификации JECFA на диоксид кремния отутствует информация о размере его частиц, что допускает использование в качестве пищевой добавки высокодисперсного аморфного SiO2, полученного газофазным гидролизом тетрахлорсилана. Данный материал, известный как «Аэросил», характеризуется размером удельной площади поверхности 300-380 м2/г и размером своих относительно слабо агломерированных частиц 6-30 нм, то есть является наноматериалом. На биологической модели исследованы морфологические изменения тканей органов и систем при пероральном введении наноразмерных частиц диоксида кремния. Крысы-самцы линии Вистар получали на протяжении 92 суток наноразмерный диоксид кремния с удельной площадью поверхности 300 м2/г и размером первичных наночастиц по данным электронной, атомно-силовой микроскопии и динамического рассеяния света в интервале 20-60 нм. Светооптическое морфологическое исследование органов крыс выявило относительно слабо выраженные воспалительные явления в структуре паренхиматозных органов (печень, почки), не демонстрирующие определенной зависимости от дозы наночастиц. Наиболее выраженными были изменения морфологии подвздошной кишки, состоящие в массивной лимфомакрофагальной и эозинофильной инфильтрации ворсинок, без видимого нарушения структуры их эпителиального пласта, что косвенно указывает на отсутствие нарушений барьерной функции кишечного эпителия. При максимальной из доз (100 мг/кгмассы тела) усиление иммунной реакции в стенке подвздошной кишки было наиболее значительным. Полученные результаты указывают на возможные риски для здоровья человека при использовании SiO2 с удельной площадью поверхности 300 м2/г и выше в составе пищевой продукции в качестве пищевой добавки.
А: наночастицы, диоксид кремния, морфологические исследования, пероральное поступление, подострая токсичность, риск здоровью
Короткий адрес: https://sciup.org/14237981
IDR: 14237981 | УДК: 615.9, | DOI: 10.21668/health.risk/2016.4.10
Текст научной статьи Влияние наночастиц диоксида кремния на морфологию внутренних органов у крыс при пероральном введении
Аморфный диоксид кремния (SiO 2 ) широко используется в качестве пищевой добавки (Е551), а также вспомогательного компонента в фармацевтических препаратах и в парфюмерно-косметической продукции. В спецификации JECFA на диоксид кремния [25] отсутствует информация о размере его частиц, что допускает использование в качестве пищевой добавки высокодисперсного аморфного SiO 2 , полученного газофазным гидролизом тетра-хлорсилана. Данный материал, известный как «Аэросил», характеризуется удельной площадью поверхности 300–380 м2/г и размером своих относительно слабо агломерированных частиц 6–30 нм, то есть является наноматериалом (НМ).
Необходимость оценки безопасности и рисков НМ для здоровья человека обосновывается в Постановлении главного государственного санитарного врача Российской Федерации № 54 от 23.07.2007 г. «О надзоре за продукцией, полученной с использованием нанотехнологий и содержащей наноматериалы» и информационном письме Роспотребнадзора «О надзоре за производством и оборотом продукции, содержащей наноматериалы» [2, 6].
Предварительная оценка степени потенциальной опасности наночастиц диоксида кремния, согласно действующим МР 1.2.2522-09, указывает на среднюю потенциальную опасность данного наноматериала, что требует проведения его развернутого токсиколого-гигиенического исследования в тестах in vivo на лабораторных животных с использованием комплекса интегральных, морфологических, биохимических и других показателей и маркеров токсичности.
Целью настоящей работы являлось изучение влияния наноразмерного SiO 2 на морфологию внутренних органов крыс при пероральном введении в течение 92 суток.
Материалы и методы. В работе использован высокодисперсный аморфный SiO2, приобретенный в фирме ООО «Силика» (Россия, Московская обл., г. Долгопрудный) под торговым наименованием «Орисил 300», соответствующий ГОСТ 14922-77. Представляет собой легкий белый порошок, дающий при диспергации ультразвуком в воде опалесцирующий бесцветный коллоидный раствор, стабильный в течение не менее 2 суток. Удельная площадь поверхности продукта, определенная методом изотерм адсорбции инертных газов, составила по данным изготовителя 300 м2/г. Выполненная в ФГБНУ «Научно-исследовательский институт питания»
и ФГБУН «Институт биохимии им. А.Н. Баха» характеристика наноматериала с использованием методов трансмиссионной электронной микроскопии, атомно-силовой микроскопии и динамического рассеяния света (ДРС) [8], показала (рис. 1), что в составе сухого продукта представлены преимущественно агломераты первичных частиц размером от 5 до 100 нм. Анализ распределения частиц образца по размеру в обработанной ультразвуком водной суспензии в концентрации 1 % по массе выявил, что преобладающая фракция наночастиц (НЧ) имела среднечисловой гидродинамический диаметр 56,6 ± 32,1 нм, 90-й перцентиль размера – 91,7 нм. Содержание частиц с диаметром более 100 нм при этом не превышало 10 % от общего числа частиц.
Работу с животными проводили в соответствии с «Руководством по уходу и использованию лабораторных животных» (ILAR, DELS) и «Правилами лабораторной практики» [5, 17]. Исследования выполнены в соответствии с [4]. Эксперимент выполнен на 75 крысах-самцах линии Вистар исходной массой 80 г, полученных из питомника «Столбовая». На протяжении всего эксперимента животные получали сбалансированный полусинтетический рацион. Крыс размещали в клетках группами по три особи, рацион и воду предоставляли в режиме свободного неограниченного доступа. В начале эксперимента животные были случайным образом разделены на пять групп равной численности (по 15 крыс), совпадающих по исходной средней массе тела. Животным 1-й (контрольной) группы вводили носитель (деионизованную воду). Крысы групп со 2-й по 5-ю получали наноразмерный SiO 2 в виде обработанной ультразвуком суспензии в деионизованной воде (время обработки 5 мин, частота 44 кГц, мощность 1 Вт/см3). В течение первых 30 суток введение НМ осуществляли внутрижелудочно через зонд, а на протяжении последующих 62 суток суспензию SiO2 добавляли к корму животных; дозу при этом рассчитывали, исходя из поедаемости рациона. Вводимая доза SiO 2 в группах 2–5 составляла 0,1; 1,0; 10 и 100 мг/кг массы тела соответственно. Выведение животных из эксперимента осуществляли на 93-е сутки опыта путем обескровливания из нижней полой вены под эфирной анестезией. Отобранные пробы внутренних органов (печень, почки, подвздошная кишка) немедленно помещали в фиксатор (3,7 % раствор формальдегида в 0,1 М натрий-фосфатном буфере рН = 7,00 ± 0,05) и транспортировали в лабора-
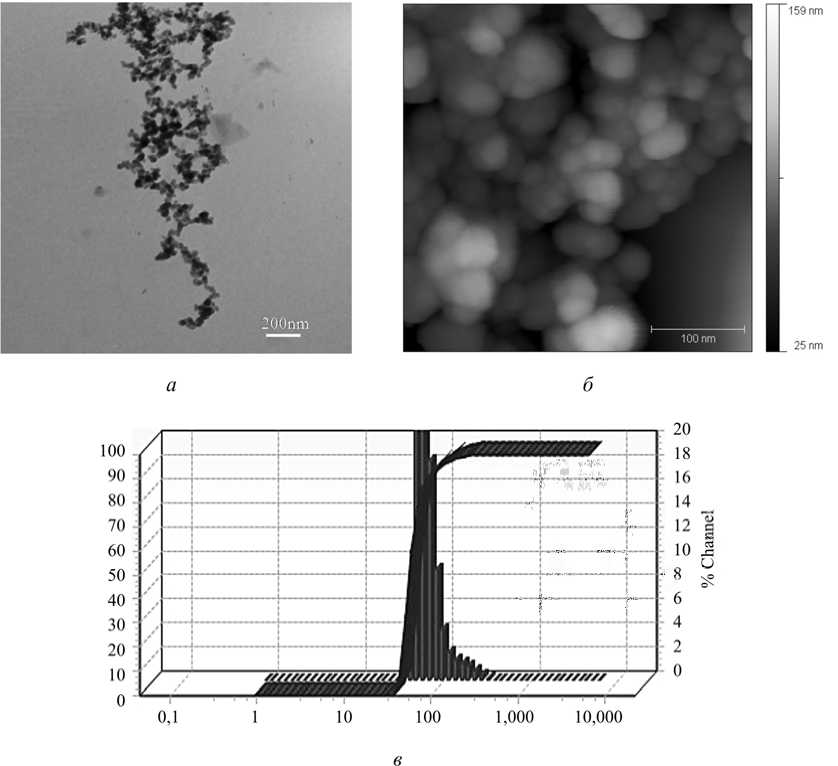
Рис. 1. Размер частиц аморфного диоксида кремния «Орисил-300»: а – метод электронной микроскопии (микроскоп «JEM-100СХ», JEOL, Япония), микроскопия образца без ультразвуковой обработки; б – метод атомно-силовой микроскопии (микроскоп «SmartSPM», «АИСТ-НТ», Россия), микроскопия образца без ультразвуковой обработки; в – метод динамического рассеяния света (прибор «Nanotrack Wave», Microtrack Inc., США), распределение по размеру частиц образца, обработанного звуком. Воспроизведено из работы [5] с разрешения авторов
торию для исследования. Подготовка гистологических препаратов включала дегидратацию фрагментов органов в спиртах восходящей концентрации, пропитку хлороформом и парафином в автоматическом гистологическом процессоре «Excelsior ES» (Thermo Scientific, Германия). Далее образцы заливали гомогенизированной парафиновой средой «Histomix» [1] на станции заливки блоков «Histo Star» (Thermo Scientific, Германия). Парафиновые срезы толщиной 3–4 мкм изготавливали на санном микротоме «JUNG SM 2000R» (Leica, Германия) и окрашивали их по общепринятой методике [3] гематоксилином и эозином в роботе-окрашивате-ле «Varistain Gemini ES» (Thermo Scientific, Германия). Полученные микропрепараты исследовали на светооптическом микроскопе «MEIJI» (Techno,
Япония) при увеличении ×50, ×100, ×200, ×400, ×800, ×1000. Микрофотографии выполняли с помощью камеры «Microscopy VISION» (VISION, Канада). Из каждого органа готовили не менее 9 микропрепаратов. Общее число проанализированных микропрепаратов (срезов) органов составило 400 штук.
Результаты и их обсуждение. Как показали результаты исследования внутренних органов, у всех животных 1-й группы (контрольной) определена персистирующая гиперплазия лимфоидной ткани подвздошной кишки с формированием вторичных фолликулов. На отдельных микропрепаратах в портальных трактах печени выявлена слабо выраженная лимфоидная инфильтрация, одиночные эозинофилы. В почках животных видимые морфологические изменения не установлены. В целом состояние морфологии внутренних органов крыс контрольной группы в основном соответствует норме для животных данного пола и возраста. Репрезентативные микрофотографии срезов печени, почки и подвздошной кишки крыс контрольной группы приведены на рис. 2.
Во 2-й группе животных (доза диоксида кремния 0,1 мг/кг массы тела) в печени выявлена слабо выраженная очаговая пылевидная и мелкокапельная жировая паренхиматозная дистрофия, эозинофилия инфильтрата портальных трактов (рис. 3, а). В части почечных клубочков отмечалась слабо выраженная пролиферация мезангиальных клеток (до 6 в дольке) без увеличения объема мезангиального матрикса; очаговое набухание клеток наружного листка капсулы нефрона (рис. 3, б). В основании крипт слизистой оболочки подвздошной кишки определяются крупные трапециевидные клетки с крупными эозинофильными гранулами в апикальной части и темным ядром в ба- зальных отделах – клетки Панета. Солитарные лимфатические узелки - крупные с большими реактивными центрами, широкими клеточными мантийными зонами, из собственной пластинки они проникают в подслизистую основу. Пейеровы бляшки распространяются из собственной пластинки слизистой в подслизистую основу. В месте расположения крупных пейеровых бляшек просвет кишки резко сужен. Лимфатические узелки между ворсинами выпячивают слизистую оболочку в просвет кишки в виде купола, который покрыт низкими эпителиоцитами с большим количеством лимфоцитов, макрофагов (рис. 3, в). В подслизистой основе небольшой отек, умеренная инфильтрация из эозинофилов, макрофагов, лимфоцитов и плазматических клеток.
У животных 3-й группы (доза диоксида кремния 1 мг/кг массы тела) гепатоциты печени находятся в состоянии очаговой пылевидной и мелкокапельной жировой дистрофии: в цитоплазме клеток множественные мелкие прозрачные
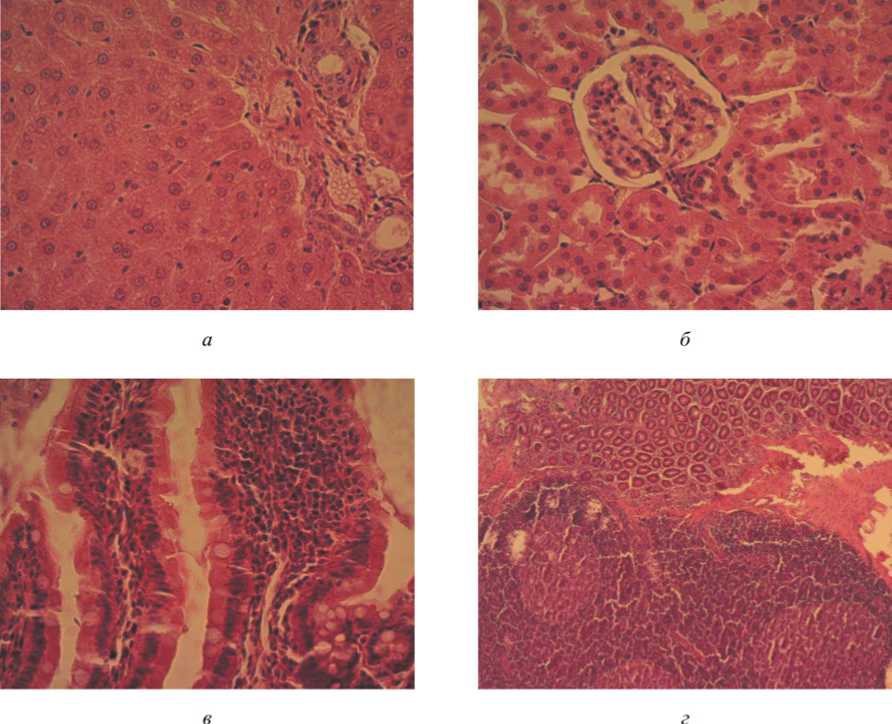
Рис. 2. Репрезентативные микрофотографии крысы группы 1 (контроль) (окраска гематоксилином и эозином, ув. ×200 ( а , г ), ×400 ( б , в )): а – печень, б – почки; в, г – подвздошная кишка
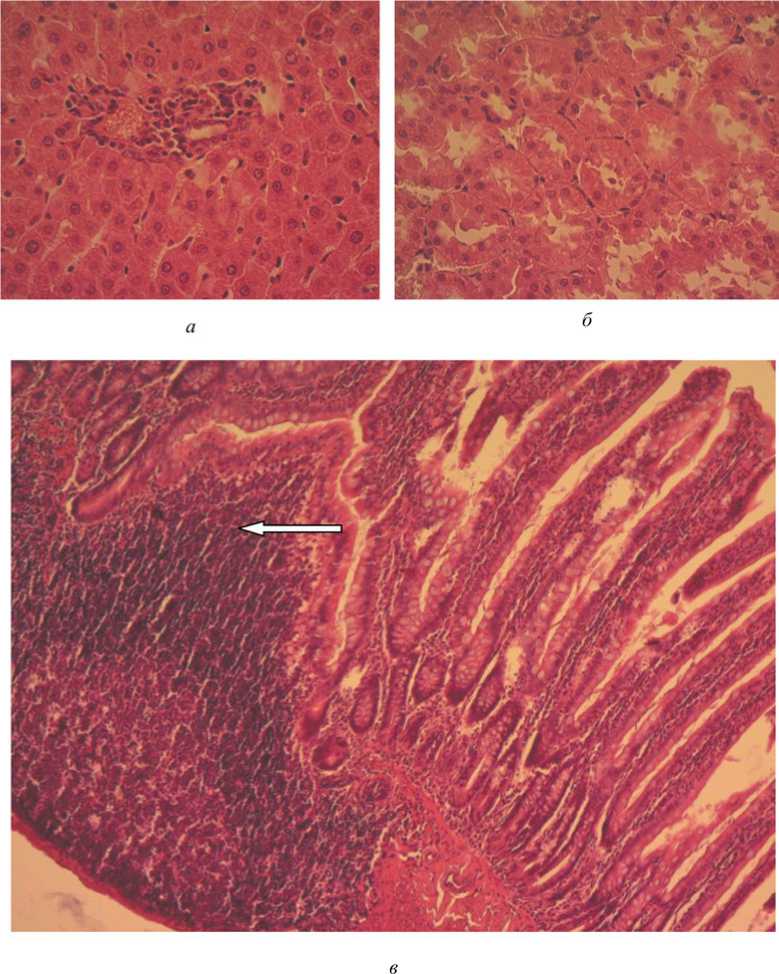
Рис. 3. Репрезентативные микрофотографии крысы группы 2 (диоксид кремния 0,1 мг/кг массы тела) (окраска гематоксилином и эозином, ув. ×200 ( а , б ); ×400 ( в )): а – печень; б – почки;
в – подвздошная кишка. Стрелкой показана межузелковая лимфоидная ткань
капли с четкими контурами, встречаются гепатоциты с двумя ядрами. В портальных трактах и синусоидах отмечается инфильтрация лимфоцитов, макрофагов, плазматических клеток с примесью единичных эозинофилов (рис. 4, а). В почках животных данной группы признаков пролиферации мезангиальных клеток и клеток наружного листка капсулы не наблюдалось. В единичных клубочках отмечено очаговое набухание клеток наружного листка капсулы (рис. 4, б). В слизистой оболочке подвздошной кишки ворсины разной формы и ширины из-за неравномерного отека и клеточной инфильтрации из лимфоцитов, макрофагов и многочисленных эозинофилов (рис. 4, в). В собственной пластинке присутствуют скопления лимфоцитов, макрофагов, плазматических клеток, множественные эозинофилы. В основании крипт большие скопления клеток Панета. Солитарные фолликулы и фолликулы пейеровых бляшек крупные, с большими реактивными центрами и широкими мантийными зонами, переходящими в межузелковую лимфоидную ткань. Фолликулы из слизистой оболочки распространяются на
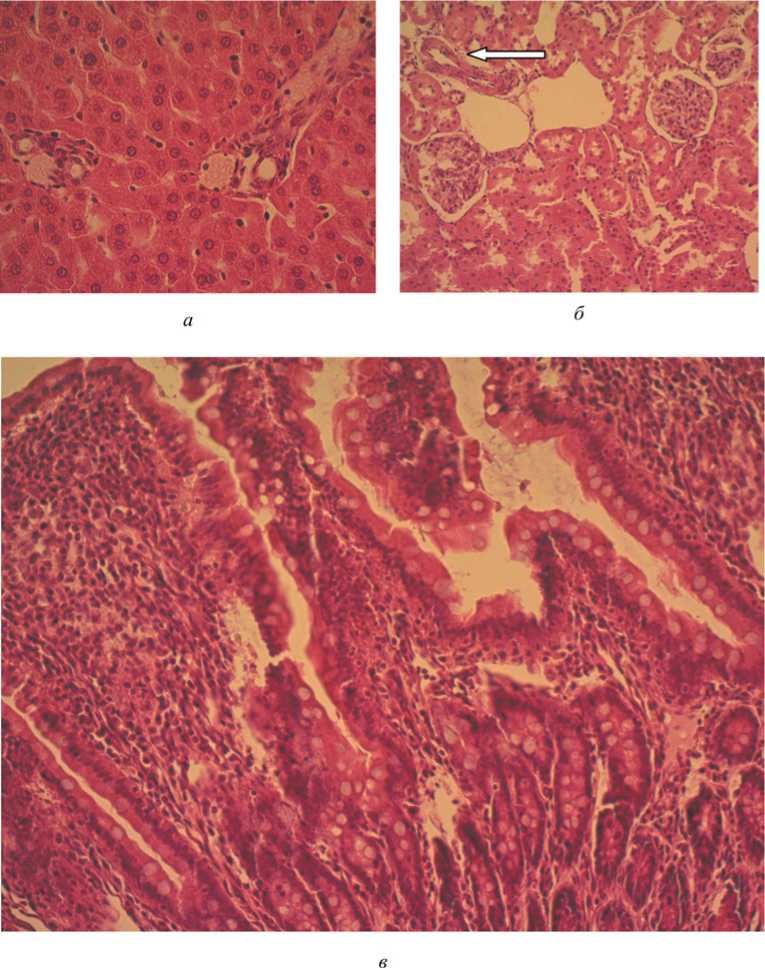
Рис. 4. Репрезентативные микрофотографии крысы группы 3 (диоксид кремния 1,0 мг/кг массы тела) (окраска гематоксилином и эозином, ув. ×200 ( а , б ), ув. ×400 ( в )): а – печень; б – почки, стрелкой показана вена; в – подвздошная кишка
подслизистую основы и резко истончают мышечную оболочку. В проекции пейеровых бляшек крипты неглубокие или отсутствуют, а ворсины короткие и неправильной формы. Лимфоидные узелки образуют выпячивания слизистой оболочки между ворсин в виде купола, покрытого низкими эпителиоцитами с большим количествам лимфоцитов, макрофагов. В подслизистой основе скопления лимфоцитов, макрофагов, плазматических клеток и большого количества эозинофилов.
У животных 4-й группы (доза диоксида кремния 10 мг/кг массы тела) гепатоциты име- ют многоугольную форму, одно или два ядра с мелкодисперсным хроматином, конденсированным у ядерной мембраны, хорошо видимыми ядрышками. Цитоплазма гепатоцитов зернистая (рис. 5, а). Портальные тракты содержат выраженную инфильтрацию из эозинофилов, макрофагов, лимфоцитов и плазматических клеток, часть клеток инфильтрата проникает в перипортальные синусоиды. В почках в части клубочков слабо выраженная пролиферация мезангиальных клеток (до 6 в дольке) без увеличения объема мезангиального матрикса (рис. 5, б). Признаков пролиферации клеток
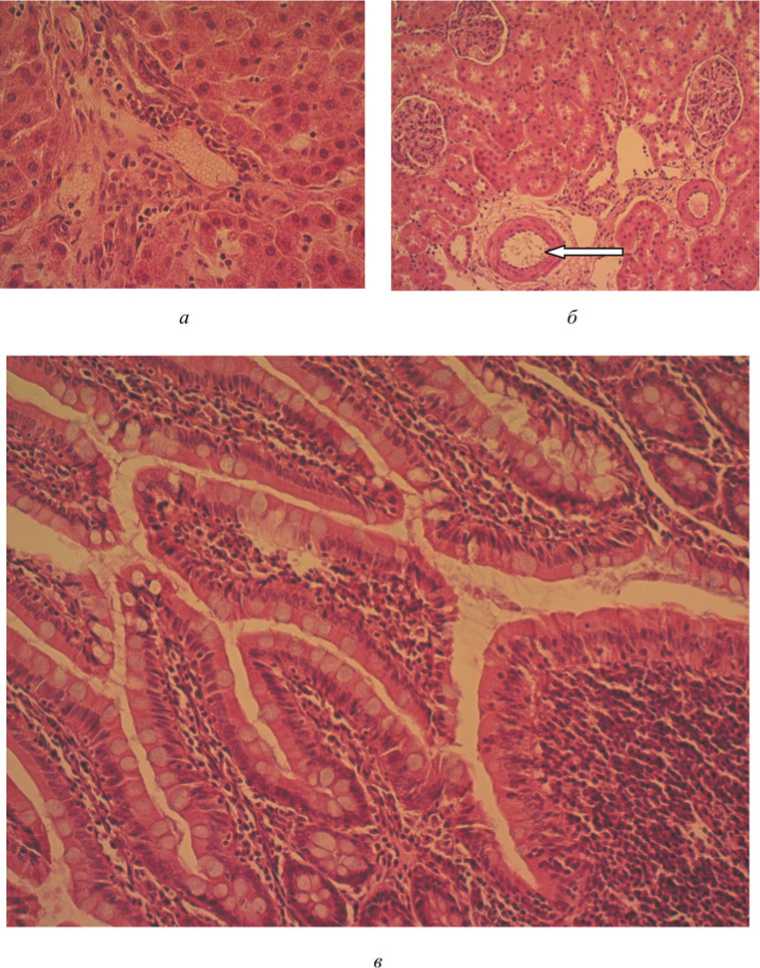
Рис. 5. Репрезентативные микрофотографии крысы группы 4 (диоксид кремния 10 мг/кг массы тела) (окраска гематоксилином и эозином, ув. ×200 ( а , б ); ув. ×400 ( в )): а – печень; б – почки, стрелкой показана артерия; в – подвздошная кишка, стрелкой показаны клетки Панета
наружного листка капсулы нет. В подвздошной кишке в собственной пластинке слизистой небольшой отек, умеренно выраженная лимфомакрофагальная инфильтрация с примесью значительного количества эозинофилов и плазматических клеток. В основании крипт кишечного эпителия хорошо дифференцируются скопления клеток Панета (рис. 5, в). Солитарные фолликулы крупные, из собственной пластинки проникают в подслизистую основу. Пейеровы бляшки содержат широкие клеточные скопления межузелковой лимфоидной ткани. В про- екции пейеровых бляшек крипты неглубокие или отсутствуют, ворсины короткие и неправильной формы. Лимфатические узелки образуют выпячивания слизистой оболочки между ворсин в виде купола, который покрыт низким призматическим эпителием с большим количеством лимфоцитов, макрофагов. В подслизистой основе умеренно выраженный отек, диффузная лимфомакрофагальная инфильтрация с примесью большого количества эозинофилов. Мышечная оболочка в проекции лимфатических фолликулов резко истончена.
■-•; *•■•.,• .эдй»
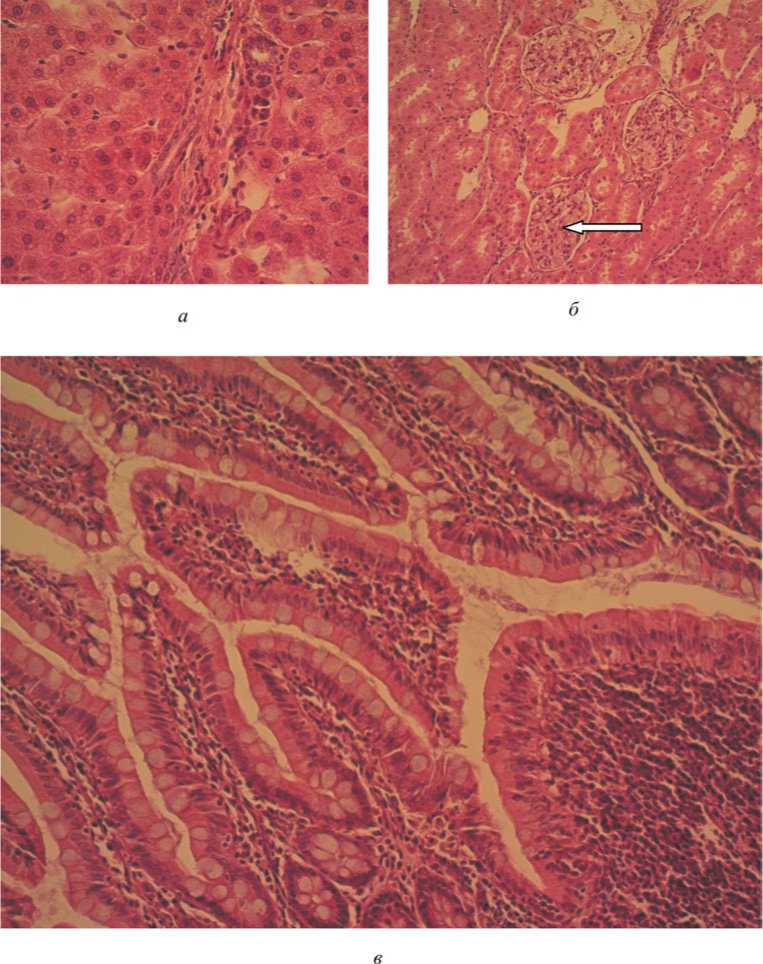
Рис. 6. Репрезентативные микрофотографии крысы группы 5 (диоксид кремния 100 мг/кг массы тела) (окраска гематоксилином и эозином, ув. ×200 ( а , б ); ув. ×400 ( в )): а – печень; б – почки, стрелкой показана артерия; в – подвздошная кишка
У животных 5-й группы (доза диоксида кремния 100 мг/кг массы тела) в печени гепатоциты имеют многоугольную форму, одно или два ядра с мелкодисперсным хроматином, конденсированным у ядерной мембраны, хорошо видимыми ядрышками. Цитоплазма гепатоцитов грубо зернистая эозинофильная (рис. 6, а). Портальные тракты содержат умеренно выраженную инфильтрацию из эозинофилов, макрофагов, лимфоцитов. Клетки Купфера крупные, неправильной формы, преобладают пери-портально. В почках в части клубочков слабо выраженная пролиферация мезангиальных кле- ток (до 6 в дольке) с незначительным увеличением объема мезангиального матрикса. Признаков пролиферации клеток наружного листка капсулы нет (рис. 6, б). В подвздошной кишке на всем протяжении эпителия слизистой оболочки хорошо дифференцируется интраэпителиальная лимфоидная ткань, представленная одиночно расположенными лимфоцитами. У ворсин варьируются ширина и форма из-за разной выраженности отека и воспалительной инфильтрации, состоящей из макрофагов, лимфоцитов, эозинофилов (рис. 6, в). Собственная пластинка слизистой содержит большое коли- чество макрофагов, лимфоцитов, плазматических клеток, эозинофилов. В основании крипт хорошо дифференцируются скопления клеток Панета. Солитарные лимфатические узелки крупные, с большими светлыми преобладающими реактивными центрами, широкими клеточными мантийными зонами; из собственной пластинки проникают в подслизистую основу. Пейеровы бляшки содержат до 8 крупных вторичных фолликулов и скопления межузелковой лимфоидной ткани, располагаются не только в собственной пластинке, но и в подслизистой основе. В проекции пейеровых бляшек крипты неглубокие или вообще отсутствуют, а ворсины короткие и неправильной формы. Лимфатические узелки между ворсин выпячивают слизистую оболочку в просвет в виде купола, который покрыт низкими эпителием (М-клетки) с большим количеством лимфоцитов, макрофагов. Реактивные центры фолликулов содержат центроциты, центробласты, иммунобласты, большое количество макрофагов. Мантийные зоны и межузелковая лимфоидная ткань представлены малыми лимфоцитами с мелкими темными ядрами, узким ободком цитоплазмы, макрофагами. Подслизистая основа представлена рыхлой волокнистой соединительной тканью, местами содержит скопления лимфоцитов, диффузно расположенные эозинофилы, макрофаги, плазматические клетки. В проекции лимфатических фолликулов мышечная оболочка резко истончена.
Результаты показывают, что в органах животных всех опытных групп отмечаются определенные изменения по сравнению с контрольной группой. В печени они представлены эозинофильной инфильтрацией портальных трактов, зернистостью цитоплазмы энтероци-тов (печень), в почках – относительно слабо выраженной очаговой дистрофией наружного листка капсулы нефрона. Эти изменения не демонстрируют определенной зависимости от дозы вводимого наноматериала и, как можно предположить, находятся в пределах возрастных изменений в указанных органах у животных старше 4 месяцев. Тем не менее направленность этих изменений, особенно в печени, свидетельствует об определенном усилении иммунной реакции, вызванной введением НЧ SiO2.
Наиболее выраженными являются изменения морфологии подвздошной кишки, состоящие в массивной лимфомакрофагальной и эозинофильной инфильтрации ворсинок, подслизистого слоя и собственной пластинки. Указанное усиление интенсивности иммунной реакции в стенке кишки, которое, возможно, является результатом раздражающего действия НЧ SiO2, нарастает монотонно во всем интервале доз НМ, что не позволяет с уверенностью установить его дозу, при которой эти изменения заведомо выходят за пределы показателей контрольной группы. Тем не менее достаточно очевидно, что при максимальной из доз (100 мг/кг массы тела) усиление иммунной реакции в стенке подвздошной кишки становится весьма значительным.
Таким образом, исследованный в работе аморфный SiO 2 широко используется в пищевой промышленности в качестве пищевой добавки Е551 с функцией антислеживающего агента и носителя. Согласно ТР ТС 029/2012, допускается использование Е551 в составе таких видов пищевой продукции, как пряности (не более 30 г/кг), продукты, плотно обернутые фольгой (30 г/кг), продукты сухие порошкообразные, включая сахарную пудру (10 г/кг), сыры и их заменители (10 г/кг), соль и ее заменители (10 г/кг), ароматизаторы (50 г/кг). В составе продуктов детского питания допускается использование Е551 в количестве до 10 г/кг, если эта пищевая добавка вносится в готовый продукт в составе другого сырьевого продукта. Норматив использования Е551 в составе сухих продуктов из зерновых (каш) для детского питания составляет 2 г/кг. В БАД к пище, сахаристых кондитерских изделиях (кроме шоколада) содержание Е551 не регламентируется и устанавливается технической документацией изготовителя. В подавляющем большинстве случаев наноразмерная структура применяемого диоксида кремния не декларируется производителями пищевой продукции, в связи с чем установить более или менее точные объемы потребления этого наноматериала с пищей не представляется возможным.
Как показало изучение острой токсичности наноразмерного SiO2 в эксперименте на мышах [7], при однократном внутрижелудоч-ном введении этого вещества через зонд в дозе до 10 000 мг/кг оно не вызывает гибели и явлений интоксикации животных. В гистологических препаратах ободочной и тощей кишки морфологические изменения отсутствовали.
С другой стороны, согласно результатам исследований на большом числе модельных систем in vitro, НЧ SiO2 цитотоксичны при контакте с клетками различных типов. Так, в работе [16] под действием этого НМ выявлено снижение жизнеспособности клеток эпителия бронхов человека линии Beas-2B, развитие процессов перекисного окисления, сдвиги в протеомном профиле ферментов внутриклеточного киназного каскада. Усиление продукции провоспалитель-ных цитокинов под действием НЧ аморфного SiO2 было установлено в двух линиях эпителиальных и эндотелиальных клеток легкого [19]. Нарушение баланса синтеза окиси азота и пероксинитрита в клетках эндотелия сосудов, обработанных этими НЧ, было обнаружено в исследовании [14]. Согласно результатам работы [20], НЧ аморфного SiO2 в клетках человека линии MCF-7 были дозозависимо цитотоксичны, а в нелетальных концентрациях вызывали гиперэкспрессию глутатион-S-трансферазы-1. Под действием НЧ SiO2 наблюдался эффект агрегации тромбоцитов, опосредуемый влиянием на баланс окиси азота и пероксинитрита [13].
НЧ SiO2 вызывали повреждение клеток линии EAHY926, притом, что аналогичные частицы субмикронного размера (100–330 нм) не были токсичны [26]. В культуре стволовых клеток эмбриона мыши наноразмерный SiO 2 с диаметром частиц 10 и 30, но не 80 нм, подавлял дифференцировку в кардиомиоциты [18]. Апоптоз и изменения в экспрессии р53, Вах и Bcl-2 под действием НЧ SiO 2 размером 21 нм были выявлены в гепатоцитах линии L-02 [21]. В культуре Купферовских макрофагов печени крыс данный вид НЧ вызывал высвобождение больших количеств реакционноспособных форм кислорода, оксида азота и TNF- α [15]. Способность рассматриваемых НЧ стимулировать процессы аутофагии в клетках эндотелия установлена в исследовании [24].
При внутрибрюшинном введении НЧ аморфного SiO2 в очень высоких дозах (вплоть до 2 г/кг массы тела) отмечали сдвиги в функции перитонеальных макрофагов, повышение продукции IL-1β, TNF-α, NO, экспрессию генов IL-1,6, TNF-α, синтазы окиси азота, циклооксигеназы-2 [22]. При внутривенном введении НЧ кремнезема диаметром 70 нм были гепатотоксичны для крыс в дозе 30 мг/кг [23]. При таком же способе введения наноматериала мышам в дозе 2–50 мг/кг массы тела были выявлены изменения пропорции CD3+, CD45+, CD4+ и CD8+ клеток в селезенке, сдвиги в уровнях общих иммуноглобулинов классов IgG и IgM [28]. По данным [29] НЧ SiO2 были способны усиливать интраназальную аллергическую сенсибилизацию мышей модельным аллергеном овальбумином. Аналогичные данные на модели бронхиальной астмы у крыс, вызываемой сенсибилизацией к овальбумину, получены в исследовании [12].
В работе [27] изучали подострую (в 84-дневном эксперименте) токсичность двух видов на-ноструктурированного SiO2 при пероральном введении крысам в дозах от 100 до 2500 мг/кг массы тела. Попытка количественно оценить всасывание и бионакопление SiO2 в органах и тканях методом масс-спектрометрии привела к неоднозначным результатам ввиду высокого фонового уровня кремния в органах животных контрольной группы. Однако качественно было констатировано достоверное увеличение содержания кремния в печени и селезенке животных, получавших НЧ в наибольшей дозе. Было отмечено дозозависимое усиление фиброза и экспрессии генов, ответственных за этот процесс, в печени. По этим показателям авторы оценивают пороговую дозу (LOAEL) НЧ SiO2 при подострой пероральной экспозиции величиной 2500 мг/кг массы тела, а максимальную недействующую дозу (NOAEL) – более 100 мг/кг массы тела. Недостатком цитируемой работы (отмечаемым самими авторами) являются очень высокие дозы вводимых животным НЧ, которые ни в каком отношении не соотносятся с возможной реальной экспозицией через пищу, составляющей, по оценкам авторов, около 1,8 мг/кг массы тела в день.
В совместных исследованиях ФГБНУ «Научно-исследовательский институт питания» и ФБУН «Федеральный научный центр медикопрофилактических технологий управления рисками здоровью населения» была проанализирована подострая пероральная токсичность для крыс и мышей производимого промышленностью наноструктурного SiO 2 типа «Аэросил» (с размером НЧ 20–60 нм) в эксперименте продолжительностью до 92 суток. Как показали результаты исследований, представленные в работах [7–11], у животных, получавших НЧ SiO 2 , отмечалась выраженная лейкопения, достоверное снижение доли Т-хелперов и возрастание доли цитотоксических лимфоцитов, уменьшение иммунорегуляторного индекса (CD4/CD8), дисбаланс цитокинов, проявлявшийся в достоверном многократном возрастании уровня TNF- α и выраженном снижении IL-10. Пороговая доза токсического воздействия НЧ SiO 2 при 92-суточной пероральной экспозиции у крыс составила в соответствии с изученными показателями 100 мг/кг массы тела в сутки.
Полученные в настоящем исследовании морфологические данные свидетельствуют о том, что при введении в этих же условиях нанораз-мерного SiO2 в желудочно-кишечный тракт животных в их подвздошной кишке развивается выраженная иммунная реакция, распространяющаяся на ассоциированную со стенкой кишки лимфоидную ткань и состоящая в массивной лимфомакрофагальной и эозинофильной инфильтрации ворсинок, без видимого нарушения структуры их эпителиального пласта, что косвенно указывает на отсутствие нарушений барьерной функции кишечного эпителия и согласуется с ранее полученными данными работы [8]. Исходя из вышеприведенных данных исследования НЧ SiO2 в системах in vitro и in vivo, можно предположить, что пусковым механизмом такой реакции является поглощение НЧ межэпителиальными и (или) входящими в состав лимфатических фолликул макрофагами, с последующей реакцией «респираторного взрыва», гиперпродукцией реакционноспособных свободнорадикальных производных кислорода и выработкой провоспалительных цитокинов и хемоки-нов, вызывающих привлечение и активацию им- мунных клеток различных типов. Следствием такой реакции может быть развитие системного воспаления, проявляющегося в вышеуказанных сдвигах в функции Т-клеточного иммунитета. Вместе с тем для выяснения деталей процесса развития местной иммунной реакции в стенке тонкой кишки под действием НЧ SiO2 необходимы дополнительные исследования, в том числе на ультраструктурном уровне.
Выводы. Проведенные исследования на светооптическом уровне выявили признаки токсического действия НЧ SiO2 с удельной площадью поверхности 300 м2/г на организм животных при пероральном введении в дозах 0,1–100 мг/кг массы тела в течение 92 суток, проявляющиеся, в первую очередь, в развитии иммунной и (или) воспалительной реакции в тонкой кишке. Полученные результаты указывают на возможные риски для здоровья человека при использовании диоксида кремния (SiO 2 ) с удельной площадью поверхности 300 м2/г и выше в составе пищевой продукции в качестве пищевой добавки.
Список литературы Влияние наночастиц диоксида кремния на морфологию внутренних органов у крыс при пероральном введении
- Меркулов Г.А. Курс патологогистологической техники. -Л.: Медицина, Ленинградское отделение, 1969. -424 с.
- Методические подходы к оценке безопасности наноматериалов/Г.Г. Онищенко, А.И. Арчаков, В.В. Бессонов, Б.Г. Бокитько, А.Л. Гинцбург, И.В. Гмошинский, А.И. Григорьев, Н.Ф. Измеров, М.П. Кирпичников, Б.С. Народицкий, В.И. Покровский, А.И. Потапов, Ю.А. Рахманин, В.А. Тутельян, С.А. Хотимченко, К.В. Шайтан, С.А. Шевелева//Гигиена и cанитария. -2007. -№ 6. -С. 3-10.
- Микроскопическая техника: руководство/под ред. Д.С. Саркисова и Ю.Л. Петрова. -М.: Медицина, 1996. -544 с.
- МУ 1.2.2520-09. Токсиколого-гигиеническая оценка безопасности наноматериалов: методические указания. -М.: Федеральный центр гигиены и эпидемиологии Роспотребнадзора, 2009. -35 с.
- Об утверждении правил лабораторной практики: Приказ Минздравсоцразвития России № 708Н от 23.08.2010 г. . -URL: http://www.consultpharma.ru/index.php/ru/documents/drugs/299-708-23-2010 (дата обращения: 10.10.2016).
- Онищенко Г.Г., Тутельян В.А. О концепции токсикологических исследований, методологии оценки риска, методов идентификации и количественного определения наноматериалов//Вопросы питания. -2007. -Т. 76, № 6. -С. 4-8.
- Токсикологическая оценка наноструктурного диоксида кремния. Параметры острой токсичности/Н.В.Зайцева, М.А.Землянова, В.Н. Звездин, Довбыш А.А., И.В. Гмошинский, С.А. Хотимченко, И.В. Сафенкова, Т.И. Акафьева//Вопросы питания. -2014. -Т. 83, № 2. -С. 42-49.
- Токсикологическая оценка наноструктурного диоксида кремния. I. Интегральные показатели, аддукты ДНК, уровень тиоловых соединений и апоптоз клеток печени/А.А. Шумакова, Е.А. Арианова, В.А. Шипелин, Ю.С. Сидорова, А.В. Селифанов, Э.Н. Трушина, О.К. Мустафина, И.В. Сафенкова, И.В. Гмошинский, С.А. Хотимченко, В.А. Тутельян//Вопросы питания. -2014. -Т. 83, № 3. -С. 52-62.
- Токсикологическая оценка наноструктурного диоксида кремния. II. Энзимологические, биохимические показатели, состояние системы антиоксидантной защиты/А.А. Шумакова, Л.И. Авреньева, Г.В. Гусева, Л.В. Кравченко, С.Х. Сото, И.В. Ворожко, Т.Б. Сенцова, И.В. Гмошинский, С.А. Хотимченко, В.А. Тутельян//Вопросы питания. -2014. -Т. 83, № 4. -С. 58-66.
- Токсикологическая оценка наноструктурного диоксида кремния. III. Микроэкологические, гематологические показатели, состояние системы иммунитета/А.А. Шумакова, Н.Р. Ефимочкина, Л.П. Минаева, И.Б. Быкова, С.Ю.Батищева, Ю.М. Маркова, Э.Н. Трушина, Мустафина О.К., Н.Э. Шаранова, И.В. Гмошинский, Р.А. Ханферьян, С.А. Хотимченко, С.А.Шевелева, В.А. Тутельян//Вопросы питания. -2015. -Т. 84, № 4. -С. 55-65.
- Токсикологическая оценка наноструктурного диоксида кремния. IV. Иммунологические и аллергологические показатели у животных, сенсибилизированных пищевым аллергеном, и заключительное обсуждение/А.А. Шумакова В.А. Шипелин, Э.Н. Трушина, О.К. Мустафина, И.В. Гмошинский, Р.А. Ханферьян, С.А. Хотимченко, В.А. Тутельян//Вопросы питания. -2015. -Т. 84, № 5. -С. 102-111.
- Adverse Effect of Nano-Silicon Dioxide on Lung Function of Rats with or without Ovalbumin Immunization/B. Han, J. Guo, T. Abrahaley //PLoS One. -2011. -Vol. 6, № 2. -P. e17236.
- Amorphous silica nanoparticles aggregate human platelets: potential implications for vascular homeostasis/J.J. Corbalan, C. Medina, A. Jacoby //Int. J. Nanomedicine. -2012. -Vol. 7. -P. 631-639.
- Amorphous silica nanoparticles trigger nitric oxide/peroxynitrite imbalance in human endothelial cells: inflammatory and cytotoxic effects/J.J. Corbalan, C. Medina, A. Jacoby //Int. J. Nanomedicine. -2011. -Vol. 6. -P. 2821-2835.
- Chen Q., Xue Y., Sun J. Kupffer cell-mediated hepatic injury induced by silica nanoparticles in vitro and in vivo//Int. J. Nanomedicine. -2013. -Vol. 8. -P. 1129-1140.
- Eom H.-J., Choi J. SiO2 Nanoparticles Induced Cytotoxicity by Oxidative Stress in Human Bronchial Epithelial Cell, Beas-2B//Environ. Health Toxicol. -2011. -Vol. 26. -P. e2011013.
- Guide for the care and use of laboratory animals. Eighth Edition/Committee for the Update of the Guide for the Care and Use of Laboratory Animals; Institute for Laboratory Animal Research (ILAR); Division on Earth and Life Studies (DELS); National Research Council of the national academies. -Washington: The National Academies Press, 2011. -246 p. . -URL: https://grants.nih.gov/grants/olaw/Guide-for-the-Care-and-use-of-laboratory-animals.pdf (дата обращения: 10.10.2016).
- In vitro developmental toxicity test detects inhibition of stem cell differentiation by silica nanoparticles/M.V. Park, W. Annema, A. Salvati, A. Lesniak, A. Elsaesser, C. Barnes, G. McKerr, C.V. Howard, I. Lynch, K.A. Dawson, A.H. Piersma, W.H. de Jong//Toxicol. Appl. Pharmacol. -2009. -Vol. 240, № 1. -P. 108-116.
- Inflammatory and cytotoxic responses of an alveolar-capillary coculture model to silica nanoparticles: Comparison with conventional monocultures/J. Kasper, M.I. Hermanns, C. Bantz //Part. Fibre Toxicol. -2011. -Vol. 8. -Р. 6.
- Microsomal glutathione transferase 1 protects against toxicity induced by silica nanoparticles but not by zinc oxide nanoparticles/J. Shi, H.L. Karlsson, K. Johansson //ACS Nano. -2012. -Vol. 6, № 3. -P. 1925-1938.
- Nano-SiO2 induces apoptosis via activation of p53 and Bax mediated by oxidative stress in human hepatic cell line/Y. Ye, J. Liu, J. Xu, L. Sun, M. Chen, M. Lan//Toxicol. In Vitro. -2010. -Vol. 24, № 3. -P. 751-758.
- Park E.J., Park K. Oxidative stress and pro-inflammatory responses induced by silica nanoparticles in vivo and in vitro//Toxicol. Lett. -2009. -Vol. 184, № 1. -P. 18-25.
- Silica nanoparticles as hepa-totoxicants/H. Nishimori, M. Kondoh, K. Isoda //Eur. J. Pharm. Biopharm. -2009. -Vol. 72, № 3. -P. 496-501.
- Silica nanoparticles enhance autophagic activity, disturb endothelial cell homeostasis and impair angiogenesis/J. Duan, Yo. Yu, Ya. Yu, Y. Li, P. Huang, X. Zhou, S. Peng, Z. Sun//Part. Fibre Toxicol. -2014. -Vol. 11, № 1. -P. 50.
- Silicon dioxide, amorphous. Rome: JECFA. -1973-1992. -2 p. . -URL: http://www. fao.org/fileadmin/user_upload/jecfa_additives/docs/Monograph1/Additive-385.pdf (дата обращения: 10.10.2016).
- Size-dependent cytotoxicity of monodisperse silica nanoparticles in human endothelial cells/D. Napierska, L.C. Thomassen, V. Rabolli, D. Lison, L. Gonzalez, M. Kirsch-Volders, J.A. Martens, P.H. Hoet//Small. -2009. -Vol. 5, № 7. -P. 846-853.
- Sub-chronic toxicity study in rats orally exposed to nanostructured silica/M. van der Zande, R.J. Vandebriel, M.J. Groot, E.Kramer, Z.E.H. Rivera, K.Rasmussen, J.S.Ossenkoppele, P. Tromp, E.R. Gremmer, R.J.B. Peters, P.J. Hendriksen, H.J.P. Marvin, R.L.A.P. Hoogenboom, A.A.M. Peijnenburg, H. Bouwmeester//Part. Fibre Toxicol. -2014. -Vol. 11. -P. 8.
- The comparative immunotoxicity of mesoporous silica nanoparticles and colloidal silica nanoparticles in mice/S. Lee, M.-S. Kim, D. Lee, T.K. Kwon, D. Khang, H.-S.Yun, S.-H. Kim//Int. J. Nanomedicine. -2013. -Vol. 8. -P. 147-158.
- Yoshida T., Yoshioka Y., Fujimura M. et al. Promotion of allergic immune responses by intranasally-administrated nanosilica particles in mice//Nanoscale Res. Lett. -2011. -Vol. 6, № 1. -P. 192-204.


