Влияние наночастиц металлов на чувствительность к антибиотикам клинических штаммов Escherichia coli
Автор: Мамонова И.А., Бабушкина И.В., Гладкова Е.В.
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Медико-биологические науки
Статья в выпуске: 4, 2014 года.
Бесплатный доступ
Устойчивость микроорганизмов к антибиотикам представляет в настоящее время серьезную проблему. В работе проведено изучение антибиотикочувствительности клинических штаммов микроорганизмов после воздействия наночастиц меди, никеля, титана и марганца. Наноча-стицы меди оказывают генотоксическое действие в отношении грамотрицательных микроорганизмов, способствующее восстановлению чувствительности штаммов Escherichia coli к ряду бета-лактамных антибиотиков, в частности, к пенициллинам расширенного действия и ин-гибиторозащищенным пенициллинам, а также аминогликозидам (гентамицин). Воздействие наночастиц никеля, титана и марганца не приводило к статистически достоверным изменениям антибиотикочувствительности клинических штаммов Escherichia coli.
Антибиотикорезистентность, наночастицы, медь, никель, титан, марганец
Короткий адрес: https://sciup.org/147204689
IDR: 147204689 | УДК: 620.18:616-093/-098:579.842.11
Текст научной статьи Влияние наночастиц металлов на чувствительность к антибиотикам клинических штаммов Escherichia coli
В настоящее время устойчивость микроорганизмов к антибиотикам представляет серьезную проблему. Ежегодно в странах Европейского союза около 25 тыс. человек умирают от инфекций, вызванных антибиотикорезистентными штаммами микроорганизмов [Draft guidelines…, 2010].
Основными генетическими механизмами формирования резистентности у микроорганизмов являются модификация собственных генов, кодирующих мишень действия антибиотиков в клетке, а также приобретение новых генетических элементов (плазмиды, транспозоны и др.). В последнее время наряду с поиском альтернативных антибактериальных средств актуален вопрос о разработке средств, препятствующих селекции антибиотико-резитстентных штаммов микроорганизмов, также способствующих повышению чувствительности микроорганизмов к антибактериальным препаратам.
В ряде работ предложены способы повышения чувствительности микроорганизмов к антибиотикам путем воздействия различных средств и химических препаратов, протеолитических бактериальных ферментов, ферментов животного происхождения [Средство для повышения чувствительности…, 2003, 2004, 2005].
В настоящее время в литературе описано 3 механизма антибактериального действия наночастиц металлов, один из которых заключается в поглощении клеткой ионов металлов, приводящих к на- рушению репликации и разрушению молекулы ДНК. Генотоксическое действие наночастиц металлов может быть направлено не только на ДНК нуклеоида, но и на дополнительные внехромосом-ные генетические элементы бактериальной клетки, такие как R-плазмиды, несущие основную генетическую информацию о приобретенной устойчивости микроорганизмов. Такой механизм действия наночастиц металлов может привести к разрушению плазмидной ДНК бактериальной клетки и как следствие к восстановлению антибиотикочувстви-тельности микроорганизма [Kotra et al., 1999; Lok et al., 2006; Kim et al., 2007; 8, Quillan, 2010].
В связи с вышесказанным целью исследования явилось изучение антибиотикочувствительности клинических штаммов микроорганизмов до и после воздействия наночастиц металлов.
Материалы и методы
В работе использовали наночастицы переходной группы металлов: меди, никеля, титана и марганца (ТУ 1733-056-00209013-2008), синтезированные на плазмохимическом комплексе филиала ФГУП РФ «Государственный научно-исследовательский институт химии и технологии элементоорганических соединений» (ФГУП РФ ГНЦ ГНИИХТЭОС г. Москва). Наночастицы металлов характеризовались следующими физико-химическими свойствами: наночастицы меди – размер час-
тиц 75.71±3.11 нм, размер их агломератов – 114.6 нм, ζ-потенциал – 34.7 мВ, в состав поверхности наночастиц меди входит 26.58% кислорода, 8.88% углерода, 9.44% железа и 55.11% меди; размеры наночастиц никеля – 80.51±2.21 нм, размеры агломератов 1145 нм, ζ-потенциал – 3.51 мВ, в состав поверхности входит 7.72% кислорода, 12.29% серы, 15.84% бериллия и 64.15% никеля; размеры наночастиц титана – 42.86±2.21 нм, их агломератов – 1025 нм, ζ-потенциал – –13,9 мВ, в состав поверхности входит 37.93% кислорода, 6.12% серы, 10.46% углерода и 45.49% титана; размер наночастиц марганца – 68.71±4.12 нм, их агломератов – 912.1 нм, ζ-потенциал – 2.92 мВ, в состав поверхности входит 36.17% кислорода, 7.54% серы, 17.07% углерода и 39.22% марганца.
В исследовании использовали 20 штаммов Escherichia coli , выделенных от больных травматолого-ортопедического профиля с посттравматическими и послеоперационными осложнениями, находившихся на лечение ФГБУ «Саратовский научно-исследовательский институт травматологии и ортопедии» Минздрава России.
Изучение изменения чувствительности микроорганизмов к антибактериальным препаратам после воздействия наночастиц металлов проводили по нижеизложенной методике.
Готовили взвеси наночастиц металлов путем их внесения в 0.9%-ный раствор хлорида натрия до достижения концентрации 0.01 мг/мл. Смешивали 850 мкл взвеси наночастиц металлов с 50 мкл 0.1%-ного раствора ЭДТА (рН 7.2–7.4) (натриевая соль этилендиаминтетрауксусной кислоты, С 10 Н 14 О 8 N 2 Nа 2 ∙2Н 2 О) (Панеко, Россия). В приготовленную смесь добавляли 100 мкл взвеси микроорганизмов.
В качестве контроля использовали 0.9%-ный раствор хлорида натрия и смесь 0.9%-ного раствора хлорида натрия и ЭДТА. В контрольные пробирки вносили 100 мкл взвеси микроорганизмов и инкубировали в термошейкере (Sky Line ST-3 (ELMI, Латвия)) при 150 об/мин. и температуре 37°С в течение 60 мин.; 100 мкл полученной биомассы высевали на агаризованную питательную среду и инкубировали в термостате при температуре 37°С в течение 18–24 ч. На следующей день просматривали чашки с выросшей культурой и определяли чувствительность микроорганизмов к антибактериальным препаратам диско-диффузионным методом в соответствии с МУК 4.2.1890-04 Определение чувствительности микроорганизмов к антибактериальным препаратам. В исследовании использовали питательную среду Mueller-Hinton-Agar (Becton Dickinson, США) и сенси-диски с антибиотиками (Becton Dickinson, США).
Для всех исследуемых штаммов микроорганизмов до и после воздействия наночастиц металлов определен условный коэффициент резистентности по следующей формуле
K=R, N где K – коэффициент резистентности; R – количество антибиотиков, к которым исследуемый штамм резистентен (в том числе с промежуточной чувствительностью); N – общее число антибактериаль- ных препаратов, принятых в исследование.
Показатели коэффициента позволяют судить об относительной интегральной резистентности штаммов микроорганизмов к используемым в исследовании антибактериальным препаратам. Полученные показатели варьируют от 0 до 1. Нулевой показатель означает отсутствие резистентности у исследуемых штаммов микроорганизмов, 1 – наличие устойчивости ко всем препаратам, принятым в исследование [Гостев, Науменко, Мартель, 2010].
Статистическая обработка данных проводилась с использованием пакета программ Microsoft Excel 2010 и Statistica 6.0 [Реброва, 2006]. Взаимосвязь качественных признаков устанавливали путем выявления взаимной сопряженности. Для достижения поставленной цели рассчитан критерий χ2 с поправкой Йетса на непрерывность. Интерпретация результатов основывалась на следующем:
-
- если р>0.05, то нулевую гипотезу об отсутствии различий между группами по частоте признаков не отвергают;
-
- если р<0.05, то следует отклонить нулевую гипотезу и принять альтернативную гипотезу о существовании различий между группами по частоте изучаемого признака.
Результаты
Формулы набираются в редакторе Microsoft Equation с выравниванием по центру и пробелами сверху и снизу по 6 пт (номер формулы, если формул несколько, выравнивается по правому краю колонки):
Все штаммы E. coli , включенные в работу, подлежали исследованию на чувствительность к 13 антибактериальным препаратам 3 классов. В результате проведенного исследования установлен высокий уровень резистентности штаммов E. coli к профильным антибиотикам. Анализ данных показал устойчивость 19 из 20 исследуемых штаммов к 5 и более антибактериальным препаратам.
Чувствительность микроорганизмов к антибактериальным препаратам различных групп продемонстрирована на рисунке.
Как видно из рисунка, все исследуемые штаммы E. coli устойчивы к ингибиторозащищенному пенициллину (амоксициллин/клавуланату), 19 штаммов – к пенициллину расширенного сектра действия (ампициллину). Резистентность к цефалоспоринам определена у 17 штаммов микроорганизмов. Так, 17 штаммов оказались не чувствительными к цефазолину и цефтриаксону, 16 – к цефепиму, 14 – к цефтазидиму, 13 – к цефотаксиму и цефоперазону. Кроме того, 1 из исследуемых штаммов обладал промежуточной чувствительностью к цефазолину, 1 – к цефотаксиму, 1 – к цефтазидиму, 2 – цефоперазону. Выявлена устойчивость штаммов E. coli к аминогликозидам (13
штаммов показали устойчивость к амикацину, 10 – к гентамицину). Наиболее высокая активность в отношении штаммов E. coli наблюдалась у карба-пенемов (13 штаммов чувствительны к имипенему и меропенему) и хинолонов (12 штаммов чувствительны к ципрофлоксацину).
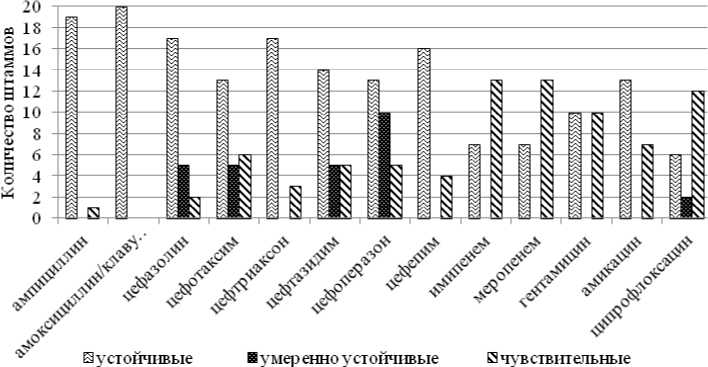
Антибиотикорезистентность клинических штаммов Escherichia coli
Изучено влияние наночастиц меди, никеля, титана и марганца на антибиотиотикочувствитель-ность клинических штаммов E. coli . В исследование включены две контрольные группы микроорганизмов, не подвергавшихся воздействию наночастиц металлов. В первой контрольной группе микроорганизмы инокулировали в 0.9%-ный раствор хлорида натрия, во второй – в 0.9%-ный раствор хлорида натрия с добавлением ЭДТА.
хлорида натрия с добавлением ЭДТА. Проведенный анализ результатов показал отсутствие статистически достоверных различий между контрольными группами исследования; в связи с этим сочли возможным объединить их в одну группу, и в дальнейшем показатели опытных групп сравнивали с усредненной цифрой. Полученные результаты представлены в таблице.
Устойчивость к антибиотикам клинических антибиотикорезистентных штаммов Escherichia coli
|
Антибиотик |
Количество штаммов, устойчивых к антибиотику |
||||||
|
Контроль с 0.9% раствором хлорида натрия (n=20) |
Контроль с ЭДТА (n=20) |
Усредненный контроль |
НЧ меди (n=20) |
НЧ никеля (n=20) |
НЧ титана (n=20) |
НЧ марганца (n=20) |
|
|
Ампициллин |
19 |
19 χ2 1 =0.53; p 1 =0.47 |
19 |
8 χ2 2 =11.40; p 2 =0.0007 |
18 χ2 2 =0; p 2 =1.0000 |
19 χ2 2 =0.53; p 2 =0.4682 |
19 χ2 2 =0.53; p 2 =0.4682 |
|
Амоксициллин/ клавуланат |
20 |
20 χ2 1 =0.0; p 1 =1.0000 |
20 |
11 χ2 2 =9.18; p 2 =0.0025 |
17 χ2 2 =1.44; p 2 =0.2299 |
20 χ2 2 =0; p 2 =1.0000 |
20 χ2 2 =0; p 2 =1.0000 |
|
Цефазолин |
18 |
18 χ2 1 =0.28; p 1 =0.5982 |
18 |
18 χ2 2 =0.28; p 2 =0.5982 |
18 χ2 2 =0.28; p 2 =0.5982 |
17 χ2 2 =0; p 2 =1.0000 |
18 χ2 2 =0.28; p 2 =0.5982 |
|
Цефотаксим |
14 |
14 χ2 1 =0.12; p 1 =0.7301 |
14 |
13 χ2 2 =0; p 2 =1.0000 |
14 χ2 2 =0.12; p 2 =0.7301 |
14 χ2 2 =0.12; p 2 =0.7301 |
14 χ2 2 =0.12; p 2 =0.7301 |
|
Цефтриаксон |
17 |
17 χ2 1 =0.20; p 1 =0.6579 |
17 |
17 χ2 2 =0.20; p 2 =0.6579 |
17 χ2 2 =0.20; p 2 =0.6579 |
17 χ2 2 =0.20; p 2 =0.6579 |
17 χ2=0.20; p 2 =0.6579 |
|
Цефтазидим |
15 |
15 χ2 1 =0.13; p 1 =0.7150 |
15 |
14 χ2 2 =0; p 2 =1.0000 |
15 χ2 2 =0.13; p 2 =0.7150 |
15 χ2 2 =0; p 2 =1.0000 |
15 χ2 2 =0; p 2 =1.0000 |
|
Цефоперазон |
15 |
15 χ2 1 =0.13; p 1 =0.7150 |
15 |
15 χ2 2 =0.13; p 2 =0.7150 |
14 χ2 2 =0; p 2 =1 |
15 χ2 2 =0.13; p 2 =0.7150 |
15 χ2 2 =0.13; p 2 =0.715 |
|
Цефипим |
16 |
16 χ2 1 =0.16; p 1 =0.6926 |
16 |
16 χ2 2 =0.16; p 2 =0.6926 |
16 χ2 2 =0.16; p 2 =0.6926 |
16 χ2 2 =0.16; p 2 =0.6926 |
16 χ2 2 =0.16; p 2 =0.6926 |
Окончание таблицы
Количество штаммов, устойчивых к антибиотику
|
Антибиотик |
Контроль с 0.9% раствором хлорида натрия (n=20) |
Контроль с ЭДТА (n=20) |
Усредненный контроль |
НЧ меди (n=20) |
НЧ никеля (n=20) |
НЧ титана (n=20) |
НЧ марганца (n=20) |
|
Имипенем |
7 |
7 χ2 1 =0.14; p 1 =0.7055 |
7 |
7 χ2 2 =0.14; p 2 =0.7055 |
7 χ2 2 =0.14; p 2 =0.7055 |
7 χ2 2 =0.14; p 2 =0.7055 |
7 χ2 2 =0.14; p 2 =0.7055 |
|
Меропенем |
7 |
7 χ2 1 =0.14; p 1 =0.7055 |
7 |
7 χ2 2 =0.14; p 2 =0.7055 |
7 χ2 2 =0.14; p=0.7055 |
7 χ2 2 =0.14; p 2 =0.7055 |
7 χ2 2 =0.14; p 2 =0.7055 |
|
Гентамицин |
10 |
10 χ21=0.10; р1=0.7518 |
10 |
0 χ22=10.80; р2=0.001 |
10 χ22=0.10; р2=0.7518 |
10 χ22=0.10; р2=0.7518 |
10 χ22=0.10; P=0.7518 |
|
Амикацин |
13 |
13 χ21=0.11; p1=0.7403 |
13 |
12 χ22=0; p2=1.0000 |
11 χ22=0.10; p2=0.7469 |
13 χ22=0.11; p2=0.7403 |
13 χ22=0.11; p2=0.7403 |
|
Ципрофлоксацин |
8 |
8 χ21=0.11; p1=0.7403 |
8 |
6 χ22=0.11; p2=0.7403 |
7 χ22=0; p2=1.0000 |
8 χ22=0.11; p2=0.7403 |
8 χ22=0.11; p2=0.7403 |
Примечание. χ2 – критерий с поправкой Йетса на непрерывность, р – показатель достоверности, χ21p1 – по срав- нению с группой контроля с 0.9%-ным раствором хлорида натрия, χ22p2 – по сравнению с группой усредненного контроля, n – количество наблюдений.
В результате проведенных исследований обнаружены статистически значимые изменения чувствительности клинических штаммов микроорганизмов после воздействия суспензии наночастиц меди в концентрации 0.01 мг/мл в течение 30 мин. к ампициллину, амиксициллину/клавуланату и гентамицину. Как видно из таблицы, у 11 из 19 резистентных к ампициллину штаммов чувствительность восстановилась к ампициллину (χ2= 11.40; p= 0.0007), у 9 из 20 – к амиксицилли-ну/клавуланату (χ2= 9.18; p= 0.0025). Кроме того, отмечено восстановление чувствительности к гентамицину всех 10 изначально резистентных клинических штаммов E. coli (χ2= 10.80; p= 0.001). Статистически достоверных изменений после воздействия наночастицами никеля, титана и марганца не обнаружено.
По результатам проведенных исследований рассчитан коэффициент резистентности клинических штаммов E. coli до и после воздействия наночастиц металлов. Полученные результаты позволяют судить об относительной интегральной устойчивости штаммов микроорганизмов к включенным в исследование антибиотикам. В контрольной группе микроорганизмов коэффициент резистентности составил 0.69±0.04. После воздействия наночастиц меди отмечено статистически значимое (р<0.05) снижение показателя до 0.55±0.04, что говорит о повышении чувствительности микроорганизмов к ряду исследуемых препаратов. После воздействия наночастиц никеля, титана и марганца статистически значимых различий с контрольной группой микроорганизмов не наблюдалось. Коэффициент резистентности клинических штаммов E. coli после воздействия наночастиц никеля составил 0.63±0.04, титана – 0.69±0.04, марганца – 0.69±0.04.
Заключение
В результате проведенного исследования установлено, что наночастицы меди способны восстанавливать чувствительность штаммов E. coli к некоторым бета-лактамным антибиотикам (ампициллину, амоксициллину/клавуланату) и аминогликозидам (гентамицину). Можно предположить, что наночастицы меди оказывают генотоксическое действие в отношении грамотрицательных микроорганизмов, способствующее восстановлению чувствительности штаммов E. coli к протии-вомикробным препаратам. Гены, ответственные за формирование резистентности к антибактериальным препаратам этих групп, в основном локализованы на плазмидной ДНК. В связи с этим можно предположить, что действие наночастиц меди в данном случае направлено именно на R-плазмиды бактериальной клетки, несущие гены, ответственные за формирование устойчивости к антибиотикам данных групп.
Воздействие наночастиц никеля, титана и марганца в концентрации 0,01 мг/мл в течение 30 мин. не приводило к статистически достоверным изменениям антибиотикочувствительности клинических штаммов E. coli .
На основании полученных данных разработан Способ повышения чувствительности микроорганизмов к антимикробным препаратам (патент РФ № 2529367, приор. от 19.04.2013 г.).
Список литературы Влияние наночастиц металлов на чувствительность к антибиотикам клинических штаммов Escherichia coli
- Гостев В.В., Науменко З.С., Мартель И.И. Антибио-тикорезистентность микрофлоры ран открытых переломов (II сообщение)//Травматология и ортопедия России. 2010. Т. 55, № 1. С. 33-37.
- Реброва О.Ю. Статистический анализ медицинских данных. Применение пакета программ Statistica. М.: МедиаСфера, 2006. 312 с.
- Средство для повышения чувствительности микроорганизмов к антимикробным препаратам/И.П. Корюкина, В.В. Сидоров, Ю.Н. Маслов ; заявитель и патентообладатель ЗАО «Усть-Качка»: пат. 2207863 Рос. Федерация, МПК7 A 61 B 33/00; заявл. 13.03.02; опубл. 10.07.03, Бюл. № 19. 3 с.
- Средство для повышения чувствительности микроорганизмов к антимикробным препаратам/В.В. Сидоров, И.П. Корюкина, А.В. Туев ; заявитель и патентообладатель ЗАО «Усть-Качка»: пат. 2230563 Рос. Федерация, МПК7 A 61 К 35/08, A 61 Р 31/00; заявл. 10.02.03; опубл. 20.06.04, Бюл. № 17. 4 с.
- Средство для повышения чувствительности микроорганизмов к антимикробным препаратам/В.В. Сидоров, И.П. Корюкина, Ю.Н. Маслов; заявитель и патентообладатель ЗАО «Усть-Качка»: пат. 2255746 Рос. Федерация, МПК7 A К 35/08, A 61 Р 43/00; заявл. 08.01.04; опубл. 10.07.05, Бюл. № 19. 4 с.
- Средство для повышения чувствительности микроорганизмов к антимикробным препаратам/И.П. Корюкина, И.В. Закачурина, Ю.Н. Маслов, А.Н. Макарян; заявитель и патентооблада-тель ЗАО «Усть-Качка»: пат. 2246541 Рос. Федерация, МПК7 С 12 Q 1/04, C 12 Q 1/18, C12 N1/36, A 61 K 35/08; заявл. 16.04.03; опубл. 20.02.05, Бюл. № 5. 6 с.
- Draft guidelines for risk analysis of foodborne antimicrobial resistance // Codex ad hoc intergovernmental task force on antimicrobial resistance: report of the fourth session, 18-22 october 2010 year [Электронный ресурс] // Codex Alimen-tarius Commission. Muju, Republic of Korea, 2010. P. 25-49. URL: http: //www. codexalimentarius. net/ download/report/746/REP11_AMe.pdf (дата обращения: 25.01.2014)
- Kim J.S. et al. Antimicrobial effects of silver nanoparticles//Nanomedicine. 2007. Р. 95-101.
- Kotra L.P. et al. Dynamics of the lipopolysaccharide assembly on the surface of Escherichia coli//Journal of the American Chemical Society. 1999. 121. Р. 8707-8711.
- Lok C.N. et al. Proteomic analysis of the mode of antibacterial action of silver nanoparticles//Journal of Proteome Research. 2006. 5. Р. 916-924.
- Quillan J. Bacterial-Nanoparticle Interactions: Thesis for the degree of Doctor of Philosophy in Biological Sciences. Exeter, 2010. Р. 211.


