Влияние нестероидных противовоспалительных препаратов (диклофенака, целекоксиба, нимесулида, диацереина) на ренальный транспорт мочевой кислоты у больных оксалатной нефропатией с сопутствующим гонартритом
Автор: Воронина Наталья Владимировна, Гельмутдинов Данир Данисович, Лемещенко Ольга Валентиновна
Журнал: Ульяновский медико-биологический журнал @medbio-ulsu
Рубрика: Клиническая медицина
Статья в выпуске: 1, 2023 года.
Бесплатный доступ
Цель. Оценка экскретируемой фракции мочевой кислоты у больных оксалатной нефропатией на ранних стадиях хронической болезни почек с гонартритом при курсовом лечении нестероидными противовоспалительными препаратами. Материалы и методы. В открытое сравнительное рандомизированное исследование было включено 192 женщины с оксалатной нефропатией и первичным гонартритом. Скорость клубочковой фильтрации составила более 60 мл/мин, ИМТ 23,4±1,8, возраст 51,4±2,3 года. Первая группа больных получала диклофенак натрия (4500 мг/мес.), вторая группа целекоксиб (6000 мг/мес.), третья группа нимесулид (6000 мг/мес.), четвертая группа диацереин (6000 мг за 2 мес.). Контрольную группу по каждому препарату составили больные с гонартритом, но без нефропатии и гиперурикемии, принимавшие препараты в тех же курсовых дозах. Оценку экскретируемой фракции мочевой кислоты у обследуемых проводили на 15, 30, 60-й дни наблюдения по общепринятым методикам. Результаты. При применении диклофенака наблюдались снижение экскретируемой фракции мочевой кислоты и гиперурикемия, снижение скорости клубочковой фильтрации. После отмены диклофенака показатели через месяц не вернулись к первоначальным значениям. Целекоксиб и нимесулид оказали незначительное влияние на изменение экскретируемой фракции мочевой кислоты и снижение скорости клубочковой фильтрации. Через месяц после их отмены показатели вернулись к исходным. Диацереин не влиял на ренальный транспорт мочевой кислоты. В контрольной группе больных достоверных изменений показателей не отмечено.
Диклофенак, целесоксиб, нимесулид, диацереин, мочевая кислота, оксалатная нефропатия
Короткий адрес: https://sciup.org/14127222
IDR: 14127222 | УДК: 616.61:615.276:616.72-007.248 | DOI: 10.34014/2227-1848-2023-1-27-42
Текст научной статьи Влияние нестероидных противовоспалительных препаратов (диклофенака, целекоксиба, нимесулида, диацереина) на ренальный транспорт мочевой кислоты у больных оксалатной нефропатией с сопутствующим гонартритом
Введение. В российских клинических рекомендациях по рациональному использованию нестероидных противовоспалительных препаратов (НПВП) [1] подчеркивается важность клинического мониторинга состояния больных, принимающих НПВП, для своевременного выявления неблагоприятных явлений, особенно у пациентов с факторами риска возможных осложнений (артериальная гипертония, гиповолемия, хроническая сердечная недостаточность, хроническая болезнь почек, прием ряда препаратов – ингибиторов АПФ, блокаторов медленных кальциевых каналов, диуретиков и др.) и с нефропатиями различного генеза.
НПВП в эквивалентных дозах обладают сходной анальгетической и противовоспалительной эффективностью, но их выбор должен определяться безопасностью в конкретных клинических условиях [2–5]. Применение НПВП у больных с уже имеющимися нефропатиями может вызывать прогрессирование почечного повреждения, негативно влиять на процессы, протекающие на уровне клубочков, снижая скорость клубочковой фильтрации (СКФ), и проксимальных канальцев, вызывая ренальную гиперурикемию [6–9].
Сформирована общая модель почечного транспорта уратов, согласно которой мочевая кислота, профильтровавшись в клубочках, подвергается активной реабсорбции, а затем активной секреции в проксимальных канальцах почек [10]. В настоящее время модель дополняется результатами исследований геномных ассоциаций (GWAS), экспрессионных систем биологических моделей, позволивших предположить взаимосвязь почечного транспорта мочевой кислоты и его нарушения с изменением функционирования уратных транспортеров URAT1 и GLUT9 в проксимальных канальцах почек человека [10–12]. НПВП, являясь слабыми органическими кислотами, секретируются в мочу через эпителий почечных канальцев с участием транспортеров органических анионов из семейства SLC22, располагающихся на базолатеральной мембране проксимальных почечных канальцев, и могут приводить к изменению их функционирования [12–15].
Диацереин является новым представителем НПВП, не относящимся к нефротоксичным препаратам, представляет собой ацетилированную форму реина, который, блокируя интерлейкин-1, снижает концентрацию металло-протеаз в хондроцитах при остеоартритах, стимулирует синтез простагландинов, гликозо-аминогликанов и гиалуроновой кислоты [3, 4]. Его рекомендуют в терапии хронической боли при остеоартрите у пациентов с противопоказаниями к НПВП [1]. Однако возможность его влияния на экскретируемую фракцию мочевой кислоты (EFUA) у больных с тубулоинтерстициальными нарушениями и кристаллу-рией целенаправленно не изучалась.
Нефропатия с оксалатно-кальциевой кри-сталлурией, именуемая оксалатной нефропатией (ОН), у взрослых чаще встречается при синдроме рецидивирующей вторичной гипероксалурии, характеризуется медленно прогрессирующим течением, клинически проявляется в периоды обострения заболевания умеренной гипероксалурией с оксалатно-кальцие-вой кристаллурией, микрогематурией и/или альбуминурией, прогрессирующим снижением функции канальцев, а в последующем и клубочков [16]. При давности болезни более 20 лет морфологически выявляются признаки хронического тубулоинтерстициального нефрита с вторичным поражением клубочков с исходом в фиброз с отложением кристаллов оксалата кальция в интерстиции [16].
К факторам риска прогрессирования ОН у пациентов с коморбидной патологией (остеоартрит, дорсопатии) относят применение НПВП, что было показано на небольшой когорте пациентов [17]. Описана клиника абак-териального цистита, связанного с увеличением оксалатно-кальциевой кристаллурии при приеме диклофенака. Феномен хронической боли у пациентов с остеоартритом и современные фармакологические подходы к лечению, основанные не только на курсовом, но и на непрерывном длительном приеме НПВП, обусловливают необходимость учета профиля их безопасности при использовании больными оксалатной нефропатией.
Следует также отметить, что в последние годы придают все большее значение гиперу-рикемии как фактору риска прогрессирования хронических неинфекционных заболеваний и роста смертности вследствие сердечно-сосудистых заболеваний [18–20].
Цель исследования. Оценка экскретируемой фракции мочевой кислоты у больных оксалатной нефропатией на ранних стадиях хронической болезни почек с гонартритом при курсовом лечении нестероидными противовоспалительными препаратами.
Материалы и методы. В открытое сравнительное рандомизированное исследование было включено 192 женщины с оксалатной нефропатией на стадии хронического тубулоинтерстициального нефрита, давностью болезни 20–30 лет, сопоставимые по индексу массы тела (ИМТ 23,4±1,8) и возрасту (51,4±2,3 года), с СКФ выше 60 мл/мин (1–2 стадия ХБП), наличием первичного гонартрита 2–3 стадии по Kellgren – Lawrence, выраженностью боли по индексу WOMAC более 400 мм. В исследование вошли больные, которые не получали НПВП, мочегонные и другие нефротоксические препараты в течение 2 мес. до момента включения в исследование, соблюдали гипо-оксалатную диету и подписали информированное согласие на участие.
Больные оксалатной нефропатией с остеоартритом были рандомизированы на 4 группы: 1-я группа (53 чел.) получала диклофенак натрия в дозе 150 мг/сут (курсовая доза за месяц – 4500 мг), 2-я группа (47 чел.) – целекок-сиб («Целебрекс», Pfizer HCP Corporation) в дозе 200 мг/сут (курсовая доза за месяц – 6000 мг), 3-я группа (42 чел.) – нимесулид («Найз», Dr. Reddy’s Laboratoris Ltd.) в дозе 200 мг/сут (курсовая доза за месяц – 6000 мг), 4-я группа (50 чел.) – диацереин («Диафлекс», Rompharm Company) по 100 мг/сут (курсовая доза за 2 мес. – 6000 мг).
В группу контроля (К) входили 120 женщин в возрасте 52,3±2,1 года с ИМТ 22,9±2,2, остеоартритом без оксалатной нефропатии и гиперурикемии, не имеющих других сопутствующих заболеваний, в т.ч. метаболического синдрома, артериальной гипертонии, сахарного диабета, нарушений функций почек, которые также были распределены на 4 группы по 30 чел. и принимали: 1-я группа – диклофенак (месячная курсовая доза – 4500 мг), 2-я группа – целекоксиб (месячная курсовая доза – 6000 мг), 3-я группа – нимесулид (месячная курсовая доза – 6000 мг), 4-я группа – диацереин (курсовая доза за 2 мес. – 6000 мг).
Оценка ренального транспорта мочевой кислоты в сопоставлении с СКФ у больных и в контрольной группе проводилась на 15-й и 30-й дни лечения диклофенаком, целекокси-бом, нимесулидом и через 30 дней после отмены препаратов (60-й день наблюдения). Длительность лечения указанными НПВП определялась наличием хронической боли в суставах. Больные, принимавшие диацереин в непрерывном режиме, оценивались на 15, 30 и 60-й дни лечения.
Для оценки ренального транспорта мочевой кислоты исследовалось содержание мочевой кислоты в плазме (Рua) и моче (Uua), рассчитывались скорость клубочковой фильтрации и экскретируемая фракция мочевой кислоты. Исследование мочевой кислоты в плазме и моче проводилось уриказным методом на биохимическом анализаторе Hitachi-912 (Hoffman la Roche, Швейцария). Уровень креатинина в сыворотке крови (Pcr) и моче (Ucr) определялся общепринятым кинетическим методом Яффе. Скорость клубочковой фильт- рации рассчитывалась по формуле СКD-EPI [18]. EFUA рассчитывалась по общепринятой формуле [7, 19].
Статистический анализ результатов проводился с использованием пакета прикладных программ StatSoft Statistica v.8.0. Результаты представлены в виде M ± σ. В зависимости от характера распределения для сравнения групп использовался t-критерий Стьюдента. Межгрупповые отличия рассчитывались по непараметрическому критерию Манна – Уитни (Mann – Whitney U-test). Статистически значимыми считались отличия при p<0,05. Для оценки статистической значимости межгрупповых различий в частоте событий использовался точный критерий Фишера. Для оценки динамики показателей на фоне лечения применялся парный непараметрический метод анализа по Вилкоксону. Достоверными считались различия при p<0,05. Наличие или отсутствие связи определялось с помощью критерия /2, при наличии связи проводилось измерение с помощью коэффициентов корреляции Пирсона.
Результаты и обсуждение. До назначения НПВП у больных ОН СКФ была не ниже 82 мл/мин/1,73 м2, уровень Рua достоверно превышал значения контрольной группы лиц и был не выше 0,37 ммоль/л, EFUA исходно была снижена, но не ниже 8 %, в группе контроля EFUA была не ниже 13 %. Результаты исследования в группах сравнения представлены в табл. 1–4.
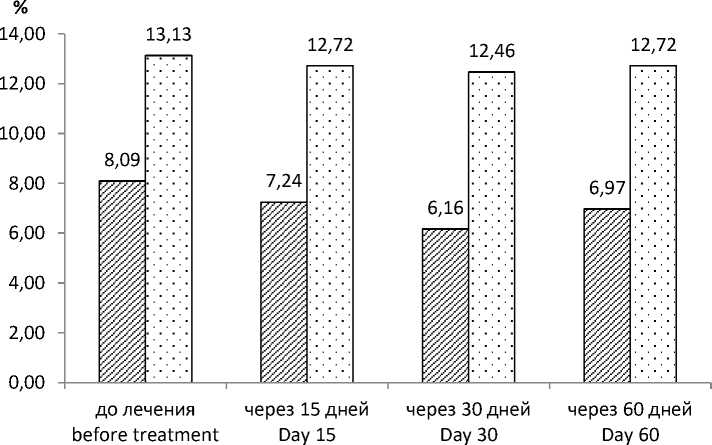
При анализе динамики показателей в ходе лечения препаратом диклофенак (табл. 1) у пациентов с ОН отмечено достоверное снижение СКФ (р<0,001), Uua (р<0,01) и EFUA (р<0,01), что повлияло на повышение Рua (р<0,01). Через 30 дней после отмены диклофенака выявлена тенденция к снижению ги-перурикемии, увеличению EFUA и СКФ (р<0,01). У пациентов контрольной группы показатели Рua, Uua и EFUA весь период оставались практически на одном уровне, а СКФ снизилась на 10 %, но после отмены препарата нормализовалась (рис. 1, 2).
Таблица 1
Table 1
Динамика показателей ренального транспорта мочевой кислоты и скорости клубочковой фильтрации у больных оксалатной нефропатией, принимающих диклофенак, в сравнении с контрольной группой (М±σ)
Parameters of renal transport of uric acid and glomerular filtration rate in patients with oxalate nephropathy taking Diclofenac in comparison with the control
|
Период Period |
Рua, ммоль/л Рua, mmol/l |
Uua, ммоль/л Uua, mmol/l |
EFUA, % |
СКФ, мл/мин/1,73 м2 GFR, ml/min/1,73 m2 |
||||
|
ОН ON |
К Control |
ОН ON |
К Control |
ОН ON |
К Control |
ОН ON |
К Control |
|
|
До лечения Before treatment |
0,36 ± 0,03* |
0,28 ± 0,03 |
2,82 ± 0,41** |
3,20 ± 0,52 |
8,09 ± 0,25* |
13,13 ± 0,94 |
83,74 ± 3,80* |
116,06 ± 4,10 |
|
Через 15 дней Day 15 |
0,41 ± 0,04* |
0,29 ± 0,03 |
2,64 ± 0,40* |
3,20 ± 0,52 |
7,24 ± 0,41* |
12,72 ± 0,88 |
64,33 ± 7,62* |
108,92 ± 4,71 |
|
Через 30 дней Day 30 |
0,47 ± 0,03* |
0,29 ± 0,03 |
2,40 ± 0,38* |
3,22 ± 0,53 |
6,16 ± 0,12* |
12,46 ± 0,91 |
48,42 ± 3,46* |
105,86 ± 4,51 |
|
Через 60 дней Day 60 |
0,39 ± 0,03* |
0,28 ± 0,02 |
2,61 ± 0,41* |
3,22 ± 0,53 |
6,97 ± 0,36* |
12,72 ± 0,88 |
65,01 ± 4,42* |
113,05 ± 4,79 |
Примечание . * – р<0,001; ** – р<0,01 при сравнении показателей в группах.
Note. * – p<0.001; ** – the differences are significant when comparing similar parameters in the groups p<0.01; GFR – glomerular filtration rate; ON – patients with oxalate nephropathy and osteoarthritis; Control – control group (patients with osteoarthritis without oxalate nephropathy).
и EFUA ( с ОН) / EFUA (with ON) □ EFUA ( без ОН) / EFUA (without ON)
Рис. 1. Изменение EFUA у пациентов, применяющих диклофенак
Fig. 1. Changes in EFUA in patients taking Diclofenac
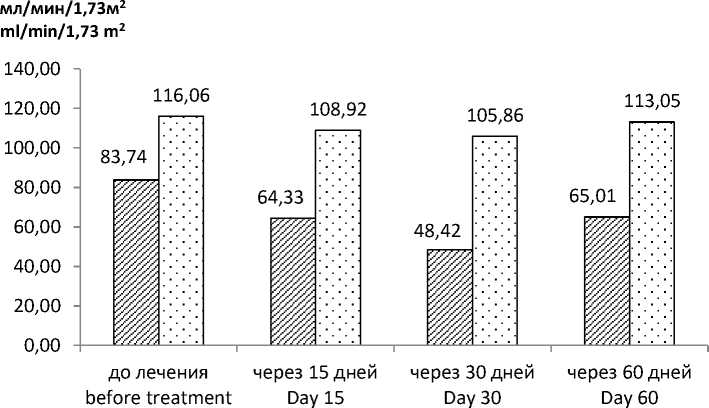
0 СКФ (с ОН) / GFR (with ON) □ СКФ (без ОН) / GFR (without ON)
Рис. 2. Изменение СКФ у пациентов, применяющих диклофенак
Анализ корреляционной зависимости показал наличие сильной прямой связи между Uua, EFUA и СКФ (r xy =0,99), сильной обратной связи между Рua и Uua (r xy =-0,95), Pua и EFUA (r xy =-0,92), Рua и СКФ (r xy =-0,96).
При анализе изменения показателей в процессе лечения нимесулидом (табл. 2) у пациентов с ОН отмечено достоверное снижение
СКФ (р<0,001), Uua (р<0,01), EFUA (р<0,01) и повышение Рua (р<0,01). Через 30 дней после отмены препарата выявлена тенденция к снижению гиперурикемии, увеличению EFUA и СКФ (р<0,01) (рис. 3, 4). У пациентов контрольной группы (без ОН) показатели Рua, Uua, EFUA и СКФ весь период оставались практически на одном уровне.
Таблица 2
Table 2
Динамика показателей ренального транспорта мочевой кислоты и скорости клубочковой фильтрации у больных оксалатной нефропатией, принимающих нимесулид, в сравнении с контрольной группой (М±σ)
Parameters of renal transport of uric acid and glomerular filtration rate in patients with oxalate nephropathy taking Nimesulid in comparison with the control (М±σ)
|
Период Period |
Рua, ммоль/л Рua, mmol/l |
Uua, ммоль/л Uua, mmol/l |
EFUA, % |
СКФ, мл/мин/1,73 м2 GFR, ml/min/1,73 m2 |
||||
|
ОН ON |
К Control |
ОН ON |
К Control |
ОН ON |
К Control |
ОН ON |
К Control |
|
|
До лечения Before treatment |
0,36 ± 0,02* |
0,27 ± 0,03 |
2,81 ± 0,36** |
3,14 ± 0,52 |
8,04 ± 0,29* |
13,16 ± 0,67 |
82,69 ± 4,30* |
118,35 ± 2,33 |
|
Через 15 дней Day 15 |
0,39 ± 0,02* |
0,27 ± 0,03 |
2,75 ± 0,35** |
3,13 ± 0,53 |
7,65 ± 0,33* |
12,93 ± 0,71 |
78,03 ± 4,70* |
117,48 ± 1,86 |
|
Через 30 дней Day 30 |
0,42 ± 0,02* |
0,27 ± 0,03 |
2,68 ± 0,35* |
3,13 ± 0,53 |
7,37 ± 0,35* |
12,82 ± 0,66 |
74,10 ± 3,89* |
117,79 ± 1,96 |
|
Через 60 дней Day 60 |
0,38 ± 0,02* |
0,28 ± 0,03 |
2,75 ± 0,36* |
3,15 ± 0,53 |
7,72 ± 0,29* |
12,90 ± 0,69 |
79,19 ± 4,28* |
117,98 ± 1,82 |
Примечание . * – р<0,001; ** – р<0,01 при сравнении аналогичных показателей в группах.
Note. * – p<0.001; ** – the differences are significant when comparing similar parameters in the groups p<0.01; ON – patients with oxalate nephropathy and osteoarthritis; Control – control group (patients with osteoarthritis without oxalate nephropathy).
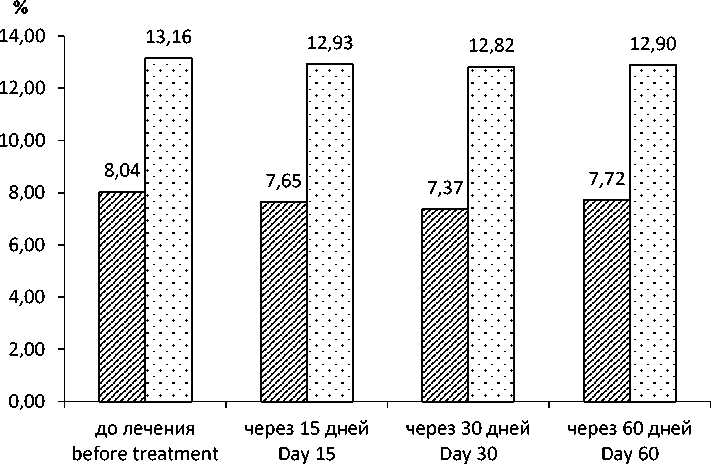
0 EFUA ( с ОН) / EFUA (with ON) □ EFUA ( без ОН) / EFUA (without ON)
Рис. 3. Изменение EFUA у пациентов, применяющих нимесулид
Fig. 3. Changes in EFUA in patients taking Nimesulid
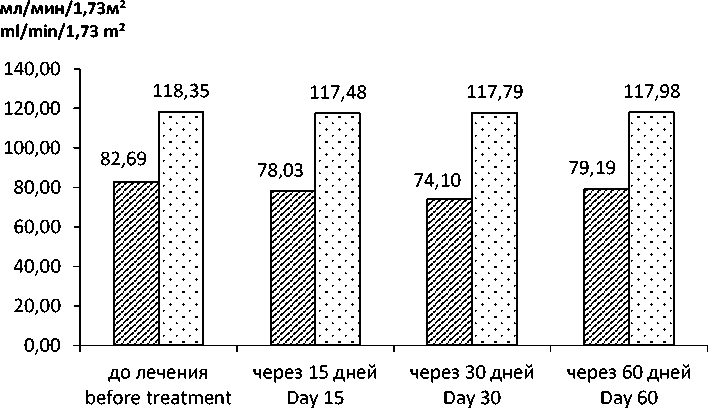
0 СКФ (с ОН) / GFR (with ON) □ СКФ (без ОН) / GFR (without ON)
Рис. 4. Изменение СКФ у пациентов, применяющих нимесулид
Анализ корреляционной зависимости показал наличие сильной прямой связи между Uua и EFUA (r xy =0,99), Uua и СКФ (r xy =0,98), сильной обратной связи между Рua и Uua, EFUA и СКФ (r xy =-0,99).
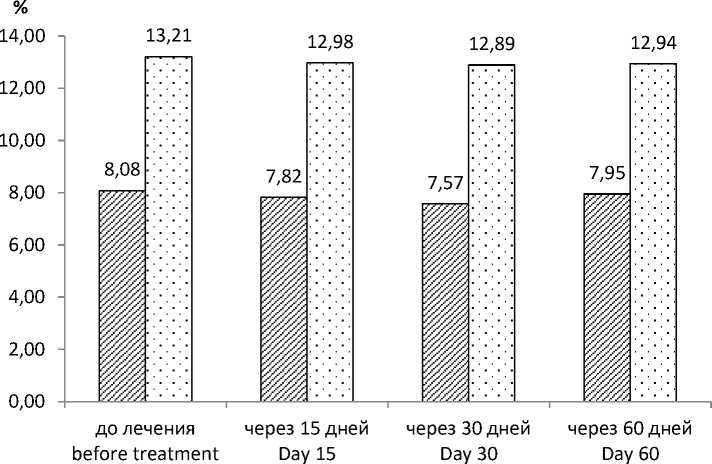
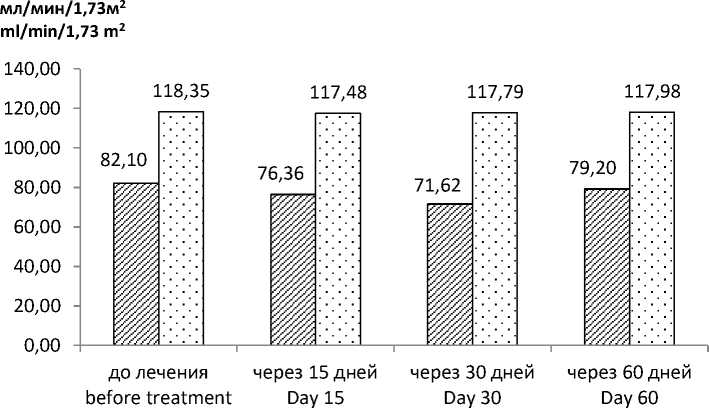
Изменения лабораторных показателей в течение 30 дней лечения целекоксибом (табл. 3) у пациентов с ОН были аналогичны таковым при приеме нимесулида. Отмечено достовер- ное снижение СКФ (р<0,001), Uua (р<0,01), EFUA (р<0,01) и динамическое повышение Рua (р<0,01). Через 30 дней после отмены препарата выявлена тенденция к снижению гипе-рурикемии, увеличению EFUA и СКФ (р<0,01) (рис. 5, 6). У пациентов контрольной группы значения Рua, Uua, EFUA и СКФ весь период оставались практически на одном уровне.
Таблица 3
Table 3
Динамика показателей ренального транспорта мочевой кислоты и скорости клубочковой фильтрации у больных оксалатной нефропатией, принимающих целекоксиб, в сравнении с контрольной группой (М±σ)
Parameters of renal transport of uric acid and glomerular filtration rate in patients with oxalate nephropathy taking Celecoxib in comparison with the control (М±σ)
|
Период Period |
Рua, ммоль/л Рua, mmol/l |
Uua, ммоль/л Uua, mmol/l |
EFUA, % |
СКФ, мл/мин/1,73 м2 GFR, ml/min/1,73 m2 |
||||
|
ОН ON |
К Control |
ОН ON |
К Control |
ОН ON |
К Control |
ОН ON |
К Control |
|
|
До лечения Before treatment |
0,37 ± 0,02* |
0,28 ± 0,03 |
2,86 ± 0,32*** |
3,20 ± 0,69 |
8,08 ± 0,41* |
13,21 ± 0,87 |
82,10 ± 4,72* |
118,35 ± 2,33 |
|
Через 15 дней Day 15 |
0,39 ± 0,02* |
0,29 ± 0,04 |
2,82 ± 0,31** |
3,20 ± 0,68 |
7,82 ± 0,45* |
12,98 ± 0,86 |
76,36 ± 5,06* |
117,48 ± 1,86 |
|
Через 30 дней Day 30 |
0,41 ± 0,02* |
0,28 ± 0,04 |
2,75 ± 0,33** |
3,19 ± 0,68 |
7,57 ± 0,45* |
12,89 ± 0,92 |
71,62 ± 5,24* |
117,79 ± 1,96 |
|
Через 60 дней Day 60 |
0,38 ± 0,02* |
0,28 ± 0,04 |
2,82 ± 0,31** |
3,19 ± 0,69 |
7,95 ± 0,42* |
12,94 ± 0,83 |
79,20 ± 4,76* |
117,98 ± 1,82 |
Примечание . * – р<0,001; ** – р<0,01; *** – р<0,05 при сравнении аналогичных показателей в группах.
Note. * – p<0.001; ** – р<0.01; *** – the differences are significant when comparing similar indicators in the groups р<0.05; ON – patients with oxalate nephropathy and osteoarthritis; Control – control group (patients with osteoarthritis without oxalate nephropathy).
0 EFUA ( с ОН) / EFUA (with ON) □ EFUA ( без ОН) / EFUA (without ON)
Рис. 5. Изменение EFUA у пациентов, применяющих целекоксиб
Fig. 5. Changes in EFUA in patients taking Celecoxib
0 СКФ (с ОН) / GFR (with ON) □ СКФ (без ОН) / GFR (without ON)
Рис. 6. Изменение СКФ у пациентов, применяющих целекоксиб
Fig. 6. Changes in GFR in patients taking Celecoxib
Анализ корреляционной зависимости показал наличие сильной прямой связи между Uua и EFUA (r xy =0,97), Uua и СКФ (r xy =0,96), сильной обратной связи между Рua и Uua (r xy =-0,97), EFUA и СКФ (r xy =-0,99).
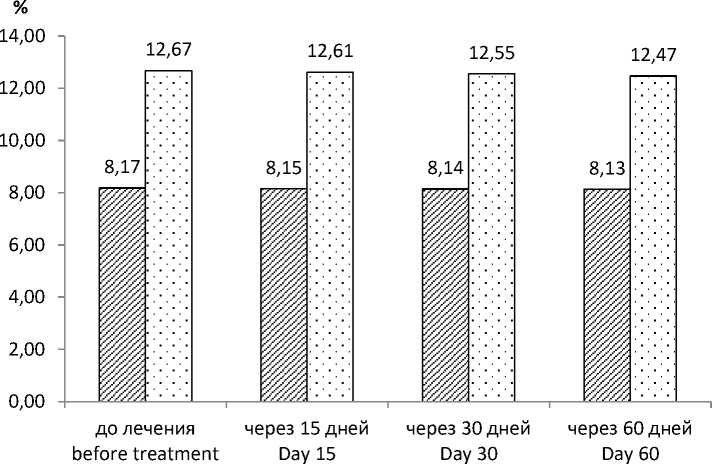
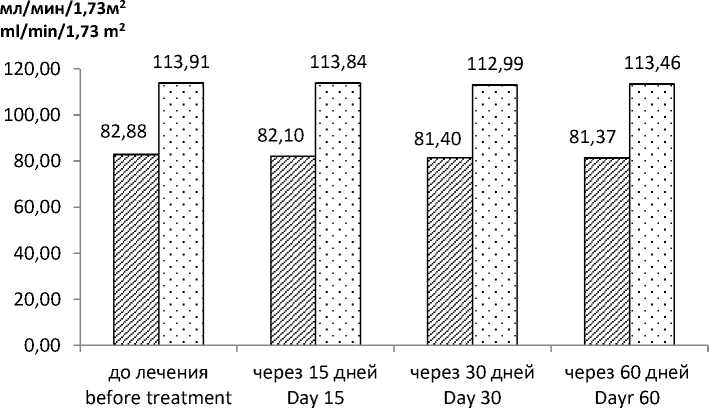
Динамика показателей ренального транспорта мочевой кислоты и СКФ у пациентов с ОН, принимающих диацереин, представлена в табл. 4 и на рис. 7, 8. При исходно несколько более высоких значениях Рua и сниженных, по сравнению с контрольной группой, показателях Uua, EFUA и СКФ не отмечено значимого изменения исследуемых показателей во время приема диацереина. Значения Рua, Uua, EFUA и СКФ в контрольной группе также весь период оставались практически на одном уровне с незначимым снижением EFUA на 1,6 % от исходных значений за 2 мес.
Таблица 4
Table 4
Динамика показателей ренального транспорта мочевой кислоты и скорости клубочковой фильтрации у больных оксалатной нефропатией, принимающих диацереин, в сравнении с контрольной группой (М±σ)
Parameters of renal transport of uric acid and glomerular filtration rate in patients with oxalate nephropathy taking Diaflex in comparison with the control (М±σ)
|
Период Period |
Рua, ммоль/л Рua, mmol/l |
Uua, ммоль/л Uua, mmol/l |
EFUA, % |
СКФ, мл/мин/1,73 м2 GFR, ml/min/1,73 m2 |
||||
|
ОН ON |
К Control |
ОН ON |
К Control |
ОН ON |
К Control |
ОН ON |
К Control |
|
|
До лечения Before treatment |
0,30 ± 0,04** |
0,27 ± 0,03 |
3,13 ± 0,41 |
3,22 ± 0,53 |
8,17 ± 0,33* |
12,67 ± 0,71 |
82,88 ± 4,31* |
113,91 ± 5,07 |
|
Через 15 дней Day 15 |
0,30 ± 0,04*** |
0,28 ± 0,03 |
3,15 ± 0,42 |
3,20 ± 0,54 |
8,15 ± 0,33* |
12,61 ± 0,70 |
82,10 ± 4,18* |
113,84 ± 4,18 |
|
Через 30 дней Day 30 |
0,31 ± 0,03** |
0,28 ± 0,03 |
3,15 ± 0,43 |
3,21 ± 0,54 |
8,14 ± 0,3* |
12,55 ± 0,78 |
81,40 ± 4,47* |
112,99 ± 4,29 |
|
Через 60 дней Day 60 |
0,30 ± 0,04 |
0,28 ± 0,03 |
3,16 ± 0,42 |
3,23 ± 0,52 |
8,13 ± 0,33* |
12,47 ± 0,76 |
81,37 ± 4,46* |
113,46 ± 4,85 |
Примечание . * – р<0,001; ** – р<0,01; *** – р<0,05 при сравнении аналогичных показателей в группах.
Note. * – p<0.001; ** – р<0.01; *** – the differences are significant when comparing similar indicators in the groups р<0.05; ON – patients with oxalate nephropathy and osteoarthritis; Control – control group (patients with osteoarthritis without oxalate nephropathy).
0 EFUA ( с ОН) / EFUA (with ON) □ EFUA ( без ОН) / EFUA (without ON)
Рис. 7. Изменение EFUA у пациентов, применяющих диацереин
Fig. 7. Changes in EFUA in patients taking Diaflex
0 СКФ (с ОН) / GFR (with ON) □ СКФ (без ОН) / GFR (without ON)
Рис. 8. Изменение СКФ у пациентов, применяющих диацереин
Fig. 8. Changes in GFR in patients taking Diaflex
Анализ корреляционной зависимости показал отсутствие значимой связи между Uua, EFUA, СКФ и Рua и наличие сильной обратной связи между Uua и EFUA (r xy =0,91), Uua и СКФ (r xy =-0,89).
Сравнение препаратов между собой по эффектам воздействия на ренальный транспорт мочевой кислоты показало значимые различия (рис. 9). Так, при применении диклофенака наблюдались достоверно более выраженные подъем Рua и снижение Uua, EFUA и СКФ, продолжавшиеся до отмены препарата (р<0,001). После отмены препарата диклофенак показатели и через месяц не вернулись к первоначальным значениям. Целекоксиб и ни- месулид оказывали сходное влияние на ренальный транспорт мочевой кислоты и СКФ, но целекоксиб, тем не менее, оказывал более слабое воздействие и показатели быстрее возвращались к исходным после отмены препарата (р<0,05). Наиболее безопасным для применения оказался диацереин, который не нуждался в отмене после второго месяца использования и практически не изменял исходные показатели, не оказывал значимого влияния на ренальный транспорт мочевой кислоты (р<0,01). В контрольной группе лиц статически значимых изменений ренального транспорта мочевой кислоты и СКФ не наблюдали.
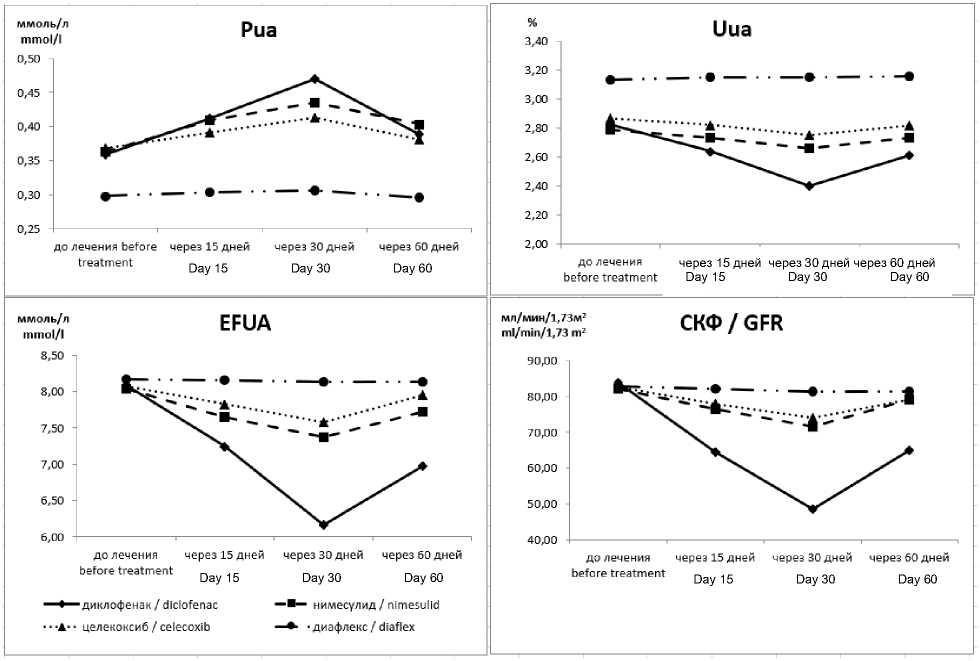
Рис. 9. Динамика показателей ренального транспорта мочевой кислоты и скорости клубочковой фильтрации у больных оксалатной нефропатией
Fig. 9. Parameters of renal transport of uric acid and glomerular filtration rate in patients with oxalate nephropathy
Заключение. Таким образом, у больных оксалатной нефропатией на 1–2 стадии ХБП при приеме нестероидных противовоспалительных препаратов (диклофенак, нимесулид, целекоксиб) наблюдали снижение СКФ и
фракционной экскреции мочевой кислоты. Наиболее выраженные изменения лабораторных показателей были отмечены при приеме диклофенака, причем они сохранялись и в течение месяца после его отмены. Прием диаце-
реина не вызывал нефротоксических эффек- имеет большое практическое значение при тов, не влиял на уровень СКФ и экскретируе- выборе безопасной терапии.
мую фракцию мочевой кислоты (EFUA), что
Список литературы Влияние нестероидных противовоспалительных препаратов (диклофенака, целекоксиба, нимесулида, диацереина) на ренальный транспорт мочевой кислоты у больных оксалатной нефропатией с сопутствующим гонартритом
- Рациональное использование нестероидных противовоспалительных препаратов. Клинические рекомендации. Научно-практическая ревматология. 2018; 56 (прил. 1): 1-29.
- Алексеева Л.И., Таскина Е.А., Кашеварова Н.Г. Остеоартрит: эпидемиология, классификация, факторы риска и прогрессирования, клиника, диагностика, лечение. Современная ревматология. 2019; 13 (2): 9-21.
- Алексеева Л.И., Кашеварова Н.Г., Таскина Е.А., Шарапова Е.П., Аникин С.Г., Короткова Т.А., Стребкова Е.А. Эффективность и безопасность диацереина у пациентов с остеоартритом коленных суставов. Современная ревматология. 2017; 11 (3): 1-8.
- Наумов А.В., Ховасова Н. О. Рекомендованная терапия остеоартрита: новые решения старых задач. РМЖ. 2016; 3: 1-4.
- Каратеев А.Е., Алексеева Л.И. Оценка переносимости диацереина в реальной клинической практике. Результаты исследования РОКАДА (Ретроспективная оценка клинических аспектов применения Диафлекса при остеоартрозе). Научно-практическая ревматология. 2015; 53 (2): 169-174.
- Сатыбалдыев А.М. Выбор нестероидных противовоспалительных препаратов у пожилого пациента с острой и хронической болью. Клиническая геронтология. 2020; 26 (5-6): 49-57. DOI: 10/26347/1607-2499202005-06049-057.
- Клинические рекомендации ассоциации нефрологов. Тубулоинтерстициальные болезни почек. Москва; 2021: 7-11.
- КутыринаИ.М. Оценка функционального состояния почек. В кн.: Тареева И.Е., ред. Нефрология: руководство для врачей. Т. 1. Москва: Медицина; 1995: 173-194.
- Zhang X., Donnan P.T., Bell S., Guthrie B. Non-steroidal antiinflammatory drug induced acute kidney injury in the community dwelling general population and people with chronic kidney disease: systematic review and meta-analysis. BMC Nephrol. 2017; 18 (1): 256. DOI: 10.1186/s12882-017-0673-8).
- Hsu C. C., Wang H., Hsu Y.H. Use of Nonsteroidal Anti-Inflammatory Drugs and Risk of Chronic Kidney Disease in Subjects with Hypertension: Nationwide Longitudinal Cohort Study. Hypertension. 2015; 66 (3): 524-533. DOI: 10.1161/Hypertensionaha.114.05105.epub 2015jul 13.
- Зверев Я. Ф., Брюханов В.М. Современные представления о механизмах почечного транспорта мочевой кислоты. Клиническая нефрология. 2016; 1: 42-49.
- Anton Ivanyuk, Francoise Livio, Jerome Biollaz, Thierry Buclin. Renal Drug Transporters and Drug Interactions. Clin Pharmacokinet. 2017; 56 (8): 825-892. DOI: 10.1007/s40262-017-0506-8.
- Tisdale J.E., Miller D.A. Drug Induced Diseases: Prevention, Detection, and Management. 3rd Ed. Be-thesda, Md.: American Society of Health-System Pharmacists; 2018; 41: 941-966.
- Endou H., Anzai N. Urate transport across the apical membrane of renal proximal tubules. Nucleosides Nucleotides Nucleic Acids. 2008; 27: 578-584.
- Harirforoosh S., Jamali F. Renal adverse effects of non-steroidal anti-inflammatory drugs. Expert Opin Drug Saf. 2009; 8 (6): 669-681. DOI: 10.1517/14740330903311023.
- Lipworth L., Abdel-Kader K., Morse J. High prevalence of non-steroidal anti-inflammatory drug use among acute kidney injury survivors in the southern community cohort study. BMC Nephrol. 2016; 17 (1): 189. DOI: 10.1186/s12882-016-0411-7.
- Воронина Н.В., Грибовская Н.В., Евсеев А.Н., Езерский Д.В. Особенности мочевого синдрома у больных оксалатной нефропатией в сопоставлении с результатами нефробиопсии. Дальневосточный медицинский журнал. 2013; 3: 15-20. 18 Воронина Н.В., Гельмутдинов Д.Д., Маркина О.И. Влияние нестероидных противовоспалительных препаратов - ингибиторов и не ингибиторов ЦОГ-2 на состояние почек у больных оксалатной нефро-патией, коморбидных по остеоартрозу. Дальневосточный медицинский журнал. 2016; 1: 14-19.
- Хроническая болезнь почек (ХБП): клинические рекомендации ассоциации нефрологов. Москва; 2021. 25.
- Арутюнов Г.П., Драгунов Д.О., Соколова А.В., Арутюнов А.Г. Фракционная экскреция мочевой кислоты как альтернативный маркер низкого уровня натрийуреза. Клиническая нефрология. 2014; 5: 20-24.
- Молчанова О.В., Бритов А.Н., Платонова Е.В. Значение повышенного уровня мочевой кислоты в развитии и профилактике хронических неинфекционных заболеваний. Профилактическая медицина. 2020; 23 (2): 102-108. DOI: 10.17116/profmed/ 202023021102.


