Влияние нитрата ртути на состав низкомолекулярных пептидов тканей крыс
Автор: Суховская Ирина Викторовна, Смирнов Лев Павлович, Немова Нина Николаевна, Осташкова Валентина Викторовна
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 6 (127), 2012 года.
Бесплатный доступ
Методом жидкостной хроматографии низкого давления исследовали состав низкомолекулярных пептидов печени, почек и мускулатуры крыс, которым ежедневно вводили в корм нитрат ртути в течение 14 и 30 дней. Изменения обнаружены во всех исследованных органах животных. Выявлены половые отличия в реакции крыс на интоксикацию нитратом ртути.
Низкомолекулярные пептиды, ртуть, жидкостная хроматография низкого давления
Короткий адрес: https://sciup.org/14750214
IDR: 14750214 | УДК: 546.49:577.112:599.323.4
Текст научной статьи Влияние нитрата ртути на состав низкомолекулярных пептидов тканей крыс
Двухвалентные тяжелые металлы – это группа ядовитых веществ, играющих заметную роль в техногенном загрязнении окружающей среды и оказывающих повреждающее действие на сочленов той или иной экосистемы [7]. В этой группе токсикантов ртуть занимает одно из ведущих мест. В результате усиливающейся индустриальной деятельности все большие количества ртути поступают в окружающую среду, поэтому становится очевидной необходимость углубленного исследования механизмов защиты у животных организмов от токсического воздействия этого элемента. Процессы биоаккумуляции и уровень интоксикации ртутью зависят от физиологического состояния организма, концентрации металла и формы (ионная или метилированная), в которой он попадает в организм. Несмотря на то что исследования по влиянию ртути на организм проводятся достаточно давно [9], [10], молекулярные механизмы ответной реакции животных до настоящего времени до конца не ясны.
Известно, что химические соединения различной природы, попавшие в организм животных, стимулируют синтез низкомолекулярных металлсвязывающих белков, классифицируе- мых как металлотионеины (МТ) [4], [6], [11]. Имеются отдельные сведения о том, что в тканях некоторых позвоночных, например в печени рыб, наряду с металлотионеинами существуют, а у подвергшихся действию тяжелых металлов и других чужеродных соединений активно образуются олигопептиды с меньшими, чем у МТ, молекулярными массами [1], [12]. Аналогичных данных по теплокровным позвоночным в доступной нам литературе не обнаружено. Целью настоящей работы было изучение качественных и количественных изменений состава низкомолекулярных пептидов в разных тканях крыс в процессе накопления ртути.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Исследования проведены на белых беспородных крысах весом 250 г. В первой серии экспериментов животные были разделены на три группы по 10 крыс в каждой. Крысам первой группы добавляли в корм нитрат ртути Hg(NO3)2 по 100 мкг/голову в пересчете на катион ежедневно в течение 14 суток. Животные второй группы получали Hg(NO3)2 в том же количестве в течение 30 суток, третья группа содержалась
на обычном рационе (контроль). Во втором эксперименте крысы были разделены на четыре группы: первая группа была сформирована из самцов, вторая из самок (по 5 особей). Животные получали с кормом Hg(NO3)2 по 100 мкг/голову в течение 30 суток. Третья и четвертая группы, в которые входили соответственно самцы и самки, были контрольными и действию ртути не подвергались. По окончании эксперимента животных декапитировали под наркозом, извлекали печень, почки, скелетные мышцы и брали навески по 0,5 г ткани. Пробы до эксперимента хранили при температуре -18 °С.
Замороженный образец ткани измельчали в фарфоровой ступке, добавляли 0,15М раствор NaCl в соотношении 1:10 и гомогенизировали в гомогенизаторе Поттера – Эльвейэма с охлаждением в течение 1 мин. Гомогенат центрифугировали (31000 g, 15 мин.) на микроцентрифуге 320a (Польша). Фракционный состав низкомолекулярных пептидов определяли в супернатанте. Для хроматографического разделения использовали стандартный набор оборудования фирмы LKB (Швеция). Колонку (К16 х 70) наполняли гелем Toyopearl TSK HW-40S (Sigma) и уравновешивали 0,15М раствором NaCl. Образец объемом 0,8–1,0 мл элюировали в нисходящем потоке со средней скоростью 43,2 мл/ч. Выходящие с колонки полипептидные фракции регистрировали на UV-абсорбциометре при длине волны 254 нм и собирали на коллекторе фракций «UltoRac-7000» (Швеция). Для калибровки колонки использовали пептиды с разными молекулярными массами (Мм) – окситоцин (1 кДа), α- и β-цепи инсулина (2,5 и 3,5 кДа), а также интактный инсулин (6 кДа).
Полученные фракции исследовали на спектрофотометре СФ-2000 (Германия) путем регистрации их спектров поглощения в диапазоне длин волн от 200 до 300 нм. Длина оптического пути кювет – 1 см.
Количественную оценку фракционного состава проводили по измерению оптической плотности при длинах волн 210 (пептидные связи) [2] и 250 нм (-S-R-связи). Результаты анализа представлены графически в виде реконструированных хроматограмм, построенных по этим значениям.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
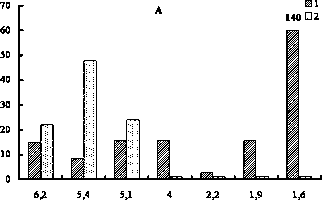
Низкомолекулярные пептиды (НМП) печени крыс всех исследованных групп в диапазоне Мм 2–9 кДа разделялись на 5 фракций (рис. 1A). Концентрация пептидов во всех фракциях у опытных крыс на 14-е сутки уменьшалась в 2,5– 13 раз по сравнению с контролем. Эти значения не изменялись до конца эксперимента (30 дней). Исключение составили пептиды с Мм 1,5 и 2,7 кДа, доля которых увеличилась в 1,5 и 1,4 раза соответственно при 30-дневном воздействии.
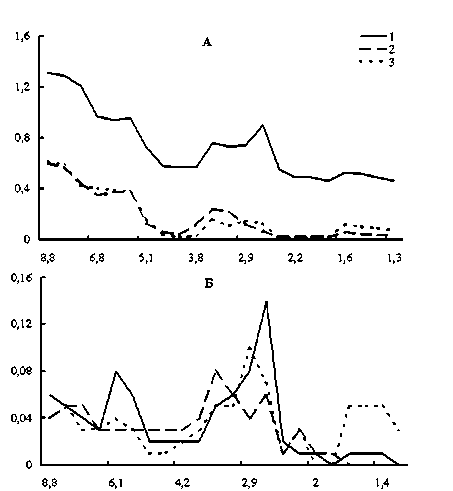
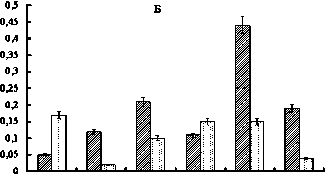
Рис. 1. Влияние нитрата ртути на фракционный состав низкомолекулярных пептидов печени крыс: 1 – контроль;
2 – 14 суток; 3 – 30 суток; по оси ординат – экстинкция при 207 нм (А), 250 нм (Б); по оси абсцисс – молекулярные массы пептидных фракций, кДа
В составе НМП печени обнаружено 5 фракций, оптически активных при 250 нм (рис. 1Б). Динамика количественных изменений этих фракций отличалась от таковой во фракциях общих пептидов. Так, на 14-е сутки у опытных крыс наблюдали снижение уровня пептидов с Мм 6,1, 2,9 и 2,7 кДа в 2,7, 2 и 2,3 раза соответственно, а во фракции 3,5 кДа отмечен их рост в 1,6 раза. Затем на 30-е сутки концентрация пептидов с Мм 6,1 и 2,9 кДа возросла по отношению к таковой в 14-суточном эксперименте в 1,3 и 2,5 раза соответственно. Кроме этого, уровень пептидов с Мм 2,9 кДа в 1,3 раза превысил контрольные значения.
На рис. 2А представлены хроматограммы НМП почек контрольной и опытных групп крыс, построенные по данным экстинкции при 207 нм. Выявлено шесть фракций с Мм 1,5–8 кДа. На 14-е сутки в почках опытной группы увеличивалось количество НМП в диапазоне Мм 1,5–3,6 кДа, наиболее заметное во фракциях 1,5, 2,0 и 2,7 кДа (1,6, 2,1 и 2,1 раза соответственно). Рост концентрации пептидов продолжался до 30-х суток практически во всех фракциях, но наиболее существенным он был во фракциях 2,0 и 5,1 кДа (в 2,6–2,8 раза выше контрольных значений).
Наибольшее количество пептидов, оптически активных при 250 нм, в почках контрольных крыс выявлено в диапазоне молекулярных масс 2,5–5,1 кДа (рис. 2Б). Поступление нитрата ртути в организм крыс привело к существенному количественному перераспределению во фракциях. Так, на 14-е сутки эксперимента наблюдался резкий рост концентрации пептидов во фракциях 6,1, 3,8, 2,7, 2,0 и 1,5 кДа в 1,7–6,3 раза. Затем на 30-е сутки уровень пептидов с Мм 6,1, 2,7, 1,5 кДа снизился почти до контрольных значений, только во фракции 2 кДа произошло дальнейшее увеличение доли пептидов в 1,4 раза по сравнению с данными 14-суточного опыта и в 9 раз относительно контроля.
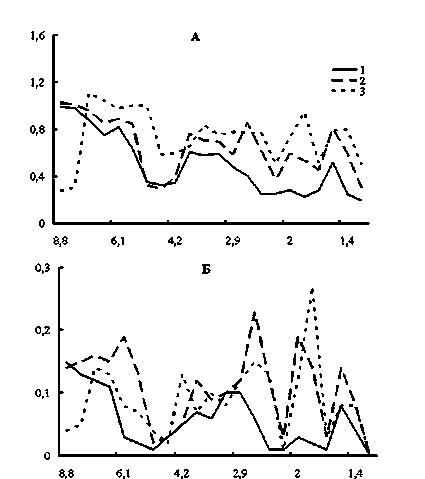
Рис. 2. Влияние нитрата ртути на фракционный состав низкомолекулярных пептидов почек крыс: 1 – контроль;
2 – 14 суток; 3 – 30 суток; по оси ординат – экстинкция при 207 нм (А), 250 нм (Б); по оси абсцисс – молекулярные массы пептидных фракций, кДа
В мышцах крыс в контроле выявлены три фракции (3,2, 4,2 и 6,8 кДа), при этом наибольшая концентрация пептидов отмечена во фракциях 4,2 и 6,8 кДа (рис. 3А). В период токсического воздействия нитрата ртути на 14-е сутки выявлено увеличение концентрации пептидов во всех фракциях, достигшее максимального значения во фракции 3,2 кДа (в 12 раз) по сравнению с контролем. В более тяжелой фракции (6,8 кДа) на 30-е сутки произошло уменьшение доли этих пептидов ниже уровня контрольных значений.
По поглощению при 250 нм в составе НМП мускулатуры выявлены четыре фракции, Мм которых определены как 2,3, 3,2, 4,2 и 6,8 кДа (рис. 3Б). У крыс, подвергнутых воздействию нитрата ртути, на 14-е сутки обнаружено увеличение концентрации пептидов с Мм 2,2, 3,2 и 6,8 кДа в 10,0, 13,0 и 2,0 раза. К концу эксперимента (на 30-е сутки) произошло снижение доли пептидов с Мм 6,8 кДа в 1,8 раза относительно контрольных значений и в 3,7 раза относительно 14-суточного эксперимента. Уровень же НМ пептидов с Мм 3,2 кДа практически не изменился. На протяжении всего эксперимента концентрация пептидов с Мм 4,2 кДа в опытных группах не отличалась от контрольных значений.
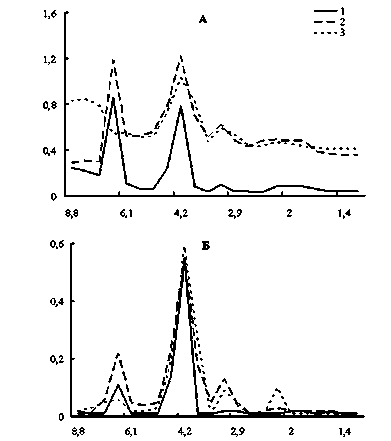
Рис. 3. Влияние нитрата ртути на фракционный состав низкомолекулярных пептидов мускулатуры крыс:
1 – контроль; 2 – 14 суток; 3 – 30 суток; по оси ординат – экстинкция при 207 нм (А), 250 нм (Б); по оси абсцисс – молекулярные массы пептидных фракций, кДа
Анализ состава НМП, оптически активных при 250 нм, печени крыс разного пола показал, что у самцов контрольной группы НМП разделялись на восемь фракций с Мм 1,5–5,6 кДа (рис. 4Б). Наибольшая концентрация отмечена для пептидов с Мм 1,5 и 1,6 кДа. В опытной группе, подвергшейся хронической интоксикации нитратом ртути, на 30-е сутки эксперимента обнаружено значительное снижение концентрации пептидов во всех фракциях.
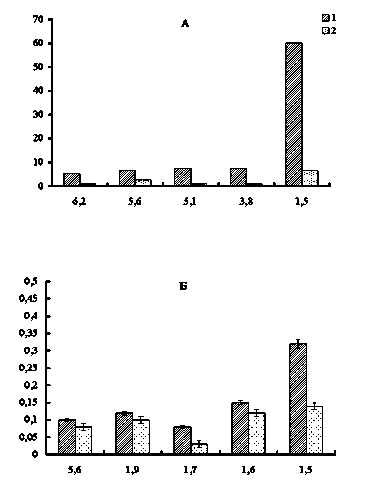
Рис. 4. Влияние нитрата ртути на фракционный состав низкомолекулярных пептидов печени самцов крыс: 1 – контроль; 2 – 30 суток (опыт); по оси ординат – экстинкция при 207 нм (А), 250 нм (Б); по оси абсцисс – молекулярные массы пептидных фракций, кДа
Качественный фракционный состав пептидов печени контрольной группы самок был сходен с таковым самцов, но имелись количественные различия (рис. 5А). Практически во всех фракциях концентрация пептидов в печени у самок была выше, чем у самцов.
Известно, что двухвалентные катионы ртути, поступающие в организм крыс через желудочнокишечный тракт, на начальных этапах интоксикации абсорбируются им не более, чем на 20 %. Уровень абсорбции при продолжительной интоксикации может снижаться до 5 % [9]. Кроме того, в этой же работе приведены данные о том, что у добровольцев, перорально получавших белковосвязанный нитрат ртути, только 15 % дозы задерживалось в организме. Остальные 85 % экскретировались на следующий день. С другой стороны, еще в 1928 году было обнаружено [3], что продолжительное применение каломели (катион Hg+) в лечебных целях может приводить к интоксикации.
5,6 2,2 1,9 1,7 1# 1;
Рис. 5. Влияние нитрата ртути на фракционный состав низкомолекулярных пептидов печени самок крыс: 1 – контроль; 2 – 30 суток (опыт); по оси ординат – экстинкция при 207 нм (А), 250 нм (Б); по оси абсцисс – молекулярные массы пептидных фракций, кДа
Проведенные нами эксперименты показали, что количественные изменения в составе НМП печени при хроническом отравлении нитратом ртути наблюдались уже на 14-й день эксперимента и сохранялись на 30-е сутки. Можно предположить, что на начальном этапе накопления катионы Hg2+ оказывали токсическое действие на белковый метаболизм, что выразилось в снижении количества пептидов во всех фракциях. Вероятный механизм этого процесса заключается в том, что ионы двухвалентной ртути по сравнению с другими двухвалентными катионами обладают максимальным сродством к суль- фгидрильным группам [13], [14]. Атакуя -S-H- и -S-S-связи, ртуть может блокировать работу ферментов, как белкового синтеза, так и протеолиза. Тем не менее на фоне снижения общего уровня пептидов наблюдалось увеличение концентрации соединений, оптически активных при 250 нм (обогащенных сульфгидрильными группами). Данный факт может свидетельствовать о том, что ежедневное добавление в корм крысам нитрата ртути в дозе 100 мкг на голову в течение 30 дней не приводило к подавлению механизмов детоксикации в печени до критического уровня. Показано, что в печени задерживается не более 8 % ртути, поступающей в организм. Подавляющая часть ртути локализуется в почках, где ее концентрация может в 78 раз превышать таковую в печени [5], [8]. Это согласуется с нашими данными о том, что наибольшие изменения в составе НМП обнаружены именно в почках. Существенный рост концентрации пептидов в самых низкомолекулярных фракциях может свидетельствовать об усилении катаболизма белков и развитии воспалительного процесса в этих органах. Динамика количественных изменений пептидов, поглощающих при 250 нм, дает возможность предполагать, что увеличение доли этих пептидов в течение первых 14 дней связано с активизацией процессов детоксикации, которые к 30-му дню частично ингибируются в результате непрерывного поступления нитрата ртути в организм.
Состав НМП в мышечной ткани в значительно меньшей степени, чем в тканях печени и почек, изменяется при интоксикации нитратом ртути. Одной из причин может быть то, что скелетная мускулатура узко специализирована и имеет специфическое строение. Она предназначена преимущественно для выполнения сократительной функции и поэтому по разнообразию белкового и пептидного состава уступает печени и почкам. Вероятно, обнаруженные изменения в составе низкомолекулярных пептидов связаны не только с белковым метаболизмом мышечной ткани крыс, но и, учитывая связь мускулатуры с другими органами через кровеносную систему, косвенно свидетельствуют об изменениях, происходящих в других тканях, например в печени и почках.
Сравнительный анализ состава низкомолекулярных пептидов печени крыс разного пола показал, что динамика количественных изменений при качественной идентичности зависела от сексуальной принадлежности исследованных животных (рис. 4, 5). Уменьшение концентрации пептидов, происходящее при хронической 30-суточной интоксикации нитратом ртути, у самцов было значительно более существенным. Эти результаты могут указывать на более высокую активность процессов детоксикации с участием НМП в печени самок по сравнению с самцами, что, вероятно, свидетельствует о более высокой устойчивости самок к хронической интоксикации ионами ртути.
Таким образом, при хронической интоксикации нитратом ртути качественных изменений в составе НМП печени, почек и мускулатуры крыс не выявлено. Количественные трансфор- мации во фракциях НМП обнаружены во всех исследованных тканях уже на 14-е сутки эксперимента. Вариабельность состава НМП возрастает от мышц к почкам. Полученные результаты подтверждают факт, что почки служат специфической мишенью для катиона двухвалентной ртути.
* Работа выполнена при финансовой поддержке гранта РФФИ № 08-04-01140-а, программы Президента РФ «Ведущие научные школы России» НШ № 3731.2010.4, Программы ОБН РАН «Биологические ресурсы России» на 2009–2010 гг. и Программы стратегического развития (ПСР) ПетрГУ в рамках реализации комплекса мероприятий по развитию научно-исследовательской деятельности на 2012–2016 гг.
Список литературы Влияние нитрата ртути на состав низкомолекулярных пептидов тканей крыс
- Смирнов Л. П., Кирилюк С. Д. Влияние загрязнения окружающей среды на фракционный состав низкомолекулярных пептидов из различных тканей сигов//Известия АН. Сер. биологическая. 1994. № 4. С. 617-622.
- Суховская И. В., Борвинская Е. В., Смирнов Л. П. Сравнительный анализ методов определения концентрации белка -спектрофотометрии в диапазоне 200-220 нм и по Брэдфорд//Труды Карельского научного центра РАН. 2010. № 2. С. 68-71.
- Almkvist J. Quecksilberchadigungen. In Handbuch der Haut-und Geschelechtskrankheiten. Jadassohn J. Ed. Springer Verlag, Berlin. 1928. Vol. 18. P. 178-188.
- Eddins D., Petro A., Pollard N., Freedman J. H., Levin E. D. Mercury-induced cognitive impairment in metallothionein-1/2 null mice//Neurotoxicol Teratol. 2008. Vol. 30(2). P. 88-95.
- Ghorbe F., Boujelbene M., Makni-Ayadi F., Guermazi F., Kammoun A., Murat J., Croute F., Soleilhavoup J. P., El-Feki A. Effect of chronic lead exposure on kidney function in male and female rats: determination of a lead exposure biomarker//Arch. Physiol. Biochem. 2001. Vol. 109(5). P. 457-63.
- Hamer D. H. Metallothionein//Ann. Rev. Biochem. 1986. Vol. 55. P. 913-951.
- IPCS, International Programme on Chemical Safety Cd.//Environmental Health Criteria, World Health Organization. Geneva, 1992. 134 p.
- Lee Y. H., Shaikh Z. A., Tohyama C. Urinary metallothionein and tissue metal levels of rats injected with cadmium, mercury, lead, copper or zinc//Toxicology. 1983. Vol. 27. P. 337-345.
- Mercury in the Environment/Eds. L. Friberg, J. Vostal. Cleveland: CRC Press, 1972. 215 p.
- Saniewska D., Beldowska M., Beldowski J., Saniewski M., Kwa ś niak J., Falkowska L. Distribution of mercury in different environmental compartments in the aquatic ecosystem of the coastal zone of the Southern Baltic Sea//J. Environ. Sci. (China). 2010. Vol. 22(8). P. 1144-1150.
- Santarelli L., Bracci M., Mocchegiani E. Influence of mercury on thymulin production: metallothioneins role//G. Ital. Med. Lav. Ergon. 2005. Vol. 27(3). P. 335-338.
- Takeda H., Shimuzu C. Existence of the metallothionein-like protein in various fish tissues//Bull. оf Jap. Soc. Sci. Fish. 1982. Vol. 48. № 5. P. 711-715.
- Viarengo A. Heavy metal cytotoxicity in marine organisms: effects on Ca2+ homeostasis and possible alteration of signal transduction pathways//Adv. Comp. Environ. Physiol. 1994. Vol. 20. P 85-110.
- Viarengo A., Nott J. Mechanism of heavy metal cation homeostasis in marine invertebrates//Comp. Biochem. Physiol. C Comp. Pharmacol. Toxicol. 1993. Vol. 104. P. 355-372.


