Влияние низких концентраций аденозина и гистамина на сокращения мышцы трахеи и бронхов
Автор: Смирнова Любовь Евгеньевна, Кирилина Валентина Михайловна, Федин Анатолий Николаевич, Кривченко Александр Иванович
Журнал: Ученые записки Петрозаводского государственного университета @uchzap-petrsu
Рубрика: Биология
Статья в выпуске: 4 (149), 2015 года.
Бесплатный доступ
Аденозин и гистамин являются важными биологически активными соединениями для клеточных структур нижних дыхательных путей. В настоящее время недостаточно изучено действие аденозина и гистамина на структуры нижних дыхательных путей в физиологически низких концентрациях, соответствующих естественному фоновому уровню организма. Нашей задачей было изучить влияние низких доз аденозина (10 мкг/мл) и гистамина (0,1 мкг/мл и 10 мкг/мл) на активность гладкой мышцы трахеи и бронхов крысы. В исследовании применялась электрическая стимуляция постганглионарных нервов и блокада гистаминовых рецепторов. При влиянии аденозина в низкой концентрации наблюдается больший дилатационный эффект, чем при действии гистамина, что связано с воздействием аденозина на различные структуры. С учетом того, что искусственно введенный в препараты трахеи и бронхов гистамин равен по концентрации эндогенно выработанному лаброцитами гистамину, следует заключить, что основной констрикторный эффект в системе нижних дыхательных путей связан с гистамином и не связан с действием аденозина или иных медиаторов тучных клеток.
Аденозиновые рецепторы, гистаминовые рецепторы, дегрануляция тучных клеток, тахикинины
Короткий адрес: https://sciup.org/14750893
IDR: 14750893 | УДК: 57.054
Текст научной статьи Влияние низких концентраций аденозина и гистамина на сокращения мышцы трахеи и бронхов
Аденозин и гистамин являются важнейшими медиаторами тучных клеток. С учетом новых биохимических данных следует рассматривать роль этих веществ в сократительной активности гладкой мускулатуры трахеи и бронхов, а соответственно и в патогенезе распространенных обструктивных заболеваний нижних дыхательных путей, к числу которых, безусловно, относятся хроническая обструктивная болезнь легких и бронхиальная астма.
Аденозин синтезируется после активации тучных клеток и является трансмиттером поздней фазы дегрануляции. Также аденозин появляется во внеклеточных пространствах вследствие разрушения клеток. При действии различных по- вреждающих факторов из клеток во внеклеточное пространство высвобождается АТФ. АТФ быстро превращается в АМФ при участии внеклеточной эктонуклеотиддифосфорилазы (экто-апиразы, или CD39). АМФ быстро трансформируется в аденозин при участии экто-5′-нуклеотидазы (CD73) [6]. Внеклеточный аденозин транспортируется обратно в клетки при участии нуклеозидного транспортера, такого как ENT1 [12]. Аденозин является как аутокринной, так и паракринной сигнальной молекулой и взаимодействует с трансмембранными рецепторами 4 подтипов: A1R, A2AR, A2BR и A3R. Соотношение этих рецепторов и локализация на мембранах различных клеток достаточно вариабельны [2], [11].
Наиболее хорошо изученными рецепторами системы GPCR (Gprotein coupled receptors) оказались аденозиновые рецепторы А1, А2 и А3. Рецепторы А1, А2 и А3 взаимодействуют с различными G-белками: рецепторы А1 и А3 – с Gi/o-белком, а рецептор А2 – с Gs-белком. Кроме того, имеются данные, что все аденозиновые рецепторы могут взаимодействовать и с другими G-белками [3], [4]. Рецепторы А1 и А3 являются ингибиторами аденилатциклазы, а рецепторы А2 – стимуляторами. После активации G-белков активируются ферменты и ионные каналы и запускается каскад сложных биохимических превращений [10]. В тучных клетках присутствуют аденозиновые рецепторы А2В и А3, которые, будучи активированными, облегчают дегрануляцию тучных клеток. Использование неселективного антагониста аденозиновых рецепторов теофиллина широко применяется при лечении астмы, хотя механизм его действия на систему GPCR до конца не ясен [4]. Гетерогенность адено-зин-ассоциированных механизмов определяется прежде всего субтипом рецептора. Взаимодействие с рецепторами тучных клеток субтипа A2B приводит к высвобождению гистамина, который ведет к сокращению гладкой мускулатуры [2]. Сформулированы представления об изменении соотношения количества пуринергических рецепторов разных подтипов. В частности, K. Varani et al. показано увеличение уровней транскриптов для A2AR и A3R при снижении A2BR у больных хронической обструктивной болезнью легких [8]. В результате присоединения аденозина в качестве лиганда к рецепторам тучных клеток А1 и А3 активируется мембраносвязанный фермент – фосфолипаза С. В результате присоединения аденозина в качестве лиганда к рецепторам тучных клеток А2 активируется аденилатциклаза. Фосфолипаза С и аденилатциклаза катализируют реакции с образованием соответственно инозитол-1,4,5-трифосфата, 1,2-диацилглицери-на и цАМФ. Инозитол-1,4,5-трифосфат и цАМФ обеспечивают фосфорилирование и активацию Са2+-связывающего белка кальмодулина, мобилизующего Са2+ из эндоплазматического ретикулума клеток в цитоплазму, в присутствии которого при участии цАМФ и 1,2-диацилглицерина активируется протеинкиназа С. Протеинкиназа С осуществляет фосфорилирование и активацию ряда других внутриклеточных ферментов, в частности Са2+-зависимой фосфолипазы А2. При этом за счет Са2+-индуцированного сокращения микротрубочек гранулы «подтягиваются» к плазматической мембране, а 1,2-диацилглицерин, продукты его расщепления (моноацилглицерин, лизофосфатидиловая кислота) и активации фосфолипазы А2 (лизофосфатидилхолин) обусловливают слияние депонирующих гранул тучной клетки со стенкой мембраносвязанных канальцев и цитоплазматической мембраной, через которые медиаторы гранул (первичные) и медиаторы, образующиеся при активации клеток, высвобождаются наружу. Медиаторы быстрой фазы дегрануляции воздействуют на гладкую мускулатуру, вызывая сокращение миоцитов.
Механизм влияния аденозина на рецепторы гладкой мускулатуры отличается от такового в тучных клетках. При присоединении аденозина к А1- и А3-рецепторам миоцитов запускаются механизмы ингибирования аденилатциклазы – фермента, обеспечивающего гидролиз АТФ до цАМФ с высвобождением пирофосфата. Инактивация аденилатциклазы приводит к уменьшению концентрации цАМФ в цитоплазме миоцитов. При низкой концентрации цАМФ не происходит фосфорилирования киназы легких цепей миозина, что является условием активности этого фермента. При одновременном увеличении концентрации ионов кальция в цитоплазме активируется белок цитоплазмы миоцитов – кальмодулин. Активация осуществляется за счет связывания кальмодулина с катионами кальция. Активный комплекс – кальций-кальмодулин – связывается с киназой легких цепей миозина и активирует этот фермент вследствие удаления с ингибиторного участка фермента ингибирующих его активность протеинов и фосфат-анионов. Активная киназа легких цепей миозина фосфорилирует легкую цепь миозина, вследствие чего последняя соединяется с тяжелой цепью миозина, далее миозиновые нити соединяются с нитями актина, образуя акто-миозиновый комплекс и вызывая гладко-мышечное сокращение [1].
Существуют данные о влиянии аденозина на эпителий и неадренэргические нехолинэргичес-кие чувствительные к капсаицину С-волокна. На С-волокна аденозин оказывает возбуждающее действие, вследствие чего волокна синтезируют медиаторы возбуждающего действия – тахикинины. Основным тахикинином является субстанция Р (SP), которая повышает сократительную активность гладкой мускулатуры трахеи и бронхов.
Другой важнейший медиатор тучных клеток, выбрасываемый в большом количестве с самого начала дегрануляции, – гистамин – оказывает прямое действие на гладкую мускулатуру, эпителий, нейроны метасимпатических ганглиев, капсаицин-чувствительные С-волокна и сами тучные клетки. Гистамин действует на данные структуры через гистаминовые рецепторы – Н1 и Н2. Н1-рецепторы в системе нижних дыхательных путей локализованы на мембране постсинаптических нервных клеток, гладкой мускулатуре, эпителии, тучных клетках. Активация этих рецепторов приводит к увеличению продукции цГМФ и повышению концентрации внутриклеточного кальция и развитию сокращения гладкой мускулатуры трахеи и бронхов. Н2-рецепторы имеют представительство на гладкой мускулатуре, эпителии и тучных клетках, восприимчивы к низким концентрациям гистамина и опосредуют расслабление мускулатуры нижних дыхательных путей. Действие ГА через эти рецепторы реализуется при повышении внутриклеточной концентрации цАМФ. Н2-рецепторы при их активации также ингибируют высвобождение серотонина, способствующего сократительной активности, и увеличивают синтез вазоактивного интестинального пептида (VIP), являющегося медиатором неадренэргической нехолинэргической системы, обеспечивающим дилатацию гладкой мускулатуры [7]. Все эти последствия активации Н2-рецепторов определяют их дилатационный эффект.
При влиянии гистамина на эпителий респираторного тракта запускается синтез простагландинов (ПГЕ2 и ПГЕ2а), оказывающих двойственный эффект на миоциты. ПГЕ2 индуцируют снижение сократительной активности, а ПГЕ2а - ее увеличение [5].
Известно, что гистаминергические реакции гладкой мышцы опосредуются через трахеобронхиальные быстро- и медленноадаптирующиеся стретч-рецепторы, расположенные в эпителиальном и мышечном слоях. Возбуждение трехео-бронхиальных стретч-рецепторов приводит к рефлекторному сокращению гладкой мускулатуры дыхательных путей и кашлевому рефлексу [7].
Таким образом, можно отметить, что действие аденозина и гистамина в нижних дыхательных путях оказывается тесно связанным. Влияние аденозина и гистамина на гладкую мышцу трахеи и бронхов опосредуется разными типами гистаминовых и аденозиновых рецепторов, которые могут быть расположены на различных структурах респираторного тракта, в том числе непосредственно на гладкомышечных клетках, чувствительных окончаниях С-волокон, дыхательном эпителии, тучных клетках. Характер реакции гладкой мышцы при этом будет определяться балансом активирующих и тормозных влияний, приходящих от рецепторных полей, локализованных на указанных структурах, и исходным состоянием гладкой мышцы. В настоящее время остаются недостаточно изученными вопросы взаимодействия аденозина и гистамина в низких концентрациях, соответствующих естественному фоновому уровню организма. Нашей задачей было изучить влияние низких доз аденозина (10 мкг/мл) и гистамина (0,1 мкг/мл и 10 мкг/мл) на активность гладкой мышцы трахеи и бронхов, связанную с эфферентными нервными структурами (постганглионарными нервными окончаниями). Также в задачи входило сопоставление эффектов аденозина и гистамина с целью установления роли каждого из этих трансмиттеров. Для этого были изучены реакции мышцы, вызванные электростимуляцией постганглионарных нервов, при действии гистамина и аденозина на фоне действия блокады Н1- и Н2-рецепторов.
МАТЕРИАЛЫ И МЕТОДЫ ИССЛЕДОВАНИЯ
Объектом исследования являлись 20 крыс линии Вистар обоего пола с массой тела 180-250 г. Подготовленные препараты трахеи и бронхов помещались в камеры с физиологическим раствором Кребса - Хензелайта, где поддерживался необходимый уровень кислорода и температурный режим. В ходе эксперимента экзогенно в виде аппликаций вводились следующие вещества: аденозин (С = 10 мкг/мл; V = 0,2 мл) для активации тучных клеток, С-волокон и аденозиновых рецепторов гладкой мышцы; гистамин (0,1 мкг/мл; 10 мкг/мл; V = 0,2 мл) для активации гистаминовых рецепторов. Кроме искусственного введения гистамина в препараты, происходило естественное поступление гистамина в систему вследствие дегрануляции тучных клеток, вызванной аденозином. Концентрации эндогенного и экзогенного гистамина являются равными. Таким образом, сравнивая результаты серии опытов «аденозин + естественно выработанный гистамин» с результатами экспериментов по влиянию на гладкомышечные сокращения одного только гистамина, можно выявить физиологический эффект аденозина и установить его роль в сокращении гладкой мускулатуры трахеи и бронхов крысы. В ходе всех экспериментов применялось раздражение препаратов электрическим полем с помощью стимулятора ЭСЛ-2. Серебряные электроды располагались вдоль продольной стенки ванночки по обе стороны препарата. Применялась стимуляция постганглионарных нервов с частотой 30 стим./с, длительность 0,5 мсек, амплитуда 20 В, продолжительность стимуляции 10 с.
РЕЗУЛЬТАТЫ ИССЛЕДОВАНИЯ
Влияние гистамина на ответы трахеи и бронхов при блокаде Н2-рецепторов
Мы заблокировали тормозные гистаминовые Н2-рецепторы блокатором циметидином. Применение 10 мкг циметидина не изменяло сокращений трахеи и бронхов, вызванных электростимуляцией постганглионарных нервов. Гистамин на фоне блокады Н2-рецепторов вызывал дозозависимое усиление сокращений на бронхах - до 109 ± 2,2 % при 0,1 мкг (P < 0,05). На трахее при дозе 10 мкг повышение амплитуды сокращения достигало 121,2 ± 1,5 % (рис. 1). Ответы трахеи и бронхов имели значимые различия (P < 0,05). Увеличение сокращения в ответ на введенный гистамин является закономерным, поскольку препарат действовал в основном на оставшиеся незаблокированными Н1-рецепторы, опосредующие констрикторный эффект.
Влияние гистамина на ответы трахеи и бронхов при блокаде Н1-рецепторов
Для блокады активирующих гистаминовых рецепторов использовали Н1-антагонист супрастин. Блокада Н1-рецепторов устраняла конс-трикторный эффект, связанный с влиянием на
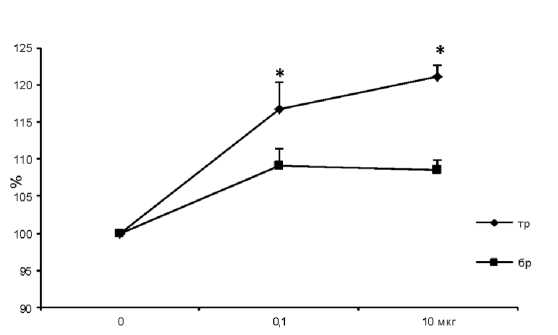
Рис. 1. Действие гистамина на сокращения гладкой мышцы трахеи и бронхов на фоне блокады Н2-рецепторов.
По оси абсцисс – концентрация гистамина в мкг, по оси ординат – изменения ответов в %. За 100 % принимается величина сокращений препаратов на фоне циметидина.
* – достоверные (P < 0,05) отличия эффекта гистамина. Сокращения: «тр» – трахея, «бр» – бронхи эти структуры гистамина, и позволяла выявить его влияние на оставшиеся незаблокированными звенья стенки респираторного тракта (Н2- и Н3-рецепторы). На фоне действия 100 мкг супрастина величина сокращений значимо снижалась (до 84,2 ± 2,5 % на трахее и до 87,6 ± 2,5 % на бронхах (P < 0,05)). Гистамин на фоне блокады Н1-рецепторов также достоверно (P < 0,05) понижал ответы трахеи и бронхов (рис. 2). Влияние гистамина на трахею носило дозозависимый характер (уменьшение ответов до 73,6 ± 3,4 % при 10 мкг), на бронхах дозозависимости не наблюдалось (амплитуда сокращений составляла 91 % при обеих дозах гистамина). Ответы трахеи и бронхов на действие гистамина имели достоверные различия (P < 0,05). Снижение сокращений респираторной мышцы связано с устранением ведущих брон-хоконстрикторных акцепторов к гистамину – Н1-рецепторов и его взаимодействием с рецепторами Н2 и Н3, опосредующими дилатацию.
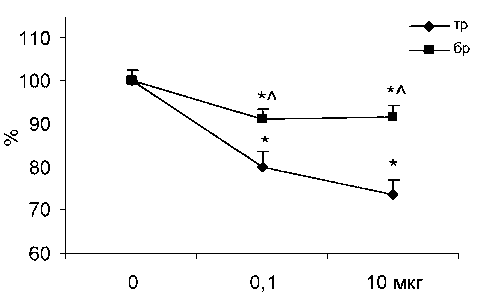
Рис. 2. Действие гистамина на сокращения гладкой мышцы трахеи и бронхов на фоне блокады Н1-рецепторов.
По оси абсцисс – концентрация гистамина в мкг, по оси ординат – изменения ответов в %. За 100 % принимается величина сокращений препаратов на фоне супрастина. * – достоверные (P < 0,05) отличия эффекта гистамина.
л - достоверные (P < 0,05) отличия между ответами препаратов трахеи и бронхов. Сокращения: «тр» – трахея, «бр» – бронхи
Влияние аденозина на ответы трахеи и бронхов при блокаде Н2-рецепторов
Для опытов с аденозином из респираторного тракта избирались препараты трахеи и бронхов с ганглиями (в местах бифуркации трахеи и бронхов) и без них (сегменты вне бифуркаций). Подобное разделение препаратов позволяло изучить влияние аденозина непосредственно на нейроны интрамурального метасимпатического ганглия и установить наличие или отсутствие аденозиновых рецепторов в нейрональных структурах ганглия. При блокаде Н2-рецепторов циметидином на фоне постганглионарной стимуляции аденозин оказывал двухфазный эффект: сначала наблюдалось увеличение сократительных ответов гладкой мышцы, а затем – уменьшение. Ответы трахеи с ганглиями повышались до 108,9 ± 2,4 % (рис. 3), что было достоверно (P < 0,05) выше действия одного аденозина. Ответы трахеи без ганглиев повышались почти на такую же величину (107,1 ± 2,6 %) и превышали (P < 0,05) эффект одного аденозина. Фаза снижения сокращения на этих препаратах равнялась 102,2 ± 3,1 % и 95,1 ± 2,8 % соответственно. При действии аденозина на фоне блокады Н2-рецепторов бронхи с ганглиями и без ганглиев показывали усиление сократительных ответов (116,1 ± 4,9 и 116,3 ± 5,2 % соответственно), которое было больше по величине, чем на трахее. Фаза снижения сокращения на бронхах с ганглиями составляла 96,7 ± 2,8 %, на бронхах без ганглиев - 97,4 ± 2,4 %. Существенных различий между препаратами трахеи и бронхов с ганглиями и без них не наблюдалось, что, вероятно,
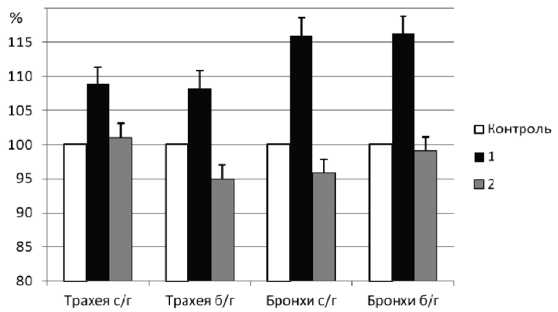
Рис. 3. Влияние блокады гистаминовых Н2-рецепторов циметидином на сократительные ответы гладкой мускулатуры трахеи и бронхов, обработанных аденозином при постганглионарной стимуляции.
По оси абсцисс обозначены используемые препараты. По оси ординат обозначены изменения ответов гладкой мышцы в %. За 100 % приняты ответы гладкой мышцы, полученные при стимуляции постганглионарных нервов на фоне действия аденозина. «Трахея с/г» – трахея с ганглиями. «Трахея б/г» – трахея без ганглиев. «Бронхи с/г» – бронхи с ганглиями. «Бронхи б/г» – бронхи без ганглиев. «1» – первая фаза действия аденозина на фоне блокады Н2-рецепторов циметидином. «2» – вторая фаза действия аденозина на фоне блокады Н2-рецепторов циметидином.
* – достоверное (P < 0,05) отличие от контроля указывает на отсутствие рецепторов к аденозину в нейронах интрамуральных ганглиев.
Влияние аденозина на ответы трахеи и бронхов при блокаде Н1-рецепторов
Блокада гистаминовых Н1-рецепторов супрастином на фоне постганглионарной стимуляции с применением блокады Н2-рецепторов уменьшала сократительные ответы гладкой мышцы всех используемых препаратов на применение аденозина. Ответы трахеи с ганглиями достоверно (P < 0,01) снижались по сравнению с контролем до 43,9 ± 1,9 % (рис. 4). Ответы трахеи без ганглиев снижались почти на такую же величину (42,1 ± 2,2 %). Действие аденозина при блокаде Н1-рецепторов на бронхи с ганглиями оказывало аналогичный эффект на сократительные ответы (42,5 ± 1,9). На бронхах без ганглиев снижение сокращения достигало 43,3 ± 2,1 %. Различий между препаратами с ганглиями и без них не наблюдалось.
%
□ Контроль
■ Супрастин
LILI J J
Трахея с/г Трахея б/г Бронхи с/г Бронхи б/г
Рис. 4. Влияние блокады Н1-рецепторов супрастином на сократительные ответы ГМ трахеи и бронхов, вызванные постганглионарной стимуляцией, на фоне блокады Н2-рецепторов циметидином при аппликации аденозина.
По оси абсцисс обозначены используемые препараты. По оси ординат обозначены изменения ответов гладкой мышцы в %. За 100 % приняты ответы гладкой мышцы, полученные при постганглионарной стимуляции на фоне аппликаций аденозина. «Трахея с/г» – трахея с ганглиями. «Трахея б/г» – трахея без ганглиев. «Бронхи с/г» – бронхи с ганглиями. «Бронхи б/г» – бронхи без ганглиев.
* – достоверное (P < 0,05) отличие от контроля
ОБСУЖДЕНИЕ РЕЗУЛЬТАТОВ
При блокаде Н2-рецепторов гистамин вызывал большее увеличение ответов в препаратах трахеи с ганглиями по сравнению с действием аденозина, что может быть связано дилатационным эффектом аденозина в системе нижних дыхательных путей. Однако в препаратах бронхов констрикторный эффект гистамина, напротив, был меньше такового эффекта аденозина. Такой результат может свидетельствовать о различном качественном и количественном составе аденозиновых рецепторов в трахее и бронхах, на что указывалось в работах K. Varani и G. Vass [8], [9].
При блокаде Н1-рецепторов происходило уменьшение сокращения мышцы трахеи и бронхов как при действии гистамина, так и при действии аденозина. Однако при влиянии аденозина наблюдался гораздо больший дилатационный эффект, чем при действии гистамина. Большая дилатационная реакция в ответ на аппликацию аденозина, вероятно, связана с более широким его действием, по сравнению с гистамином, на структуры, опосредующие дилатационный эффект. Это может быть связано с действием аденозина на А2-рецепторы гладкой мышцы, стимулирующие аденилатциклазу и приводящие к инактивации киназы легких цепей миозина, что является причиной гладкомышечного расслабления [3]. Так же аденозин мог воздействовать на С-волокна неадренэргической нехолинэргичес-кой системы, запуская высвобождение оксида азота и вазоактивного интестинального пептида, опосредующих дилатацию. Кроме вышеупомянутых воздействий аденозина нельзя исключать влияния аденозина на тучные клетки с запуском последующей дегрануляции и высвобождением низких доз эндогенного гистамина. Выработанный тучными клетками гистамин оказывает влияние на Н2-и Н3-рецепторы, опосредующие дилатацию [6]. Влияния аденозина на нейроны интрамуральных ганглиев не наблюдалось, так как различия в величинах гладкомышечного сокращения препаратов с ганглиями и без них отсутствовали. По-видимому, нейрональные структуры метасимпатического ганглия не имеют рецепторов к аденозину.
ВЫВОДЫ
Основное констрикторное действие при влиянии гистамина и аденозина опосредовано активацией Н1-рецепторов, а основное дилатирующее – активацией Н2-рецепторов. Однако при влиянии аденозина в применяемой концентрации наблюдается больший дилатационный эффект, чем при действии гистамина, что связано с воздействием аденозина на различные структуры. С учетом того, что искусственно введенный в препараты трахеи и бронхов гистамин равен по концентрации (5–10 мкг/мл) эндогенно выработанному лаброцитами гистамину [5], следует заключить, что основной констрикторный эффект в системе нижних дыхательных путей связан с гистамином и не связан с действием аденозина или иных медиаторов тучных клеток, выделяемых при их частичной дегрануляции.
Таким образом, можно отметить, что действие аденозина и гистамина в нижних дыхательных путях оказывается тесно связанным. Влияние аденозина и гистамина на гладкую мышцу трахеи и бронхов опосредуется разными типами гистаминовых и аденозиновых рецепторов, которые могут быть локализованы на различных структурах респираторного тракта – в том числе непосредственно на гладкомышечных клетках, чувствительных окончаниях С-волокон, дыхательном эпителии, тучных клетках.
* Работа выполнена при поддержке Программы стратегического развития ПетрГУ в рамках реализации комплекса мероприятий по развитию научно-исследовательской деятельности на 2012–2016 гг.
ADENOSINE AND HISTAMINE LOW CONCENTRATION INFLUENCE ON MUSCLE CONTRACTION IN TRACHEA AND BRONCHI
Список литературы Влияние низких концентраций аденозина и гистамина на сокращения мышцы трахеи и бронхов
- Гусев Н. Б. Молекулярные механизмы мышечного сокращения//Соросовский Образовательный Журнал. 2000. T 6. № 8. С. 24-32.
- Anvari F., Sharma A. K., Fernandez L. G. Tissue-derived proinflammatory effect of adenosine A2B-receptor in lung ischemia-reperfusion injury//Thorac Cardiovasc Surg. 2010. Vol. 140. № 4. P. 871-877.
- Auchampach J. A., Gross G. J. Adenosine A1 receptors, KATP channels, and ischemic preconditioning in dogs//Am. J. Physiol. 2005. P. 264.
- Baraldi P. G., Cacciari B., Merighi S. et al. A(3) adenosine receptor ligands: history and perspectives//Med. Res. Rev. 2000. P. 20.
- Begueret H., Berger P., Vernejoux J. M., Dubuisson L., Marthan R., Tunon-De-Lara J. M. Inflammation of bronchial smooth muscle in allergic asthma//Thorax. 2007. Vol. 62. № 1. P. 8-15.
- Linden A., Eltzschig Y. K. Role of pulmonary adenosine during hypoxia: extracellular generation, signaling and metabolism by surface adenosine deaminase/CD26//Expert Opinion on Biological Therapy. 2007. Vol. 7. № 9. P. 1437-1447.
- Undem B., Kollarik M. The Role of Vagal Afferent Nerves in Chronic Obstructive Pulmonary Disease//The Proceedings of the American Thoracic Society. 2005. Vol. 2. P. 355-360.
- Varani K., Caramori G., Vincenzi F., Adcock I. Alteration of adenosine receptors in patients with chronic obstructive pulmonary disease//Am. J. Respir. Crit. Care Med. 2006. Vol. 173. P. 398-406.
- Vass G., Horvath I. Adenosine and adenosine receptors in the pathomechanism and treatment of respiratory diseases//Curr. Med. Chem. 2008. Vol. 15. № 9. P. 917-922.
- Winchilli V. M., Elswick R. K. The multivariante assessment of distributions//J. Royal. Stat. 2007. Vol. 7. № 1. P. 444-460.
- Zhong H., Belardinelli L., Maa T., Zeng D. Synergy between A2B adenosine receptors and hypoxia in activating human lung fibroblasts//Am. J. Respir. Cell. Mol. Biol. 2005. Vol. 32. P. 2-8.
- Zhou Y., Schneider D. J., Blackburn M. R. Adenosine signaling and the regulation of chronic lung disease//Pharmacol. Ther. 2009. Vol. 123. № 1. P. 105-116.


