Влияние низкодозового импульсно-периодического рентгеновского излучения на рост и метастазирование карциномы легких Льюис
Автор: Булдаков Михаил Александрович, Литвяков Николай Васильевич, Климов Игорь Александрович, Кутенков О.П., Большаков М.А., Ростов В.В., Чердынцева Надежда Викторовна
Журнал: Сибирский онкологический журнал @siboncoj
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 6 (48), 2011 года.
Бесплатный доступ
В экспериментах изучалось влияние низкодозового импульсно-периодического рентгеновского излучения (ИПРИ) с импульсами наносекундной длительности на опухолевые клетки карциномы легких Льюис in vitro и in vivo. Установлена зависимость цито- статического и антиметастатического действия ИПРИ от частоты повторения импульсов и мощности импульса. Ингибирование пролиферативной активности опухолевых клеток карциномы легких Льюис in vitro, достигало 30-60 %. Двукратное облучение опухолевого узла ИПРИ с СОД, не превышающей 0,06 Гр, in vivo приводило к торможению роста опухоли лишь на 10-20 %. Максимальное ингибирование процесса метастизирования достигало 16 %.
Низкодозовое импульсно-периодическое рентгеновское излучение, карцинома легких льюис
Короткий адрес: https://sciup.org/14055965
IDR: 14055965 | УДК: 616.24-006.6-033.2:539.12.047]-092.9
Текст научной статьи Влияние низкодозового импульсно-периодического рентгеновского излучения на рост и метастазирование карциномы легких Льюис
Ранее нами было показано, что импульснопериодическое рентгеновское излучение (ИПРИ) с импульсами наносекундной длительности способно проявлять антипролиферативную активность в системе in vitro на культуре опухолевых клеток [2]. При этом цитостатический эффект ИПРИ в значительной степени зависел от используемой частоты повторения импульсов («частотное окно» – 8, 10, 13, 16, 25 имп/с), поглощенной дозы («дозовый коридор» 0,003 до 0,1 Гр) и линии опухолевых клеток. Наиболее значимое ингибирование пролиферативной активности клеток мастоцитомы Р-815 выявлено при частоте излучения 10, 13, 16 имп/с, а карциномы Эрлиха – при частотах 13, 16, 25 имп/с [2]. Было показано, что механизмы антипролиферативного действия ИПРИ на опухолевые клетки in vitro связаны с индукцией активных форм кислорода, выходом цитохрома С из митохондрий, активацией экспрессии р53 и, в конечном счете, с индукцией процесса апоптоза [9]. Таким образом, ИПРИ в системе in vitro способно оказывать «прямое» цитостатическое действие на опухолевые клетки различных линий. В системе in vivo действие ИПРИ на опухолевые клетки может в значительной степени модифицироваться факторами организма и опухоли, такими как антиоксидантная система, иммунные и эндокринные факторы, опухоль-стромальные взаимодействия и многое другое. Настоящее исследование предпринималось с целью определить, как изменяется в системе in vivo цитостатический эффект ИПРИ, установленный in vitro. Для этого была использо- вана модель метастазирующей опухоли, при этом ингибирующей эффект на рост первичной опухоли, можно было (с определенной долей условности) связывать с «прямым» антипролиферативным действием ИПРИ, в то время как антиметастати-ческий эффект свидетельствовал бы о вовлечении факторов организма в его реализацию.
Материал и методы
В работе использована модель метастазирующей опухоли мышей – карциномы легких Льюис (LLC). Исследование проводилось с разрешения локального этического комитета НИИ онкологии. Дизайн исследования предполагал на первом этапе оценку антипролиферативного эффекта ИПРИ на клетки LLC в системе in vitro в различных режимах сочетания частоты повторения импульсов и мощности дозы за импульс (табл. 1), далее выбирались только те режимы ИПРИ, которые оказывали выраженный цитостатический эффект, и в системе in vivo оценивалось их действие на рост первичной опухоли и влияние на процесс метастазирования.
В качестве источника наносекундного импульсно-периодического рентгеновского излучения использовалась установка «Синус-150», сконструированная в Институте сильноточной электроники СО РАН (г. Томск). Длительность импульса составляла 4 нс, энергия электронов – 160 кЭв, ток пучка – 3,5 кА. Суммарная экспозиционная доза составила 1,2 Р; 4 Р; 6 Р при дозах за импульс 0,3; 1,0 и 1,5 мР/имп соответственно. Время воздействия было ограничено количеством импульсов – 4000 импульсов за сеанс – и составляло в среднем 5–6 мин. Использовались следующие частоты повторения импульсов: 8, 10, 13, 16 и 19 имп/с.
Для экспериментов in vitro опухолевые клетки LLC, извлеченные из опухолевого узла объемом 0,4–0,7 см3, помещали в культуральную среду
(RPMI-1640 с 10 % телячьей сывороткой) и через сутки инкубации во влажной атмосфере с 5 % уровнем СО2 при 37°С (в СО2-инкубаторе MCO-5AC Sanyo, Япония) готовили суспензию клеток в концентрации 1 млн/мл. Облучение клеточной суспензии проводили в пенициллиновых флаконах. Выбранные режимы облучения (частота и мощность дозы за импульс) представлены в табл. 1. Все исследования проводились в двух сериях по 6 исследований на каждый режим в каждой серии.
Пролиферативную активность клеток оценивали радиоизотопным методом по включению в ДНК клеток 3Н-тимидина через 24 ч после облучения [10] с помощью β-счетчика (1450 MicroBeta Wal-lac Trilux, Perkin Elmer, Голландия), в качестве результата использовали значение включения 3Н-тимидина в ДНК клеток, выраженное в импульсах флуоресценции сцинтилляционного субстрата в минуту (имп/мин).
Для исследования in vivo мышам линии С57Bl6 (по 6 мышей в каждой группе) проводили трансплантацию опухолевых клеток LLC в заднюю правую лапу в количестве 3 млн на мышь. Замеры опухолевого узла проводили в 3 измерениях, начиная с 6-х сут после трансплантации, по ним вычисляли объем опухоли по формуле (R1+ R2+ R3)/2 [4] . Первый сеанс облучения проводили, когда объем опухоли достигал 1 см3 (6-е сут после трансплантации), второй – через 7 дней (13-е сут после трансплантации). Воздействие ИПРИ проводилось на область опухоли, для этого животные помещались в пластиковую камеру и накрывались сверху и снизу свинцовым колпаком, при этом задняя правая конечность с опухолевым узлом находилась за пределами защитной камеры.
На 21-е сут после трансплантации опухоли животных забивали методом цервикальной дислокации под эфирным наркозом и проводили
Таблица 1
Режимы сочетания частоты повторения импульсов и мощности дозы за импульс, использовавшиеся для облучения культур клеток LLC
Статистическую значимость различий между выборками оценивали при помощи критерия Манна-Уитни в программе Statistica 6.0.
Результаты и обсуждение
Для исследования влияния ИПРИ на культуру опухолевых клеток LLC были выбраны частоты повторения импульсов 8; 10; 13; 16; 19 имп/с и мощность дозы за импульс 0,3; 1; 1,5 мР/имп (табл. 1), поскольку именно при таких частотах и мощностях наблюдался выраженный цитостатический эффект на других опухолевых линиях [1, 2, 3, 9].
Уровень пролиферации клеток LLC в течение 24 ч после облучения ИПРИ статистически значимо увеличивался или уменьшался по сравнению с контролем (клетки LLC с ложным облучением) в 5 случаях. Ингибирование пролиферативной активности опухолевых клеток отмечалось при использовании частот повторения импульсов 10 имп/с (0,3 мР/имп); 16 имп/с (1 мР/имп) и 13 имп/с (1,5 мР/имп) и составляло 46, 50 и 65 % соответственно от уровня контроля (табл. 2). Статистически значимая стимуляция процессов клеточной пролиферации отмечалась в 2 случаях – при воздействии с частотой повторения импульсов 16 имп/с (0,3 мР/ имп) – на 45 % и более чем в 2 раза при использовании частоты повторения импульсов 19 имп/с (1,5 мР/имп). Облучение опухолевых клеток на других режимах не влияло на их пролиферацию.
Полученные на культуре клеток данные позволили выбрать только три эффективных режима для дальнейшей оценки действия ИПРИ in vivo , на трансплантированную LLC – 10 имп/с при 0,3 мР/ имп (группа А); 13 имп/с при 1,5 мР/имп (группа Б); 16 имп/с при 1 мР/имп (группа В). В течение 3 сут после локального облучения первичной опухоли (с 6-х по 9-е сут после трансплантации LLC) не отмечалось никаких различий по объему опухолевого узла ни в одной группе животных по сравнению с группой контроля. Начиная с 10-х сут статистически значимое торможение роста опухоли наблюдалось в группах А и Б и составляло от 12 до 23 %, после второго облучения статистически значимое торможение роста опухоли было отмечено и в группе В, но на 20-е и 21-е сут (через неделю после облучения) отличия с контролем сохранялись только в группах животных А и Б (рис. 1).
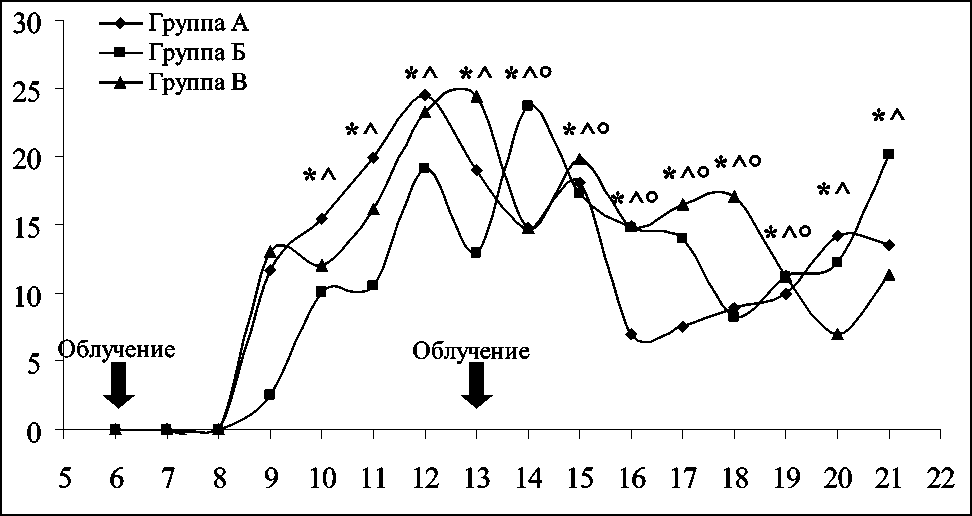
Рис. 1. Динамика торможения роста первичной опухоли LLC.
Примечание: по оси ординат – индекс ТРО, %; по оси абсцисс – сутки после трансплантации опухоли; * – различия группы А с контролем статистически значимы, р ≤ 0,05; ^ – различия группы Б с контролем статистически значимы, р ≤ 0,05; ° – различия группы В с контролем статистически значимы, р ≤ 0,05
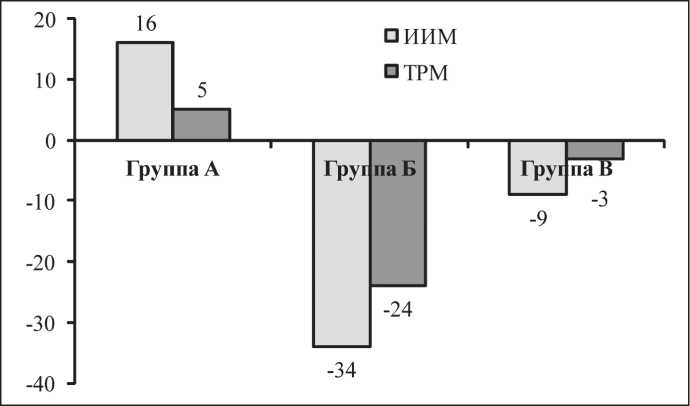
Рис. 2. Влияние ИПРИ на метастазирование LLC.
Примечание: по оси ординат представлены индекс ингибиции метастазирования (ИИМ) и индекс торможения роста метастазов (ТРМ) в процентах
Использование 3 режимов воздействия, показавших на культуре клеток LLC цитостатический эффект на уровне 46–65 %, не позволило получить такой же высокой эффект при локальном облучении опухоли, трансплантированной мышам. Можно только констатировать, что цитостатический эффект, отмеченный для 3 режимов ИПРИ в системе in vitro , сохранялся и в системе in vivo , но значительно снижался. Это может быть обусловлено низкой проникающей способностью ИПРИ при облучении ткани опухоли и большим количеством опухолевых клеток, по сравнению с клеточной культурой. Нельзя исключать роль организма в снижении цитостатического эффекта ИПРИ по сравнению с клеточной культурой. Тем не менее исследование подтвердило возможность «прямого» повреждающего действия ИПРИ на рост первичной опухоли.
Влияние различных режимов ИПРИ на метастазирование LLC (как показателя действия ИПРИ, опосредованного факторами организма) оказалось разнонаправленным. Выраженный эффект отмечался на интенсивность метастазирования (число метастазов в легких и частоту метастазирования). В группе, получавшей ИПРИ в режиме 10 имп/c при 0,3 мР/имп (группа А), индекс ингибиции метастазирования, рассчитанный с учетом частоты и числа метастазировавших колоний в легких, составил 16 %, тогда как в других группах (Б и В) отмечалась стимуляция процесса метастазирования (рис. 2). Подсчет площади метастазов показал незначительное торможение роста метастазов (ТРМ) в группе А, в то время как в других группах площадь метастатических колоний в легких была больше, чем в контроле (рис. 2). Особенно сильный стимулирующий эффект на процесс метастазирования оказало использование ИПРИ с частотой повторения импульсов 13 имп/с (группа Б).
Таким образом, при локальном облучении ИПРИ мышей в области первичной опухоли в двух группах отмечалось влияние на процесс гематогенного метастазирования. В группе А при частоте 10 имп/c 0,3 мР/имп рентгеновское излучение ингибировало процесс метастазирования LLC, а в группе Б при частоте 13 имп/c при 1,5 мР/имп наблюдалось увеличение частоты, интенсивности и размеров метастатических колоний в легких. Полученные данные свидетельствуют о вовлечении факторов организма в реализацию влияния ИПРИ на процесс метастазирования LLC. Наиболее вероятным фактором является иммунная система, определенные звенья которой могут быть активированы после облучения и способны как ингибировать метастазирование, так и стимулировать рост метастатических колоний. Возможность активации системы иммунитета при локальном облучении в «малых» дозах (СОД 0,1–0,2 Гр) показана в работах ряда авторов. Отмечается стимуляция натуральных киллеров, ма-
Таблица 2
Уровень включения 3Н-тимидина в ДНК клеток LLC через 24 ч после облучения
|
0,3 мР/имп |
1 мР/имп |
1,5 мР/имп |
|
|
Контроль |
2405 ± 288 |
2405 ± 288 |
3785 ± 515 |
|
8 имп/с |
2162 ± 578 |
2392 ± 258 |
Не проводилось |
|
10 имп/с |
1317 ± 130* |
1617 ± 110 |
Не проводилось |
|
13 имп/с |
2420 ± 387 |
2734 ± 254 |
1348 ± 200* |
|
16 имп/с |
3509 ± 256* |
1221 ± 133* |
3448 ± 1041 |
|
19 имп/с |
3730 ± 528 |
1877 ± 87 |
7850 ± 359* |
Примечание: * – различия с группой контроля статистически значимы (р≤0,05).
СИБИРСКИЙ ОНКОЛОГИЧЕСКИЙ ЖУРНАЛ. 2011. №6 (48)
крофагов, цитотоксических Т-лимфоцитов, СD8+, экспрессия ИФН-γ и ФНО [5–7, 8].
Заключение
Цитостатический эффект, отмеченный для трех режимов ИПРИ в системе in vitro , сохранялся и при локальном облучении опухоли в системе in vivo . ИПРИ ингибировало рост первичной опухоли LLC, но эффект был значительно ниже, чем его анти-пролиферативное действие на клетки в культуре in vitro . ИПРИ оказывало влияние на процесс гематогенного метастазирования LLC. В одной группе отмечалось ингибирование, в другой группе – стимуляция частоты, интенсивности и размеров метастатических колоний в легких, что свидетельствует о вовлечении факторов организма в реализацию влияния ИПРИ на процесс метастазирования. В дальнейшем планируется исследовать причины снижения антипролиферативного действия ИПРИ на первичную опухоль и изучить механизмы его влияния на метастазирование.
Работа поддержана проектами АВЦП № 2.1.1/2777 и 2.1.1/13778.


