Влияние низкомолекулярного хитозана на регенерацию полнослойной гнойной раны в эксперименте
Автор: Гладкова Екатерина Вячеславовна, Бабушкина Ирина Владимировн, Белова Светлана Вячеславовна, Мамонова Ирина Александровна, Матвеева О.В., Карякина Елена Викторовна
Журнал: Вестник Пермского университета. Серия: Биология @vestnik-psu-bio
Рубрика: Медико-биологические науки
Статья в выпуске: 3, 2012 года.
Бесплатный доступ
Изложена процедура формирования полнослойной кожной гнойной раны у крыс, инфицированных клиническими полиантибиотикорезистентными штаммами Staphylococcus aureus, выделенными у пациентов травматолого-ортопедического стационара. Оценены регенераторные и антибактериальные свойства раневого покрытия на основе низкомолекулярного хитозана. Показано, что использование раневого покрытия на основе хитозана у животных с полнослойной гнойной раной приводит к профилактике вторичного инфицирования и сокращению сроков ее заживления.
Хитозан, экспериментальная гнойная рана
Короткий адрес: https://sciup.org/147204608
IDR: 147204608 | УДК: 616-002.3-089:615.468:616-006
Текст научной статьи Влияние низкомолекулярного хитозана на регенерацию полнослойной гнойной раны в эксперименте
Одним из актуальных направлений в медицине, в том числе - хирургии, является разработка био-совместимых, биодеградируемых и обладающих низкой токсичностью раневых покрытий, предназначенных для применения в условиях гнойного воспаления мягких тканей. В данном контексте рассматривается возможность использования различных композиций на основе природного биополимера хитозана [Марквичева, 2002]. Биодеградация полимерных носителей на его основе при воздействии неспецифических ферментов является одним из основных преимуществ [Чернова и др., 2009]. Кроме того, известны антибактериальные и регенерирующие [Регенерирующая ..., 2005; Бауэр и др., 2011] эффекты данного полимера.
Актуальным представляется оценка влияния местного применения гидрогеля хитозана на динамику заживления полнослойной кожной раны, осложненной гнойным процессом, вызванным клиническими полиантибиотикорезистентными штаммами Staphylococcus aureus [Бесчастнов и др., 2009; Божкова, 2011]. Выбор в качестве объекта для воздействия грамположительных кокков St. aureus, как транзиторного так и облигатного происхождения, обоснован широкой его распространенностью и преобладанием в структуре послеоперационных раневых инфекций [Гайдуль, Муконин, 2005].
Цель исследования
Целью настоящего исследования явилось изучение репаративной регенерации мягких тканей при использовании гидрогеля природного биополимера хитозана в условиях экспериментальной гнойной раны.
Материалы и методы
Исследование проводили на 60 белых беспородных крысах - половозрелых самцах, массой тела 190-240 г.
Животные содержались в отдельных боксиро-ванных помещениях, питание осуществлялось согласно стандартной диете. Все манипуляции производились в рамках Правил и рекомендаций Европейской конвенции по защите позвоночных животных, используемых в экспериментальных работах. Содержание животных, их питание и уход за ними проводились по «Санитарным правилам по устройству, оборудованию и содержанию экспериментально-биологических клиник (вивариев) от 06.04.1973», эвтаназия экспериментальных животных осуществлялась согласно «Правил проведения работ с использованием экспериментальных животных» (приложение 3, 4 к приказу Минздрава СССР от 12.08.1977, №755).
Формирование раны размером 20 х 20 мм осуществлялось в межлопаточной области животных
по предварительно нанесенному трафарету и представляло собой иссечение полнослойного кожного лоскута, сопровождаемое дополнительной механической травматизацией краев и дна раны [Van Sprang. Janssen, 2001]. Непосредственно после формирования раневой поверхности осуществлялось ее инфицирование путем зашивания в полученный дефект на 2 сут. марлевого тампона весом 0.5 г. пропитанного взвесью суточной культуры St. aureus. выделенной от пациентов с гнойными посттравматическими и послеоперационными осложнениями, в дозе 2-Ю6 КОЕ/мл. По истечении указанного срока были сняты швы и удален тампон. Все клинические и лабораторные признаки полнослойной раны с выраженным гнойным воспалением отмечали на 3-5 сут. [Гайдуль, Муконин, 2005].
В ходе эксперимента оценивали характер течения раневого процесса: наличие и особенности воспалительной реакции, состояние краев и дна раны, сроки очищения раны от некротических тканей, сроки появления грануляций и их особенности, сроки эпителизации ран. планиметрические характеристики на 3^ 5-. 7-. 10- и 14-е сутки. Всем животным были произведены исследования основных гемато-логических показателей с использованием гематологического анализатора Micros 60 АВХ (Франция), цитологические характеристики мазков-отпечатков ран. окрашенных («Лейкодиф» 200) с использованием микроскопа Revelation III (США), с подсчетом количества нейтрофильных лейкоцитов, макрофагов и фиброзных элементов из расчета на 100 клеток (иммерсионный объектив 10x100). а также бактериологических исследований обсемененности раневой поверхности с использованием микробиологического анализатора BD BBL Cristal Aytoreader. а также метода разведения с использованием стандартных сред.
Проводилось определение вязкости гидрогеля хитозана с помощью «SV-Ю Vibro -viscorer».
Экспериментальные животные были разделены на 3 группы по 20 крыс в каждой: 1 группа - интактные животные; 2 группа - опытная (животные с полнослойной гнойной раной, однократно покрытой гидрогелем хитозана; 3 группа - сравнения, животные с полнослойной гнойной раной, которую однократно обрабатывали 0.9%-ным изотоническим раствором хлорида натрия. Гидрогель хитозана готовили непосредственно перед нанесением на экспериментальную поверхность путем растворения навески хитозана массой 1 г в предварительно подогретом до 372^ стерильном изотоническом 0.9%-ном растворе натрия хлорида.
В работе был использован хитозан пищевой, произведенный ЗАО «БИОПРОГРЕСС»» г. Москва. Нанесение гидрогеля осуществлялось однократно равномерным слоем посредством накожной аппликации в количестве 1 г (рис. 1).
Статистическую обработку полученных данных проводили с помощью программы «Medstat», предназначенной для обработки результатов медицинских и биологических наблюдений.
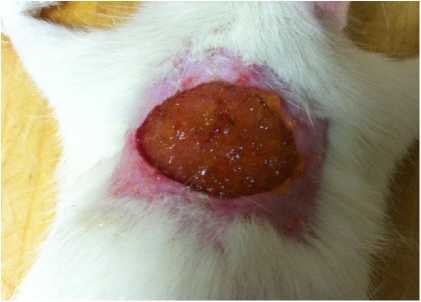
Рис. 1. Экспериментальная рана с нанесенным гидрогелем хитозана
Результаты и обсуждения
На третьи сутки с момента формирования полнослойной гнойной раны у животных отмечено снижение веса и аппетита, уменьшение общей активности. При визуальном осмотре отмечалась гиперемия и отечность краев и дна раны, появление на ее поверхности экссудата, а у ряда животных (около 30%) от их общего числа - наличие гнойного отделяемого. У всех крыс опытной группы и группы сравнения при проведении бактериологического исследования констатировали наличие St. aureus в количестве не менее 3 10s КОЕ/ мл.
У животных группы сравнения отмечалась гиперемия краев раны, наличие отдельных участков некроза, с частичным отторжением струпа, гнойным отделяемым (рис. 2).
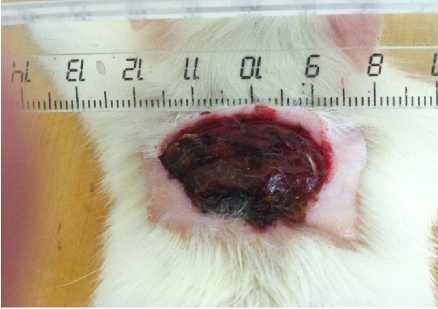
Рис. 2. Экспериментальная гнойная рана у животного группы сравнения на 14-е сутки
К 14-м сут. отмечалась лишь частичная эпите-лизация и незначительная положительная динамика по уменьшению площади раны (табл. 1). Отмечено статистически значимое (р<0.05) уменьшение площади раны у животных опытной группы по сравнению с группой сравнения, уже начиная с 5-х сут. наблюдения. Данная тенденция сохранялась и в дальнейшем.
У крыс опытной группы после нанесения гидрогеля хитозана на раневую поверхность уже к 6-м сут. отмечено уменьшение площади поверхности раны, чем у крыс группы сравнения (табл. 1). На 10-е сут. отмечено отсутствие признаков воспаления и выраженное уменьшение площади раневой поверхности. На 14-е сут. после формирования полнослойной инфицированной раны у большинства животных опытной групп отмечалось формирование раневого струпа, состоятельная эпителизация. частичное восстановление волосяного покрова (рис. 3).
Таблица 1
Изменение площади раневой поверхности у экспериментальных животных
|
Сутки ис-следо-ва-ния |
Группа сравнения, и =20 |
Применение гидрогеля хитозана, и = 20 |
|
1 |
396.3 ±5.4 |
399.2 ±5.8 |
|
3 |
368.8 ±7.3 |
353.6 ±7.1 |
|
5 |
329.1 ± 17.4 |
277.2 ± 11.4 р<0.05* |
|
7 |
288.3 ± 18.4 |
202.1 ±23.5 р<0.01* |
|
10 |
235.6 ±23.7 |
149.8 ±20.6 р<0.01* |
|
14 |
195.3 ±23.6 |
88.9 ± 18.7 р<0.001* |
* р - уровень достоверности различий показателей опытной группы по отношению к группе сравнения.
У оставшихся представителей опытной группы полная эпителизация и восстановление волосяного покрова имелись на 16-е сут.
В установленные сроки животным было произведено бактериологическое исследование отделяемого ран. У животных группы сравнения вплоть до завершения процесса эпителизации отмечалось выявление St. aureus от З ТО 6 КОЕ к 7-м суткам до 3 10’ КОЕ к 20-22-м суткам наблюдения. Кроме того, у 8 крыс была отмечена вторичная контаминация Е. coli в количестве 2 х 104КОЕ.
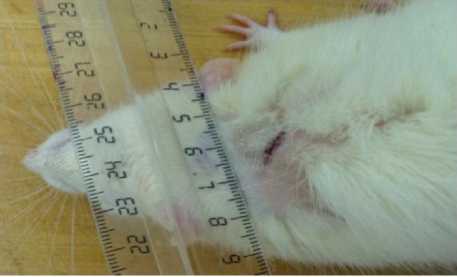
Рис. 3. Экспериментальная гнойная рана у животного опытной группы
При исследовании раневого отделяемого у всех животных опытной группы в первые 14 дней наблюдения отмечалось наличие St. aureus в ране, средняя концентрация которого достигала ЗЮ3 КОЕ; в дальнейшем зафиксировано ее снижение. К моменту полного заживления ран (16-18-е сут.) лишь у 3 животных отмечалось наличие St. aureus в концентрации 3 102 КОЕ. Посевы с поверхности ран остальных животных опытной группы роста не давали.
В те же сроки производилась оценка лейкоцитарной формулы периферической крови, полученной при подрезании кончика хвоста (табл. 2).
Таблица 2
Динамика изменений содержания лейкоцитарной формулы у крыс различных групп
|
Сутки |
Серия |
Лейкоциты, общее содержание |
П/я нейтр. |
С/я нейтр. |
Лимфоциты |
|
3 |
Контрольная группа |
11.7 ± 3.4-107л |
3.3 ±0.8 |
25.1 ±3.7 |
67.4 ±6.9 |
|
Группа сравнения |
29.4 ± 5.2-107л |
19.7 ± 1.7 |
38.1 ±2.1 |
39.1 ± 1.4 |
|
|
Гидрогель хитозана |
27.3 ±8. Г 107л |
16.5 ± 1.2 |
40.8 ±2.3 |
39.0 ±3.7 |
|
|
5 |
Контрольная группа |
10.2 ±2.8-107л |
4.1 ± 1.1 |
23.3 ±2.8 |
69.3 ±5.1 |
|
Группа сравнения |
34.3 ± 12.3 107л |
13.7 ± 1.6 |
32.1 ± 1.4 |
48.5 ±2.2 |
|
|
Гидрогель хитозана |
27.8 ±5.3-107л |
11.0 ±0.8 |
38.6 ± 1.5 р< 0.001* |
45.4 ±2.3 |
|
|
7 |
Контрольная группа |
11.8 ±3.1 107л |
3.7 ±0.9 |
21.3 ±2.8 |
65.4 ±7.3 |
|
Группа сравнения |
21.3 ±2.8- 107л |
10.6 ± 1.2 |
32.0 ± 1.6 |
53.3 ±2.6 |
|
|
Гидрогель хитозана |
14.9 ±4.4-107л |
6.2 ± 1.6 р<0.05* |
29.8 ± 1.5 |
57.4 ± 1.5 |
* р - уровень достоверности различий показателей опытной группы по отношению к группе сравнения.
Динамика изменения цитологических характеристик раневых отпечатков представлена в табл. 3.
При изучении относительного содержания ключевых показателей лейкоцитарной формулы отме чена положительная динамика содержания сегментоядерных нейтрофилов в группе животных, получавших лечение гидрогелем хитозана по отношению к группе сравнения уже на 5-е сут. В те же сроки наблюдения у животных группы сравнения сохранялся дегенеративно-воспалительный тип цитограммы (рис. 4). Статистически значимые различия в содержании палочкоядерных нейтрофилов отмечены к 7-м сут.
Таблица 3 Цитологические показатели дна раневых отпечатков экспериментальных животных в различные сроки заживления
|
Показатели |
Группа сравнения, п = 20 |
Опытная группа, п=20 |
|
1-е сут. наблюдения |
||
|
нейтрофилы |
97.6 ±7.2 |
93.5 ±6.3 |
|
макрофаги |
2.1 ±2.3 |
0.9 ±2.3 |
|
фибробласты и фиброциты |
1.1 ±2.9 |
2.1 ±0.9 |
|
З-и сут. наблюдения |
||
|
нейтрофилы |
89.3 ±3.9 |
93.4 ±6.4 |
|
макрофаги |
10.1 ±7.3 |
7.6 ±2.1 |
|
фибробласты и фиброциты |
0.9 ±3.9 |
1.1 ± 1.8 |
|
5-е сут. наблюдения |
||
|
нейтрофилы |
82.0 ± 1.9 |
79.8 ±2.3 |
|
макрофаги |
10.0 ±7.6 |
10.2 ±6.2 |
|
фибробласты и фиброциты |
6.9 ±4.9 |
8.1 ±4.8 |
|
7-е сут. наблюдения |
||
|
нейтрофилы |
76.1 ± 13.2 |
72.1 ±9.2 |
|
макрофаги |
5.8 ±6.4 |
4.9 ±7.3 |
|
фибробласты и фиброциты |
17.4 ±2.2 |
22.0 ±2.2 |
|
14-е сут. наблюдения |
||
|
нейтрофилы |
25.7 ±3.8 |
30.1 ± 1.8 |
|
макрофаги |
8.9 ±6.2 |
12.2 ±2.3 |
|
фибробласты и фиброциты |
63.2 ± 1.2 |
59.8 ±2.1 |
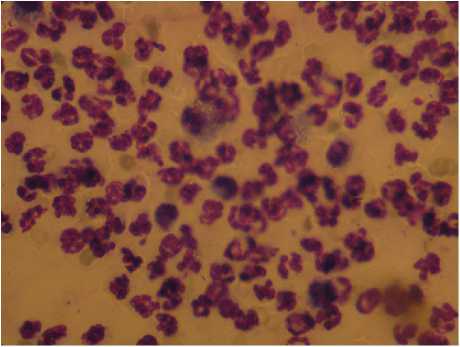
Рис. 4. Отпечаток гнойной раны у животного группы сравнения на 5-е сут. Скопление измененных нейтрофилов и микроорганизмов
Цитологическое исследование клеточного состава раневого дна показало наличие в течение первых суток развития патологического процесса, преобладание дегенеративно измененных сегментоядерных нейтрофилов в сочетании с элементами крови и нитями фибрина.
Если на 3-5-е сут. отмечалось преобладание измененных нейтрофилов, то к 9-м - неизмененных нейтрофилов, единичных лимфоцитов и моноцитов. что сопровождалось снижением экссудации и началом формирования грануляционной ткани. К 15-м сут. в препаратах обнаруживали профибробласты на фоне снижения содержания полиморфноядерных нейтрофилов до 19-22 в поле зрения.
Выводы
Результаты проведенного исследования свидетельствуют об антибактериальном и регенерирующем эффектах гидрогеля хитозана в условиях экспериментальной гнойной раны, вызванной клиническими полиантибиотикорезистентными штаммами St. aureus.
Список литературы Влияние низкомолекулярного хитозана на регенерацию полнослойной гнойной раны в эксперименте
- Бауэр А.М. и др. Регенерация тканей преддверья рта при использовании геля хитозана//Медицина и образование в Сибири. 2011. № 5: электрон. науч. изд. Сибир. гос. мед. ун-та. URL: http://www.ngmu.ru/cozo/mos/article/text_rull.php ?id=529
- Бесчастнов В.В. и др. Результаты микробиологического мониторинга лечения гнойных ран в условиях общехирургического стационара//Совр. технологии в медицине. 2009. № 2. С. 53-56.
- Божкова С.А. Современные принципы диагностики и антибактериальной терапии инфекции протезированных суставов (обзор литературы)//Травматология и ортопедия России. 2011. № 3 (61). С. 128-136.
- Гайдуль К.В., Муконин А.А. Раневая инфекция: этиология, диагностика и антимикробная терапия: краткое пособие для практических врачей. Б.м.: Б.и., 2005. 32 с.
- Марквичева Е.А. Хитин и хитозан: получение, свойства и применение. М.: Наука, 2002. С. 315-326.
- Регенерирующая активность и антибактериальное действие низкомолекулярного хитозана/Т.А. Байтукалов, О.А. Богословская, И.П. Ольховская и др.//Изв. РАН. Сер. биология. 2005. № 6. С. 659-663.
- Чернова В.В. и др. Деструкция хитозана под действием фермента гиалуронидазы//Вестн. Башкир. ун-та. 2009. Т 14, № 1. С. 44-47.
- Van Sprang P.A., Janssen C.R. Toxicity identification or metals: development or toxicity identirication fingerprints//Environmental toxicology and chemistry. 2001. Vol. 20, № 11. P. 2604-2610.


