Влияние новой коронавирусной инфекции на состояние артериального русла у здоровых лиц и больных артериальной гипертензией
Автор: Павленко К.И., Авдеева И.В.
Журнал: Саратовский научно-медицинский журнал @ssmj
Рубрика: Кардиология
Статья в выпуске: 3 т.20, 2024 года.
Бесплатный доступ
Цель: выявление показателей ригидности артерий, которые изменяются после COronaVIrus Disease-2019 (COVID-19). Материал и методы. Всего в анализ включены 112 человек, обследованных до и после начала пандемии новой коронавирусной инфекции: здоровые лица (группы «З» и «З/COVID+») и больные артериальной гипертонией (АГ) (группы «АГ» и «АГ/COVID+»). Проводили изолированно сравнительное исследование в группах здоровых и пациентов с АГ.
Covid-19, артериальная жесткость, артериальная гипертензия, объемная сфигмография
Короткий адрес: https://sciup.org/149146941
IDR: 149146941 | УДК: 616.132 | DOI: 10.15275/ssmj2003278
Текст научной статьи Влияние новой коронавирусной инфекции на состояние артериального русла у здоровых лиц и больных артериальной гипертензией
EDN: WMNAQT
актуальной мировой проблемой. Глобальные масштабы поражения Severe Acute Respiratory Syndrome CoronaVirus 2 (SARS-CoV-2) отражают данные Всемирной организации здравоохранения: на 2023 г. зарегистрировано более 772 млн случаев заболевания, из них приблизительно 7 млн летальных исходов.
С начала пандемии COVID-19 во многих странах были созданы регистры по оценке последствий перенесенного заболевания. Так, по данным исследования «ТАРГЕТ-ВИП» («ПроспекТивный госпитАльный РеГистр пациЕнТов с предполагаемыми либо подтвержденными коронаВИрусной инфекцией (COVID-19) и внебольничной Пневмонией»), за 2 года наблюдения 5,9% погибли [1]. Кроме того, доказана ассоциация смерти в постковидный период с более старшим возрастом, мужским полом, тяжелым течением НКИ [1]. Схожие данные получены учеными США в регистре CORE-19 [2].
Одним из наиболее распространенных последствий COVID-19 является поражение сердечно-сосудистой системы, что связано со способностью вируса SARS-CoV-2 повреждать эндотелиоциты и стимулировать гиперсекрецию коллагеназы и эластазы воспалительными клетками [3]. Описанные механизмы проявляются нарушением структурных и функциональных свойств стенки артерий, раннее проявление которых — повышение их жесткости (АЖ) и развитие эндотелиальной дисфункции [3].
Как в отечественном исследовании «АКТИВ» («Анализ динамики Коморбидных заболеваний у пациенТов, перенесшИх инфицироВание SARS-CoV-2»), так и в работе китайских ученых показано, что предиктором неблагоприятного прогноза COVID-19 служит наличие АГ [4, 5]. Учитывая ее большую распространенность в мировой популяции [6] как наиболее значимого фактора риска сердечно-сосудистых заболеваний (ССЗ), представляется очевидной необходимость поиска параметров поражения артериального русла, которые изменяются после НКИ.
В последнее время активно изучаются биомаркеры, позволяющие прогнозировать тяжелое течение и летальные исходы при COVID-19 [7]. При этом возможности инструментальных методов диагностики освещены в литературе недостаточно. До настоящего момента остается нерешенным вопрос по стратификации риска кардиоваскулярных катастроф у лиц после COVID-19. Исследование параметров АЖ призвано выявить лиц с высокой вероятностью возникновения сердечно-сосудистых событий, что имеет особую важность у людей, перенесших НКИ.
Цель — выявление показателей ригидности артерий, которые изменяются после COVID-19.
Материал и методы. В открытое сравнительное исследование включены 112 здоровых добровольцев и больных АГ 35–65 лет. Исследование выполнялось согласно стандартам Надлежащей клинической практики (Good Clinical Practice) и принципам Хельсинской декларации. До проведения каких-либо процедур обследуемые подписывали согласие, форма которого была одобрена комитетом по этике ФГБОУ ВО «Пензенский государственный университет».
Критерии включения для здоровых лиц (группа «З»): отсутствие патологических изменений (по результатам объективного, лабораторного и инструментального обследований) и регулярного приема каких-либо препаратов; нормальные параметры артериального давления (АД). Для здоровых добровольцев, перенесших НКИ (группа «3/COVID+»), помимо перечисленных критериев, обязательным являлось наличие подтвержденного диагноза COVID-19 с помощью метода полимеразной цепной реакции.
Критерии включения в группу больных АГ (группа «АГ»): уровень систолического АД (САД) 140–179, диастолического АД (ДАД) 90–109 мм рт. ст., а также отсутствие в анамнезе гиполипидемической терапии. Для группы пациентов с АГ, перенесших НКИ (группа «Ar/COVID+»), критерии включения были аналогичными. Кроме того, обязательным было наличие перенесенного COVID-19 (положительный мазок на SARS-CoV-2 методом полимеразной цепной реакции).
Критерии невключения: симптоматическая гипертензия; АД ≥ 180 и 110 мм рт. ст. в анамнезе; острое нарушение мозгового кровообращения/острый коронарный синдром в анамнезе; стенокардия; сахарный диабет, требующий коррекции инсулином; хроническая сердечная недостаточность (III–IV функционального класса по классификации New York Heart Association); тяжелые нарушения функции почек и печени.
Для лиц, перенесших НКИ, ограничением для включения в исследования являлся срок более 6 мес после инфицирования SARS-Cov-2.
Проводили сравнительное исследование в группах здоровых лиц и пациентов с АГ, обследованных до и после начала пандемии COVID-19.
Группа «З» включала 20 здоровых добровольцев (42,4±3,01 года), наблюдавшихся в 2018–2019 гг. Группа «3/COVID+» представлена 27 здоровыми лицами, перенесшими НКИ (41,9±5,6 года).
Группа «АГ» состояла из 34 пациентов, обследованных в 2010–2015 гг. (42 [35; 47] года), группа «Ar/COVID+» — из 31 больного, перенесшего инфицирование SARS-CoV-2 (46 [41; 48] лет).
Обследование проводили после 10 дней washout period, во время которого использовались только препараты короткого действия ситуационно.
Оценивали жалобы, анамнез жизни (наследственность, вредные привычки, наличие перенесенных заболеваний). Объективный осмотр лиц, включенных в исследование, состоял из оценки основных антропометрических показателей, таких как рост, масса тела, с последующим расчетом индекса массы тела, окружность талии, а также измерение АД по методу Короткова.
Биохимический анализ крови (OLYMPUS AU400, OLYMPUS CORPORATION, Япония) проводили с определением липидного профиля: общий холестерин (ОХС), триглицериды (ТГ), холестерина липопротеидов высокой плотности (ХС ЛВП); уровня глюкозы и креатинина. Рассчитывали показатели холестерина липопротеидов низкой плотности (ХС ЛНП) и невысокой плотности (ХС неЛВП) и скорости клубочковой фильтрации (СКФ) по CKD-EPI (Chronic Kidney Desease Epidemiology Collaboration).
С помощью объемной сфигмографии (VS-1000, Fukuda Denshi, Япония) определяли такие показатели, как скорость распространения пульсовой волны в аорте (PWV), скорость распространения пульсовой волны в артериях преимущественно эластического типа справа и слева (R/L — PWV), скорость распространения пульсовой волны в артериях мышечного типа (B — PWV), индекс аугментации (AI), биологический возраст, а также сердечно-лодыжечный сосудистый индекс слева (L-/CAVI 1 ).
Пациентам с АГ проводили суточное мониторирование АД (СМАД, BPLab «Петр Телегин», Россия). Регистрировали среднесуточные, среднедневные и средненочные значения САД, ДАД, ПАД, частоты сердечных сокращений (ЧСС). В зависимости от степени ночного изменения АД выделяли пациентов с нормальным (10-20%, диппер), недостаточным (0-10%, нон-диппер), чрезмерным (>20%, овер-диппер) снижением
Основные факторы риска в группах сравнения, n =112
Таблица 1
Результаты обрабатывали с использованием программы Statistica 13.0 (StatSoft Inc., США). При нормальном распределении данных для сравнительного анализа применяли критерий Стьюдента, результаты представляли в виде среднего арифметического и стандартного отклонения ( М ± SD ); при непараметрическом распределении — критерий Манна — Уитни, данные — в виде медианы и 25; 75 процентилей ( Me [ Q 25%; Q 75%]). При сравнении качественных порядковых переменных использовали критерий χ2. Различия считали статистически значимыми при p <0,05.
Результаты. Длительность от момента инфицирования SARS-CoV-2 до включения в исследование составила 58 (35; 160) дней для здоровых лиц и 120 (38; 174) дней — для пациентов с АГ. Среди лиц, перенесших COVID-19, преобладали амбулаторные больные. В группе «3/COVID+» легкая степень тяжести заболевания отмечена у 20 (74,1%) человек, в группе «Ar/COVID+» — у 29 (93,5%). Были госпитализированы 7 (25,9%) лиц группы «3/COVID+» и 2 (6,5%) больных группы «Ar/cOviD+», у которых заболевание протекало в среднетяжелой форме. Лечение НКИ проводилось в соответствии с действующими временными методическими рекомендациями по профилактике, диагностике и лечению НКИ.
В группе «З» возраст обследуемых составил 42,4±3,0 года, в группе «3/COVID+» — 41,9±5,6 года ( р =0,739); в группах больных АГ — 42 (35; 47) года и 46 (41; 48) лет ( р =0,051) соответственно. В группе «З» отмечено преобладание мужчин, в группах больных АГ — равномерное распределение пациентов по гендерному признаку. У здоровых, перенесших НКИ, зарегистрировано большее количество лиц с отягощенной наследственностью. Группы «АГ» и «Ar/COVID+» были сопоставимы в отношении основных факторов риска ССЗ (табл. 1).
Длительность АГ составила 6 (3,5; 10) и 5 (4; 12) лет соответственно в группах сравнения ( р =0,674). АГ 1-й степени диагностирована в группе «АГ» у 19 пациентов, в группе «Ar/COVID+» — у 17 обследуемых; 2-я степень АГ — у 15 и 14 человек соответственно
( р =0,933). Пациенты в группах сравнения с сопоставимой частотой использовали блокаторы ренин-ан-гиотензин-альдостероновой системы — 12 (35,35) и 15 (43,4%) человек ( р =0,285), антагонисты кальция — 3 (8,8%) и 2 (6,5%), диуретики — 5 (14,7%) и 4 (9,7%) обследуемых ( р =0,834) соответственно. При этом в группе «АГ» 7 человек использовали β-адреноблокаторы при отсутствии применения этой группы препаратов в группе «Ar/COVID+» ( р =0,008). Принимали 2 лекарственных средства и более 3 (8,8%) и 4 (12,9%) обследуемых соответственно ( р =0,597). До включения в исследования не лечились по 14 пациентов в каждой группе, из них впервые выявлена АГ была у 1 человека группы «АГ» и у 7 лиц группы «Ar/COVID+» ( р =0,017).
Гипертрофия левого желудочка отмечена у 8 (23,5%) и 5 (16,1%) больных в группах сравнения ( р =0,457).
В группе «3/COVID+» отмечены более высокие показатели ХС неЛВП, ХС ЛНП и более низкие значения ХС ЛВП ( p =0,038; 0,032; 0,006) при сравнении с группой «З». Пациенты с АГ, обследованные до и после начала пандемии НКИ, по параметрам липидного профиля не различались ( p >0,05) (рис. 1).
В группах здоровых лиц уровень глюкозы составил 5,2±0,4 и 5,1±0,5 ммоль/л соответственно ( р =0,364); в группах больных АГ — 5,6 (5,3; 6,1) и 5,5 (4,9; 5,8) ммоль/л соответственно ( р =0,211). СКФ, рассчитанная по CKD-EPI, также достоверно не отличалась в группах сравнения: 88,2 (86,9; 89,6) мл/мин/1,73 м2 — в группе «3» и 87,8±12,7 мл/мин/1,73 м2 — в группе «3/COVID+» ( р =0,646); 83,8±16,6 мл/мин/1,73 м2— в группе «АГ» и 85 (78; 98) мл/мин/1,73 м2 — в группе «Ar/COVID+» ( р =0,341).
Дополнительно определяли категорию СКФ (по KDIGO): у здоровых добровольцев С1 определена у 3 (15%) и 12 (44,4%) человек ( р =0,015), С2 — у 17 (75%) и 15 (55,6%) лиц ( р =0,033) соответственно. В группе «АГ» категория С1 зарегистрирована у 13 (38,2%) больных, С2 — у 18 (52,9%), С3 — у 3 (8,9%) обследуемых; в группе «Ar/COVID+» — 11 (35,5%), 20 (64,5%) и 0 (0%) пациентов ( р =0,819; р =0,345; р =0,091) соответственно.
Результаты СМАД продемонстрировали, что среднесуточные, средние дневные и ночные значения АД были сопоставимы в группах «АГ» и «Ar/COVID+». При этом отмечено достоверное отличие пациентов по ночному уровню RWTT (табл. 2).
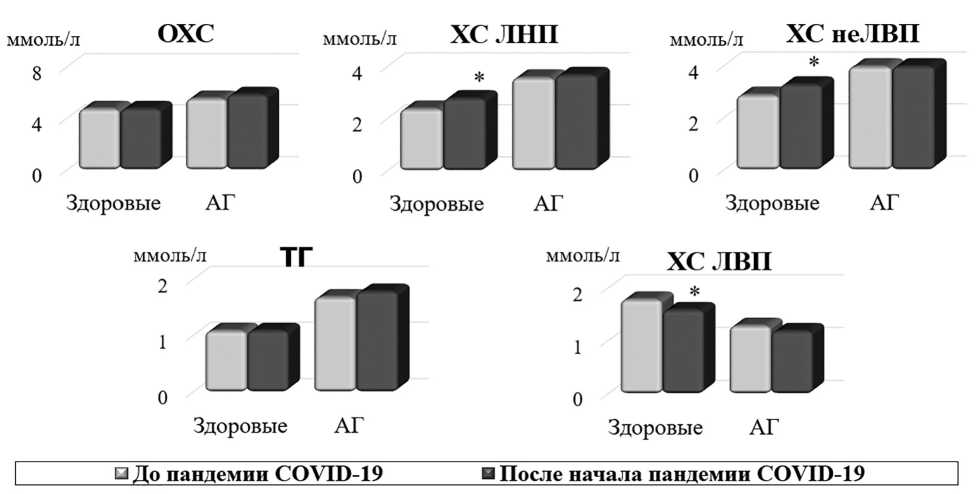
Рис. 1. Параметры липидного профиля в группах сравнения. Здесь и далее в рис. 2: *значимые различия между группами
Таблица 2
|
Показатель |
Группа |
р |
|
|
«АГ» ( n =34) |
«Ar/COVID+» ( n =31) |
||
|
Среднесуточные параметры |
|||
|
САД, мм рт. ст. |
139,1±7,7 |
141,1±10,6 |
0,345 |
|
ДАД, мм рт. ст. |
88,6±6,5 |
89,6 (86; 93) |
0,799 |
|
ЧСС, уд/мин |
75,9±9,5 |
75,3±5,9 |
0,982 |
|
ПАД, мм рт. ст. |
50,5±5,7 |
51,4±7,6 |
0,438 |
|
RWTT, мс |
137,1±11,3 |
134 (127; 146) |
0,284 |
|
СДао, мм рт. ст. |
128,2±7,2 |
129 (124; 135) |
0,569 |
|
ДДао, мм рт. ст. |
90,4±7,4 |
90 (88; 96) |
0,424 |
|
ПДао, мм рт. ст. |
37,5±4,5 |
38 (35; 40) |
0,871 |
|
Aixao,% |
10,9±14,9 |
3 (-4; 20,5) |
0,569 |
|
Средние дневные параметры |
|||
|
САД, мм рт. ст. |
144,1±8,2 |
144 (137; 150) |
0,966 |
|
ДАД, мм рт. ст. |
93,2±6,8 |
92,2±6,2 |
0,587 |
|
ПАД, мм рт. ст. |
50,9±5,9 |
52,7±7,9 |
0,345 |
|
RWTT, мс |
132,4±11 |
132 (125; 146) |
0,516 |
|
СДао, мм рт. ст. |
132,7±6,8 |
132 (127; 138) |
0,886 |
|
ДДао, мм рт. ст. |
95,2±6,9 |
94,4±6,4 |
0,669 |
|
ПДао, мм рт. ст. |
37,4±4,4 |
39 (35; 41) |
0,385 |
|
Aixao,% |
9,7±15,8 |
6,9±13,9 |
0,491 |
|
Средние ночные параметры |
|||
|
САД, мм рт. ст. |
118 (115; 129) |
125 (118; 138) |
0,133 |
|
ДАД, мм рт. ст. |
75,4±7,9 |
78±8,8 |
0,118 |
|
ПАД, мм рт. ст. |
47,6±6,9 |
47,7±8,3 |
0,942 |
|
RWTT, мс |
144,6±12,8 |
133 (129; 142) |
0,023 |
|
СДао, мм рт. ст. |
112,5 (110; 124) |
117 (110; 129) |
0,206 |
|
ДДао, мм рт. ст. |
78,6±9,2 |
82,8±9,4 |
0,106 |
|
ПДао, мм рт. ст. |
37,4±4,9 |
37,9±6,6 |
0,783 |
|
Aixao,% |
18,5 (2; 31) |
12,6±19,9 |
0,354 |
|
Примечание. PWV ao — скорость распространения пульсовой волны в аорте. |
|||
Параметры суточного мониторирования артериального давления в группах сравнения, n =65
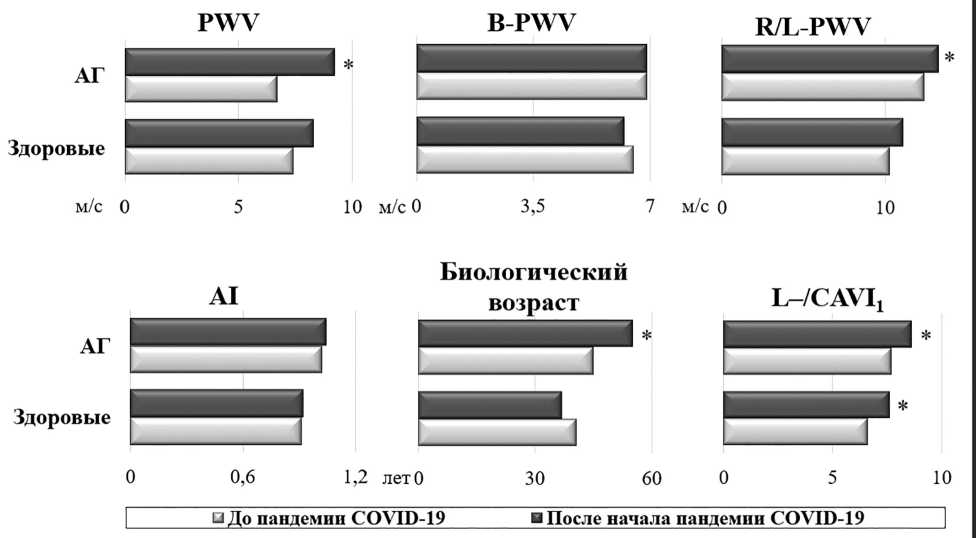
Рис. 2. Сравнение показателей артериальной ригидности по данным объемной сфигмографии
Анализ суточного профиля АД не выявил межгрупповых различий по САД: диппер — 24 (70,6%) и 20 (64,5%) пациентов ( p =0,602), нон-диппер — 9 (26,5%) и 8 (25,8%) больных ( p =0,952), овер-дип-пер — 1 (2,9%) и 2 (6,5%) человека ( p =0,501), найт-пикер — 0 (0%) и 1 (3,2%) пациент ( p =0,292) соответственно. При сопоставимом количестве дипперов, нон-дипперов и найт-пикеров зафиксировано преобладание овер-дипперов в группе «АГ» по степени ночного снижения ДАД: диппер — 20 (58,8%) и 21 (67,7%) ( p =0,457), нон-диппер — 3 (8,8%) и 6 (19,4%) ( p =0,221), овер-диппер — 11 (32,4%) и 3 (9,7%) ( p =0,027), найт-пикер — 0 (0%) и 1 (3,2%) ( p =0,292) соответственно.
По данным объемной сфигмографии отмечено повышение L-/CAVI 1 у здоровых и больных АГ, перенесших COVID-19. У пациентов с АГ при сопоставимом уровне В-PWV и AI зарегистрированы более высокие значения PWV, R/L-PWV и биологического возраста в группе «АГ/COVID+» (рис. 2).
У здоровых лиц, обследованных до и после пандемии НКИ, отмечено соответствие биологического и паспортного возрастов. При этом у больных группы «АГ» биологический возраст опережал паспортный на 2 года ( р =0,032), у лиц группы «АГ/COVID+» — на 9 лет ( р =0,001).
Обсуждение. В последнее время появляется все больше данных, демонстрирующих отягощающее влияние COVID-19 на течение кардиоваскулярной патологии, что проявляется развитием или декомпенсацией уже имеющихся ССЗ. Показано, что НКИ не ограничивается острым периодом заболевания, а приводит к формированию долгосрочных последствий [8], часть из которых продолжает изучаться.
Результаты международного регистра АКТИВ продемонстрировали, что среди вновь диагностированных заболеваний за 12 мес наблюдения на долю АГ приходится 24,63% случаев. Показано также, что COVID-19 способствовал росту заболеваемости АГ в 4,4 раза (при сравнении с данными исследования «ЭПОХА») и в 7,0 раза (при сравнении с данными Росстата за 2019 г.) [4]. Данные исследования «случай — контроль» продемонстрировали, что у участников с НКИ в анамнезе САД было значимо выше, при сравнении с неболевшими лицами [9].
Особенности метаболизма вируса SARS-CoV-2, его проникновение в клетку с использованием липидной оболочки, а также иммуноопосредованное нарушение метаболизма — факторы, определяющие развитие дислипидемии у пациентов после COVID-19 [10]. В когортном исследовании зарегистрированы более высокие уровни ОХС, ХС ЛНП и ТГ у пациентов, госпитализированных по поводу НКИ, по сравнению с группой амбулаторных больных [11]. В другой зарубежной работе также выявлено повышение ТГ и ХС ЛНП через 3 мес после выздоровления в отличие от неболевших лиц [9]. В настоящем исследовании отмечено достоверное повышение ОХС, ХС неЛВП и снижение ХС ЛВП у здоровых лиц, перенесших COVID-19, при сравнении с группой «З». Отсутствие достоверных отличий между группами пациентов с наличием АГ, вероятно, связано с небольшим размером выборки.
АЖ является интегральным маркером сердечно-сосудистого риска, которая отражает феномен старения сосудов [12]. Еще в 2020 г. сделано предположение о том, что повышение артериальной ригидности может стать важным последствием НКИ [13]. Согласно литературным данным, COVID-19 способствует развитию изменений АЖ даже у здоровых лиц [14]. При этом у больных АГ выявляются более выраженные изменения сосудистой жесткости [3]. По данным I. Ikonomidis и соавт. (2022 г.) отмечены повышенные значения АЖ через 12 мес наблюдения при сравнении с контрольной группой [15].
Данные метаанализа продемонстрировали корреляцию между инфицированием SARS-CoV-2 и увеличением каротидно-феморальной скорости распространения пульсовой волны [16]. В работе 2021 г. S. M. Ratchford и соавт. показано повышение данного параметра у лиц с диагностированным COVID-19 в отличие от неболевших [17]. Учеными представлены данные об увеличении L-/CAVI 1 после инфицирования SARS-CoV-2, кроме того, повышенные уровни индекса сохранялись через 7 мес наблюдения [18].
В проведенном нами исследовании у здоровых лиц, перенесших НКИ, отмечено достоверное увеличение L-/CAVI1, при сравнении с контрольной группой. У пациентов группы «Ar/COVID+» зарегистрировано повышение PWV, R/L-PWV, биологического возраста, а также L-/CAVI1
COVID-19 способствует ра.ннему сосудистому старению, что проявляется несоответствием между биологическим и паспортным возрастом [19]. В настоящей работе у больных АГ, перенесших COVID-19, биологический возраст на 9 лет опережал значения паспортного, что, вероятно, явилось следствием инфицирования SARS-Cov-2.
По литературным данным описана связь RWTT с коронарным кровотоком, поэтому представляет интерес обнаружение более низких значений данного показателя у пациентов с АГ после COVID-19 [20].
Заключение. В настоящем исследовании у здоровых лиц, перенесших COVID-19, отмечены нарушения липидного профиля, а также повышение L-/CAVI 1 при сравнении с группой неболевших. У больных АГ после COVID-19 отмечено негативное изменение большинства показателей АЖ.
Вклад авторов: все авторы сделали эквивалентный вклад в подготовку публикации.
Список литературы Влияние новой коронавирусной инфекции на состояние артериального русла у здоровых лиц и больных артериальной гипертензией
- Lukyanov MM, Andreenko EYu, Martsevich SYu, et al. Two-year outcomes in patients after hospitalization for COVID-19: data from the TARGET-VIP registry. Cardiovascular Therapy and Prevention. 2023; 22 (10): 3757. (In Russ.) Лукьянов М. М., Андреенко Е. Ю., Марцевич С. Ю. и др. Исходы за двухлетний период наблюдения больных после госпитального лечения по поводу COVID-19 (данные регистра ТАРГЕТ-ВИП). Кардиоваскулярная терапия и профилактика. 2023; 22 (10): 3757. DOI: 10.15829 / 1728‑8800‑2023‑3757
- Giannis D, Allen SL, Tsang J, et al. Postdischarge thromboembolic outcomes and mortality of hospitalized patients with COVID-19: the CORE-19 registry. Blood. 2021; 137 (20): 2838–47. DOI: 10.1182 / blood. 2020010529
- Vidya G, Sowganthikashri A, Madhuri T, et al. Arterial stiffness and COVID-19: potential association with diabetes, hypertension and obesity: A cross sectional study. Maedica (Bucur). 2023; 18 (3): 447–54. DOI: 10.26574 / maedica. 2023.18.3.447
- Arutyunov GP, Tarlovskaya EI, Arutyunov AG, et al. Clinical features of post-COVID period. Results of an International Register “Dynamics Analysis of Comorbidities in SARSCoV- 2 Survivors (ACTIV SARS-CoV-2)” (12‑month follow-up). Russian Journal of Cardiology. 2023; 28 (4): 5424. (In Russ.) Арутюнов Г. П., Тарловская Е. И., Арутюнов А. Г. и др. Вновь диагностированные заболевания и частота их возникновения у пациентов после новой коронавирусной инфекции. Результаты международного регистра «Анализ динамики коморбидных заболеваний у пациентов, перенесших инфицирование SARS-CoV-2 (АКТИВ SARS-CoV-2)» (12 мес наблюдения). Российский кардиологический журнал. 2023; 28 (4): 5424. DOI: 10.15829 / 1560‑4071‑2023‑5424
- Gu T, Chu Q, Yu Z, et al. History of coronary heart disease increased the mortality rate of patients with COVID-19: A nested case-control study. BMJ Open. 2020; 10 (9): e038976. DOI: 10.1136 / bmjopen-2020-038976
- NCD Risk Factor Collaboration (NCD-RisC). Worldwide trends in hypertension prevalence and progress in treatment and control from 1990 to 2019: A pooled analysis of 1201 population-representative studies with 104 million participants. Lancet. 2021; 398 (10304): 957–80. DOI: 10.1016 / S0140- 6736(21)01330-1
- Gumerov RM, Gareeva DF, Davtyan PA, et al. Serum biomarkers of cardiovascular complications in COVID-19. Russian Journal of Cardiology. 2021; 26 (2S): 4456. (In Russ.) Гумеров Р. М., Гареева Д. Ф., Давтян П. А. и др. Предикторные сывороточные биомаркеры поражения сердечно-сосудистой системы при COVID-19. Российский кардиологический журнал. 2021; 26 (S2): 4456. DOI: 10.15829 / 1560‑4071‑2021‑4456
- Bunova SS, Okhotnikova PI, Skirdenko YuP, et al. COVID-19 and cardiovascular comorbidity: novel approaches to reduce mortality. Cardiovascular Therapy and Prevention. 2021; 20 (4): 2953. (In Russ.) Бунова С. С., Охотникова П. И., Скирденко Ю. П. и др. COVID-19 и сердечно-сосудистая коморбидность: поиск новых подходов к снижению смертности. Кардиоваскулярная терапия и профилактика. 2021; 20 (4): 2953. DOI: 10.15829 / 1728‑8800‑2021‑2953
- Gameil MA, Marzouk RE, Elsebaie AH, et al. Long-term clinical and biochemical residue after COVID-19 recovery. Egypt Liver J. 2021; 11 (1): 74. DOI: 10.1186 / s43066‑021‑00144‑1
- Wrona M, Skrypnik D. New-onset diabetes mellitus, hypertension, dyslipidaemia as sequelae of COVID-19 infectionsystematic review. Int J Environ Res Public Health. 2022; 19 (20): 13280. DOI: 10.3390 / ijerph192013280
- Dennis A, Wamil M, Alberts J, et al; COVERSCAN study investigators. Multiorgan impairment in low-risk individuals with post-COVID-19 syndrome: a prospective, community-based study. BMJ Open. 2021; 11 (3): e048391. DOI: 10.1136 / bmjopen-2020-048391
- Podrug M, Koren P, Dražić Maras E, et al. Long-termadverse effects of mild COVID-19 disease on arterial stiffness, and systemic and central hemodynamics: A pre-post study. J Clin Med. 2023; 12 (6): 2123. DOI: 10.3390 / jcm12062123
- Varga Z, Flammer AJ, Steiger P, et al. Endothelial cell infection and endotheliitis in COVID-19. Lancet. 2020; 5 (2): 1417–18. DOI: 10.1016 / S0140-6736(20)30937-5
- Rodilla E, López-Carmona MD, Cortes X, et al; SEMI–COVID-19 Network. Impact of arterial stiffness on all-cause mortality in patients hospitalized with COVID-19 in Spain. Hypertension. 2021; 77 (3): 856–67. DOI: 10.1161 / HYPERTENS IONAHA.120.16563
- Ikonomidis I, Lambadiari V, Mitrakou A, et al. Myocardial work and vascular dysfunction are partially improved at 12 months after COVID-19 infection. Eur J Heart Fail. 2022; 24 (4): 727–9. DOI: 10.1002 / ejhf.2451
- Jannasz I, Pruc M, Rahnama-Hezavah M, et al. The impact of COVID-19 on carotid-femoral pulse wave velocity: A systematic review and meta-analysis. J Clin Med. 2023; 12 (17): 5747. DOI: 10.3390 / jcm12175747
- Ratchford SM, Stickford JL, Province VM, et al. Vascular alterations among young adults with SARS-CoV-2. Am J Physiol Heart Circ Physiol. 2021; 320 (1): H404–10. DOI: 10.1152 / ajpheart.00897.2020
- Can Y, Kocayigit I, Kocayiğit H, et al. Ongoing effects of SARS-CoV-2 infection on arterial stiffness in healthy adults. Angiology. 2023; 75 (2): 116–21. DOI: 10.1177 / 00033197231183227
- Badaras I, Laučytė-Cibulskienė A. Vascular aging and COVID-19. Angiology. 2023; 74 (4): 308–16. DOI: 10.1177 / 00033197221121007
- Vasilieva IN, Chesnikova AI, Klimenkova OS, et al. Evaluation of the effectiveness of drug treatment in patients with arterial hypertension and insomnia. South Russian Journal of Therapeutic Practice. 2021; 2 (4): 49–59. (In Russ.) Васильева И. Н., Чесникова А. И., Клименкова О. С. и др. Оценка эффективности медикаментозного лечения пациентов с артериальной гипертензией и инсомнией. Южно-Российский журнал терапевтической практики. 2021; 2 (4): 49–59. DOI: 10.21886 / 2712‑8156‑2021‑2‑4‑49‑59


