Влияние окислителя на кинетические закономерности процесса выщелачивания урана из руд месторождений Зауралья
Автор: Клюшников А.М., Газалеева Г.И.
Журнал: Вестник Восточно-Сибирского государственного университета технологий и управления @vestnik-esstu
Статья в выпуске: 4 (43), 2013 года.
Бесплатный доступ
Изучены закономерности сернокислотного выщелачивания упорных забалансовых урановых руд Зауралья. Было показано значительное влияние температуры, а также добавок солей железа (III) и нитрита натрия на показатели выщелачивания. Показано, что использование окислителей позволяет повысить скорость выщелачивания в 1,25-1,3 раза. Были найдены оптимальные условия проведения процесса, обеспечивающие извлечение в раствор до 55% урана.
Выщелачивание, уран, нитрит натрия, железо (iii), серная кислота
Короткий адрес: https://sciup.org/142148159
IDR: 142148159 | УДК: 66.061.3:669.2/8
Текст научной статьи Влияние окислителя на кинетические закономерности процесса выщелачивания урана из руд месторождений Зауралья
В работе приведены исследования по изучению кинетических закономерностей выщелачивания забалансовых руд урана из руд одного из месторождений Зауральского региона. Целью исследований было определение влияния добавок окислителя на величину энергии активации химической реакции выщелачивания урана, что позволит сделать вывод о лимитирующей стадии реакции, а также о способах интенсификации процесса выщелачивания. С целью выявления связи извлечения урана с содержанием окислителей была поставлена цель определения порядка реакции по железу (III).
Как известно, выщелачивание урановых руд кислыми растворами протекает преимущественно по схеме
2Fe3+ + UO 2 = 2Fe2+ + UO 2 2+. (1)
Таким образом, процесс протекает преимущественно с участием солей железа (III).
Кинетические параметры выщелачивания определялись по стандартной методике [1]. Массовое соотношение фаз Ж:Т было принято равным 1:20 исходя из того, чтобы в процессе выщелачивания убыль концентрации выщелачивающего реагента была пренебрежимо малой.
При всех определениях кинетических параметров в соответствие с рекомендациями [1] производили предварительное контактирование образца руды с водой с целью извлечения водорастворимого урана, окисленного при транспортировке рудных кернов, и мешающего кинетическим определениям. Выявлено, что водой извлекается 18,0% рудного урана. В дальнейшем эта цифра не учитывалась при расчете кинетических показателей. Предварительными рентгенографическими исследованиями, а также с помощью микрозондового анализа установлено, что остаточный уран в руде после водной промывки был представлен полностью в виде соединений урана (IV), заключенных на 38 % в виде минерала настурана, 20%
-
- коффинита, и около 42 % - браннерита. В опытах использовались образцы руды, содержащей 0,013 % урана. Данная руда технологически относится к упорным рудам, извлечение урана из которой затруднено вследствие наличия высокого содержания браннерита. Руда представляла собой песчаную породу естественной крупности (100 % класса минус 1 мм). Поскольку в реальных условиях руды Зауралья отрабатываются методом подземного выщелачивания, измельчение руды не производилось.
Эксперименты проводились в агитаторе с импеллерным перемешивающим устройством при скорости вращения импеллера, обеспечивающей максимальные показатели скорости выщелачивания. Ранее определено, что в процессах выщелачивания оптимальным является поддержание концентрации железа (III) 1 г/дм3 и нитрита натрия не выше 2 г/дм3 [1,2]. Указанные значения концентраций использованы в данных исследованиях.
Частный порядок реакции по j-ному компоненту (n j ) можно найти по методу Вант-Гоффа [3] по уравнению:
ln V 2 / V 1 (2)
n j = ln Cj2 / C j1
или построением логарифмической зависимости по уравнению ln V = ln K + nj * ln Cj, (3)
где Сj1, C j2 - концентрации компонента в момент времени 1 и 2;
-
V 1 , V 2 – скорость химической реакции в момент времени 1 и 2.
Для большей точности оперируем графическим способом, основанным на уравнении (3). Очевидно, что построение зависимости в координатах «lnCj – lnV» можно заменить зависимостью «lnCj - ln(dw/dt)» (где w - степень извлечения урана в раствор, а dw/dt - производная, найденная по кривой численными или графическими способами).
В качестве значений скоростей для удобства оперируем значениями скоростей в начальный момент времени, легко находимым по кинетическим кривым на рисунке 1 численным дифференцированием.
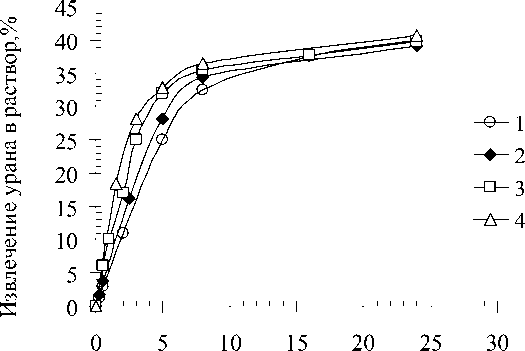
Продолжительность эксперимента, ч
Рис. 1. Зависимости извлечения урана в раствор от времени при следующих значениях начальной концентрации Fe(III) в растворе, г/дм3: 0,25 (1); 0,5(2); 1,0(3); 2,0(4)
По полученным данным видно, что начальная скорость реакции остается постоянной длительное время, примерно до достижения степени извлечения 37 % (с учетом водорастворимого урана - 55 %). При более высоких степенях извлечения кинетическая кривая выходит на плато, а значения скорости резко снижаются. Важно отметить, что оба участка кривой, соответствующих временам 0-5 ч и 8-24 ч, практически линейны, то есть выщелачивание протекает в данных промежутках времени с постоянной скоростью.
Данные линейные области отделяются друг от друга отчетливым изломом. Эти участки соответствуют выщелачиванию различных минеральных форм урана. Начальная область соответствует минеральным образованиям, сравнительно легко и быстро переходящим в раствор, причем скорость их растворения сильно зависит от концентрации окислителя. Вторая линейная область соответствует минеральным образованиям, сравнительно труднорастворимым, слабо подверженным влиянию окислителя. Во второй области скорость реакции значительно замедляется во времени, что указывает на вероятное лимитирующее действие внут-ридиффузионных процессов. Поэтому определение всех кинетических параметров проводим для данных двух участков: в начальный момент времени, а также при степени выщелачивания, равной 37 %.
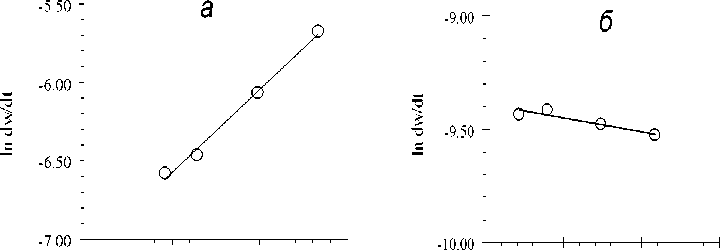
-6.00 -5.00 -4.00 -3.00 -5.50 -4.50 -3.50 -2.50
In C InC
Рис. 2. Логарифмические зависимости для определения порядка реакции по железу (III) : а - в начальный момент реакции при w=0 %; б - в момент при w=37%
В результате графическим методом по рисунку 2 а находим, что для минералов урана, вступающих в реакцию в начальный момент, порядок реакции равен 0,52 ±0,04 (здесь и далее при нахождении тангенса линейной функции рассчитывается по соответствующей методике [4], также доверительный интервал для уровня значимости р=0,95).
Для сравнения построим аналогичный график логарифмической зависимости для точки, соответствующей значению w=37,0% (рис. 2 б). По графику находим, что порядок равен нулю, то есть на данном участке практически отсутствует зависимость скорости выщелачи- вания от наличия окислителя.
Для определения энергии активации процесса при отсутствии в растворе ионов трехвалентного железа проводится снятие кинетических кривых выщелачивания при различных температурах (рис. 3). Концентрация железа в процессе опыта составляет за счет перехода в раствор рудного железа около 10 мг/дм3, что, однако, не является нарушением условий эксперимента, поскольку все железо в растворе в данных условиях количественно находится в двухвалентном состоянии.
Энергию активации находим графическим методом, используя уравнение Аррениу- са [3]:
d ln k _ E dT ” R * T2 .
При интегрировании этого уравнения получим зависимость, которую непосредственно используем в определении энергии активации:
ln (w dn _ E i _ 1
( d w / d t ) T2,w i R T 1 T 2 , где Е - энергия активации (кДж/моль);
T i,2 - температура (К);
w - степень извлечения полезного компонента;
R – универсальная газовая постоянная ( 8,314 Дж/моль ).
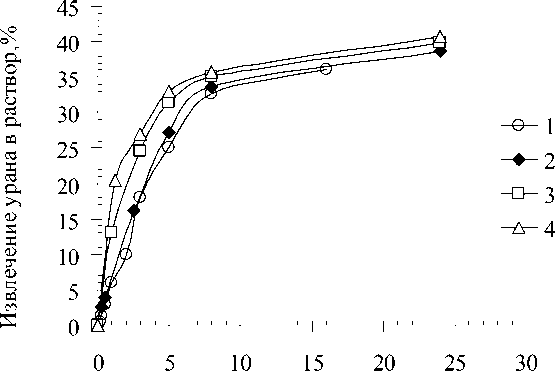
Продолжительность эксперимента, ч
Рис. 3. Кинетические кривые выщелачивания урановой руды раствором серной кислоты без добавок реагентов при различных температурах: 20оС (1); 40 оС (2); 60оС (3); 80оС (4)
Выражение (5) представляет собой уравнение прямой в координатах lndw/dt - 1/T, где тангенс угла наклона равен Е/ R. Таким образом, значения скорости находятся в условиях одинакового значения степени извлечения.
Для определения энергии активации строим логарифмическую зависимость lndw/dt - 1/T. В качестве точек для нахождения производной по скорости выбираем две характерные точки: при w = 0 и w=37 % (соответствует выходу кривой на плато).
Таким образом, находим два значения энергии активации для каждого из двух участков кинетической кривой.
Обрабатывая соответствующим образом кривые, изображенные на рисунке 4 а, получим логарифмические зависимости, изображенные на рисунке 4 б.
Получим значение энергии активации для начального момента реакции:
E A = 2540,03 *8,314 = 21,1 (кДж/моль).
Значение энергии активации для начального момента реакции, соответствующего w=37,0 %, составляет
E A = 105,12 *8,314 = 0,87 (кДж/моль).
Энергию активации в условиях присутствия избытка железа (III) определяем по схеме, описанной ранее. В процессе опыта убыль концентрации железа на восстановительные реакции сравнительно невелика (ввиду большого объема реакционного сосуда), поэтому можно принять концентрацию Fe(III) в процессе опыта неизменной.
Обрабатывая данные рисунка 5 стандартными методами, получим значение энергии активации для начального момента времени реакции
E A = 1893,2 *8,314 = 15,74 (кДж/моль).
Энергия активации для момента времени при w=37% составит по данным рисунка 5
E A = 106,26 *8,314 = 0,88 (кДж/моль).
Таким образом, ввод в раствор ионов железа не приводит к изменению лимитирующей стадии на данном временном отрезке выщелачивания, а также совершенно не вызывает его ускорения.
По данным рисунка 6 можно определить, что значение энергии активации для начального момента реакции
E A = 1459,4 * 8,314 = 11,86 (кДж/моль).
Энергия активации для момента при w=37% составит
E A = 107,33 * 8,314 = 0,893 (кДж/моль).
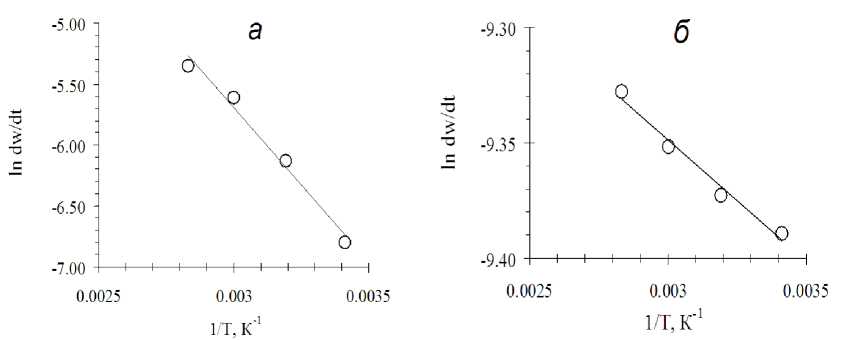
Рис. 4. Логарифмическая зависимость для определения энергии активации в отсутствии железа в растворе в начальный момент реакции: а - при w=0 %; б - в момент при w=37%
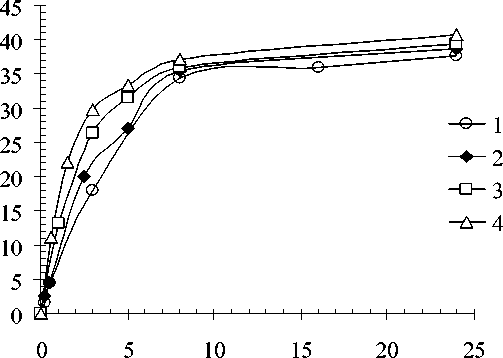
Продолжительность эксперимента, ч
Рис. 5. Кинетические кривые выщелачивания урановой руды раствором серной кислоты в присутствии 1 г/дм3 Fe(III) при различных температурах:
20оС (1); 40 оС (2); 60оС (3); 80оС (4)
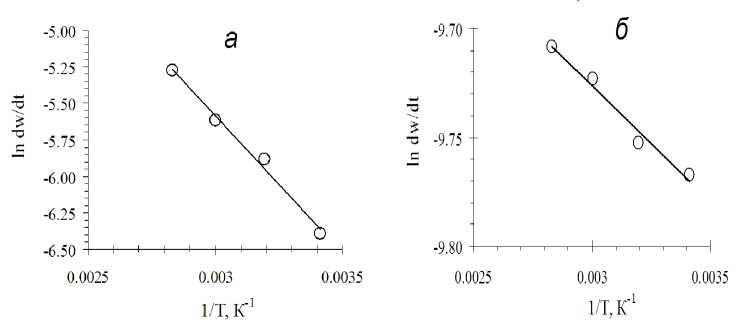
Рис. 6. Логарифмическая зависимость для определения энергии активации в присутствии
1 г/дм3 Fe(III) в растворе в начальный момент реакции: а - при w=0 %; б - в момент при w=37%
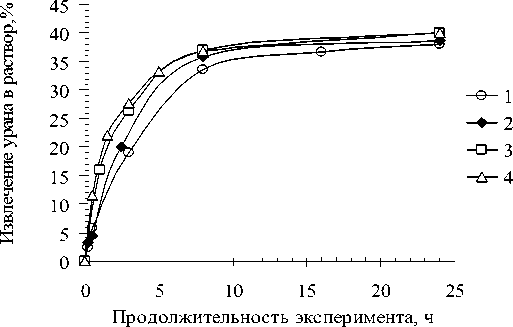
Рис. 7. Кинетические кривые выщелачивания урановой руды раствором серной кислоты в присутствии 2 г/дм3 NaNO 2 при различных температурах: 20оС (1); 40 оС (2); 60оС (3); 80оС (4)
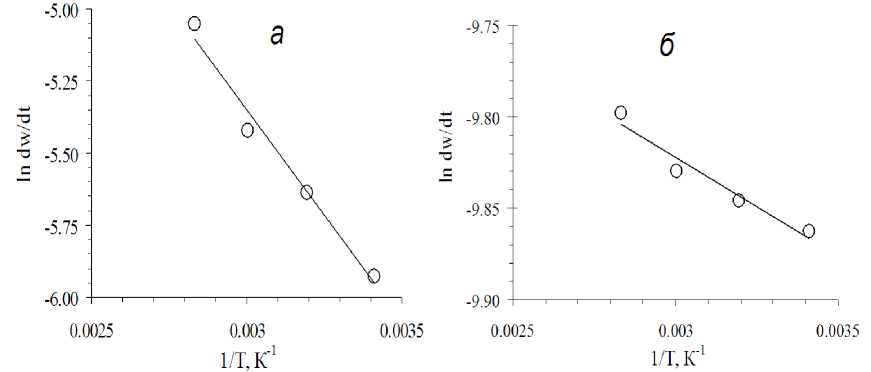
Рис. 8. Логарифмическая зависимость для определения энергии активации в присутствии 2 г/дм3 NaNO 2 в растворе в начальный момент реакции: а - при w=0 %; б - в момент при w=37%
Результаты определения энергии активации для различных временных участков и при различных условиях приведены в сводной таблице. Данные приведены с учетом соответствующей математической обработки (рассчитаны доверительные интервалы на уровне значимости 0,95 согласно [4]).
Таблица
|
Состав раствора в опыте |
Значения энергии активации (кДж/моль) при разных значениях извлечения урана в раствор (W) |
|
|
w=0% |
w=37% |
|
|
2 г/дм3 NaNO 2 |
12±1 |
0,9±0,1 |
|
1 г/дм3 Fe(III) |
15±2 |
0,88±0,1 |
|
окислитель отсутствует |
21±2 |
0,87±0,2 |
По данным таблицы видно, что на начальной стадии в условиях отсутствия окислителя процесс протекает в переходном диффузионно-кинетическом режиме. Значение энергии активации на данной стадии в отсутствии окислителей, составляющее 21 кДж/моль, превышает значения, характерные для диффузионных режимов (8-10 кДж/моль), но не достигает высоких значений, характерных для кинетического режима (свыше 40 кДж/моль). Очевидно, что на этой стадии целесообразно применение катализаторов процесса окисления железа [3,
-
5] . В качестве катализатора можно использовать, в частности, соли азотистой кислоты. Взаимодействие данных солей с технологическими растворами сводится к протеканию реакции
Fe2+ + NO 2 - + 2H+ = Fe3+ + NO+ H 2 O. (6)
Образующиеся соли трехвалентного железа вновь вовлекаются во взаимодействие по реакции (1), в результате чего реализуется каталитический механизм выщелачивания урана, в котором выщелачивающими реагентами служат ионы железа (III), а катализаторами - нит-рит-ионы.
Как видно из рисунков, а также исходя из предполагаемого механизма, нитрит натрия оказывается именно таким катализатором, позволяющим понизить энергию активации процесса: введение нитрита натрия обеспечивает снижение значения энергии активации с 21 до 12-15 кДж/моль, то есть до значений, характерных для диффузионных режимов выщелачивания. Таким образом, кинетические затруднения полностью исчерпываются, и процесс переходит во внутридиффузионный режим.
При определении энергии активации, соответствующей участку с высокой степенью выщелачивания, получены низкие значения, на уровне 1 кДж/моль, свидетельствующие о лимитировании процесса внутренней диффузией через твердую оболочку минерала [5]. В то же время на стадии довыщелачивания урана (при достижении извлечения около 55%) влияние реагентов-окислителей на кинетику выщелачивания отсутствует. Это свидетельствует о скрытокристаллической структуре урановых минералов, подвергаемых выщелачиванию на данном этапе, а также объясняет отсутствие влияния катализаторов на кинетику выщелачивания. Использование добавок NaNO 2 и солей железа (III) приводит к устранению кинетических затруднений процесса на начальной стадии выщелачивания, что определяется по снижению значения энергии активации с 21 до 15 и 12 кДж/моль соответственно, а также по значительному ускорению процесса (в 1,25-1,3 раза).
Значение порядка реакции выщелачивания на первой стадии составляет 0,52±0,04, на второй - равно нулю. Это указывает на большую тесноту связи выхода урана в раствор на первой стадии с концентрацией растворителя, характерную для химической кинетики, и подтверждает наличие внутридиффузионной кинетики на второй стадии.
Выводы
Изучены кинетические закономерности агитационного выщелачивания образца упорной забалансовой руды Зауральского региона в присутствии окислителей. На основании полученных значений энергии активации обоснована необходимость применения окислителя в качестве реагента, позволяющего ускорить химическое взаимодействие урановых минералов с растворителем. Показано, что использование окислителей позволяет ускорить процесс выщелачивания урана в 1,25-1,3 раза. Показана целесообразность выщелачивания до 55% урана из руд данного типа.


