Влияние особенностей мелкомасштабной структуры молочной железы на распределение глубинной температуры при использовании радиотермометрической диагностики
Автор: Хоперсков Александр Валентинович, Храпов Сергей Сергеевич, Новочадов Валерий Валерьевич, Бурнос Дарья Владимировна
Журнал: Математическая физика и компьютерное моделирование @mpcm-jvolsu
Рубрика: Информационные технологии и математическое моделирование
Статья в выпуске: 6 (25), 2014 года.
Бесплатный доступ
Обсуждается роль сложной мелкомасштабной структуры молочной железы в формировании распределения температуры из-за сильной пространственной неоднородности коэффициента теплопроводности и удельного тепловыделения различных биологических компонентов. В свою очередь пространственные изменения диэлектрической проницаемости и электропроводности в биоткани способны существенно влиять на яркостную температуру биотканей под антенной. Переход от многослойных моделей к многокомпонентной биоткани с учетом ее тонкой структуры и неоднородных параметров (теплопроводность, влагосодержание, удельное тепловыделение, электропроводность, диэлектрическая проницаемость, теплоемкость) может повысить эффективность проведения диагностики опухолей на ранних стадиях.
Перенос тепла, биоткани, радиационный перенос, радиотермометрия, диагностика, молочные железы
Короткий адрес: https://sciup.org/14968972
IDR: 14968972 | УДК: 616.053 | DOI: 10.15688/jvolsu1.2014.6.6
Текст научной статьи Влияние особенностей мелкомасштабной структуры молочной железы на распределение глубинной температуры при использовании радиотермометрической диагностики
Микроволновая радиотермометрия (далее – МТ) является важным инструментом диагностики опухолей молочной железы. МТ при всех своих достоинствах имеет низкую нозологическую специфичность [15; 21]. При обследованиях этим методом в «группу риска» попадают как наиболее опасные быстрорастущие опухоли, так и пациенты с выраженной пролиферацией, мастопатией или воспалительными процессами в тканях [14]. Для повышения специфичности необходимо детализировать и усложнить анализ результатов измерения. С этой целью в последней редакции методики микроволновой радиотермометрии для оценки результата требуется учитывать повышение величины термоасимметрии между одноименными точками молочных желез, повышенный разброс температур между отдельными точками в пораженной молочной железе, повышенную дисперсию разности температур между железами и т. д. [1; 3; 6].
Одним из важных признаков здоровой молочной железы клиницисты считают однородность температур как поверхностных (далее – ИК), так и глубоких (далее – РТМ) в пределах молочной железы, что обосновывается строением молочной железы. Большая грудная мышца создает общий температурный фон, отделяя молочную железу от крупных сосудов и органов грудной полости, а симметричное расположение долек железы вокруг соска обусловливает однородность температурного поля. Однако свойства тканей в молочной железе (железистой, жировой, соединительной) могут отличаться по излучению тепла. Например, известно, что температура крови, притекающей по артериям в различные органы, определяется температурой «теплового ядра» тела и составляет около 37 °С. Но за счет конвективного теплообмена одни ткани могут нагреваться, а другие охлаждаться. Подобные изменения температуры могут быть связаны с особенностями строения и кровоснабжения различных тканей в молочной железе, в том числе и опухолевых. Сильная неоднородность строения молочной железы требует построения адекватных компьютерных моделей с очень высоким разрешением. Отметим, например, важнейшую область соска, вблизи которого располагаются наиболее мелкие структуры и где данные о температуре являются наиболее информативными для диагностики онкологических и других заболеваний молочной железы. Первые модели, основанные на определении глубины проникновения плоской волны в однородную биологическую ткань, показали глубину проникновения на несколько сантиметров и сильную зависимость от влагосодержания и параметров и частоты излучения [10; 12]. Учет многослойной структуры тканей человека, поскольку различные параметры биологических тканей (диэлектрическая проницаемость, теплопроводность, электропороводность, удельное тепловыделение, коэффициенты теплообмена, пара- ISSN 2222-8896. Вестн. Волгогр. гос. ун-та. Сер. 1, Мат. Физ. 2014. № 6 (25) 61
метры кровотока, определяющие эффективность передачи тепла от артериальной крови тканям) могут различаться в несколько раз и даже более чем на порядок, позволяет получить более реалистичную картину [2]. Однако такого рода модели учитывают перенос тепла за счет теплопроводности в стационарном приближении. К тому же параметры непрерывно меняются внутри ткани одного типа и эта зависимость всех параметров от координат является существенным фактором.
Наибольшее распространение получил аппликационный радиометрический СВЧ-метод [5; 9; 11], при использовании которого антенна имеет непосредственный контакт с телом человека. Применение СВЧ радиометрии на частотах 1.1–1.6 ГГц демонстрирует достаточную чувствительность, чтобы отслеживать клинически значимые изменения температуры глубоко в тканях (4 см и больше) в отличие от методов инфракрасной термографии [19]. Моделирование тепловых и электромагнитных процессов для почек и мозга указывает на хорошее согласие с экспериментальными результатами [18]. Хорошие результаты дает применение радиотермометрии для ранней диагностики варикозной болезни [8].
Моделирование тепловых процессов
Численное моделирование излучения тканей, включая опухоли, проводится на основе уравнений теплопроводности и уравнений Максвелла в приближении [2; 17]:
V {k(x, y, z) V T(x, y, z)} = - Qbi(x, y, z) - Qmet(x, y, z),(1)
^^^^
V2 E (x, y, z)+ too^oSoe (x, y, z)• E (x, y, z) = 0,(2)
где k – коэффициент теплопроводности; T – температура; Q bl – источник тепла от кровотоков (определяется балансом тепла артериальной Q a и венозной Q v систем); Q met – источник тепла в результате метаболических процессов в тканях (рис. 1); E – вектор электрического поля; ε – диэлектрическая проницаемость; ∇ – оператор набла. Теплообмен с воздухом на границе, задаваемой единичным нормальным к поверхности вектором ^? ( г) , имеем
(^•^) = ^^5^(Г(%'У'2)- т^)- (3)
^VA,y,Z)
На рисунке 1 изображена схема теплообмена между биотканью и окружающей средой с температурой T air , определяющаяся коэффициентом теплопередачи h air , для которого можно принять h air = 13.5 Вт/(м∙оС). Отличительной особенностью биоткани является сильная пространственная неоднородность физических параметров [2; 4; 20]. Изменения электропроводности биоткани варьируются в пределах 0.1–3 см/м. Относительные изменения диэлектрической проницаемости также могут изменяться более чем на порядок: ε ≈ 2–80. Коэффициент теплопроводности варьируется в пределах 0.15–0.7 Вт/(м∙оС). Важнейшим фактором является удельное содержание воды в ткани α w , определяющее теплофизические характеристики из-за сильной зависимости плотности ткани, теплоемкости и температуропроводности от α w . Наличие злокачественной опухоли в наибольшей степени изменяет распределения удельного тепловыделения Q met ≈ 250–70 000 Вт/м3 и параметров кровотока.
Сложная геометрия и многокомпонентность при использовании методов конечноразностных аппроксимаций дифференциальных уравнений в частных производных требует применения специальных неструктурированных численных сеток [16] и задания граничных условий (3) на сложной поверхности (рис. 2). Использование тетраэдров в качестве элементов сетки является удобным и для моделирования распространения излучения в биоткани [7]. Часто ограничиваются приближением многослойной среды [2].
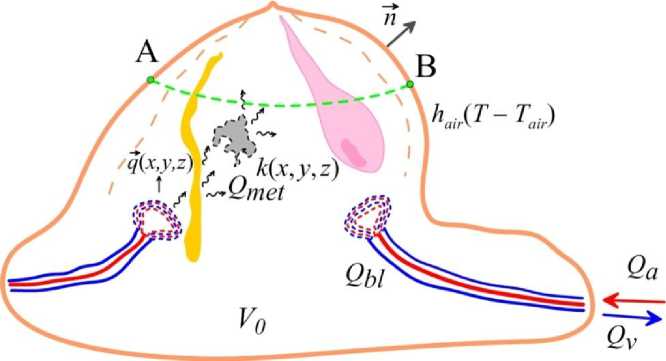
Рис. 1. Неоднородность биоткани и тепловые процессы в ней
Измеряемая яркостная температура T br определяется пространственными распределениями температуры ткани T , коэффициента удельной электрической проводимости о и вектора электрического поля E , создаваемого антенной:
Т ьг = Тд/[(1 - R(f))(JVo C(r,f)T(r)dV + T emi ) + R(nTREC]df, (4) где интегрирование ведется по полосе частот A f и объему биоткани V0 ( Г = { x , y , z } - радиус-вектор), температуры T EMI , T REC характеризуют свойства антенны, а весовая функция C определяется электромагнитным полем и электрофизическими свойствами биоткани [2; 13; 17].
C(x,y,z,f) =
g(f,f)|E(f,f)|2
J yo CT(7V)|E(r,f)|2 dv ’
Мощность электромагнитного излучения на выходе антенны равна P a = kBTbr (1- R ) A f, ( kB -постоянная Больцмана, A f - полоса частоты излучения, R - коэффициент отражения антенны).
Использование в расчетах постоянных электрофизических параметров [2] может давать большую погрешность. Выделяются различные области частот излучения с различной дисперсией ε ( f ), зависящие от преобладания тех или иных физических механизмов (релаксация зарядов на микрососудах, релаксация макромолекул, релаксация молекул воды), причем диэлектрическая проницаемость ε является комплексной величиной [17]. Проводимости крови, лимфы, межклеточной и внутриклеточной жидкостей различаются больше, чем на порядок.
На рисунке 3 приведены модельные одномерные профили основных физических параметров биоткани, определяющих модель (1), (2). Зависимости являются типичными вдоль линии AB на рисунке 1 и учитывают компоненты кожи (эпидерма, дерма, гипердерма), соединительные, жировые ткани, дольки молочной железы, кровотоки, млечный синус. Оценки показывают, что дополнительные неоднородности распределения температуры, обусловленные многокомпонентно-стью биологической ткани, могут заметно влиять на вычисление яркостной температуры T br по формуле (4). В реальных трехмерных условиях картина существенно усложняется.
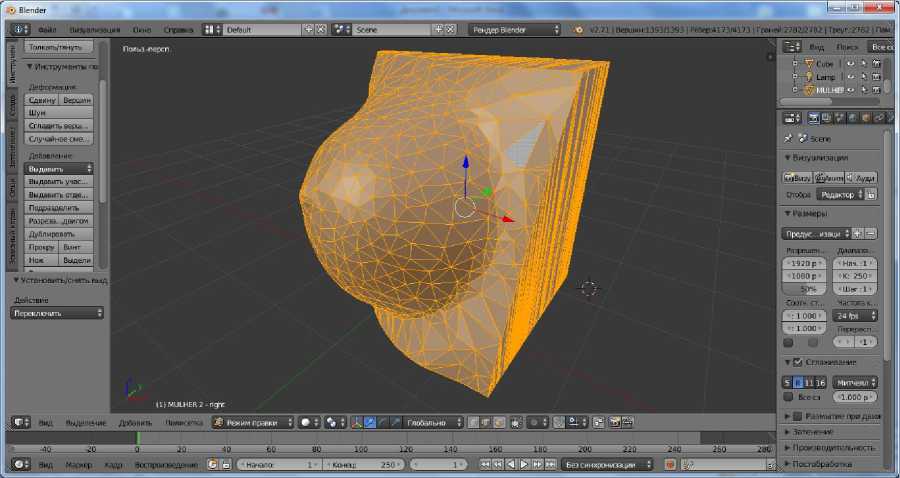
Риc. 2. 3D-модель правой груди
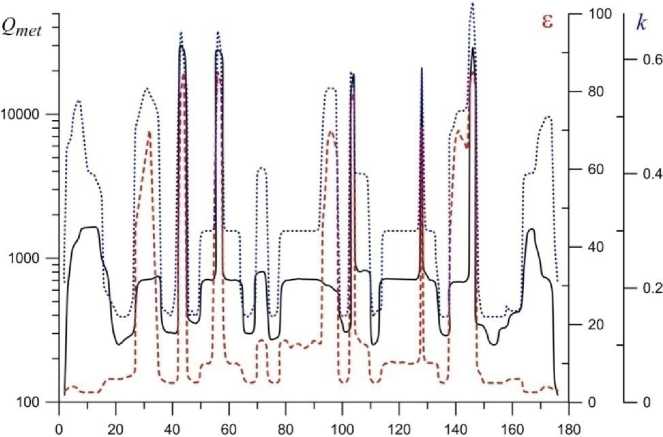
Риc. 3. Модельное распределение физических параметров вдоль линии AB на рис. 1: сплошная черная линия – удельное тепловыделение Q met [Вт/м3]; красная штриховая линия – диэлектрическая проницаемость; синяя пунктирная линия – коэффициент теплопроводности [Вт/(м∙оС)]
Список литературы Влияние особенностей мелкомасштабной структуры молочной железы на распределение глубинной температуры при использовании радиотермометрической диагностики
- Авраменко, Г. В. Использование радиотермометрии в скрининге непальпируемых новообразований молочных желез/Г. В. Авраменко//Вестник рентгенологии и радиологии. -2007. -№ 5. -C. 11-14.
- Веснин, С. Г. Разработка серии антенн-аппликаторов для неинвазивного измерения температуры тканей организма человека при различных патологиях/С. Г. Веснин, М. К. Седанкин//Инженерный журнал: наука и инновации. -2012. -№ 11. -C. 43-61.
- Веснин, С. Г. Современная микроволновая радиотермометрия молочных желез/С. Г. Веснин, А. М. Каплан, Р. С. Авакян//Медицинский альманах.-2008. -№ 3. -C. 82-87.
- Гинзбург, А. С. Теплофизические характеристики пищевых продуктов/А. С. Гинзбург, М. А. Громов, Г. И. Красовская. -М.: Агропромиздат, 1990. -С. 287.
- Маречек, С. В. Радиометрические методы исследования температурного режима приповерхностного слоя биоткани/С. В. Марчек, В. М. Поляков, Ю. Г. Тищенко//Биомедицинские технологии и радиоэлектроника. -2003. -№ 8. -C. 57-64.
- Мустафин, Ч. Н. Опыт использования радиотермометрии в диагностике злокачественных опухолей молочной железы/Ч. Н. Мустафин//Российский онкологический журнал. -2009. -№ 4. -C. 36-42.
- Сетейкин, А. Ю. Трехмерная модель распространения света в биологических тканях/А. Ю. Сетейкин, И. В. Красников, М. С. Павлов//Вестник Санкт-Петербургского университета. Серия 11, Медицина. -2010. -№ 3. -С. 166-172.
- Ставров, Т. А. Математическая модель верификации ранних рецидивов варикозной болезни по данным радиотермометрии/Т. А. Ставров, Е. В. Букина, А. Г. Лосев, Т. В. Замечник//Вестник новых медицинских технологий. -2013. -Т. 20, № 2. -С. 14-18.
- Убайчин, А. В. Печатная антенна для измерения глубинной температуры биологических объектов аппликационным радиометрическим СВЧ-методом/А. В. Убайчин//Доклады Томского государственного университета систем управления и радиоэлектроники. -2013. -№ 3 (29). -С. 47-52.
- Barrett, A. H. Subcutaneous Temperature: A method of Non-invasive Sensing/A. H. Barrett, Ph. C. Myers//Science. -1975. -Vol. 190. -P. 669-671.
- Filatov, A. V. A two-receiver microwave radiometer with high transfer characteristic linearity/A. V. Filatov, A. V. Ubaichin, A. A. Bombizov//Measurement Techniques. -2013. -Vol. 55, № 11. -P. 1281-1286.
- Gautherie, M. Temperature and Blood Flow Patterns in Breast Cancer During Natural Evolution and Following Radiotherapy/M. Gautherie//Biomedical Thermology. -1982. -Vol. 107. -P. 21-64.
- Gonzalez, F. J. Thermal simulation of breast tumors/F. J. Gonzalez//Revista mexicana de fisica. -2007. -Vol. 53, № 4. -P. 323-326.
- Kelly, P. Microwave radiometric signatures of temperature anomalies in tissue/P. Kelly, T. Sobers, B. S. Peter, P. Siqueira, G. Capraro//Proc. SPIE 8313, Medical Imaging 2012: Physics of Medical Imaging. -2012. -Mode of access: Article ID 831368, DOI: DOI: 10.1117/12.910785
- Kelly, P. Temperature anomaly detection and estimation using microwave radiometry and anatomical information/P. Kelly, T. Sobers, B. S. Peter, P. Siqueira, G. Capraro//Proc. SPIE 7961, Medical Imaging 2011: Physics of Medical Imaging. -2011. -Mode of access: Article ID 79614U. -DOI: DOI: 10.1117/12.878136
- Ng, E.Y-K. Computer simulation in conjunction with medical thermography as an adjunct tool for early detection of breast cancer/E. Y-K. Ng, N. M. Sudharsan//BMC Cancer. -2004. -Vol. 4, № 17. -6 p. DOI: DOI: 10.1186/1471-2407-4-17
- Rodrigues, D. B. Numerical 3D modeling of heat transfer in human tissues for microwave radiometry monitoring of brown fat metabolism/D. B. Rodrigues //Proc. SPIE. -2013. -20 p. Mode of access: Article ID 8584. -DOI: DOI: 10.1117/12.2004931
- Stauffer, P. R. Utility of Microwave Radiometry for Diagnostic and Therapeutic Applications of Non-Invasive Temperature Monitoring/P. R. Stauffer, D. B. Rodrigues, P. F. Maccarini//IEEE BenMAS (Benjamin Franklin Symposium on Microwave and Antenna Sub-systems).-2014. -DOI: DOI: 10.13140/2.1.3762.0487
- Umadevi, V.Framework for estimating tumour parameters using thermal imaging/V. Umadevi, S. V. Raghavan, S. Jaipurkar//The Indian Journal of Medical Research. -2011. -Vol. 134, № 5. -P. 725-731. -DOI: DOI: 10.4103/0971-5916.91012
- Valvano, J. W. Tissue Thermal Properties and Perfusion/J. W. Valvano//Optical-Thermal Response of Laser-Irradiated Tissue/еd. by A. J. Welch and van M. J. C. Gemert. -1995. -P. 445-488. -DOI: DOI: 10.1007/978-90-481-8831-4_12
- Wust, P. Thermal monitoring: invasive, minimal-invasive and non-invasive approaches/P. Wust, C. H. Cho, B. Hildebrandt, J. Gellermann//International Journal of Hyperthermia. -2006. -Vol. 22, № 3. -P. 255-262. DOI: DOI: 10.1080/02656730600661149


