Влияние пептида HLDF6 на пролиферативную активность спленоцитов в культуре клеток на фоне введения агонистов опиатных рецепторов
Автор: Сысоева Г.М., Даниленко Е.Д., Масычева В.И., Самуков В.В., Костанян И.А.
Журнал: Сибирский журнал клинической и экспериментальной медицины @cardiotomsk
Рубрика: Лабораторные и экспериментальные исследования
Статья в выпуске: 4-1 т.24, 2009 года.
Бесплатный доступ
В культуре клеток исследовали влияние биологически активного пептида HLDF6 на пролиферативную активность спленоцитов мышей линии C57BL/6 на фоне введения селективных агонистов опиатных рецепторов мю-, дельта- и каппа-типа (DAGO, DADLE, динорфин (1-13)). Показано, что агонисты DAGO, DADLE и динорфин (1-13) обладали способностью усиливать пролиферативную активность лимфоцитов при их прямом взаимодействии с клетками. Интенсивность стимуляции определялась типом агониста и, соответственно, опиатного рецептора. Пептид HLDF6 повышал спонтанный и конкан- авалин-стимулированный пролиферативный ответ клеток при добавлении в среду на начальном этапе культивирования. Данные, касающиеся совместного использования HLDF6 и опиатных агонистов, свидетельствуют о взаимодействии пептида и эндогенной опиатной системы.
Пептид hldf6, агонисты опиатных рецепторов, пролиферативная активность, спленоциты, мыши
Короткий адрес: https://sciup.org/14919144
IDR: 14919144 | УДК: 612.014.3+616.8-091.81
Текст научной статьи Влияние пептида HLDF6 на пролиферативную активность спленоцитов в культуре клеток на фоне введения агонистов опиатных рецепторов
Как известно, формирование синдрома наркотической зависимости сопряжено с изменением иммунного статуса организма [1-3]. Есть данные о способности ряда иммуномодуляторов снижать тяжесть абстинентного синдрома при лечении наркомании [1-4]. Это обусловлено тем, что между нейроэндокринной и иммунной системами существует тесная двусторонняя связь [1, 5-8], механизмы реализации которой привлекают пристальное внимание исследователей.
Важную роль в процессе коммуникации между нервной и иммунной системами играют опиоидные пептиды и специфические опиатные рецепторы. Многочисленными исследованиями установлено, что эндогенные опиоидные пептиды и синтетические агонисты опиатных рецепторов могут модулировать функции лимфоцитов, NK-клеток и макрофагов через присутствующие на их поверхности опиатные рецепторы трех основных типов: р, б и к [9-14].
В лаборатории белков гормональной регуляции Института биоорганической химии имени академиков М.М. Шемякина и Ю.А. Овчинникова из культуральной среды клеток человеческого промиелоци-тарного лейкоза HL-60 был выделен белок HLDF с молекулярной массой 8,2 кДа, который вызывал дифференцировку клеток по гранулоцитарному пути. В структуре пептида был обнаружен шестичленный фрагмент HLDF6 (TGENHR), который воспроизводил способность полноразмерного фактора индуцировать дифференцировку и ингибировать пролиферацию клеток HL-60 [15].
Ранее было показано, что введение HLDF6 подавляло проявление основных симптомов абстинентного синдрома у мышей [16], нормализовало показатели ноцицептивных реакций у потомства морфинто- лерантных животных [17]. В процессе исследования влияния пептида на функцию опиатной системы было установлено, что HLDF6 отменял анальгетический эффект агонистов р- и к-рецепторов [18], усиливал адгезивные свойства и функциональную активность перитонеальных макрофагов, ослаблял эффекты селективных агонистов опиатных рецепторов [19]. Эти данные свидетельствует о взаимодействии пептида и эндогенной опиатной системы ЦНС и клеток иммунной системы, хотя вопрос об особенностях реализации этой взаимосвязи, в частности, на иммунокомпетентных клетках изучен пока недостаточно.
Целью данной работы являлось исследование влияния пептида HLDF6 на пролиферативную активность лимфоцитов селезенки и его способности модулировать иммунорегуляторные эффекты селективных лигандов р, б и к -опиатных рецепторов.
МАТЕРИАЛ И МЕТОДЫ
В качестве рецептор-специфических агонистов опиатных рецепторов были выбраны агонист μ-ре-цепторов DAGO (Tyr-D-Ala-Gly-(N-Me)Phe-Gly-ol), агонист δ-рецепторов DADLE (Tyr-D-Ala-Gly-Phe-D-Leu) и агонист к -рецепторов динорфин (1-13) (Tyr-Gly-Gly-Phe-Leu-Arg-Arg-Ile-Arg-Pro-Lys-Leu-Lys), полученные методом химического синтеза по специально разработанным методикам. Препараты DAGO и DADLE синтезировали по схемам (3 + 2). Синтез C-концевого сегмента DAGO проводили по специально разработанной трехстадийной схеме из 2-гидроксиэтиламида фенилаланина. Динорфин (1-13) синтезировали твердофазным методом на сти-рол-дивинилбензольной смоле Ванга с использованием Nsc-аминокислот. Пептид HLDF6 (Thr-Gly-Glu -Asn-His-Arg) был синтезирован методом активированных эфиров в растворе по авторской методике.
Спонтанную и индуцированную пролиферацию спленоцитов мышей линии C57Bl/6 оценивали после инкубации in vitro с пептидом HLDF6 и/или опиатными агонистами с помощью МТТ-теста по уровню восстановления клетками 3-(4,5-диметилти-азолил-2)-2,5-дифенил тетразолиум бромида (МТТ) [20]. Клеточную суспензию спленоцитов мышей готовили с использованием полной среды RPMI-1640, содержащей 10% эмбриональной сыворотки телят (10 мМ Hepes, 2 мМ L-глутамина, 50 мкг/мл гентамицина). Суспензию клеток распределяли по лункам 96-луночных круглодонных планшет по 100 мкл на лунку. Для индукции пролиферации использовали митоген – конканавалин А (ConA, ICN Biomedicals Inc) в концентрации 10 мкг/мл. Пептид добавляли в инкубационную среду непосредственно перед началом культивирования в концентрациях 0,01100 мкг/мл индивидуально либо в сочетании с опиатными агонистами (0,01-0,1 мкг/мл). Планшеты культивировали при температуре 37°С и 85-90% влажности в течение 72 ч. По окончании периода куль-55
тивирования во все лунки добавляли 20 мкл рабочего раствора МТТ с концентрацией 5 мг/мл, инкубировали в течение трех часов, после чего из лунок удаляли супернатант и вносили 200 мкл/лунку растворителя кристаллов красителя (формазана) – диметилсульфоксид (ДМСО). Планшеты оставляли при комнатной температуре на 30 минут, в течение которых происходило полное растворение кристаллов формазана. Оптическую плотность содержимого лунок замеряли с помощью спектрофотометра для микропланшетов при длине волны 540 нм.
Данные экспериментов подвергали статистической обработке с использованием пакета программ Statgrapfics 5.0 (Statistical Graphics Corp., USA). В качестве критерия статистической значимости обнаруженных межгрупповых различий был выбран t-критерий Стьюдента. Для подтверждения статистической значимости различий считали достаточным значение достигнутого уровня значимости (вероятности ошибочно принять отсутствие различий за их наличие) P<0,05.
РЕЗУЛЬТАТЫ И ОБСУЖДЕНИЕ
В ходе исследования было обнаружено, что внесение рецептор-специфических агонистов опиатных рецепторов в культуральную среду, как правило, приводило к повышению пролиферативной активности спленоцитов мышей. Однако интенсивность эффекта зависела как от типа агониста, так и от его дозы.
Повышение спонтанной пролиферативной активности клеток в результате воздействия на начальном этапе культивирования агониста д -рецепторов
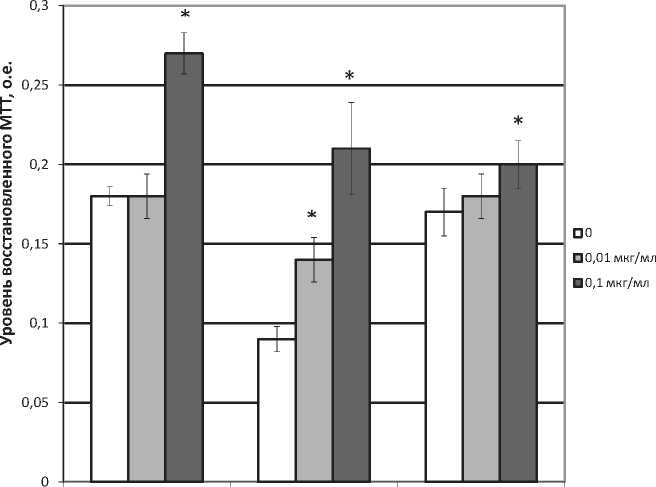
DAGO Динорфин (1-13) DADLE
Рис. 1. Влияние агонистов опиатных рецепторов μ-, δ- и κ-типа DAGO, DADLE и динорфина (1-13) на спонтанную пролиферативную активность спленоцитов мышей.
* – различия статистически значимы по отношению к контролю (физиологический раствор), р≤0,05
DAGO наблюдалось в дозе 0,1 мкг/мл: показатели МТТ-теста возрастали по отношению к контрольному уровню на 50% (рис. 1). Инкубация спленоцитов с агонистом к -рецепторов динорфином (1-13) также стимулировала клеточную пролиферацию, причем особенностью воздействия данного агониста являлось то, что эффект носил дозозависимый характер и обнаруживался уже в минимальной использованной дозе. Повышение клеточной пролиферации составляло 55 и 133% при внесении препарата в концентрациях 0,01 и 0,1 мкг/мл, соответственно.
Наименьшей способностью стимулировать пролиферативную активность лимфоцитов обладал агонист δ-рецепторов DADLE, который в дозе 0,1 мкг/мл повышал показатели МТТ-теста лишь на 19%. Описанные различия в активности опиатных агонистов разных типов рецепторов сохранялись и на клетках, обработанных Т-клеточным митогеном конканава-лином А.
Анализ имеющихся литературных данных подтвердил тот факт, что селективные агонисты опиатных рецепторов разных типов способны модулировать пролиферативный ответ лимфоцитов, причем есть сведения как о стимулирующем, так и об ингибирующем эффектах этих препаратов. Так, установлено, что селективные агонисты д -, б- и к -рецепторов (DAGO, DPDPE, U-50488) являются потенциальными стимуляторами митоген-индуцированной пролиферации Т-лимфоцитов мышей в системе in vitro, которая отменялась селективными антагонистами соответствующих рецепторов [21, 22]. В работах [23, 24] приводятся данные о стимулирующем влиянии Динорфина на митогениндуцированную пролиферацию спленоцитов крыс, пролиферативный ответ спленоцитов мышей и продукцию ими IL-2 и IL-1 β .
С другой стороны, показано, что агонист δ-рецепторов (лей-энкефа-лин) в зависимости от используемой дозы может негативно регулировать митогениндуцированную пролиферацию, стимулируя клетки-супрессоры или клетки-хелперы иммунного ответа [25, 26]. Есть данные и о зависимости направленности эффекта селективных агонистов μ- и δ- рецепторов DAGO и DADLE от состава клеточной фракции [27].
Пептид HLDF6, подобно агонистам опиатных рецепторов, усиливал пролиферативный процесс в культуре клеток селезенки мышей. Показатели пролиферативной активности спленоцитов после инкубации с пептидом в концентрациях от 0,01 до 10 мкг/мл возрастали в 2,4-5,1 раза (показатель спонтан- ной активности) или 2,2-3 раза в условиях воздействия митогена (табл.). Добавление HLDF6 в дозе 100 мкг/мл не приводило к дальнейшему усилению эффекта, более того, отмечена тенденция к некоторому снижению показателей МТТ в этих лунках по сравнению с показателями, зарегистрированными после инкубации клеток с пептидом в дозе 10 мкг/мл.
Культивирование спленоцитов в среде, содержащей DAGO и HLDF6, приводило как к усилению, так и к ингибированию способности клеток восстанавливать МТТ по сравнению с показателями, зарегистрированными в лунках с добавлением одного DAGO. При этом направленность эффекта зависела от концентрации агониста и интенсивности вызванной им реакции (рис. 2). Так, добавление пептида в среду, содержащую DAGO в концентрации 0,01 мкг/мл, которая не вызывала статистически значимого изменения спонтанной пролиферации спленоцитов, приводило к значительному повышению показателей МТТ-теста, превышавшему контрольный уровень в
1,5-1,8 раза. В том случае, когда результатом внесения DAGO (0,1 мкг/мл) являлось значительное повышение уровня пролиферативной активности клеток, пептид ослаблял эффект опиатного агониста. Те же закономерности были обнаружены при оценке последствий совместного применения агониста μ-ре-цепторов и HLDF6 в культуре клеток, индуцированных внесением в среду конканавалина А, где пептид в концентрациях 0,01 и 0,1 мкг/мл ослаблял стимулирующий эффект DAGO (0,1 мкг/мл) на пролиферацию митоген-индуцированных спленоцитов. Наиболее выраженный эффект был отмечен при использовании препаратов DAGO и HLDF6 в концентрациях 0,1 и 1 мкг/мл, соответственно, то есть при десятикратном избытке пептида.
Усиление под действием пептида HLDF6 спон- танной пролиферации спленоцитов в условиях слабо выраженного эффекта опиатного агониста наблюдалось и в экспериментах с использованием аго- ниста к-рецепторов динорфина (рис. 3). Отличи-
Таблица
тельной особенностью этих экспериментов являлось отсутствие
Пролиферативная активность спленоцитов мышей С57ВL/6 при культивировании в среде с добавлением пептида HLDF6
|
Препарат |
Концентрация, мкг/мл |
Уровень восстановленного МТТ, о.е. |
|
|
спонтанный |
митогениндуцированный |
||
|
Физраствор |
– |
0,155±0,189 |
0,335±0,043 |
|
HLDF6 |
0,01 |
0,352±0,014* |
0,734±0,030* |
|
0,1 |
0,564±0,015* |
0,884±0,031* |
|
|
1,0 |
0,732±0,028* |
1,030±0,031* |
|
|
10,0 |
0,767±0,015* |
1,017±0,011* |
|
|
100,0 |
0,630±0,027* |
0,947±0,039* |
|
* – различие статистически значимо по отношению к контролю (физиологический раствор), р<0,05.
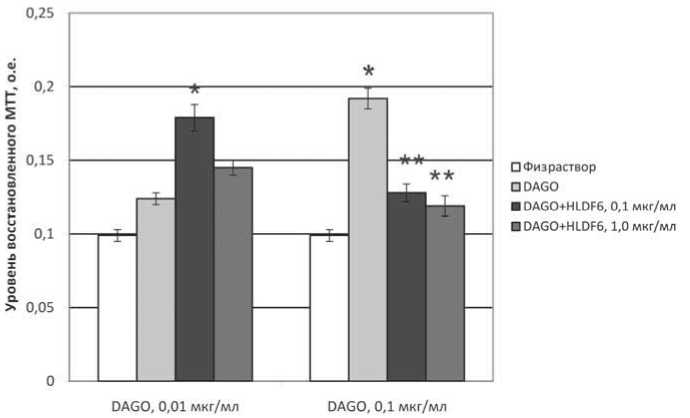
Рис. 2. Показатели спонтанной пролиферативной активности спленоцитов мышей при культивировании с агонистом опиатных μ-рецепторов DAGO и пептидом HLDF6.
Различия статистически значимы (р<0,05): * – по отношению к контролю (физиологический раствор); ** – по отношению к показателям в лунках, содержащих DAGO в соответствующей концентрации
статистически значимого ингибирующего эффекта пептида в условиях выраженной активации спонтанной пролиферативной активности клеток, вызванной динорфином. Кроме того, не было зарегистрировано сколько-либо значимого влияния HLDF6 на показатели митогениндуци-рованной пролиферации клеток на фоне добавления динорфина.
Внесение HLDF6 в среду культивирования, содержащую DADLE, в соотношении 1:1 и 10:1 не оказывало существенного влияния на показатели спонтанной и индуцированной пролиферативной активности, за исключением незначительного усиления эффекта агониста в концентрации 0,01 мкг/мл (на 21% по отношению к показателям в лунках с добавлением одного DADLE) (рис. 4).
Таким образом, установлено, что пептид HLDF6 обладал способностью модулировать эффекты агонистов разных типов опиатных рецепторов, изменяя как спонтанную, так и митоген-индуцированную активность лимфоцитов селезенки. Направленность эффекта пептида зависела от типа агониста и интенсивности вызванной им реакции.
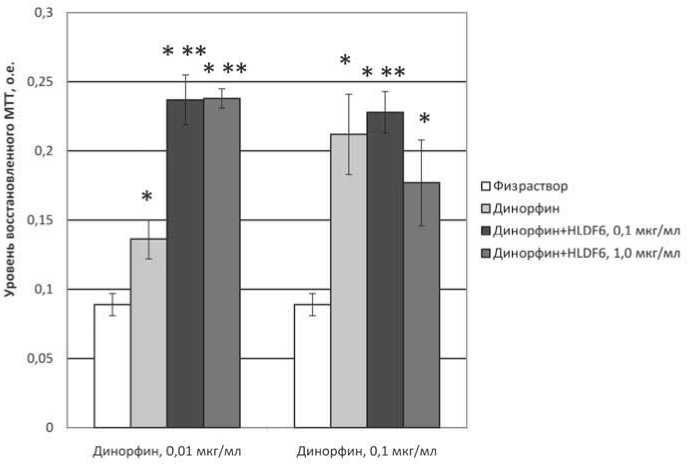
Рис. 3. Показатели спонтанной пролиферативной активности спленоцитов мышей при культивировании с агонистом опиатных κ-рецепторов динорфином (1-13) и пептидом HLDF6. Различия статистически значимы (р<0,05): * – по отношению к контролю (физиологический раствор); ** – по отношению к показателям в лунках, содержащих динорфин в соответствующей концентрации
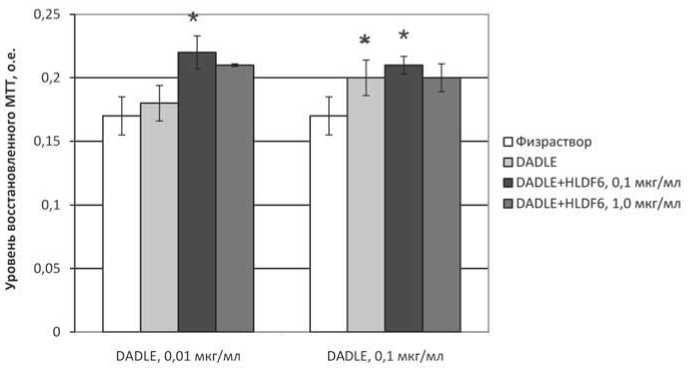
Рис. 4. Показатели спонтанной пролиферативной активности спленоцитов мышей при культивировании с агонистом опиатных δ-рецепторов DADLE и пептидом HLDF6. Различия статистически значимы (р<0,05): * – по отношению к контролю (физиологический раствор); ** – по отношению к лункам, содержащим DADLE в соответствующей концентрации
мом ингибирующего эффекта HLDF6 могут быть конформационные изменения структуры ионных каналов, в частности кальциевых, которые подвержены регуляции опиатными пептидами [15]. В связи с этим не исключено, что эффект HLDF6 на функциональное состояние спленоцитов может быть обусловлен деблокированием Ca2+-каналов, вызванным опиатами, и активацией Ca2+-кальмодулин-опосредованных путей передачи клеточного сигнала.
Таким образом, показано, что агонисты р-, б- и к -опиатных рецепторов (DAGO, DADLE, динорфин (1-13)) обладают способностью модулировать пролиферативную активность спленоцитов при их прямом взаимодействии с клетками. Направленность и интенсивность эффекта определялись типом агониста и, соответственно, опиатного рецептора. Пептид HLDF6 повышал пролиферативную активность спленоци-тов при добавлении его в инкубационную среду на начальном этапе культивирования. Данные, касающиеся совместного использования HLDF6 и опиатных агонистов, свидетельствуют о взаимодействии пептида и эндогенной опиатной системы. Направление эффекта пептида зависело от типа опиатного агониста и используемой дозы.
Механизмы модуляторного эффекта HLDF6 на спленоциты пока неясны. Известно, что связывание рецептор-специфических агонистов с опиатными рецепторами разных типов на поверхности клетки приводит к снижению активности аденилатциклазы и уровня цАМФ в клетке [28]. Добавление HLDF6 к активно пролиферирующим клеткам HL-60 вызывало аналогичные изменения (уменьшение синтеза цАМФ и фосфорилирования белков клетки) [29]. Однако подобная схема, если она верна и в отношении лимфоцитов, может объяснить только потенцирующий эффект HLDF6.
С другой стороны, как было установлено ранее, HLDF6 вызывает модификацию физико-химических свойств клеточной мембраны, повышая ее текучесть [15]. Следовательно, возможным механиз-
Список литературы Влияние пептида HLDF6 на пролиферативную активность спленоцитов в культуре клеток на фоне введения агонистов опиатных рецепторов
- Захарова Л.А., Василенко А.М. Опиоидэргическая система в сочетанной регуляции боли и иммунитета//Известия РАН. Сер. Биол. -2001. -№3. -С. 339-352.
- Зозуля А.А., Пшеничкин С.Ф. Опиоидные рецепторы и их лиганды//Итоги науки и техники/ВИНИТИ. Сер. Иммунология. -М. -1990. -Т. 25. -С. 48-120.
- Herz A. Role of immune processes in peripheral opioid analgesia//Adv. Exp. Med. Biol. -1995. -Vol. 373. -P. 193-199.
- McCarthy L., Wetzel M., Sliker J.K. et. al Opioids, opioid receptors, and the immune response//Drug Alcohol. Depend. -2001. -Vol. 62. -№2. -P. 111-123.
- Коростелев С.А., Исакова К.Л., Щеголев А.И., Утешев Б.С. Влияние эндогенных опиоидных пептидов и их синтетических аналогов на T-клеточный иммунитет//Эксперим. и клин. фармакология. -1994. -Т. 57. -№1. -С. 57-60.
- Чейдо М.А., Идова Г.В. Влияние опиоидных пептидов на процессы иммуномодуляции//Рос. физиол. журн. им. И.М. Сеченова. -1998. -Т. 84. -№4. -С. 385-390.
- Roy S., Loh H.H. Effects of opioids on the immune system//Neurochem.Res. -1996. -Vol. 21. -P. 1306-1375.
- Stefano G.B., Scharrer B., Smith E.M. et. al Opioid and opiate immunoregulatory processes//Crit. Rev. Immunol. -1996. -Vol. 16. -P. 109-144.
- Гейн С.В. Эффект динорфина А (1-13) на пролиферативный ответ лимфоцитов и изменение Th1/Th2 цитокинового профиля//Докл. РАН. -2009. -Т. 424. -№4. -С. 563-566.
- Гейн С.В., Симоненко Т.А., Черешнев В.А. Влияние μ-эндорфина и селективного агониста µ-опиатных рецепторов DAGO на пролиферативную активность лимфоцитов//Докл. РАН. -2003. -Т. 391. -№1. -С. 128-130.
- Alicea C., Belkowski S., Eisenstein T.K. et al. Inhibition of primary murine macrophage cytokine production in vitro following treatment with κ-opioid agonist U50,488H//J. Neuroimmunol. -1996. -Vol. 64. -P. 83-90.
- Band L., Pert A., Williams W. et al. Central µ-opioid receptors mediate suppression of natural killer cell activity in vitro//Prog. Neuroendocrin. Immunol. -1992. -Vol. 5. -P. 95-101.
- Sharp B.M. Multiple opioid receptors on immune cells modulate intracellular signaling//Brain Behav. Immun. -2006. -Vol. 20. №1. -P. 9-14.
- Taub D.D., Eisenstein T.K., Geller E.B. et al. Immuno-modulatory activity of mu-and kappa-selective opioid agonists//Proc. Nat. Acad. Sci. USA. 1991. -Vol. 88. -P. 360-364.
- Костанян И.А., Астапова М.В., Новолотская Е.В., Лепихова Т.Н., Драницына С.М., Телегин Г.В., Родионов И.Л., Байдакова Л.К., Золотарев Ю.А., Молотковская И.М., Липкин В.М. Биологически активный фрагмент фактора дифференцировки клеток линии HL-60. Идентификация и свойства//Биоорган. хим. -2000. -Т. 26. -№7. -С. 505-511.
- Литвинова С.В., Калюжный А.Л., Аристов В.В. и др. Подавление пептидом HLDF6 симптомов абстинентного синдрома на экспериментальной модели опийной наркомании//Бюл. эксперим. биологии и медицины -2004. -Т. 137. -№2. -С. 511-515.
- Литвинова С.В., Костанян И.А., Аристов В.В. и др. Применение пептида для коррекции патологии эндогенной опиоидной системы у потомства морфинтолерантных животных//Бюлл. эксперим. биологии и медицины -2003. -Т. 135. -№2. -С. 155-158.
- Федосова Л.К., Даниленко Е.Д., Масычева В.И., Костанян И.А., Самуков В.В. Оценка анальгетических свойств фрагмента пептидного фактора дифференцировки клеточной линии HL-60//Новые информационные технологии в медицине, биологии, фармакологии и экологии: 10-я юбилейная междунар. конф. и дискус. науч. клуб: -Запорожье, 2002. -С. 365-366.
- Даниленко Е.Д., Фадина В.А., Масычева В.И. и др. Модуляция пептидом HLDF6 функциональной активности макрофагов на фоне введения агонистов опиатных рецепторов//Мед. иммунология. -2005. -Т. 7. -№1. -С. 77-84.
- Mosmann T. Rapid colorimetric assay for cellular growth and survival: application to proliferation and cytotoxicity assays//J. Immunol. Methods. -1983. -Vol. 65. -№1-2. -P. 55-63.
- Kowalski J. Immunomodulatory action of class mu-, and kappa-opioid receptor agonists in mice//Neuropeptides. -1998. -Vol. 32. -№4. -P. 301-306.
- Гейн С.В., Бабаева Т.А. Бетаэндорфин и селективные агонисты опиатных рецепторов в регуляции пролиферативного ответа лимфоцитов. Роль блокады опиатных рецепторов//Вестник Пермского университета. -2007. -№5. -С. 190-193.
- Ni X., Lin B.C., Song C.Y. et al. Dynorphin A enhances mitogen-induced proliferative response and interleukin-2 production of rat splenocytes//Neuropeptides. -1999. -Vol. 33. -№2. -P. 137-143.
- Bidlack J.M. Detection and function of opioid receptors on cells from the immune system//Clin. Diagnostic Lab.Immunol. -2000. -Vol. 7. -№5. -P. 719-723.
- Sizemore R.C., Dienglewicz R.L., Pecunia E. et al. Modulation of concanavalin A-induced, antigen-nonspecific regulatory cell activity by leu-enkephalin and related peptides//Clin. Immunol. Immunopathol. -1991. -Vol. 60. -№2. -P. 310-318.
- Lin J., Lu G., Jiang G. In vitro influence of enkephalins on the proliferative response of mouse and rat splenic lymphocytes to phytohemagglutinin//Proc. Chin. Acad. Med. Sci. Pecin Union Med. Coll. -1990. -Vol. 5. -№3. -P. 145-148.
- Гейн С.В., Баева Т.А., Гейн О.Н., Черешнев В.А. Роль моноцитов в реализации эффектов β-эндорфина и селективных агонистов µ-и δ-опиатных рецепторов на пролиферативную активность лимфоцитов//Физиология человека. -2006. -Т. 32. -№3. -С. 111-116.
- Keith D.E., Anton B., Murray S.R. et al. Mu-opioid receptor internalization: opiate drugs have differential effects on a conserved endocytic mechanism in vitro and in the mammalian brain//Molecular Pharmacology. -1998. -Vol. 53. -P. 377-378.
- Жохов С.С., Костанян И.А., Гибанова Н.В. и др. Сходство и различие действия пептидов TGENHR и TQVEHR на промиелоциты линии HL-60 и клетки Пуркинье червя мозжечка крыc//Докл. РАН -2004. -Т. 394. -№5. -С. 696-669.


