Влияние пищевых волокон на структурообразование в мышечной ткани объекта глубоководного рыбного промысла макруруса малоглазого в присутствии трансглутаминазы
Автор: Пивненко Татьяна Николаевна, Ковалев Николай Николаевич, Конькова Дарья Александровна, Позднякова Юлия Михайловна
Журнал: Вестник Красноярского государственного аграрного университета @vestnik-kgau
Рубрика: Ветеринария и зоотехния
Статья в выпуске: 2, 2022 года.
Бесплатный доступ
Цель исследования - изучить структурообразование в системе мышечных белков макруруса малоглазого Albatrossia pectoralis под действием трансглутаминазы при использовании в качестве субстратов пищевых волокон животного происхождения. Задачи исследования - определить изменение вязкости растворов коллагена и хитозана под действием трансглутаминазы, определить реологические свойства и фракционный состав белков мышечной ткани объекта глубоководного промысла макруруса малоглазого в присутствии пищевых волокон и трансглутаминазы. Исследование проводилось на базе НИИ инновационных биотехнологий Дальневосточного государственного технического рыбохозяйственного университета г. Владивостока. Эффективность каталитического действия фермента оценивали по изменению вязкости растворов при использовании в качестве субстратов коллагена и его комбинированных растворов, включающих высокомолекулярный хитозан или его производное (лактат хитозана). Показана прямая зависимость вязкости от концентрации фермента при наибольшем ее росте в присутствии лактата хитозана. Анализ динамики изменения вязкости позволил предположить, что лактат хитозана влияет на направленность образования внутри- и межмолекулярных связей коллагена. Добавление коллагена и лактата хитозана в измельченную мышечную ткань макруруса малоглазого в присутствии трансглутаминазы позволило увеличить прочность образцов на 90 % по сравнению с исходным сырьем, обеспечивая удержание воды и сохранение формы готовых изделий после термообработки. Методом электрофореза исследован фракционный состав белков мышечной ткани макруруса малоглазого после ферментации. Показаны изменения, соответствующие полимеризации белков, сохранение направленности ферментативного катализа при снижении количества низкомолекулярных белков и повышении количества высокомолекулярных белковых агрегатов, усиливающих прочность образцов. Полученный продукт может быть позиционирован в качестве изделия функционального назначения.
Макрурус малоглазый, трансглутаминаза, коллаген, хитозан
Короткий адрес: https://sciup.org/140293568
IDR: 140293568 | УДК: 664.951+573.6
Текст научной статьи Влияние пищевых волокон на структурообразование в мышечной ткани объекта глубоководного рыбного промысла макруруса малоглазого в присутствии трансглутаминазы
Введение. В связи с сокращением объема вылова традиционных объектов рыбного промысла актуальной является проблема использования нетрадиционного сырья для производства пищевой продукции. Рациональное использование водно-биологических ресурсов может быть обеспечено переработкой недоиспользуемых объектов и вторичного сырья. Современное перспективное направление переработки – применение ферментных технологий с использованием трансглутаминазы (ТГ) для улучшения структурно-механических свойств мышечной ткани [1]. Процессы эффективной ферментативной сшивки макромолекул могут быть реализованы в присутствии белковых и углеводных субстратов, что позволяет усилить функциональную значимость продуктов. Работы в этом направлении интенсивно ведутся в Японии, Китае и других странах АТР [2–3]. Также исследования последних лет показывают безопасность использования ТГ в продуктах, подвергнутых термической обработке [4].
В настоящее время промышленный промысел глубоководных видов рыб имеет большие пер- спективы. Одним из многочисленных глубоководных видов рыб северной части Тихого океана является макрурус малоглазый Albatrossia pectoralis, возможность вылова которого составляет до 30– 40 тонн в сутки. Однако, несмотря на хорошие питательные свойства и большие запасы, макру-русы остаются недоиспользованными из-за особенностей мышечной ткани: высокой обводненности и неспособности миофибриллярных белков удерживать воду при различных способах технологической обработки [5].
Добавление пищевых волокон (ПВ) в рыбные продукты представляет большой интерес как для улучшения технологических свойств продуктов, так и для усиления их функциональности. С технологической точки зрения введение ПВ улучшает связывание воды, прочность, эмульсионную способность и желирующие свойства продуктов. С физиологической точки зрения добавление ПВ усиливает полезные эффекты рыбной продукции (снижение уровня холестерина, гликемического индекса, увеличение пребиотической емкости) [6]. Такие ПВ, как коллаген и хитозан, могут быть рассмотрены в качестве субстратов ТГ в реакции образования изопептидных связей, образующих прочный и термостабильный каркас в структуре мышечной ткани. Участие коллагена в этом процессе целесообразно, но требует дополнительных исследований [7]. Использование хитозана находится на начальной стадии исследований, имеются противоречивые данные по участию его в образовании сшивок с молекулами белков [8]. Но во всех исследованиях отмечаются антимикробные и антиоксидантные качества, обеспечивающие увеличение сроков хранения продукции [9].
Цель исследования – изучить структурооб-разование в системе мышечных белков макру-руса малоглазого под действием трансглутаминазы при использовании в качестве субстратов пищевых волокон животного происхождения.
Задачи: изучить изменение вязкости растворов коллагена и хитозана под действием ТГ, определить реологические свойств и фракционный состав белков мышечной ткани макруруса в присутствии ПВ и ТГ.
Условия, материалы и методы . Все экспериментальные исследования проводились в лаборатории НИИ инновационных биотехнологий Дальневосточного государственного рыбохозяйственного университета («Дальрыбвтуз»).
Макрурус малоглазый Albatrossia pectoralis выловлен в Охотском море в 2020 г. Срок хранения замороженных образцов 3–4 мес. В качестве ПВ использовали коллаген из кожи минтая, высокомолекулярный хитозан и лактат хитозана (ООО «ФармОушенЛаб», Россия), ферментный препарат ACTIVA® TG-TI («Аджиномото Ко. Инк.» Япония).
Динамическую вязкость растворов ( ʋ , мПа/с) определяли на ротационном вязкозиметре «FungilabSMARTR» («Fungilab»), используя шпиндель R4, скорость вращения 100 об/мин. Величину прочности образцов на разрыв (Н) определяли на приборе Валента ВЦ-1 с грибовидным индентором.
Для определения прочности были приготовлены образцы: фарш макруруса без добавок; фарш с добавлением 1 % ПВ без ТГ; фарш с добавлением 1м % ПВ и 0,1 % мТГ; фарш с добавлением 1 % ПВ и 0,25 % мТГ; фарш с добавлением 1 % ПВ и 0,5 % мТГ. Образцы помещали в поливиниловую оболочку (диаметр образца 2,5 см), плотно запечатывали с обоих концов, помещали на водяную баню и выдерживали при 25 °С в течение 2 ч, после чего фермент инактивировали при 90 °С в течение 20 мин. После охлаждения измеряли прочность.
Электрофорез (ЭФ) проводили в 7%-м полиакриламидном геле с добавлением додецилсульфата натрия (ДСН-ПААГ). Для экстракции белков образцы выдерживали в 1/15 М фосфатном буфере, содержащем 0,5 М КCl, при 40 °С в течение 3 часов Для получения геля использовали 0,05 М трис-HCl буфер (рН 8,8) с 1 мМ ЭДТА и 0,1 % ДСН. Разделение вели при напряжении 100–150 В и силе тока 5–8 мА на пластину. Молекулярную массу (Мм) белков определяли по калибровочным графикам, построенным в координатах зависимости Rf от Мм стандартных маркерных белков (от 8 до 250 кДа) (Sigma-Aldrich, США). Денситограммы пластинок и расчет площадей пиков снимали при помощи программы Image J.
Результаты и их обсуждение. Ранее нами была показана целесообразность сочетания двух различных типов структурообразователей – желатина и хитозана – в технологии желеобразных продуктов из мышечной ткани макруруса малоглазого [5]. Полученные студни имели доказанные высокие питательные и органолептические качества, биологическую ценность. Однако данный вид кулинарной продукции имел ограниченный потребительский спрос, предпочтительными являются формованные рыбные изделия, выдерживающие тепловую обработку при сохранении текстуры. Также было показано, что для получения прочной структуры мышечной ткани макруруса недостаточно введения ТГ, что связано с очень низкой концентрацией миофибрил-лярных белков. Только использование дополнительных белковых и/или углеводных субстратов инициирует формирование полимерной сети, стабилизирующей структуру мышечного геля. Определяющим фактором термостабильности готового пищевого продукта является реакция образования изопептидных связей.
Коллаген считается хорошим субстратом для ТГ, но в водном растворе происходит самосборка его отдельных цепей в трехспиральную структуру, близкую к нативной. Это затрудняет реакцию его взаимодействия с ТГ [10]. Поэтому важно установить факторы, влияющие на этот процесс. Вторым компонентом из разряда ПВ был взят хитозан в двух его формах: коммерческий препарат с Мм 588 кДа и степенью деацилирования 75 % и лактат хитозана, полученный на его основе. Оба этих продукта являются поликатионами, но отличаются растворимостью, которая зависит от степени протонирования аминогрупп, рН системы и рК а кислоты [11]. При этом хитозан растворяется при рН менее 6,0, а лактат хитозана растворим в воде. Относительно способности хитозана быть субстратом для ТГ существуют противоречивые данные [9, 12]. С одной стороны, постулируется, что аминогруппы хитозана могут служить акцепторами ацильных групп в реакции переноса ацила от y- карбоксиламидных групп к глутамильным остаткам белка. С другой стороны, его присутствие рассматривается как препятствие для образования межбелковых сшивок. Но во всех случаях отмечено стабилизирующее влияние на текстуру продукта и значимость в качестве ПВ.
При определении влияния ПВ на эффективность действия ТГ использовали следующие системы в виде растворов: коллаген + ТГ (1); коллаген + хитозан + ТГ (2); коллаген + лактат хитозана + ТГ(3). Концентрация мТГ составляла 0,1; 0,25 и 0,5 % для каждого образца соответственно. рН растворов поддерживали на уровне
6,0±0,2, что входит в диапазон активности мТГ [1]. Соотношение ПВ было определено по способности к образованию однородной системы, содержащей в растворенном состоянии 4 % коллагена и 1 % хитозана или лактата хитозана. Эффективность реакции оценивали по увеличению вязкости. Вязкость исходных растворов составила для образцов без добавления фермента: 29,8 (1); 38,3 (2) и 31,0 мПа/с (3). Динамика изменений вязкости представлена на рисунке 1. Время становления максимальной вязкости составило для растворов: (1) - 90 мин, (2) - 75 мин, (3) - 105 мин при всех концентрациях ТГ. При этом увеличение вязкости по сравнению с контролем было максимальным при концентрации фермента 0,5 % и составило 109, 110 и 120 % соответственно.
Как видно из рисунка 1, для всех образцов характерно первоначальное снижение вязкости по сравнению с контролем (без ТГ), что связано с разбавлением при добавлении раствора фермента. Выраженное повышение вязкости проявилось только через 30–45 мин и продолжалось до 75–105 мин с различной интенсивностью в зависимости от состава образцов. Наиболее высокие значения вязкости отмечены для образцов, содержащих коллаген и лактат хитозана, - прирост значений к контролю составил почти 20 %. При добавлении высокомолекулярного хитозана эта величина не превышала 10 %, что было практически равным величине вязкости для чистого коллагена. Способность одинарных цепей коллагена в растворе самоор-ганизовываться в трехспиральные фибриллы, стабилизирумые водородными связями, приводило к маскировке реакционноспособных групп и снижало эффективность действия ТГ. Добавление реагентов, препятствующих образованию водородных связей, обеспечивало ферментативный катализ. При этом график изменения контролируемых показателей в процессе самосборки коллагена имел типичную сигмоидную конфигурацию. Лаг-фаза соответствовала процессу формирования волокон, а выход на плато - окончанию процесса [10].
Доказательством изменений вязкости именно под действием фермента является зависимость процесса от концентрации ТГ. Во всех случаях наблюдали линейную зависимость вязкости от концентрации фермента (рис. 2).
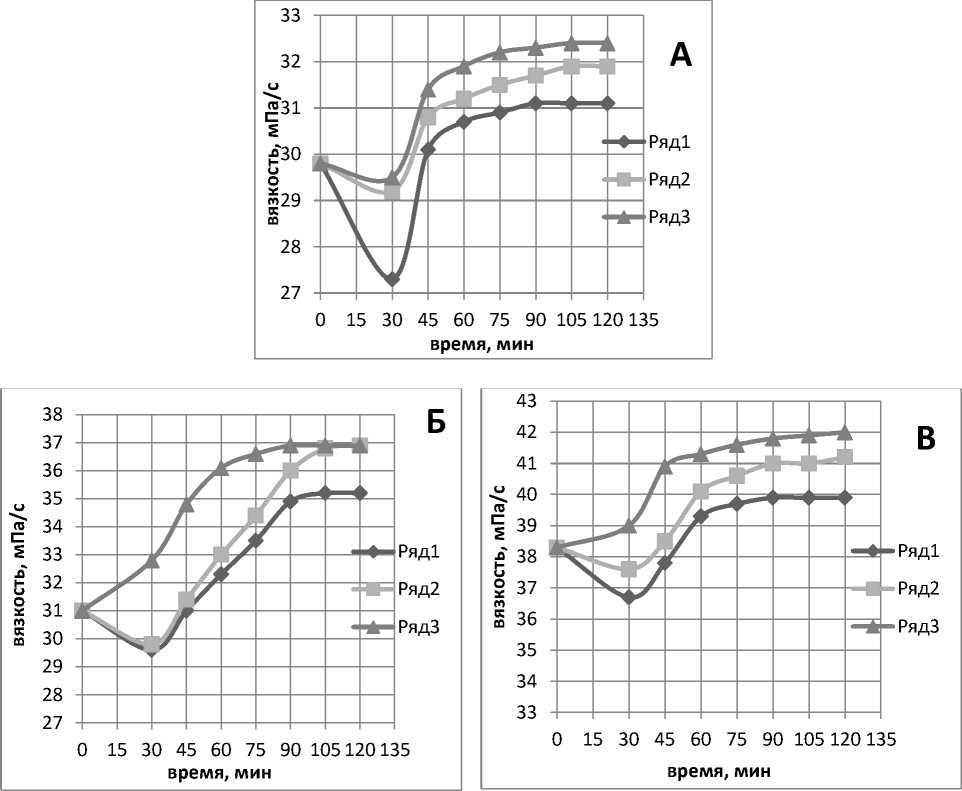
Рис. 1. Динамика изменения вязкости под действием различных концентраций ТГ в образцах: А – коллаген; Б – коллаген + лактат хитозана; В – коллаген + хитозан;
1 – 0,1 % мТГ; 2 – 0,25 % мТГ; 3 – 0,5 % мТГ
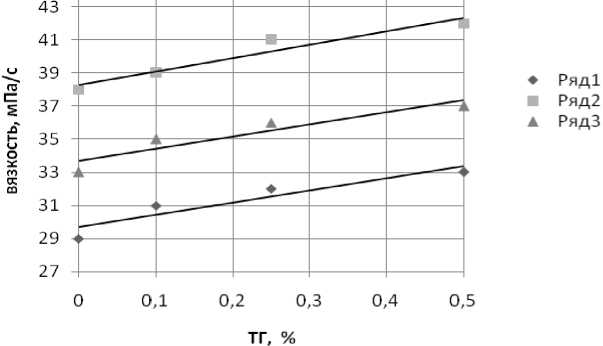
Рис. 2. Зависимость изменения вязкости растворов от концентрации ТГ: 1 – коллаген; 2 – коллаген + лактат хитозана; 3 – коллаген + хитозан
В нашем эксперименте для образцов коллагена без добавления хитозана графики имели сигмоидную форму, наиболее выраженную при минимальной концентрации ТГ. Добавление хитозана нивелирует эту зависимость, однако в значительно меньшей степени, чем лактата хитозана. Сопоставляя эти результаты с литературными данными, можно предположить, что хитозан способен тормозить самосборку коллагена, препятствуя образованию внутримолекулярных взаимодействий. Это увеличивает возможности формирования межмолекулярных ковалентных
Вестник КрасГАУ. 2022. № 2 сшивок с помощью ТГ. Образование такого ферментативно реструктурированного коллагена повышает температуру его денатурации и термостабильность продуктов на его основе. Это, в свою очередь, очень важно для получения продуктов из мышечной ткани глубоководных рыб, так как способствует удержанию воды, увеличению прочности и сохранению формы.
Полученные результаты были использованы для изучения процессов взаимодействия системы коллаген+ лактат хитозана + ТГ при добавлении к мышечной ткани макруруса малоглазого (табл. 1).
Таблица 1
Влияние различных концентраций ТГ на прочность системы миофибриллярных белков макруруса малоглазого с добавлением ПВ
|
ТГ, % к сырью |
ПВ, % к сырью |
Прочность, Н |
Прирост к контролю, % |
|
0 |
0 |
0,844±0,043 |
100 |
|
0 |
1 |
1,001±0,057 |
118,6±2,9 |
|
0,1 |
1 |
1, 119±0,086 |
132,6±3,7 |
|
0,25 |
1 |
1, 579±0,088 |
187,8±5,3 |
|
0,5 |
1 |
1, 618±0,090 |
192,2±5,5 |
Полученные результаты свидетельствуют о целесообразности использования выбранного способа для повышения прочности фаршей на основе мышечной ткани макруруса малоглазого, что может быть использовано в технологии формованной рыбной продукции.
Для выяснения изменения молекулярного-массового распределения белков в мышечной ткани макруруса после обработки ТГ использовали метод ЭФ (рис. 3).
После сканирования гелей были получены данные, характеризующие изменения в количественном составе белковых фракций после проведения ферментативной реакции (табл. 2).
1 2 3 4 5 М
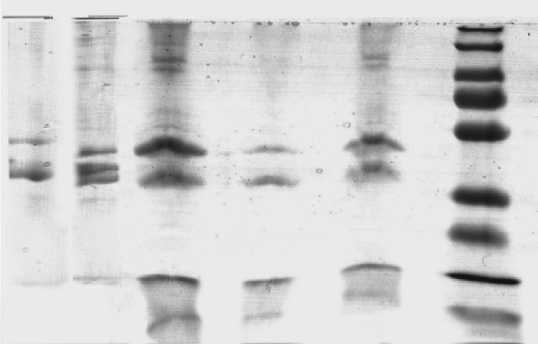
Рис. 3. Разделение белков методом электрофореза в 7 %-м ДСН-ПААГ:
1 - контроль + 0,5 % ТГ; 2 - контроль без добавок. Образцы с добавлением 1 % системы лактат хитозана + коллаген при различных концентрациях ТГ: 3 - 0,5 %; 4 - 0,1 %; 5 - 0,25 %; М -маркеры
Таблица 2
Распределение белковых фракций после ЭФ образцов мышечной ткани макруруса (номера образцов соответствуют указанным на рисунке 3)
|
Мм, кДа |
8 |
15 |
30 |
43 |
46 |
52 |
57 |
62 |
72 |
105 |
110 |
128 |
250 |
|
Площадь пиков, мм2 |
|||||||||||||
|
1 |
172 |
– |
– |
1173 |
– |
281 |
– |
– |
– |
– |
– |
66 |
74 |
|
2 |
553 |
– |
439 |
1295 |
1945 |
1350 |
– |
– |
227 |
478 |
374 |
668 |
343 |
|
3 |
1924 |
2115 |
– |
4111 |
– |
5673 |
691 |
832 |
– |
1393 |
2198 |
1134 |
1058 |
|
4 |
695 |
910 |
– |
3187 |
– |
4146 |
535 |
632 |
– |
857 |
891 |
636 |
575 |
|
5 |
230 |
925 |
– |
1383 |
– |
755 |
– |
– |
– |
275 |
323 |
519 |
864 |
Как показывают результаты, в исходном сырье преобладали белки с Мм 43–52 кДа, относящиеся к группе миогенов. Миофибриллярные белки с Мм 220 кДа и выше образовывали пики меньшей интенсивности. После воздействия ТГ снизилась доля как миогенов, так и миофибрил-лярных белков, вероятно, за счет образования высокомолекулярных конъюгатов, не входящих в диапазон разделяемых компонентов. Также полностью исчезли фракции в диапазоне 57– 110 кДа. В присутствии ПВ характер воздействия фермента изменился. Сохранилось преобладание миогенов, однако их количество снижалось по мере увеличения концентрации ТГ. При этом с ростом концентрации фермента также снизилось количество фракций в диапазоне 57–110 кДа. Возможно, происходит увеличение количества высокомолекулярных конъюгатов, не входящих в диапазон разделяемых компонентов. Сопоставление результатов изменения молекулярно-массового распределения белков мышечной ткани макруруса малоглазого в присутствии системы коллаген + лактат хитозана и реологических характеристик этих образцов позволяет говорить, что субстратная специфичность и направленность воздействия в этих условиях не изменяются, но количество белковых фракций в их полимерной форме возрастает. Это служит причиной повышения прочности образцов и может быть использовано в технологии формованных продуктов из обводненного рыбного сырья.
Заключение. Исследовано влияние коллагена, хитозана и лактата хитозана на каталитическое действие ТГ, оцениваемое по увеличению вязкости растворов, наибольший рост которой наблюдается в присутствии лактата хитозана. Выраженное действие ТГ проявляется через
45 мин инкубации, максимальное повышение вязкости происходит через 90 мин с разной интенсивностью для отдельных образцов. Полученные результаты позволяют предположить, что лактат хитозана способен тормозить самосборку коллагена и обеспечивать формирование межмолекулярных ковалентных сшивок с помощью мТГ. При исследовании влияния системы коллаген + лактат хитозана на формирование текстуры мышечной ткани макруруса малоглазого показано увеличение прочности мышечной ткани на 90 % по сравнению с исходным сырьем, что обеспечивает удержание воды и сохранение формы готовых изделий после термообработки. Исследование фракционного состава белков мышечной ткани макруруса малоглазого под действием ТГ показывает, что внесение коллагена и лактата хитозана не изменяет направленность действия фермента, но обеспечивает уменьшение фракции миогенов и повышение количества высокомолекулярных белковых агрегатов. Полученные результаты служат обоснованием технологии формованного продукта из фарша макруруса малоглазого, который может быть позиционирован в качестве изделия функционального назначения.
Список литературы Влияние пищевых волокон на структурообразование в мышечной ткани объекта глубоководного рыбного промысла макруруса малоглазого в присутствии трансглутаминазы
- Gaspar A., de Gôes-Favoni S. Action of microbial transglutaminase in the modification food proteins // Food Chem. 2015. V. 171. P. 315-322.
- Kuraishi C., Yamazaki K. Susa Y. Transglutaminase: Its utilization in the food industry // Food Reviews International. 2001. V. 17. P. 221-246.
- Ahhmed A.M., Kuroda R., Kawahara S. et al. Dependence of microbial transglutaminase on meat type in myofibrillar proteins cross-linking // Food Chemi. 2009. V. 112. P. 354-361.
- Гартованная Е.А., Иванова К.С. Биологическая безопасность фарша на основе мяса перепела, обогащенного белково-углеводной композицией и ферментом трансглютаминазой // Вестник КрасГАУ. 2020. № 1. С. 139-145.
- Pivnenko T.N., Karpenko Y.V., Krashchen-ko V.V. et al. Biochemical factors affecting the quality of products and the technology of processing deep-sea fish Albatrossia pectoralis // J. Ocean Univ. China. 2020. V. 19. Р. 681-690.
- Borderias A., Sanchez-Alonso I., Perez-Mateos M. New applications of fibres in foods: Addition to fishery products // Trends Food Sci Technol. 2005. V. 16. P. 458-465.
- Cheng S., Wang W., Li Yu et al. Cross-linking and film-forming properties of transglutami-nase-modified collagen fibers tailored by dena-turation temperature // Food Chem. 2019. V. 271 (15). P. 527-535.
- Benjakul S., Visessangua W., Phatchrat S., Tanaka M. Chitosan affects transglutaminase-induced surimi gelation // J. Food Biochem. 2002. V. 27. P. 653-661.
- Jeon Y., Shahidi F, Kim S. Preparation of chitin and chitosan oligomers and their applications in physiological functional foods // Food Reviews International. 2000. V. 16 (2). P. 159-176.
- Nomura Y., Toki S., Ishii Y., Shirai K. Improvement of shark type I collagen with microbial transglutaminase in urea // Biosci. Biotechnol. Biochemi. 2001. V. 65 (4). Р. 982-985.
- Rinaudo M., Pavlov G., Desbrieres J. Solubilization of chitosan in strong acid medium // Int. J. Polym. Anal. Charact. 1999. V. 5. P. 267-276.
- Gomez-Guillen C., Montero P.M., Solas T. et al. Effect of chitosan and microbial transglu-taminase on the gel forming ability of horse mackerel muscle under high pressure // Food Res Int. 2005, V. 38 (1). Р. 103-110.
- Ooizumi T, Xiong Y.L. Identification of cross-linking site(s) of myosin heavy chains in oxidatively stressed chicken myofibrils // Food Science. 2006. V. 71 (3). P. 196-199.


