Влияние полиморфизма гена каспазы 8 на риск развития и течение хронической сердечной недостаточности
Автор: Березикова Екатерина Николаевна, Пустоветова Мария Геннадьевна, Шилов Сергей Николаевич, Ефремов Анатолий Васильевич, Тепляков Александр Трофимович, Сафронов Игорь Дмитриевич, Самсонова Елена Николаевна
Журнал: Патология кровообращения и кардиохирургия @journal-meshalkin
Рубрика: Кардиология
Статья в выпуске: 4 т.17, 2013 года.
Бесплатный доступ
Цель исследования - выявление генетических детерминант повышенного риска развития и тяжести течения хронической сердечной недостаточности (ХСН). Изучены клинико-генетические аспекты влияния полиморфизмов гена каспазы 8 (полиморфные локусы -652(6N)I/D и D302H) на риск развития и тяжесть течения ХСН у больных ишемической болезнью сердца (ИБС). Обследованы 277 человек в возрасте от 45 до 65 лет. Идентификацию генотипов проводили с помощью ПДРФ-анализа ПЦР-продуктов. В группу контроля вошли 136 человек (средний возраст 53,6±4,8 лет), не имевших, по данным обследования, признаков сердечно-сосудистых нарушений. Носительство аллеля del и генотипа del/del полиморфного локуса -652(6N)I/D гена каспазы 8 ассоциировалось с повышенным риском развития ХСН, тогда как аллель ins и генотип ins/ins проявили себя как протективные факторы. Аллель ins и генотип ins/ins полиморфного локуса -652(6N)I/D гена каспазы 8 ассоциируются с протективными свойствами в отношении характера течения ХСН у больных ИБС, а аллель del и генотип del/del - с прогностическими факторами неблагоприятного течения заболевания. Достоверных различий в распределении частот встречаемости генотипов и аллелей полиморфного локуса D302H гена каспазы 8 у больных ХСН ишемического генеза и в группе контроля, а также в зависимости от функционального класса ХСН не выявлено. Определение полиморфизма -652(6N)I/D гена каспазы 8 может быть рекомендовано для раннего прогнозирования риска развития и тяжести течения ХСН.
Сердечная недостаточность, апоптоз, каспаза 8, генетический полиморфизм
Короткий адрес: https://sciup.org/142140570
IDR: 142140570 | УДК: 616.12-008.46:612.6.05
Текст научной статьи Влияние полиморфизма гена каспазы 8 на риск развития и течение хронической сердечной недостаточности
За исключением редко встречающихся моногенных заболеваний этиология заболеваний сердечно-сосудистой системы чрезвычайно сложна. С эпидемиологической точки зрения этиология заболевания включает комплексное взаимодействие между многочисленными факторами окружающей среды (климатом, диетой, физической активностью, микробиологическими, психологическими и другими факторами) и генетическими факторами [1, 2].
Научную концепцию предупреждения сердечно-сосудистых заболеваний составляет концепция факторов риска, под которыми понимают характеристики, способствующие развитию и прогрессированию заболеваний. К ним относятся такие изменяемые факторы, как повышение уровня артериального давления, глюкозы, изменение показателей липидного спектра крови; кроме того это и образ жизни человека – низкая физическая нагрузка, курение, злоупотребление алкоголем. В то же время такие характеристики, как пол, возраст, наследственность представляют собой неизменя- емые, немодифицируемые факторы риска и могут использоваться для прогнозирования риска возникновения заболевания.
Постоянное накопление информации о патогенезе заболеваний сердечно-сосудистой системы привело к пониманию того, насколько значительную роль в их развитии играют генетические факторы. Наиболее частые заболевания: атеросклероз, ишемическая болезнь сердца, артериальная гипертензия (АГ), хроническая сердечная недостаточность – являются мультифакто-риальными. В формирование клинического фенотипа при этих заболеваниях вносят вклад наследственность и среда.
Для каждого заболевания существует большое число генов, различные аллельные формы которых влияют на вероятность развития заболевания, скорость прогрессирования и выраженность клинических симптомов. Как правило, генами предрасположенности являются те гены, белковые продукты которых прямо или косвенно вовлечены в патогенез заболевания [3].
В исследованиях последних лет указаны инструментально-морфологические параллели, позволяющие говорить о ремоделировании сердца как о едином клинико-морфологическом синдроме, имеющем важное значение для прогноза у больных с ишемической болезнью сердца [4]. Один из существенных звеньев развития ремоделирования сердца – апоптоз мышечных и немышечных клеток миокарда. Установлена достоверная зависимость основных гемодинамических показателей, характеризующих систолическую и диастолическую функцию сердца, от числа кардиомиоцитов, подвергшихся апоптозу [5]. Уровень апоптоза во многом определяет вариант ремоделирования миокарда и в итоге темп прогрессирования ХСН [6].
Апоптоз – очень сложный, энергетически зависимый процесс разрушения клетки, ассоциируемый с повышенной экспрессией специфических рецепторов Fas/ APO-1, высвобождением митохондриальных белков и активацией белка p53 [7–10]. Вне зависимости от инициального механизма активации (рецепторный, митохондриальный, р53-зависимый) «суицидальной» программы клеточной смерти происходит фрагментация ДНК, и клетка делится на маленькие апоптотичес-кие тельца – фрагменты клетки, окруженные мембраной и способные к жизнедеятельности, – с последующим фагоцитозом этих тел макрофагами [7, 10, 11].
В настоящее время интенсивно исследуются процессы апоптоза в патогенезе дилатационной и ишемической кардиомиопатий, аритмогенной дисплазии правого желудочка, отторжения трансплантата при аортокоронарном шунтировании. Наиболее изучены апоптотические процессы при формировании коронарного атеросклероза [9].
Нарушение баланса регуляторных белков и активация эффекторных апоптотических механизмов в миокарде пациентов с различными заболеваниями сердечно-сосудистой системы приводят к утрате сократительных (рабочих) кардиомиоцитов, их дислокации и «соскальзыванию» относительно друг друга, что сопряжено либо с непосредственным формированием прогностически неблагоприятной эксцентрической гипертрофии миокарда, либо с переходом от адаптивного концентрического типа ремоделирования к дизадаптивному [12, 13].
Апоптоз клеток зависит от функции многих молекул, включающих каспазу 8. В результате активации каспаз происходит расщепление клеточных субстратов, что приводит к серьезным структурным изменениям клеток в процессе их запрограммированной гибели [14].
Цель исследования – выявление генетических детерминант повышенного риска развития и тяжести течения ХСН. Проведено одноцентровое, обсервационное, одномоментное, рандомизированное клиническое исследование влияния полиморфизмов гена каспазы 8 (полиморфные локусы -652(6N)I/D и D302H) на риск развития и тяжесть течения ХСН у больных ИБС.
Материал и методы
В исследование включены пациенты с ИБС, осложненной ХСН II–IV функциональных классов (ФК) по NYHA. Группу больных составили 277 человек (182 мужчины и 95 женщин) в возрасте от 45 до 65 лет (средний возраст 59,2±7,7 года). Все пациенты, включенные в исследование ХСН, разделены на три группы по функциональному классу. Разделение пациентов проводилось по классификации Нью-Йоркской ассоциации кардиологов (NYHA) с использованием теста с 6-минутной ходьбой. В 1-ю группу вошли 112 пациентов со II ФК, во 2-ю группу – 101 пациент с III ФК, в 3-ю – 64 пациента с IV ФК. Больные ХСН получали базисную терапию. Группу контроля составили 136 человек (средний возраст 53,6±4,8 года) без сердечно-сосудистой патологии и тяжелых хронических заболеваний.
Основая причина развития ХСН во всех группах – ИБС в сочетании с АГ. По наличию таких факторов риска развития сердечно-сосудистых заболеваний, как пол, средний возраст, избыточная масса тела, наследственная отя-гощенность по сердечно-сосудистым заболеваниям, курение, исследуемые группы были сопоставимы.
У всех пациентов забирался генетический материал (буккальный эпителий) с последующим типирова-нием аллелей гена каспазы 8 – полиморфные маркеры -652(6N)I/D и D302H. Для выделения ДНК использовали метод фенол-хлороформной экстракции.
Генотипирование проводили методом ПЦР; использовали праймеры, синтезированные в Институте химической биологии и фундаментальной медицины СО РАН.
Статистическую обработку результатов проводили с использованием статистических программ Statistica. Критический уровень значимости при проверке статистических гипотез принимался равным 0,05 (р – достигнутый уровень значимости). Оценку значимости межгрупповых различий и соответствие частот встречаемости генотипов в наблюдаемой выборке закону Харди – Вайнберга проводили при помощи критерия χ 2. Силу ассоциаций генотипических характеристик изученных генов с риском развития неблагоприятного исхода оценивали по значениям показателя отношения шансов (ОШ) – odds ratio (OR) и его 95% доверительного интервала (95% ДИ) – C.I. Величина OR = 1 указывала на отсутствие ассоциаций, при OR>1 имела место положительная ассоциация аллеля или генотипа с заболеванием (фактор риска), при OR<1 – отрицательная ассоциация аллеля или генотипа с заболеванием (протективный фактор).
Результаты
Распределение частот встречаемости генотипов полиморфных локусов -652(6N)I/D и D302H гена каспазы 8 в группе больных и в контрольной группе соответствовало ожидаемому при равновесии закона Харди – Вайн-берга. На основании анализа распределения частот встречае-
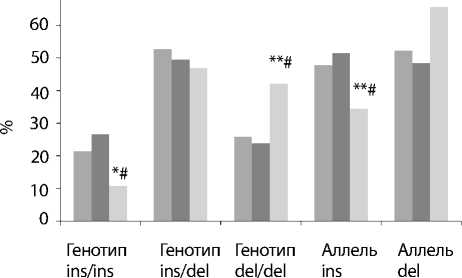
Рис. 1.
Встречаемость генотипов и аллелей полиморфного локуса -652(6N) I/D гена каспазы 8 в зависимости от ФК ХСН, достоверность различий по сравнению с: * p<0,05, ** p<0,01 II ФК; # p<0,01 III ФК.
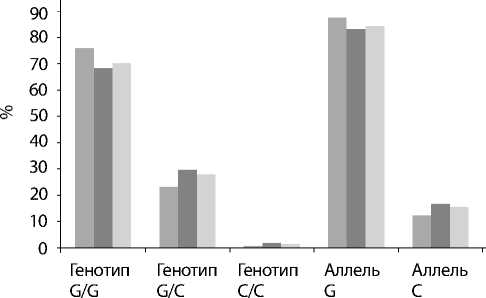
Рис. 2.
Встречаемость генотипов и аллелей полиморфного локуса D302H гена каспазы 8 в зависимости от ФК ХСН.
**#
-
■ II ФК
-
■ III ФК
-
■ IV ФК
■ II ФК
■ III ФК
■ IV ФК
мости генотипов гена каспазы 8 (-652(6N)I/D) у больных ХСН установлены достоверные (р<0,05) различия по сравнению с группой здоровых. Действительно, аллель del (54,0 против 43,4%; р<0,05) и генотип del/del (28,9 против 19,1%; р<0,05) преобладали у пациентов с ХСН по сравнению с группой контроля (табл. 1). Таким образом, вариабельность аллеля del (ОШ = 1,53; 95% ДИ = 1,142–2,050; p = 0,004) и генотипа del/del (ОШ = 2,33; 95% ДИ = 1,293– 4,215; p = 0,005) ассоциировалась с повышенным риском развития ХСН, а частота вариабельности аллеля ins
(ОШ = 0,65; 95% ДИ = 0,488–0,875; p = 0,004) и генотипа ins/ ins (ОШ = 0,43; 95% ДИ = 0,237–0,774; p = 0,005) проявили себя как протективные факторы. Проведенный анализ не выявил достоверных различий в распределении частоты встречаемости генотипов и аллелей полиморфного локуса D302H гена каспазы 8 у больных ХСН ишемического генеза и в группе контроля (табл. 2). На рис. 1 и 2 представлены результаты исследования взаимосвязи полиморфизмов гена каспазы 8 с тяжестью функционального класса хронической сердечной недостаточности (по NYHA).
Частота генотипа del/del полиморфного локуса -652(6N) I/D гена каспазы 8 в 3-й группе достоверно преобладала над показателями во 2-й и 1-й группах (42,2 против 23,8% и 25,9%; p<0,01). В то же время генотип ins/ins в 3-й группе (10,9%) встречался реже, чем во 2-й и 1-й группах (26,7 и 21,4%; р<0,01). Различия по частоте аллеля del (II ФК – 52,2%, III ФК – 48,5% и IV ФК – 65,6%) и аллеля ins (II ФК – 47,8%, III ФК – 51,5% и IV ФК – 34,4%) также оказались существенными (р<0,01). Следовательно, аллель ins и генотип ins/ins полиморфного локуса -652(6N)I/D гена каспазы 8 ассоциируются с протективными свойствами тяжести течения ХСН у больных ИБС, а аллель del и генотип del/del – с прогностическими факторами неблагоприятного течения заболевания. Анализ распределения частоты встречаемости генотипов и аллелей гена D302H гена каспазы 8 в зависимости от ФК ХСН (NYHA) не выявил каких-либо закономерностей в генезе ХСН у больных ИБС.
Обсуждение
В процессе расшифровки генома человека исследователи обнаружели многочисленные полиморфные варианты ДНК. В отличие от мутаций, приводящих к изменению генотипа и часто к патологическим изменениям, снижающим жизнеспособность, генетические полиморфизмы в фенотипе менее выражены [3]. Вместе с тем генетические полиморфизмы могут либо не влиять на фенотипические проявления, либо проявляться экспрессией белковых продуктов с модифицированными физико-химическими характеристиками и, соответственно, с параметрами функциональной активности [3, 4].
Однонуклеотидные замены в смысловых участках гена в значительном числе случаев влияют на экспрессию, изменяют такие характеристики белка, как третичная структура, термостабильность, прочность связывания с субстратом [1, 2]. При этом функциональный спектр активности таких протеинов варьирует от практически нейтрального эффекта генетического полиморфизма до частичного изменения или полного нарушения функции соответствующего белка, что может привести к развитию патологических изменений [6]. Вероятно, у носителей генотипа del/del полиморфного локуса -652(6N)I/D гена каспазы 8 повышена активность апоптоза, играющего важную роль в развитии и прогрессировании ХСН [7, 10, 11]. Полученные результаты открывают новые перспективы для понимания генетических механизмов развития и прогрессирования сердечно-сосудистых заболеваний.
В настоящее время молекулярно-генетические методы прогнозирования развития заболеваний все шире внедряются в клиническую практику. Проводятся масштабные многоцентровые исследования, направленные на создание регистров больных с генетической предрасположенностью к сердечно-сосудистой патологии, содержащие результаты генетических и клинических исследований и оценку эффективности и безопасности лекарственной терапии с учетом фармакогенетических подходов [9]. Системный подход к сопоставлению генетических и клинических данных дает основание полагать, что существует прямая взаимосвязь между генетическими особенностями человека, клинической картиной и прогнозом сердечно-сосудистых заболеваний [15].
В связи со значительной распространенностью и прогрессирующим увеличением количества больных ХСН актуально определение предикторов тяжелого течения заболевания и выявление больных высокого риска для более активного терапевтического воздействия. Понимание механизмов прогрессирования сердечной недостаточности у конкретного пациента дает возможность назначения персонифицированной терапии хронической сердечной недостаточности [9, 14].
Персонифицированные подходы к первичной и вторичной профилактике с учетом генетического полиморфизма особенно важны и эффективны для предупреждения болезней с наследственной предрасположенностью, к которым относится коронарная и сердечная недостаточность. Исключение модифицируемых факторов, способствующих развитию патологического процесса, – прямой путь к профилактике таких болезней [13].
Выраженные различия в частоте встречаемости разработанных нами комбинированных генетических признаков предрасположенности к развитию хронической сердечной недостаточности ишемического генеза позволяют рекомендовать более широкое использование в кардиологической практике разработанных критериев ранней диагностики – генетических маркеров предрасположенности пациента к развитию коронарной и сердечной недостаточности.
Носители генотипа del/del полиморфного локуса -652(6N) I/D гена каспазы 8 представляют особую популяцию высокого риска развития хронической сердечной недостаточности, поэтому именно эти пациенты с ИБС составляют, прежде всего, приоритетную группу диспансерного наблюдения с организацией эффективных целевых профилактических мероприятий, направленных на улучшение качества жизни пациентов и предотвращение у них исключительно высокой преждевременной смертности.
Подходы к профилактике развития сердечно-сосудистых заболеваний, в основе которых лежит концепция факторов риска, должны быть направлены на выявление людей с генетической предрасположенностью к развитию патологии для последующего снижения риска ее развития. Это снижение достижимо с помощью профилактических мероприятий, направленных на изменение влияния модифицируемых факторов риска развития сердечно-сосудистых заболеваний.
Таким образом, проведенное нами исследование полиморфизмов гена каспазы 8, играющей важную роль в патогенезе ишемического ремоделирования левого желудочка, в развитии постинфарктной дисфункции сердца и хронической сердечной недостаточности, открывает новые перспективы для понимания не известных ранее молекулярно-генетических механизмов инициации, становления и прогрессирования коронарной и сердечной недостаточности, а также для ранней диагностики развития и течения патологии с целью осуществления своевременных профилактических мероприятий.
Носительство аллеля del и генотипа del/del полиморфного локуса -652(6N)I/D гена каспазы 8 ассоциируется с повышенным риском развития хронической сердечной недостаточности и является прогностическим фактором неблагоприятного течения заболевания.
При оценке наследственной предрасположенности к развитию хронической сердечной недостаточности в популяции Западной Сибири целесообразно внедрение метода генетического тестирования в клиническую практику обследования пациентов с целью формирования групп повышенного риска заболевания и раннего прогнозирования тяжести течения хронической сердечной недостаточности для осуществления эффективных профилактических мероприятий. Типи-рование полиморфного локуса -652(6N)I/D гена каспазы 8 позволяет выявить лиц с предрасположенностью к развитию и неблагоприятному течению хронической сердечной недостаточности ишемического генеза.


