Влияние пробиотического штамма Bifidobacterium longum на микробиом кишечника карпа
Автор: Аринжанов Азамат Ерсаинович
Журнал: АгроЗооТехника @azt-journal
Рубрика: Кормопроизводство, кормление сельскохозяйственных животных и технология кормов
Статья в выпуске: 1 т.6, 2023 года.
Бесплатный доступ
Желудочно-кишечный тракт животных представляет собой передовую линию системы защиты от различных патогенов, которые попадают в организм с кормом и способны колонизировать клетки и ткани хозяина. Целью исследования стала оценка влияния пробиотического штамма Bifidobacterium longum («Соя-бифидум») на микробиом кишечника карпа. На базе кафедры биотехнологии животного сырья и аквакультуры Оренбургского государственного университета в условиях аквариумного стенда проведен эксперимент на годовиках карпа продолжительностью 56 суток. Методом пар-аналогов было сформировано 3 группы рыб: контрольная и две опытные. Контрольная группа находилась на основном рационе, а опытным группам в основной рацион дополнительно вводили пробиотический штамм Bifidobacterium longum (I опытная) в количестве 0,7 мл / кг корма и антибиотик ципрофлоксацина гидрохлорид (II опытная) в количестве 100 мг / кг корма. Анализ микробиома кишечника рыб показал, что преобладающими бактериальными типами у подопытного карпа были Proteobacteria, Bacteroidetes, Actinobacteria, Firmicutes и Fusobacteriota. Установлено, что введение в рацион карпа Bifidobacterium longum сопряжено с наращиванием в кишечнике филума Actinobacteria и снижением условно патогенного филума Firmicutes. Также в кишечнике рыб выявлен род Bifidobacterium - микроорганизмы, положительно влияющие на состав и численность микрофлоры в кишечнике за счет продукции антибиотических веществ, препятствующих росту численности патогенов, в частности бактерий рода Aeromonas. Введение же в рацион рыб антибиотика приводит к увеличению численности Proteobacteria и входящего в его состав класса Gammaproteobacteria с ростом численности бактерий родов Aeromonas и Pseudomonas, что свидетельствует о нарушении нормальной микрофлоры кишечника и повышении количества санитарно-неблагополучных микроорганизмов и может вести к эпизоотиям.
Кормление, пробиотики, антибиотики, рыба, кишечник, микробиом
Короткий адрес: https://sciup.org/147239144
IDR: 147239144 | УДК: 639.3.043:636.087.8(470.56) | DOI: 10.15838/alt.2023.6.1.2
Текст научной статьи Влияние пробиотического штамма Bifidobacterium longum на микробиом кишечника карпа
Введение водство расширяется в новых направлени-
При постоянном увеличении потребитель- ях, интенсифицируясь и диверсифицируясь. ского спроса на рыбную продукцию рыбо- Интенсивное выращивание рыбы создает стрессовую физиологическую среду, приводящую к подавлению иммунной системы и восприимчивости к инфекционным заболеваниям. Кроме того, присутствие ксенобиотиков в водной среде считается индуктором различных заболеваний и является основным препятствием для культивирования многих видов рыб (Fiorella et al., 2021).
На протяжении последних десятилетий для профилактики болезней рыб и борьбы с ними использовались химиотерапевтические препараты, такие как антибиотики. Однако потребительский спрос на выращиваемую рыбу все больше подчеркивает качество и безопасность без наличия антибиотиков и канцерогенов. Традиционное использование антибиотиков в рыбоводстве подверглось критике из-за потенциального развития устойчивых к ним бактерий, загрязнения окружающей среды и кумуляции в рыбе. В настоящее время многие страны ратифицировали запрет на использование кормовых антибиотиков, а ученые активизировали усилия по выявлению и разработке безопасных добавок, которые улучшают жизнедеятельность, здоровье и иммунную систему выращиваемой рыбы (Chakraborty, Hancz, 2011).
С начала 2000-х годов началось активное изучение потенциала пробиотиков в качестве альтернативы антибиотикам. Использование пробиотических препаратов показало многообещающие результаты в животноводстве, птицеводстве и рыбоводстве (Newaj-Fyzul, Austin, 2015). Пробиотики способны улучшать усвояемость корма (ten Doeschate, Coyne, 2008) путем генерации необходимых питательных веществ, например жирных кислот (Vine et al., 2006), а также производства ферментов (Zokaeifar et al., 2012).
Многие пробиотические штаммы можно использовать в качестве иммуномодуляторов для стимуляции врожденного и клеточного иммунитета (Aly et al., 2008). Выявлена способность ряда пробиотических штаммов ингибировать патогены A. hydrophila (Das et al., 2013), V. арисvulnificus (Pan et al., 2013), V. Anguillarum (Sorroza et al., 2013), Streptococcus iniae и St. Parauberis (Kim et al., 2013); V. Anguillarum (Huang et al., 2014), V. Anguillarum (Sorroza et al., 2012).
В настоящее время изучено влияние пробиотического штамма Bifidobacterium longum лишь на организм сельскохозяйственных животных и птицы (Kvan et al., 2018), в области кормления рыб такие работы фактически отсутствуют. В связи с этим исследование влияния пробиотического штамма Bifidobacterium longum в питании рыб является актуальным и имеет как научное, так и практическое значение.
Целью работы стала оценка влияния пробиотического штамма Bifidobacterium longum на микробиом кишечника карпа.
Задачи:
– осуществить таксономические исследования влияния пробиотического штамма Bifidobacterium longum на микробиоценоз кишечника карпа методом метаге-номного секвенирования;
– провести сравнительную оценку действия пробиотического штамма Bifidobacterium longum и антибиотика ципрофлоксацин гидрохлорида на таксономический профиль кишечника карпа.
Новизна исследований состоит в том, что впервые проведен метагеномный анализ микробиома кишечника рыб при поступлении с кормом пробиотического штамма Bifidobacterium longum в составе препарата «Соя-бифидум» (ООО «НПФ «Экобиос», г. Оренбург) и установлено положительное влияние Bifidobacterium longum на микроэ-кологический статус кишечника карпа.
Материалы и методы
Исследования проведены на базе кафедры биотехнологии животного сырья и аквакуль- туры Оренбургского государственного университета в условиях аквариумного стенда. Объектом исследований являлись годовики карпа массой 38 г. Методом пар-аналогов сформированы 3 группы рыб (n = 20): контрольная и две опытные. Контрольная группа находилась на основном рационе (ОР), I опытная – в ОР дополнительно вводили пробиотический штамм Bifidobacterium longum (дозировка 0,7 мл / кг корма), II опытная – в ОР дополнительно вводили антибиотик ципрофлоксацин гидрохлорид (дозировка 100 мг/кг корма). Продолжительность эксперимента составила 56 суток.
В качестве основного рациона был использован корм КРК-110-1 производства ОАО «Оренбургский комбикормовый завод» (г. Оренбург). Источником пробиотического штамма Bifidobacterium longum (1 х 109 КОЕ) являлся препарат «Соя-би-фидум» производства ООО «НПФ «Экобиос» (г. Оренбург).
Для оценки микробиома рыб были отобраны образцы содержимого кишечника, которые использовали для выделения очищенных препаратов ДНК. Концентрация ДНК измерялась трехкратно: после выделения ДНК, после первой полимеразной цепной реакции (ПЦР) со специфичными 16S прокариотическими праймерами и после второй ПЦР с адаптерами и индексами протоколов Nextera XT. Анализ микрофлоры осуществлялся методом метагеномного секвенирования (Illumina MiSeq, «Illumina», США) с набором реагентов MiSeq® Reagent Kit v3 (600 cycle). Для биоинформатической обработки результатов применялась программа PEAR (PairEnd AssembeR, PEAR v0.9.8).
Результаты секвенирования были обработаны с использованием пакета программ Microsoft Excel. В результатах учитывались таксоны, численность которых более 1%. Проверка соответствия полученных данных нормальному закону распределения осуществлялась при помощи критерия согласия Колмогорова. Значение с Р≤0,05 считалось статистически значимым.
Результаты и обсуждение
Кишечник представляет собой сложную экосистему, включающую клетки хозяина, питательные вещества и кишечную микробиоту. Основные функции кишечной микробиоты – иммунный барьер слизистой оболочки кишечника, переваривание и всасывание вспомогательной пищи и стимулирование метаболизма питательных веществ (Zhang et al., 2021). В желудочнокишечном тракте комменсальные бактерии могут синтезировать незаменимые аминокислоты, витамины и короткоцепочечные жирные кислоты, способствуя эффективности использования корма.
Кишечная микробиота играет решающую роль в поддержании здоровья организма, изменяя несколько физиологических функций, включая пищеварение, метаболизм и иммунные реакции (Ali et al., 2022). Желудочно-кишечный тракт животных представляет собой передовую линию системы защиты от различных патогенов, которые попадают в организм с кормом и способны колонизировать клетки и ткани хозяина (Фисинин, Сурай, 2013). Хорошо известно, что группа факторов защитной системы включает физические барьеры (Klasing, 2007), компоненты самой иммунной системы, которые активируются в кишечнике (Laptev et al., 2019).
Создание стабильной микробиоты является сложным процессом, на который влияют различные факторы, включая рацион питания и наличие болезней, поэтому любое изменение кишечной микробиоты может иметь функциональные последствия для здоровья и, следовательно, производительности (Zhou et al., 2016).
Анализ микробиома кишечника рыб показал преобладание у подопытного карпа бактериальных типов Proteobacteria, Bacteroidetes, Actinobacteria, Firmicutes и
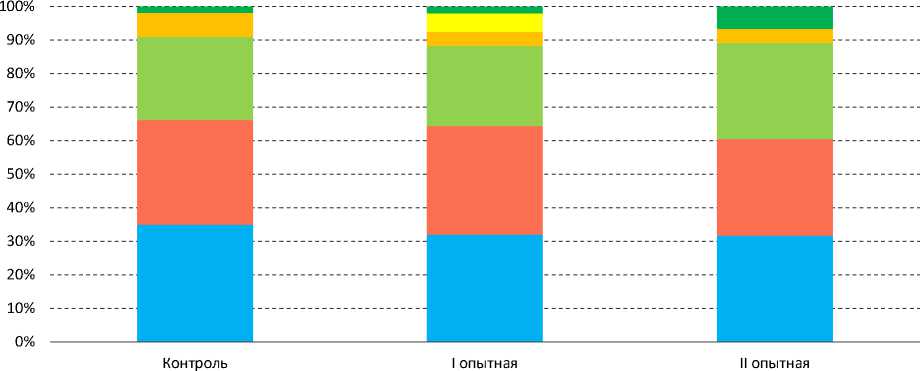
■ Fusobacteria ■ Verrucomicrobia Proteobacteria ■ Firmicutes ■ Actinobacteria ■ Неклассифицированные Рис. Гистограмма филумов кишечника подопытных рыб Источник: исследования автора.
Fusobacteriota (рис.) , что согласуется с литературными данными (Zhang et al., 2021). Выявленный филум Verrucomicrobia состоит из микроорганизмов, чаще всего встречающихся в различных водных экосистемах. Эти микроорганизмы аллохтонные и определяются в водном микробном сообществе (Zakharova et al., 2013).
В контрольной группе преобладали преимущественно представители Fusobacteria, Verrucomicrobia и Proteobacteria (табл. 1). Среди семейств Fusobacteriaceae представлены анаэробные, грамотрицательные, неспорообразу- ющие бактерии (34,98% от общего числа) и Verrucomicrobiaceae (29,76%) – грамотрица-тельные микроорганизмы. Также в контроле присутствовали такие семейства, как Xanthobacteraceae, Hyphomicrobiaceae, Aeromonadaceae и Streptococcaceae. Среди родов преобладали Cetobacterium (33,87%) – грамотрицательные, плеоморфные, неспорообразующие, палочковидные бактерии, Luteolibacter – грамотрицательные бактерии, Lactococcus – грамположительные, неподвижные кокки, а также Aeromonas – грам-отрицательные палочковидные бактерии, являющиеся условными патогенами рыб.
Таблица 1. Таксономический состав микробиома кишечника рыб контрольной группы
|
Филум |
Класс |
Семейство |
Род |
|
Fusobacteria (34,42 ± 1,32%) |
Fusobacteria (34,42 ± 1,32%) |
Fusobacteriaceae (34,98 ± 1,34%) |
Cetobacterium (33,87 ± 1,16%) |
|
Verrucomicrobia (30,7 ± 1,12%) |
Verrucomicrobiae (30,7 ± 1,12%) |
Verrucomicrobiaceae (29,76 ± 1,04%) |
Luteolibacter (24,98 ± 1,0%) |
|
Rubritalea (2,36 ± 0,16%) |
|||
|
Proteobacteria (24,45 ± 0,88%) |
Alphaproteobacteria (19,52 ± 0,83%) |
Xanthobacteraceae (6,17 ± 0,45%) |
Devosia (2,52 ± 0,18%) |
|
Hyphomicrobiaceae (2,05 ± 0,14%) |
Azorhizobium (2,65 ± 0,21%) |
||
|
Gammaproteobacteria (4,38 ± 0,36%) |
Aeromonadaceae (5,23 ± 0,39%) |
Aeromonas (3,18 ± 0,26%) |
|
|
Firmicutes (7,08 ± 0,51%) |
Bacilli (5,99 ± 0,41%) |
Streptococcaceae (6,1 ± 0,47%) |
Lactococcus (5,15 ± 0,38%) |
|
Источник: исследования автора. |
|||
В группе с добавлением в рацион пробиотического штамма Bifidobacterium longum были установлены следующие представители: Fusobacteria, Verrucomicrobia, Proteobacteria, Firmicutes и Actinobacteria (табл. 2). Среди семейств преобладали в численности представители Fusobacteriaceae (30,01%) и Verrucomicrobiaceae (28,98%), также присутствовали Xanthobacteraceae (3,25%), Hyphomicrobiaceae (2,13%), Streptococcaceae (3,21%). Стоит отметить присутствие филума Actinobacteria, который не зафиксирован как в контроле, так и во II опытной группе, а также представителя Bifidobacteriaceae (5,02%), семейства, не обнаруженного в контрольной группе. Видовой состав был представлен Cetobacterium, Luteolibacter, Rubritalea, Devosia, Azorhizobium, Lactococcus и Bifidobacterium. Анализ данных показал снижение количества грамположительных микроорганизмов филума Firmicutes на 3% (P ≤ 0,05) по сравнению с контролем.
При добавлении в рацион рыб антибиотика было выявлено снижение бактериального разнообразия в кишечнике рыб, при этом среди филумов отмечалось некоторое сокращение численности таксонов, присутствующих в контроле, таких как Fusobacteria и Verrucomicrobia (табл. 3) , с одновременным увеличением численности
Таблица 2. Таксономический состав микробиома кишечника рыб I опытной группы
|
Филум |
Класс |
Семейство |
Род |
|
Fusobacteria (30,27 ± 1,23%) |
Fusobacteria (30,01 ± 1,13%) |
Fusobacteriaceae (30,01 ± 1,13%) |
Cetobacterium (29,96 ± 1,04%) |
|
Verrucomicrobia (30,6 ± 1,34%) |
Verrucomicrobiae (30,6 ± 1,34%) |
Verrucomicrobiaceae (28,98 ± 1,21%) |
Luteolibacter (23,67 ± 1,11%) Rubritalea (2,45 ± 2,45%) |
|
Proteobacteria (22,56 ± 1,14%) |
Alphaproteobacteria (18,46 ± 1,04%) |
Xanthobacteraceae (3,25 ± 0,35%) |
Devosia (2,31 ± 0,21%) |
|
Hyphomicrobiaceae (2,13 ± 0,18%) |
Azorhizobium (2,10 ± 0,17%) |
||
|
Firmicutes (4,08 ± 0,41%)* |
Bacilli (3,99 ± 0,37%) |
Streptococcaceae (3,21 ± 0,32%) |
Lactococcus (3,09 ± 0,28%) |
|
Bifidobacteriaceae (5,02 ±0,53%) |
Bifidobacterium (4,87 ± 0,44%) |
||
|
Actinobacteria (5,20 ± 0,45%) |
Actinobacteria (5,12 ± 0,39%) |
Не классифицированы |
Не классифицированы |
|
* Различия с контролем статистически значимы при P ≤ 0,05. Источник: исследования автора. |
|||
Таблица 3. Таксономический состав микробиома кишечника рыб II опытной группы
|
Филум |
Класс |
Семейство |
Род |
|
Fusobacteria (31,28 ± 1,36%) |
Fusobacteria (30,22 ± 1,29%) |
Fusobacteriaceae (28,47 ± 1,25%) |
Cetobacterium (25,98 ± 1,27%) |
|
Verrucomicrobia (28,34 ± 1,4%) |
Verrucomicrobiae (28,34 ± 1,4%) |
Verrucomicrobiaceae (27,54 ± 1,28%) |
Luteolibacter (23,63 ± 1,04%) |
|
Proteobacteria (28,32 ± 1,39%)* |
Alphaproteobacteria (18,33 ± 1,17%) |
Xanthobacteraceae (5,20 ± 0,51%) |
Devosia (1,52 ± 0,23%) |
|
Hyphomicrobiaceae (2,21 ± 0,37%) |
Azorhizobium (2,09 ± 0,28%) |
||
|
Gammaproteobacteria (8,67 ± 0,89%) |
Aeromonadaceae (5,23 ± 0,47%) |
Aeromonas (3,48 ± 0,31%) |
|
|
Pseudomonadaceae (3,3 ± 0,29%) |
Pseudomonas (3,22 ± 0,25%) |
||
|
Firmicutes (4,11 ± 0,38%)* |
Bacilli (3,97 ± 0,36%) |
Streptococcaceae (2,1 ± 0,23%) |
Lactococcus (1,21 ± 0,13%) |
|
* Различия с контролем статистически значимы при P ≤ 0,05. Источник: исследования автора. |
|||
Proteobacteria на 3,9% (P ≤ 0,05) и входящего в него класса Gammaproteobacteria на 4,3% (P ≤ 0,05), относительно контрольных значений соответственно. При этом сохранялась тенденция к уменьшению численности родов, представленных в контроле: Fusobacteria-ceae, Verrucomicrobiaceae, Xanthobacteraceae, Hyphomicrobiaceae и Streptococcaceae , на фоне появления семейства Pseudomonadaceae .
Таким образом, в ходе проведенных исследований были выявлено, что бактериальное разнообразие, изученное в контрольных образцах кишечника карпа, схоже по своей структуре с описанным в некоторых литературных источниках (Kashinskaya et al., 2015). Введение в рацион карпа пробиотического штамма Bifidobacterium longum сопряжено с наращиванием филума Actinobacteria, микроорганизмов, обеспечивающих защиту от кишечных патогенов и модуляцию локального иммунного ответа. Кроме того, обнаружен род Bifidobacterium, который является микроорганизмом, положительно влияющим на состав и численность микрофлоры в кишечнике животных за счет продукции антибиотических веществ, препятствующих росту численности патогенов (Liu et al., 2018). Этим объясняется снижение в кишечнике рыб условных патогенов: филума Firmicutes и бактерий рода Aeromonas.
При добавлении в рацион карпам антибиотика установленное увеличение численности микроорганизмов рода Proteobacteria и входящего в его состав класса Gammaproteobacteria с ростом численности представителей родов Aeromonas и Pseudomonas говорит о нарушении нормальной микрофлоры кишечника и повышении количества санитарно-неблагополучных микроорганизмов, что может вести к эпизоотиям.
Выводы
Таким образом, полученные результаты показывают, что включение в рацион рыб пробиотического штамма Bifidobacterium longum нормализует микроэкологический статус и способствует увеличению фи-лума Actinobacteria , а также численности представителей рода Bifidobacterium , которые обеспечивают защиту от кишечных патогенов, за счет продукции антибиотических веществ.
Список литературы Влияние пробиотического штамма Bifidobacterium longum на микробиом кишечника карпа
- Фисинин В.И., Сурай П. (2013). Кишечный иммунитет у птиц: факты и размышления (обзор) // Сельскохозяйственная биология. Т. 48. № 4. С. 3–25. DOI: 10.15389/agrobiology.2013.4.3rus
- Ali U., Naveed S., Qaisrani S.N. [et al.] (2022). Characteristics of essential oils of Apiaceae family: Their chemical compositions, in vitro properties and effects on broiler production. The Journal of Poultry Science, 59 (1), 16–37. DOI: 10.2141/jpsa.0210042
- Aly S.M., Abd-El-Rahman A.M., John G., Mohamed M.F. (2008). Characterization of some bacteria isolated from Oreochromis niloticus and their potential use as probiotics. Aquaculture, 277, 1–6. DOI: 10.1016/j.aquaculture.2008.02.021
- Chakraborty S.B., Hancz C. (2011). Application of phytochemicals as immunostimulant, antipathogenic and antistress agents in finfish culture. Reviews in Aquaculture, 3, 103–119. DOI: 10.1111/J.1753-5131.2011.01048.X
- Das A., Nakhro K., Chowdhury S., Kamilya D. (2013). Effects of potential probiotic Bacillus amyloliquefaciens [corrected] FPTB16 on systemic and cutaneous mucosal immune responses and disease resistance of catla (Catla catla). Fish Shellfish Immunol, 35 (5), 1547–1553. DOI: 10.1016/j.fsi.2013.08.022
- Fiorella K.J., Okronipa H., Baker K., Heilpern S. (2021). Contemporary aquaculture: Implications for human nutrition. Current Opinion in Biotechnology, 70, 83–90. DOI: 10.1016/j.copbio.2020.11.014
- Huang J.B., Wu Y.C., Chi S.C. (2014). Dietary supplementation of Pediococcus pentosaceus enhances innate immunity, physiological health and resistance to Vibrio anguillarum in orange-spotted grouper (Epinephelus coioides). Fish Shellfish Immunol, 39 (2), 196–205. DOI: 10.1016/j.fsi.2014.05.003
- Kashinskaya E.N., Belkova N. L., Izvekova G.I. [et al.] (2015). A comparative study on microbiota from the intestine of Prussian carp (Carassius gibelio) and their aquatic environmental compartments, using different molecular methods. Journal of Applied Microbiology, 119 (4), 948–961. DOI: 10.1111/jam.12904
- Kim D., Beck B.R., Heo S.B. [et al.] (2013). Lactococcus lactis BFE920 activates the innate immune system of olive flounder (Paralichthys olivaceus), resulting in protection against Streptococcus iniae infection and enhancing feed efficiency and weight gain in large-scale field studies. Fish & Shellfish Immunology, 35 (5), 1585–1590. DOI: 10.1016/j.fsi.2013.09.008
- Klasing K.C. (2007). Nutrition and the immune system. British Poultry Science, 48, 525–537. DOI: 10.1080/00071660701671336
- Kvan O.V., Gavrish I.A., Lebedev S.V. [et al.] (2018). Effect of probiotics on the basis of Bacillus subtilis and Bifidobacterium longum on the biochemical parameters of the animal organism. Environmental Science and Pollution Research, 25 (3), 2175–2183. DOI: 10.1007/s11356-017-0534-9
- Laptev G.Y., Filippova V.A., Kochish I.I. [et al.] (2019). Examination of the expression of immunity genes and bacterial profiles in the caecum of growing chickens infected with Salmonella Enteritidis and Fed a Phytobiotic. Animals (Basel), 9 (9), 615. DOI: 10.3390/ani9090615.
- Liu H., Li J., Guo X., Liang Y., Wang W. (2018). Yeast culture dietary supplementation modulates gut microbiota, growth and biochemical parameters of grass carp. Microbial biotechnology, 11 (3), 551–565. DOI: 10.1111/1751-7915.13261
- Newaj-Fyzul A., Austin B. (2015). Probiotics, immunostimulants, plant products and oral vaccines, and their role as feed supplements in the control of bacterial fish diseases. Journal of Fish Diseases, 38 (11), 937–955. DOI: 10.1111/jfd.12313
- Pan C.-Y., Wang Y.-D., Chen J.-Y. (2013). Immunomodulatory effects of dietary Bacillus coagulans in grouper (Epinephelus coioides) and zebrafish (Danio rerio) infected with Vibrio vulnificus. Aquaculture International, 21, 1155–1168. DOI: 10.1007/s10499-012-9619-0
- Sorroza L., Padilla D., Acosta F. [et al.] (2012). Characterization of the probiotic strain Vagococcus fluvialis in the protection of European sea bass (Dicentrarchus labrax) against vibriosis by Vibrio anguillarum. Veterinary Microbiology, 155 (2–4), 369–373. DOI: 10.1016/j.vetmic.2011.09.013
- Sorroza L., Real F., Acosta F. [et al.] (2013). A probiotic potential of Enterococcus gallinarum against Vibrio anguillarum infection. Fish Pathology, 48, 9–12. DOI: 10.3147/jsfp.48.9
- Ten Doeschate K.I., Coyne V.E. (2008). Improved growth rate in farmed Haliotis midae through probiotic treatment. Aquaculture, 284, 174–179. DOI: https://doi.org/10.1016/j.aquaculture.2008.07.018
- Vine N.G., Leukes W.D., Kaiser H. (2006). Probiotics in marine larviculture. FEMS Microbiology Reviews, 30 (3), 404–427. DOI: 10.1111/j.1574-6976.2006.00017.x
- Zakharova Y.R., Galachyants Y.P., Kurilkina M.I. [et al.] (2013). The structure of microbial community and degradation of diatoms in the deep nearbottom layer of Lake Baikal. PLoS One, 8 (4), e59977. DOI: 10.1371/journal.pone.0059977
- Zhang B., Zhuang X., Guo L., McLean R.J., Chu W. (2019). Recombinant N-acyl homoserine lactone-Lactonase AiiAQSI-1 Attenuates Aeromonas hydrophila virulence factors, biofilm formation and reduces mortality in crucian carp. Marine drugs, 17 (9), 499. DOI: 10.3390/md17090499
- Zhang Y., Zhang P., Shang X., Lu Y., Li Y. (2021). Exposure of lead on intestinal structural integrity and the diversity of gut microbiota of common carp. Comparative Biochemistry and Physiology – Part C: Toxicology & Pharmacology, 239, 108877. DOI: 10.1016/j.cbpc.2020.108877
- Zhou S., Zhang A., Yin H., Chu W. (2016). Bacillus sp. QSI-1 Modulate quorum sensing signals reduce Aeromonas hydrophila level and alter gut microbial community structure in fish. Frontiers in Cellular and Infection Microbiology, 6, 184. DOI: 10.3389/fcimb.2016.00184
- Zokaeifar H., Balcázar J.L., Saad C.R., Kamarudin M.S., Sijam K., Arshad A., Nejat N. (2012). Effects of Bacillus subtilis on the growth performance, digestive enzymes, immune gene expression and disease resistance of white shrimp, Litopenaeus vannamei. Fish & Shellfish Immunology, 33 (4), 683–689. DOI: 10.1016/j.fsi.2012.05.027


