Влияние пробиотиков на основе Saccharomyces sp. и Bacillus subtilis на бактериальное сообщество слепых отростков кишечника и продуктивность цыплят-бройлеров
Автор: Егорова Т.А., Ленкова Т.Н., Ильина Л.А., Йылдырым Е.А., Никонов И.Н., Филиппова В.А., Лаптев Г.Ю., Новикова Н.И., Грозина А.А., Манукян В.А., Фисинин В.И., Егоров И.А.
Журнал: Сельскохозяйственная биология @agrobiology
Рубрика: Микробиом и продуктивность
Статья в выпуске: 6 т.51, 2016 года.
Бесплатный доступ
Изучение свойств пробиотических микроорганизмов, продуцирующих ферменты и аминокислоты, - важный подход при создании биопрепаратов для профилактики различных заболеваний и увеличения продуктивности сельскохозяйственной птицы. Бактерии родов Lactobacillus и Bifidobacterium получили широкое применение в качестве пробиотиков благодаря способности к адгезии на слизистой кишечника и выраженной антагонистической активности в отношении различных патогенных микроорганизмов. Менее изученными, однако перспективными в качестве пробиотиков для птицы считаются бактерии рода Bacillus и дрожжи рода Saccharomyces из-за их способности синтезировать антибиотические соединения и других полезных свойств. Используя молекулярно-генетические методы T-RFLP (terminal restriction fragment length polymorphism) и ПЦР в реальном времени, мы сравнили численность и состав бактериального сообщества в слепых отростках кишечника у трех групп цыплят-бройлеров кросса Сobb 500 в возрасте 37 сут. Цыплята I группы (контроль) получали рассыпные сбалансированные комбикорма (ОР). Птицу из II группы кормили аналогичными комбикормами, которые обогащали пробиотиком на основе живых клеток дрожжей рода Saccharomyces в количестве 1 кг/т корма. Бройлеры III группы получали такой же рацион, но с добавкой пробиотического препарата целлобактерин-Т в количестве 1 кг/т корма. Бактериальное сообщество слепых отростков кишечника бройлеров характеризовалось разнообразной таксономической структурой, включающей, помимо традиционно присутствующих в желудочно-кишечном тракте (ЖКТ) птицы микроорганизмов, ряд неидентифицированных филотипов. Таксономическими доминантами сообщества были представители филума Firmicutes, объединяющего преимущественно бактерии с целлюлозо- и амилолитическими свойствами класса Clostridia, а также микроорганизмы родов Bacillus, Lactobacillus и Enterococcus, как правило, обладающих антимикробной активностью. Помимо этого, обнаружены разнообразные условно-патогенные и патогенные бактерии, связанные с заболеваниями птицы, в том числе вызывающие поражения респираторного тракта (семейство Pasteurellaceae, род Mycoplasma и др.). Включение в рецептуру комбикорма пробиотиков приводило к увеличению общей численности бактерий и снижению биоразнообразия в содержимом слепых отростков ЖКТ бройлеров. Наиболее значительные различия по сравнению с остальными группами были обнаружены у птицы при скармливании дрожжевого пробиотика: бактериальное сообщество слепых отростков во II группе характеризовалось наименьшей величиной индекса Шеннона и показателя индекса доминирования Симпсона. Наибольший пробиотический эффект был обнаружен в результате применения пробиотика целлобактерина-Т. В сообществе слепых отростков ЖКТ птицы в III группе по сравнению с контролем достоверно увеличилось содержание бактерий рода Bacillus - в 1,38 раз (Р 2 и каротиноидов в печени были зафиксированы у бройлеров в III группе. Введение в рацион птицы дрожжевого препарата способствовало повышению потребления кормов. Влияния препаратов на химический состав грудных и ножных мышц бройлеров обнаружено не было.
Микрофлора слепых отростков, цыплята-бройлеры, бактериальное сообщество, пцр в реальном времени, пробиотик, целлобактерин-т, дрожжи, продуктивность бройлеров
Короткий адрес: https://sciup.org/142213994
IDR: 142213994 | УДК: 636.52/.58:636.084:579.64 | DOI: 10.15389/agrobiology.2016.6.891rus
Текст научной статьи Влияние пробиотиков на основе Saccharomyces sp. и Bacillus subtilis на бактериальное сообщество слепых отростков кишечника и продуктивность цыплят-бройлеров
На сегодняшний день фундаментальный научный интерес пред-
Исследование выполнено при поддержке гранта Российского научного фонда по научному проекту «Современные представления о микрофлоре кишечника птицы при различных рационах питания: молекулярно-генетические подходы» ¹ 14-16-00140.
ставляют работы по изучению влияния пробиотических биопрепаратов на основе штаммов полезных микроорганизмов, продуцирующих ферменты, аминокислоты и другие биологически активные вещества, на состав микробиома кишечника птицы (1, 2). Известно, что нормальная микрофлора кишечника оказывает воздействие на формирование иммунной системы макроорганизма, участвует в инактивации некоторых вредных продуктов распада и препятствует размножению условно-патогенных бактерий (3, 4). У птицы, как правило, исследуют слепые отростки желудочно-кишечного тракта (ЖКТ), где содержимое кишечника задерживается на длительный период и происходят основные процессы микробиального протеолиза, расщепления целлюлозы и крахмала (5, 6).
Бактерии рода Bacillus — перспективные объекты для создания пробиотических препаратов. Так, в качестве пробиотиков для человека были апробированы виды Bacillus subtilis , B. licheniformis , B. coagulans , B. clausii , B. pumilus , B. cereus (7). Несмотря на то, что по свойствам бациллы значительно отличаются от классических пробиотических микроорганизмов, таких как лактобактерии или бифидобактерии, они имеют ряд преимуществ. Прежде всего, благодаря наличию спор бациллы более устойчивы к условиям ЖКТ (8). Показано, что бациллы способны колонизировать пищеварительный тракт птицы, взаимодействуя как с эпителием кишечника организма-хозяина, так и непосредственно с населяющими ЖКТ микроорганизмами. Подавляющее число бацилл способны к синтезу органических кислот, бактериоцинов, антибиотических веществ, в связи с чем они как антагонисты способны вытеснять из кишечника патогенов (сальмонелл, протея, стафилококков, кишечную палочку, стрептококков) (8, 9). Кроме того, большинство штаммов бацилл обладает широкой ферментативной активностью и принимает участие в процессах метаболизма различных питательных субстратов.
В качестве пробиотика для птицы интерес представляют дрожжи рода Saccharomyces благодаря продуцированию разнообразных антибиотических соединений, подавляющих рост патогенов (10, 11). Важнейшее конкурентное преимущество дрожжей — их устойчивость к антибиотикам. Сообщалось о благоприятном воздействии дрожжей на слизистую оболочку кишечника (увеличение размера ворсинок и плотности бокаловидных клеток), а также продуктивность различных моногастричных и жвачных животных (12, 13). При этом положительный эффект дрожжей связывают не только с вырабатываемыми метаболитами, но и с компонентами их клеточных стенок (14, 15). Исследования также подтверждают положительное влияние пробиотических микроорганизмов на иммунитет птицы (16-18). Так, недавно показана способность двух штаммов Saccharomyces boulardii и B. subtilis активировать иммунитет благодаря взаимодействию с толл-подо-бными рецепторами (TLR) клеток птицы (18-20).
Несмотря на широкий интерес к представленной теме, перечисленные микроорганизмы — достаточно новые пробиотические объекты в птицеводстве. Воздействие бацилл и дрожжей на состояние микробиоценоза кишечника и показатели продуктивности до сих пор изучено не в полной мере. Работа осложняется практически полным отсутствием методической базы для исследования факультативно- и строго анаэробных микроорганизмов, населяющих пищеварительный тракт птицы.
Согласно традиционным представлениям, сложившимся на основе классических методов микробиологии, преобладающими среди микроорганизмов кишечника считаются бифидобактерии, лактобациллы, неспорообразующие анаэробы, бактероиды (21, 22). Благодаря достижениям мик-892
робиологии последних десятилетий появилась возможность анализировать состав микроорганизмов кишечного тракта с помощью молекулярно-генетических методов и определять микробное разнообразие, минуя стадию культивирования (23-24). В результате было выявлено присутствие гораздо большего числа видов, чем предполагалось ранее, что привело к переоценке классических взглядов. Молекулярно-генетические методы, такие как T-RFLP-анализ (terminal restriction fragment length polymor-phism), позволяют дать развернутую характеристику микробного сообщества, обнаружить таксономические доминанты и минорные компоненты, в том числе некульти-вируемые микроорганизмы, доля которых в разных экосистемах достигает 90 % (25). Метод ПЦР в реальном времени дает возможность установить количество микроорганизмов в экосистеме (26). Однако примеры изучения кишечного микробиома сельскохозяйственной птицы молекулярно-генетическими методами единичны (24-28), а сведения о воздействии пробиотических штаммов бацилл и дрожжей на микробиоценоз содержимого кишечника практически полностью отсутствуют.
В настоящем исследовании, использовав T-RFLP и ПЦР в реальном времени (ПЦР-РВ), мы впервые продемонстрировали влияние препаратов на основе живых клеток дрожжей рода Saccharomyces и пробиотика целлобактерина-Т на основе бактерий B. subtilis на бактериальное сообщество слепых отростков ЖКТ . На основе анализа коэффициентов биоразнообразия было показано, что дрожжевой препарат обладал наибольшим эффектом воздействия на бактериальное сообщество. При этом пробиотический эффект в отношении патогенных микроорганизмов оказался выше при применении бактериального препарата.
Цель работы заключалась в изучении особенностей бактериального сообщества слепых отростков кишечника и продуктивности цыплят-бройлеров при включении в рационы пробиотиков на основе дрожжей рода Saccharomyces и бактерий Bacillus subtilis .
Методика. Объектом исследования были три группы бройлеров кросса Соbb 500 (по 35 гол. в каждой) в период с 1- до 37-суточного возраста (виварий ФГУП «Загорское ЭПХ ВНИТИП», Московская обл.). Кормление цыплят осуществляли вручную вволю сухими полнорационными комбикормами в соответствии с нормами для кросса. Цыплята I группы (контроль) получали рассыпные сбалансированные комбикорма (ОР). Во II группе аналогичные комбикорма обогащали пробиотиком на основе живых клеток дрожжей рода Saccharomyces иностранного производства в дозе 1 кг/т корма. У бройлеров из III группы был такой же ОР, но с добавкой пробиотического препарата целлобактерина-Т (ООО «Биотроф») в количестве 1 кг/т корма. Первые 5 сут птице получала одинаковые престартерные гранулированные комбикорма, в дальнейшем кормление осуществлялось в соответствии со схемой опыта.
Цыплят содержали в клеточных батареях AviMax («Big Dutchman Livestock Equipment Co., Ltd», Китай) по группам без разделения по полу с соблюдением всех технологических параметров, соответствующих нормам Всероссийского научно-исследовательского и технологического института птицеводства (ВНИТИП).
Учитывали сохранность поголовья, живую массу бройлеров в возрасте 7, 21 и 37 сут (индивидуальное взвешивание), среднесуточный прирост живой массы, потребление и затраты корма на 1 кг живой массы, содержание витаминов и каротиноидов в печени, химический состав грудных и ножных мышц, переваримость и использование питательных ве- ществ корма по методике физиологического (балансового) опыта (29).
Состав бактериального сообщества слепых отростков кишечника птицы исследовали методами Т-RFLP и ПЦР-РВ. Отбор содержимого слепых отростков для молекулярно-генетических исследований проводили в 37-суточном возрасте при убое со строгим соблюдением стерильности в соответствии с установленными требованиями (30).
Тотальную ДНК из образцов выделяли с помощью набора Genomic DNA Purification Kit («Fermentas, Inc.», Литва) согласно рекомендациям производителя. ПЦР проводили на ДНК-амплификаторе Verity («Life Technologies, Inc.», США) с эубактериальными праймерами 63F (CAGGCCT-AACACATGCAAGTC), имеющим метку на 5´-конце (флуорофор WellRed D4, «Beckman Coulter», США), и 1492R (TACGGHTACCTTGTTACGACTT). Флуоресцентно меченные продукты амплификации гена 16S-pРНК очищали по стандартной методике (31). Рестрикцию ампликонов (30-50 нг) проводили эндонуклезами HaeIII, HhaI и MspI, следуя рекомендации изготовителя («Fermentas», Литва). Продукты рестрикции анализировали на CEQ 8000 («Beckman Coulter», США) согласно прилагаемой инструкции. Принадлежность бактерий к филогенетическим группам определяли с помощью программы Fragment Sorter . ПЦР-РВ для учета общей численности бактерий выполняли на амплификаторе ДТ Lite-4 (ООО «НПО ДНК-Технология», Россия) с «Набором реактивов для проведения ПЦР-РВ в присутствии интеркалирующего красителя EVA Green» (ЗАО «Синтол», Россия) и праймерами Eub338/Eub518 (5´-ACTCCTACGGGAGGCAGCAG-3´ и 5´-ATTACCGCGGCTGCTGG-3´), используя следующий протокол: 3 мин при 95 °С; 13 с при 95 °С, 13 с при 57 °С, 30 с при 72 °С (40 циклов).
Статистическую обработку результатов осуществляли методом дисперсионного анализа с программным обеспечением Microsoft Excel 2010. Коэффициенты биоразнообразия Шеннона и Симпсона рассчитывали в программе Past .
Результаты . Известно, что бактерии служат таксономическими доминантами в микробном сообществе слепых отростков кишечника и, согласно традиционным представлениям, играют важную роль в обеспечении организма птицы питательными компонентами, витаминами и другими жизненно необходимыми веществами.
Общая численность бактерий в слепых отростках птицы в контрольной группе составляла 2,43½108±8,31½106 экв. геномов/г (табл. 1). Добавление в рацион бройлеров живых клеток микроорганизмов вызвало достоверное увеличение этого показателя в обеих опытных группах: при применении в рационе целлобактерина-Т — в 2,88 раза, дрожжевого пробиотика — в 1,77 раза.
Структура бактериального сообщества слепых отростков кишечника птицы характеризовалась достаточно богатым таксономическим разнообразием. Наибольшее биоразнообразие наблюдалось у цыплят контрольной группы. При введении в рацион пробиотиков происходило его снижение по сравнению с контролем на 12,32 (Р < 0,05) и на 21,09 % соответственно для II и III групп (см. табл. 1).
При таксономическом анализе бактериального сообщества значительную долю последовательностей ДНК не удалось идентифицировать (от 18,92±0,67 до 24,19±1,12 % в зависимости от опытной группы). Присутствие неидентифицированных микроорганизмов в слепых отростках исследователи выявляли и ранее (32, 33), что указывает на полное отсутствие 894
знаний о существовании этих таксонов.
1. Численность и соотношение бактериальных таксонов в слепых отростках кишечника у цыплят-бройлеров кросса Cobb 500 в возрасте 37 сут при использовании в рационах пробиотика целлобактерина-Т и дрожжевого пробиотика ( Х ± х , виварий ФГУП «Загорское ЭПХ ВНИТИП», Московская обл.)
|
Показатель |
I группа (контроль, n = 3) |
II группа (опыт, n = 3) |
III группа (опыт, n = 3) |
|
Общая численность бактерий, |
|||
|
экв. геномов/г содержимого |
2,43½108±8,31½106 |
4,31½108±3,15½106*** |
7,02½108±1,42½106*** |
|
Индекс биоразнообразия Шеннона |
4,28±0,20 |
4,00±0,19 |
4,21±0,17 |
|
Индекс биоразнообразия Симпсона |
0,98±0,04 |
0,96±0,03 |
0,98±0,03 |
|
Число филотипов, ед. |
155±6,24 |
128±5,93* |
138±5,45 |
|
Встречаемость таксона, %: |
|||
|
филум Bacteroidetes |
22,00±1,09 |
21,18±0,87 |
20,69±1,01 |
|
филум Firmicutes |
39,09±1,85 |
43,05±1,99 |
42,85±2,11 |
|
класс Clostridia |
19,49±0,79 |
23,90±1,20* |
21,60±0,88 |
|
семейство Lachnospiraceae |
2,96±0,12 |
2,20±0,10** |
2,32±0,10** |
|
семейство Eubacteriaceae |
6,06±0,28 |
9,97±0,38*** |
8,50±0,09*** |
|
семейство Ruminococcaceae |
3,50±0,16 |
4,80±0,21** |
4,09±0,13* |
|
cемейство Clostridiaceae |
6,63±0,21 |
6,29±0,24 |
5,64±0,35 |
|
род Peptococcus |
0,34±0,02 |
0,64±0,03*** |
1,05±0,04*** |
|
род Lactobacillus |
3,58±0,16 |
4,31±0,19* |
5,29±0,22*** |
|
род Enterococcus |
2,81±0,11 |
1,44±0,06*** |
1,57±0,08*** |
|
род Bacillus |
4,55±0,21 |
3,84±0,16* |
6,30±0,28** |
|
род Staphylococcus |
1,22±0,05 |
0,90±0,04** |
1,31±0,06 |
|
порядок Negativicutes |
7,44±0,32 |
8,66±0,38 |
6,78±0,31 |
|
филум Actinobacteria |
4,81±0,23 |
3,96±0,17* |
4,53±0,21 |
|
род Bifidobacterium |
1,55±0,06 |
1,07±0,04*** |
1,26±0,12 |
|
прочие |
3,26±0,12 |
2,86±0,11* |
3,27±0,10 |
|
филум Proteobacteria |
6,14±0,28 |
8,08±0,39* |
7,95±0,31* |
|
семейство Enterobacteriaceae |
2,70±0,09 |
2,00±0,04*** |
1,87±0,05*** |
|
семейство Сampylobacteriaceae |
0,33±0,01 |
0,49±0,02*** |
0,11±0,01*** |
|
семейство Pseudomonadaceae |
2,52±0,16 |
4,86±0,22*** |
5,21±0,19*** |
|
семейство Pasteurellaceae |
0,59±0,03 |
0,73±0,03* |
0,66±0,06*** |
|
филум Tenericutes (род Mycoplasma ) |
3,02±0,14 |
3,84±0,10** |
3,06±0,16 |
|
филум Fusobacteria |
0,75±0,12 |
0,97±0,15 |
0,87±0,14 |
|
неклассифицированные |
|||
|
последовательности |
24,19±1,12 |
18,92±0,67** |
20,15±0,98* |
|
П р и м е ч а н и е. Описание групп см. в разделе «Методика». |
|||
|
*Р < 0,05; **Р < 0,01; *** Р<0,001. |
|||
Состав идентифицированных микроорганизмов включал шесть филумов, главным образом представителей филума Firmicutes , в том числе бактерий семейств Bacillaceae , Lactobacillaceae , Lachnospiraceae , Ruminococc-aceae , Clostridiaceae , Eubacteriaceae . В меньших количествах обнаруживали микроорганизмы, принадлежащие к филумам Proteobacteria , Bacteroidetes , Actinobacteria , Tenericutes и Fusobacteria .
В опыте была зафиксирована невысокая численность традиционно выявляемых в ЖКТ птицы условно-патогенных и патогенных микроорганизмов рода Staphylococcus , семейств Campylobacteriaceae и Enterobacteriaceae. Присутствие этих микроорганизмов, как правило, связывают с дисбиоти-ческими нарушениями ЖКТ у млекопитающих и птицы. Помимо них, были обнаружены патогены из семейств Pasterellaceae , Actinobacteriaceae и филы Fusobacteria , наличие которых в ЖКТ птицы было выявлено только благодаря молекулярно-генетическим исследованиям (24, 34). При этом значительный интерес представлял факт присутствия в ЖКТ цыплят-бройлеров бактерий семейства Pasterellaceae и рода Mycoplasma , которые у птицы обнаруживаются преимущественно в респираторном тракте и считаются возбудителями заболеваний дыхательных органов.
Полученные нами экспериментальные данные по количеству и составу бактерий в содержимом слепых отростков кишечника птицы в целом согласуются с имеющимися на сегодняшний день представлениями. В монографии М.А. Тимошко (22) описаны следующие бактерий в кишечнике птицы, обнаруженные с помощью традиционных микробиологических методов: бактероиды, эубактерии, пептококки, молочнокислые бактерии, бифидобактерии, стрептококки, энтеробактерии, стафилококки, бациллы (22). Отечественные и зарубежные публикации, основанные на молекулярногенетических исследованиях с применением NGS (next-generation sequencing) и T-RFLP, подтверждают присутствие перечисленных микроорганизмов, в том числе различных патогенных бактерий из родов Campylobacter, Arcobacter, Shigella, Salmonella, Enterobacter.
Мы установили, что введение в рацион птицы живых клеток пробиотических культур дрожжей и бактерий способствовало изменению качественного и количественного состава бактериальной микробиоты в содержимом слепых отростков.
У цыплят-бройлеров из III группы, в рационе которых присутствовал целлобактерин-Т, отмечали достоверное увеличение содержания представителей рода Bacillus в 1,38 раза (Р < 0,01) по сравнению с контролем, что, очевидно, было связано с успешной приживаемостью и размножением интродуцированных бацилл в содержимом кишечника. Полученные результаты согласуются с данными авторов о том, что некоторые виды бацилл, включая B. subtilis , способны к адгезии на слизистой кишечника. Это позволяет им колонизировать пищеварительный тракт и занимать свободные экологические ниши в микробиоме кишечного тракта, оказывая пробиотический эффект (9, 35). Напротив, у цыплят из II группы доля бацилл снижалась на 18,49 % (Р < 0,05).
У птицы во II и III опытных группах отмечалось увеличение количества бактерий рода Lactobacillus соответственно на 20,39 (Р < 0,05) и 47,77 % (Р < 0,005). Известно, что благодаря синтезу ряда органических кислот и бактериоцинов эти микроорганизмы способны к конкурентному вытеснению патогенов. При этом содержание других микроорганизмов с аналогичными свойствами из рода Enterococcus и семейства Bifidobacteriaceae у цыплят во II и III группах снижалось соответственно на 95,13 (Р < 0,005) и 78,98 % (Р < 0,005); 44,86 (Р < 0,005) и 23,02 %.
Добавление пробиотиков к рационам практически не сказалось на содержании бактерий из филы Bacteroidetes , обладающих целлюлозо- и амилолитическими ферментами, однако оказало непосредственное влияние на бактерии со сходными свойствами из филума Firmicutes. Интересно, что направленность действия бактериального и дрожжевого препаратов в отношении указанных микроорганизмов имела сходный характер. В опытных группах по сравнению с контролем наблюдалось повышение доли представителей семейств Eubacteriaceae , Ruminococcaceae , рода Peptococ-cus и снижение — Clostridiaceae , Lachnospiraceae . При этом суммарная доля перечисленных микроорганизмов, входящих в класс Clostridia , при использовании пробиотических препаратов во II и III группах увеличивалась соответственно на 22,63 (Р < 0,05) и 10,83 % по отношению к контролю.
Введение в рацион пробиотических препаратов оказало положительный эффект на снижение содержания патогенов в слепых отростках ЖКТ. Пробиотики уменьшали количество условно-патогенных энтеробактерий в опытных II и III группах на 35,00 и 45,94 % по сравнению с контролем. Кроме того, целлобактерин-Т в 3 раза (Р < 0,005) сократил содержание кампилобактерий семейства Сampylobacteriaceae , патогенных не только для птицы, но и для человека. Использование дрожжевого препарата приводило к снижению доли стафилококков на 35,56 % (Р < 0,01), однако содержание других патогенных бактерий, напротив, увеличивалось: кампилобак-терий — на 48,50 % (Р < 0,005), пастерелл — на 23,72 % (Р < 0,05), мико-896
плазм — на 27,15 % (Р < 0,05).
Различие в составе микробиомов слепых отростков в кишечнике бройлеров при применении бактериального и дрожжевого пробиотиков подтверждалось индексами биоразнообразия (см. табл. 1). Индексы Шеннона были меньше у цыплят, рацион которых содержал пробиотики, что указывает на большую определенность и однородность состава микробиоценозов. При скармливании рациона с включением дрожжевого пробиотика бактериальное сообщество слепых отростков кишечника у такой птицы имело наибольшие различия с микробиомом у остальных групп и характеризовалось наименьшей величиной индекса Шеннона (4,00±0,19), а также индекса доминирования Симпсона (0,9±0,03), что свидетельствует о более выраженном эффекте воздействия этого препарата.
Сохранность птицы во всех группах составляла 100 %. С изменениями в структуре бактериального сообщества оказалась связана продуктивность цыплят-бройлеров (табл. 2).
2. Продуктивность цыплят-бройлеров кросса Cobb 500 при использовании в рационах пробиотика целлобактерина-Т и дрожжевого пробиотика ( Х ± х , виварий ФГУП «Загорское ЭПХ ВНИТИП», Московская обл.)
|
Показатель |
I группа (контроль, n = 35) |
II группа (опыт, n = 35) |
III группа (опыт, n = 35) |
|
Сохранность поголовья, % Живая масса, г: |
100,0 |
100,0 |
100,0 |
|
в возрасте 1 сут |
42,8±0,25 |
42,1±0,31 |
41,9±0,27 |
|
в возрасте 7 сут |
193,9±2,27 |
195,6±2,52 |
196,3±2,94 |
|
в возрасте 21 сут Средняя живая масса в |
779,7±11,81 |
786,0±11,77 |
809,5±13,41 |
|
возрасте 37 сут, г |
2096,2±68,15 |
2128,9±71,21 |
2188,2±59,30 |
|
в том числе у курочек |
1980,5±16,65 |
2004,3±17,09 |
2062,9±20,45** |
|
в том числе у петушков Среднесуточный прирост |
2211,9±14,86 |
2253,5±11,54* |
2313,4±16,09*** |
|
живой массы, г |
55,5 |
56,4 |
58,0 |
|
Затраты корма на 1 гол., кг Затраты корма на 1 кг прироста |
3,46 |
3,59 |
3,45 |
|
живой массы, кг |
1,69 |
1,72 |
1,61 |
|
П р и м е ч а н и е. Описание групп см. в разделе «Методика». * Р < 0,05; ** Р < 0,01; *** Р < 0,001. |
|||
80'
Группа
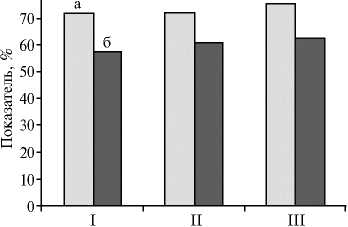
Переваримость сухого вещества корма (а) и использование азота (б) цыплятами-бройлерами кросса Cobb 500 в условиях физиологического (балансового) опыта при включении в рационы пробиотика целлобакте-рина-Т и дрожжевого пробиотика (виварий ФГУП «Загорское ЭПХ ВНИТИП», Московская обл.). Описание групп см. в разделе «Методика».
Прирост живой массы птицы во II группе в 7-, 21- и 37-суточном возрасте был выше, чем в контроле, на 0,9; 0,8 и 1,6 %; в III группе — на 1,2; 3,8 и 4,4 %. Следовательно, наибольшей скоростью роста отличались цыплята, комбикорма для которых обогащали пробиотиком целлобакте-рином-Т. В возрасте 37 сут живая масса курочек в III группе была выше контрольных значений на 4,2 % (Р ≤ 0,01), петушков — на 4,6 % (Р ≤ 0,001).
При использовании дрожжевого пробиотика потребление корма птицей увеличивалось на 3,8 % по сравнению с контролем. Затраты корма на 1 кг прироста живой массы во II группе были выше, чем в контроле и III группе соответственно на 1,8 и 4,7 %.
Результаты физиологического (балансового) опыта согласовывались с данными по продуктивности бройлеров (рис.). Так, во всех опытных группах переваримость сухого вещества корма была выше, чем в контроле. Она оказалась наибольшей в III группе (с разницей по показателю 3,7 %). Эта группа отличалась от других более высоким среднесуточным приростом живой массы — 58,0 г. В III группе (по сравнению с остальными)
также установили аналогичную закономерность по использованию азота корма: анализируемый показатель был на 4,7 % достоверно выше, чем у
сверстников из контрольной группы.
Использование пробиотических добавок повлияло на накопление
витаминов в печени бройлеров (табл. 3). По сравнению с контролем во II и III группах количество витаминов увеличивалось: А — на 4,7 и 8,9 %; Е — на 7,7 и 22,1 % (Р < 0,01 ); В2 — на 7,3 и 12,4 %; каротиноидов — на 4,8 и 9,2 %.
3. Содержание витаминов и каротиноидов (мкг/г) в печени у 37-суточных цыплят-бройлеров кросса Cobb 500 при использовании пробиотика цел-лобактерина-Т и дрожжевого пробиотика (виварий ФГУП «Загорское ЭПХ ВНИТИП», Московская обл.).
Биоактивные вещества
Витамин А
Витамин Е
Витамин В2
Каротиноиды
I группа (контроль, n = 3) 139,85±5,35 5,71±0,12 10,96±0,42 4,37±0,18
II группа III группа
(опыт, n = 3) (опыт, n = 3) 146,40±6,12 152,23±4,95
6,15±0,17 6,97±0,09*
11,76±0,18 12,32±0,32
4,58±0,02 4,77±0,07
П р и м еч а ни е. Описание групп см. в разделе «Методика». * Р < 0,01.
По химическому составу грудных и ножных мышц у бройлеров различий между группами установлено не было.
Необходимо отметить, что результаты выращивания во многом объясняются составом бактериального сообщества в кишечнике бройлеров. В других работах было продемон-
стрировано, что некоторые облигатные обитатели кишечника способны оказывать непосредственное влияние на продуктивность птицы. V.A. Torok с соавт. (24) выявили корреляцию между составом микроорганизмов в слепых отростках кишечника и эффективностью использования энергии кормов. Согласно мнению исследователей, немаловажную роль играют бакте-
рии, продуцирующие различные кислоты, прежде всего масляную, которая служит предпочтительным источником энергии и увеличивает размер эпителия кишечника (36, 37), обеспечивая тем самым барьер для токсичных агентов (38). К основным бутират-продуцирующим микроорганизмам относят представителей филума Firmicutes (39), включая бактерии Eubacterium rectale (семейство Eubacteriaceae ), род Roseburia (семейство Lachnospiraceae ), Faecalibacterium prausnitzii (семейство Ruminococcaceae ) (27, 28, 40). Анализируя действие обоих испытанных нами пробиотиков, мы наблюдали увеличение доли микроорганизмов семейств Eubacteriaceae и Ruminococcaceae в слепых отростках у бройлеров. Этот факт может указывать на то, что повышение продуктивности связано с увеличением количества масляной кислоты в кишечнике.
Кроме того, некоторые авторы отмечают зависимость между продуктивностью птицы и содержанием в кишечнике молочной кислоты, продуцируемой лактобактериями родов Lactobacillus, Enterococcus и др. Известно, что лактат обладает более выраженными антимикробными свойствами в отношении патогенов по сравнению с другими кислотами (уксусной, пропионовой и др.), продуцируемыми кишечной микрофлорой. Как правило, в кишечнике не накапливается значительных количеств молочной кислоты вследствие ее быстрого всасывания и усвоения микроорганизмами родов Anaerostipes, Veillonella и Megasphaera из порядка Nega-tivicutes, ферментирующими лактат. Согласно полученным нами результатам, применение целлобактерина-Т приводило к повышению доли лактат- продуцирующих бактерий рода Lactobacillus и снижению количества лак-тат-ферментирующих бактерий порядка Negativicutes, что могло способствовать большему накоплению молочной кислоты в кишечнике птицы в III группе и, соответственно, более выраженному антимикробному эффекту в отношении патогенов по сравнению с показателями во II группе. В результате применения живых дрожжей в рационе бройлеров доля лактат-ферментирующих бактерий порядка Negativicutes в кишечнике несколько увеличивалась, что могло привести к лучшему усвоению молочной кислоты и, как следствие, к снижению антимикробных свойств по сравнению с проявляемыми в III группе (41, 42).
Таким образом, целлобактерин-Т обладает высокой пробиотической активностью, оказывая положительное воздействие на состав бактериального сообщества в слепых отростках кишечника у цыплят-бройлеров. В результате скармливания препарата происходило достоверное увеличение численности нормофлоры (представители родов Bacillus и Lactobacillus ), а также снижение количества микроорганизмов, традиционно связанных с дисбиозом кишечника у человека и животных (семейства Enterobacteriaceae и Сampylobacteriaceae ). Применение дрожжевого пробиотика позитивно повлияло на содержание целлюллозолитических микроорганизмов класса Clostridia , однако оказало меньший эффект в отношении патогенных микроорганизмов, в частности приводило к достоверному возрастанию доли кампилобактерий, пастерелл, микоплазм. Применение обоих пробиотиков положительно отразилось на продуктивности птицы, переваримости питательных веществ и содержании витаминов в печени. При этом в группе, потреблявшей целлобактерин-Т, цыплята характеризовались наибольшим приростом живой массы, ускоренным ростом, кроме того, у них была выше переваримостью питательных веществ корма и накопление витаминов А, Е, В2 и каротиноидов в печени.
Список литературы Влияние пробиотиков на основе Saccharomyces sp. и Bacillus subtilis на бактериальное сообщество слепых отростков кишечника и продуктивность цыплят-бройлеров
- Czerwinski J., Hojberg O., Smulikowska S., Engberg R.M., Mieczkowska A. Influence of dietary peas and organic acids and probiotic supplementation on performance and caecal microbial ecology of broiler chickens. Brit. Poultry Sci., 2010, 51(2): 258-569 ( ) DOI: 10.1080/00071661003777003
- Малик Н.И., Панин А.Н. Ветеринарные пробиотические препараты. Ветеринария, 2001, 1: 27.
- Stanley D., Hughes R.J., Moore R.J. Microbiota of the chicken gastrointestinal tract: influence on health, productivity and disease. Appl. Microbiol. Biotechnol., 2014, 98: 4301-4309 ( ) DOI: 10.1007/s00253-014-5646-2
- Rodriguez-Lecompte J.C., Yitbarek A., Brady J., Sharif S., Cavanagh M.D., Crow G., Guenter W., House J.D., Camelo-Jaimes G. The effect of microbial-nutrient interaction on the immune system of young chicks after early probiotic and organic acid administration. J. Anim. Sci., 2012, 90(7): 2246-2254 ( ) DOI: 10.2527/jas.2011-4184
- Stanley D., Hughes R.J., Moore R.J. Microbiota of the chicken gastrointestinal tract: influence on health, productivity and disease. Appl. Microbiol. Biotechnol., 2014, 98: 4301-4310 ( ) DOI: 10.1007/s00253-014-5646-2
- Rehman H., Vahjen W., Awad W., Zentek J. Indigenous bacteria and bacterial metabolic products in the gastrointestinal tract of broiler chickens. Arch. Anim. Nutr., 2007, 61: 319-335 ( ) DOI: 10.1080/17450390701556817
- Urdaci M.C., Bressollier P., Pinchuk I. Bacillus clausii probiotic strains: antimicrobial and immunomodulatory activities. J. Clin. Gastroenterol., 2004, 38: 86-90.
- Mazza P. The use of Bacillus subtilis as an antidiarrhoeal microorganism. Boll. Chim. Farm., 1994, 133: 3-18.
- Hong H.A., Huang J.M., Khaneja R., Hiep L.V., Urdaci M.C., Cutting S.M. The safety of Bacillus subtilis and Bacillus indicus as food probiotics. J. Appl. Microbiol., 2008, 105: 510-520 ( ) DOI: 10.1111/j.1365-2672.2008.03773.x
- Mountzouris K.C., Dalaka E., Palamidi I., Paraskeuas V., Demey V., Theodoropoulos G., Fegeros K. Evaluation of yeast dietary supplementation in broilers challenged or not with Salmonella on growth performance, cecal microbiota composition and Salmonella in ceca, cloacae and carcass skin. Poultry Sci., 2015, 94(10): 2445-2455 ( ) DOI: 10.3382/ps/pev243
- M'Sadeq S.A., Wu S.B., Choct M., Forder R., Swick R.A. Use of yeast cell wall extract as a tool to reduce the impact of necrotic enteritis in broilers. Poultry Sci., 2015, 94(5): 898-905 ( ) DOI: 10.3382/ps/pev035
- DeVries T.J., Chevaux E. Modification of the feeding behavior of dairy cows through live yeast supplementation. J. Dairy Sci., 2014, 97(10): 6499-6510 ( ) DOI: 10.3168/jds.2014-8226
- Zhang Z., Cao L., Zhou Y., Wang S., Zhou L. Analysis of the duodenal microbiotas of weaned piglet fed with epidermal growth factor-expressed Saccharomyces cerevisiae. BMC Microbiol., 2016, 28: 161-166 ( ) DOI: 10.1186/s12866-016-0783-7
- Pizzolitto R.P., Armando M.R., Combina M., Cavaglieri L.R., Dalcero A.M., Salvano M.A. Evaluation of Saccharomyces cerevisiae strains as probiotic agent with aflatoxin B₁ adsorption ability for use in poultry feedstuffs. J. Environ. Sci. Health. B, 2012, 47(10): 933-941 ( ) DOI: 10.1080/03601234.2012.706558
- Slizewska K., Piotrowska M. Reduction of ochratoxin A in chicken feed using probiotic. Ann. Agric. Environ. Med., 2014, 21(4): 676-680 ( ) DOI: 10.5604/12321966
- Amit-Romach E., Uni Z., Reifen R. Multistep mechanism of probiotic bacterium, the effect on innate immune system. Mol. Nutr. Food. Res., 2010, 54: 277-284 ( ) DOI: 10.1002/mnfr.200800591
- Pagnini C., Saeed R., Bamias G., Arseneau K.O., Pizarro T.T., Cominelli F., Amit-Romach E., Uni Z., Reifen R. Probiotics promote gut health through stimulation of epithelial innate immunity. PNAS USA, 2010, 107: 454-459 ( ) DOI: 10.1073/pnas.0910307107
- Rajput I.R., Hussain A., Li Y.L., Zhang X., Xu X., Long M.Y., You D.Y., Li W.F. Saccharomyces boulardii and Bacillus subtilis B10 modulate TLRs mediated signaling to induce immunity by chicken BMDCs. J. Cell. Biochem., 2014, 115(1): 189-198 ( ) DOI: 10.1002/jcb.24650
- Alizadeh M., Rogiewicz A., McMillan E., Rodriguez-Lecompte J.C., Patterson R., Slominski B.A. Effect of yeast-derived products and distillers dried grains with solubles (DDGS) on growth performance and local innate immune response of broiler chickens challenged with Clostridium perfringens. Avian Pathol., 2016, 45(3): 334-345 ( ) DOI: 10.1080/03079457.2016.ne
- Alizadeh M., Rodriguez-Lecompte J.C., Yitbarek A., Sharif S., Crow G., Slominski B.A. Effect of yeast-derived products on systemic innate immune response of broiler chickens following a lipopolysaccharide challenge. Poultry Sci., 2016, 95(10): 2266-2273 ( ) DOI: 10.3382/ps/pew154
- Тараканов Б.В. Методы исследования микрофлоры пищеварительного тракта сельскохозяйственных животных и птицы. М., 2006.
- Тимошко М.А. Микрофлора пищеварительного тракта сельскохозяйственных животных. Кишинев, 1990.
- Park S.H., Lee S.I., Ricke S.C. Microbial populations in naked neck chicken ceca raised on pasture flock fed with commercial yeast cell wall prebiotics via an Illumina MiSeq Platform. PLoS ONE, 11(3): e0151944 ( ) DOI: 10.1371/journal.pone.0151944
- Torok V.A., Hughes R.J., Mikkelsen L.L. Identification and characterization of potential performance-related gut microbiota in broiler chickens across various feeding trials. Appl. Environ. Microbiol., 2011, 77(17): 5868-5878 ( ) DOI: 10.1128/AEM.00165-11
- Witzig M., Camarinha-Silva A., Green-Engert R., Hoelzle K., Zeller E., Seifert J., Hoelzle L.E., Rodehutscord M. Correction: spatial variation of the gut microbiota in broiler chickens as affected by dietary available phosphorus and assessed by T-RFLP analysis and 454 pyrosequencing. PLoS ONE, 2015, 10(12): e0145588 ( ) DOI: 10.1371/journal.pone.0145588
- de Boer P., Rahaoui H., Leer R.J., Montijn R.C., van der Vossen J.M. Real-time PCR detection of Campylobacter spp.: a comparison to classic culturing and enrichment. Food Microbiol., 2015, 51: 96-100 ( ) DOI: 10.1016/j.fm.2015.05.006
- Hold G.L., Schwiertz A., Aminov R.I., Blaut M., Flint H.J. Oligonucleotide probes that detect quantitatively significant groups of butyrate-producing bacteria in human feces. Appl. Environ. Microbiol., 2003, 69: 4320-4324.
- Bjerrum L., Engberg R.M., Leser T.D., Jensen B.B., Finster K., Pedersen K. Microbial community composition of the ileum and cecum of broiler chickens as revealed by molecular and cellular-based techniques. Poultry Sci., 2006, 85: 1151-1164.
- Методика проведения научных и производственных исследований по кормлению сельскохозяйственной птицы. Молекулярно-генетические методы определения микрофлоры кишечника/Под ред. В.И. Фисинина. Сергиев Посад, 2013.
- Инструкция по санитарно-микробиологическому контролю тушек, мяса птицы, птицепродуктов, яиц и яйцепродуктов на птицеводческих и перерабатывающих предприятиях. М., 1990.
- Маниатис Т., Фрич Э., Сэмбрук Дж. Методы генетической инженерии. Молекулярное клонирование. М., 1984.
- Gong J., Forster R.J., Yu H., Chambers J.R., Sabour P.M., Wheatcroft R., Chen S. Diversity and phylogenetic analysis of bacteria in the mucosa of chicken ceca and comparison with bacteria in the cecal lumen. FEMS Microbiol. Lett., 2002, 208: 1-7 ( ) DOI: 10.1016/S0378-1097(01)00521-3
- Amit-Romach E., Sklan D., Uni Z. Microflora ecology of the chicken intestine using 16S ribosomal DNA primers. Poultry Sci., 2004, 83: 1093-1098 ( ) DOI: 10.1093/ps/83.7.1093
- Rinttila T., Apajalahti J. Intestinal microbiota and metabolites -Implications for broiler chicken health and performance. J. Appl. Poultry Res., 2013, 22(3): 647-658 ( ) DOI: 10.3382/japr.2013-00742
- Sanchez B., Arias S., Chaignepain S., Denayrolles M., Schmitter J.M., Bressollier P., Urdaci M.C. Identification of surface proteins involved in the adhesion of a probiotic Bacillus cereus strain to mucin and fibronectin B. Microbiology, 2009, 155: 1708-1716 ( ) DOI: 10.1099/mic.0.025288-0
- Le Blay G., Blottiere H.M., Ferrier L., Le Foli E.C., Bonnet J.P., Galmiche C., Cherbut C. Shortchain fatty acids induce cytoskeletal and extracellular protein modifications associated with modulation of proliferation on primary culture of rat intestinal smooth muscle cells. Dig. Dis. Sci., 2000, 45: 1623-1630.
- Yasuoka T., Tsujikawa Y. Fujiyama, Bamba T. Effects of the soluble fibre pectin on intestinal cell proliferation, fecal short chain fatty acid production and microbial population. Digestion, 2003, 67: 42-49.
- Niba A.T., Beal J.D., Kudi A.C., Brooks P.H. Bacterial fermentation in the gastrointestinal tract of non-ruminants: Influence of fermented feeds and fermentable carbohydrates. Trop. Anim. Health Prod., 2009, 41: 1393-1407 ( ) DOI: 10.1007/s11250-009-9327-6
- Pryde S.E., Duncan S.H., Hold G.L., Stewart C.S., Flint H.J. The microbiology of butyrate formation in the human colon. FEMS Microbiol. Lett., 2002, 217: 133-139.
- Louis P., Young P., Holtrop G., Flint H.J. Diversity of human colonic butyrate-producing bacteria revealed by analysis of the butyryl-CoA:acetate CoA-transferase gene. Environ. Microbiol., 2010, 12: 304-314 ( ) DOI: 10.1111/j.1462-2920.2009.02066.x
- Belenguer A., Duncan S.H., Holtrop G., Anderson S.E., Lobley G.E., Flint H.J. Impact of pH on lactate formation and utilization by human fecal microbial communities. Appl. Environ. Microbiol., 2007, 73: 6526-6533.
- Harmsen H.J.M., Raangs G.C., He T., Degener J.E., Welling G.W. Extensive set of 16S rRNAbased probes for detection of bacteria in human feces. Appl. Environ. Microbiol., 2002, 68: 2982-2990.
- Swiqtkiewicz S., Arczewska-Wlosek, Jozetiak D. Immunomodulatory efficacy of yeast cell products in poultry: a current review. World's Poultry Science Journal, 2014, 70(1): 57-68.
- Birgit K. Hefen in der Nutztierfutterung. Feed Mag., 2015, 98(1-2): 17-21.
- Fanelli A., Agazzi A., Alborali G.L., Pilotto A., Pilotto A., Bontempo V., Dell'Orto V., Demey V., Caputo J.M., Savoini G. Prevalence reduction of pathogens in poultry fed with Saccharomyces cerevisiae. Biotechnol. Agron. Soc. Environ., 2015, 19(1): 3-10.


