Влияние продуктов личинок анизакид на морфологию тонкого кишечника крыс
Автор: Сивкова Т.Н.
Статья в выпуске: 1 т.200, 2010 года.
Бесплатный доступ
В результате эксперимента по скармливанию лабораторным крысам нежизнеспособных личинок анизакид и мяса инвазированной рыбы установлено, что продукты гельминтов вызывают развитие катарального аллергического энтерита.
Рыба, домашние животные, анизакидоз, аллергическая реакция
Короткий адрес: https://sciup.org/14286782
IDR: 14286782 | УДК: 619:616.995.132
Текст обзорной статьи Влияние продуктов личинок анизакид на морфологию тонкого кишечника крыс
Анизакидоз – гельминтозное заболевание с выраженным аллергическим компонентом, вызываемое личинками нематод семейства Anisakidae. Для профилактики заражения свежевыловленную рыбу подвергают глубокой заморозке. Установлено, что низкие температуры, вызывая гибель нематод, не способны разрушать структуру белковых молекул. При попадании в организм человека или плотоядных животных они способны вызывать иммунный ответ и аллергическую реакцию.
Целью настоящей работы стало изучение морфологических изменений, происходящих в тонком кишечнике лабораторных животных при длительном пероральном употреблении личинок анизакид в зависимости от дозы и при поедании мышечной ткани рыбы в зависимости от степени ее инвазированности.
Материалы и методы. Материалом для эксперимента служили нежизнеспособные личинки Anisakis simplex, выделенные из замороженных тушек путассу (Micromesistius poutassou). Извлеченных личинок многократно промывали водопроводной водой, затем для предотвращения роста микрофлоры обрабатывали растворами антибиотиков. Также в эксперименте использовали мясо инвазированной рыбы. В зависимости от степени зараженности рыбы личинками ее делили на три группы: менее 10 личинок, от 20 до 50 и более 50. Мышечную ткань отделяли, измельчали с помощью блендера до состояния фарша и использовали для кормления лабораторных крыс. До использования рыбный фарш хранили в бытовой морозильной камере при температуре -10ОС.
Нелинейных лабораторных крыс-самцов (Rattus norvegicus) массой 120-150г делили на группы по шесть голов. Первым пяти группам животных в течение 10 дней скармливали нежизнеспособных личинок анизакид в дозах 5, 10, 25, 50 и 100 штук/голову, соответственно. Крысы шестой, седьмой и восьмой групп получали рыбный фарш, приготовленный из путассу, инвазированной менее чем 10, от 20 до 50 и более чем 50 личинками, соответственно. Девятая группа служила интактным контролем и находилась на стандартном для лабораторных животных рационе.
На десятые сутки животных декапитировали под эфирным наркозом. Участок тонкого кишечника промывали, фиксировали 10%-ным раствором нейтрального формалина с целью уплотнения. Далее производили его проводку по спиртам возрастающей крепости с целью обезвоживания материала по общепринятой методике. Затем кусочки заливали в парафин и изготавливали блоки 2х2см. С полученных блоков на микротоме-полуавтомате делали срезы толщиной 4-5 микрон. Их помещали на предметное стекло и окрашивали гематоксилином и эозином
(обзорная методика) и по ван Гизону с целью выявления степени развития склеропластических процессов.
Просмотр готовых препаратов производили с помощью микроскопа фирмы “Leica” и “Zeiss” при увеличении окуляра х10, с объективами х10, х40 и х90 с подробным описанием имеющейся морфологической картины. В органах оценивали дисциркуляторные, дистрофические, склеропластические, воспалительные, гиперпластические, регенераторные процессы.
Иллюстрации выполняли с использованием цифровой видеокамеры “Sony” на компьютере “Pentium-III” и Toshiba. Наиболее интересные и показательные фрагменты микропрепаратов фотографировали и сохраняли в памяти компьютера.
Результаты и обсуждение . Общее состояние лабораторных животных оставалось удовлетворительным на протяжении всего эксперимента.
Гистологические исследования показали, что патологические изменения в состоянии тонкого кишечника экспериментальных животных происходили уже при скармливании 5 личинок. В слизистой оболочке кишечника наблюдали небольшой отек стромы, полнокровие сосудов, отдельные лимфоциты или их небольшие группы, в подслизистом слое также отмечали наличие незначительного отека.
С увеличением дозы введенных личинок до 10 и 25 к указанным выше изменениям присоединялись увеличение количества бокаловидных клеток и гиперсекреция слизи. В строме слизистой оболочки выявляли группы зрелых лимфоцитов с примесью макрофагов и эозинофилов, которые с увеличением дозы скармливаемых личинок также становились крупнее.
При дозе в 50 личинок кишечные ворсинки становились более рыхлыми, извитыми, в строме – отек и наличие крупных групп лимфоцитов и плазматических клеток с примесью макрофагов и эозинофилов. Также незначительный отек отмечали в подслизистом слое.
Наиболее выраженные изменения происходили в кишечнике крыс, получавших ежедневную дозу в 100 личинок анизакид. Слизистая оболочка отечна, эпителий верхушек ворсинок десквамирован. В строме – диффузные скопления зрелых лимфоцитов и плазмоцитов, а также довольно большого количества эозинофилов. В подслизистом слое выражен отек, полнокровие сосудов, явления плазморрагии. Данные изменения соответствуют катаральному энтериту с аллергическим компонентом (Рис.1).
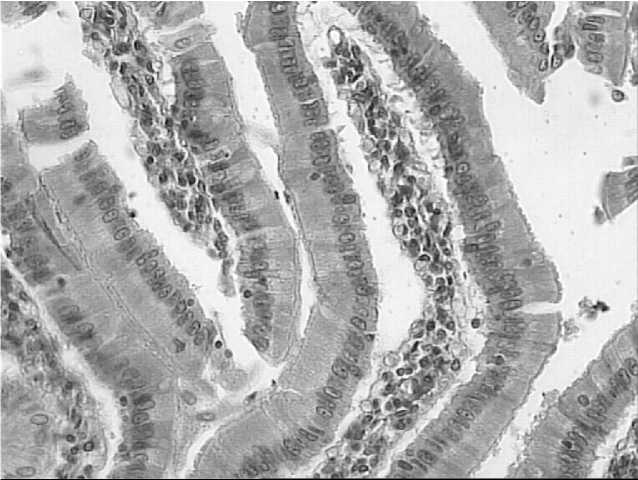
-
1. Кишечник крысы после скармливания личинок анизакид. Окраска гематоксилином и эозином.
-
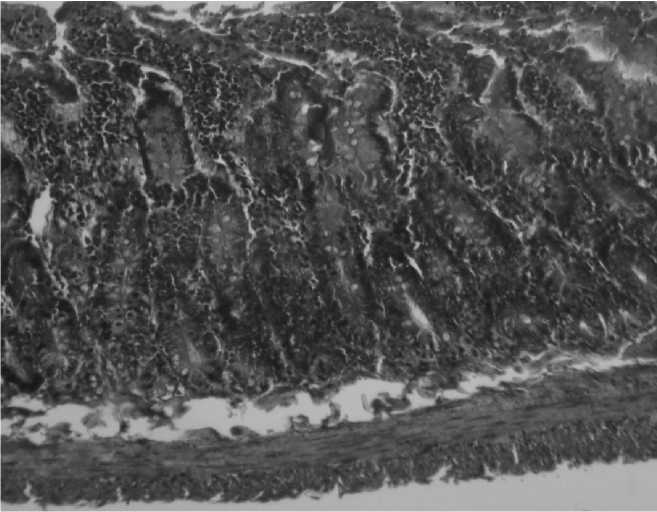
2. Кишечник крысы после скармливания рыбы, инвазированной личинками анизакид. Окраска гематоксилином и эозином. Увел. 10 ок. х 10 об.
Увел. 10 ок. х 40 об.
При скармливании рыбного фарша патологические изменения тканей тонкого кишечника также присутствовали, причем степень их выраженности соответствовала интенсивности инвазии рыбы личинками анизакид. Если при скармливании фарша, приготовленного из путассу, содержащей менее 10 личинок, обнаруживали лишь отек слизистой оболочки и подслизистого слоя с наличием в апикальных отделах ворсинок одиночных зрелых лимфоцитов или их мелких групп, то зараженность рыбы 20-50 личинками вызывала уже и увеличение количества бокаловидных клеток, и формирование в строме слизистой оболочки и подслизистого слоя полиморфных клеточных инфильтратов с примесью значительной доли эозинофилов. Наиболее высокая зараженность рыбы (более 50 личинок) вызывала изменения, соответствующие катаральному энтериту, с десквамацией эпителия апикальной части ворсинок, формированием диффузных инфильтратов лимфоцитами, плазмоцитами и эозинофилами (Рис.2).
При гистологическом исследовании соответствующих органов контрольных животных подобных изменений не отмечали.
Таким образом, нежизнеспособные личинки рода Anisakis и продукты их жизнедеятельности, сохраняющиеся в свежемороженой рыбе, вызывают в кишечнике лабораторных животных развитие катарального аллергического энтерита.
Аллергенное действие живых личинок анизакид отмечали многие авторы. При миграции личинок в подслизистый слой желудочнокишечного тракта развивается аллергическое воспаление, образование эозинофильных гранулем, которые впоследствии заменяются на лимфоидные (Oshima T., 1972; Nawa Y. et al, 2005; Roland S. K. et al, 2008). В связи с серьезной угрозой здоровью человека и домашних животных, вызванных инвазией анизакидами, всю свежевыловленную рыбу подвергают немедленному обеззараживанию методом глубокой заморозки. При замораживании происходит быстрая гибель гельминтов, однако, белковые молекулы не свертываются, а ферменты не разрушаются (Пискарев В.И., 1960; Загаевский И.С., 1970).
Результаты нашей работы свидетельствуют о том, что процесс длительной глубокой заморозки не влияет на аллергенные свойства белковых продуктов гельминтов. Подобные выводы согласуются с мнениями других авторов. Установлено, что образование антител JgE вызывают экскреторно-секреторные продукты гельминтов, которые не инактивируются высокими или низкими температурами (Moreno-Ancillo A. et al, 1997; Audicana M. T. et al, 2002).
Следовательно, употребление в пищу и кормление домашних животных зараженной личинками анизакид рыбы приводит к развитию аллергической реакции, которая выражается в катаральном воспалении тонкого кишечника.
Выводы и предложения. Пероральное введение лабораторным животным нежизнеспособных личинок анизакид вызывает развитие аллергического катарального воспаления тонкого кишечника, тяжесть проявления которого напрямую зависит от дозы личинок. Наиболее выраженные изменения происходят при дозе 50 и более личинок..
В процессе инвазирования рыбы личинками анизакид и неоднократном замораживании и оттаивании экскреторно - секреторные и соматические продукты гельминтов проникают в мышечную ткань, вызывая аллергическую реакцию у лабораторных животных при скармливании рыбного фарша.
В связи с опасностью развития аллергических реакций при проведении ветеринарно-санитарной экспертизы морской рыбы необходимо помимо наличия жизнеспособных личинок анизакид, учитывать также степень ее инвазированности, и не использовать в пищевых целях рыбу с интенсивностью инвазии более 50 штук.
Для кормления домашних животных рекомендуется использовать только потрошеную морскую рыбу. Из рациона домашних животных с поражением желудочно-кишечного тракта или склонных к развитию аллергических реакций зараженную морскую рыбу необходимо исключать.
ВЛИЯНИЕ ПРОДУКТОВ ЛИЧИНОК АНИЗАКИД НА МОРФОЛОГИЮ ТОНКОГО КИШЕЧНИКА КРЫС
Сивкова Т.Н.
Резюме
В результате эксперимента по скармливанию лабораторным крысам нежизнеспособных личинок анизакид и мяса инвазированной рыбы установлено, что продукты гельминтов вызывают развитие катарального аллергического энтерита.
ANISACIDS GRUBS PRODUCTS INFLUENCE ON THE MORPHOLOGY OF RATS` SMALL INTESTINES
Sivkova T.N.


